長期増強
小林 静香、真鍋 俊也
東京大学 医科学研究所 神経ネットワーク分野
DOI:10.14931/bsd.10565 原稿受付日:2024年1月26日 原稿完成日:2024年1月30日
担当編集委員:林 康紀(京都大学大学院医学研究科 システム神経薬理学分野)
英:long-term potentiation 独:Langzeitpotenzierung 仏: potentialisation à long terme
英略語:LTP
シナプスにおける情報伝達の効率は常に一定に保たれているわけではなく、むしろニューロンの活動履歴に応じて柔軟に変化することが知られている。このような神経活動依存的なシナプス伝達の持続的変容をシナプス可塑性と呼ぶが、中でもシナプス伝達効率が長期的に増強される現象を長期増強(long-term potentiation, LTP)と呼ぶ。LTPは数時間から、場合によっては数カ月間も持続することが知られており、その持続時間の長さから記憶・学習の基本過程であると考えられてきた。
長期増強とは
シナプスの伝達効率は神経の活動履歴に応じて柔軟に変化することが知られている。このような変化をシナプス可塑性 (synaptic plasticity) と呼び、代表的なものに長期増強(long-term potentiation, LTP)や長期抑圧(long-term depression, LTD)がある。一般的に、シナプス伝達効率の増強が1時間以上持続する場合をLTPと呼び、それよりも短い場合は短期増強(short-term potentiation, STP)と呼ばれることが多い。LTPは、数時間から、場合によっては数カ月も持続する現象であるが、時間経過に沿って、タンパク質合成を伴わない前期LTP(early-LTP, E-LTP)と、タンパク合成をともなう後期LTP (late-LTP, L-LTP)とに区分する場合もある。
LTPは様々な脳領域において観察される現象であるが、特に陳述記憶の中枢である海馬において、他の領域と比較してより容易に誘導されること、また後述するLTPの基本的特性(共同性、入力特異性、連合性)が記憶のもつ特性と類似性を持つこと、さらにLTPが長い持続性を示す現象であることから、学習や記憶形成の細胞レベルでの基礎過程であると考えられてきた。一般的に、LTPがおきる機序は、誘導(induction)、発現(expression)、維持 (maintenance)の2つのステップにわけることができるとされ、それぞれのステップを担う分子機序の解明が盛んに試みられている。
1966年の北欧での学会で、Lømoにより海馬歯状回でのシナプス伝達効率が高頻度刺激により長時間にわたって増強される現象、すなわちLTPの存在、が初めて報告された[1]。これを体系的にまとめたのがBlissとLømoによる1973年の論文である[2]。これらの研究では、麻酔下のウサギ海馬歯状回からガラス管微小電極を用いて興奮性シナプス応答を記録し、歯状回への入力線維である貫通線維(perforant path)を高頻度で刺激することによってLTPが誘導されることが示されたが、より生理的条件に近い無麻酔のウサギにおいても同様の現象が誘導できることも同時に報告された[3]。さらに、LTPが記憶形成を十分説明しうるだけの持続時間を示すことなどから、記憶・学習との関連性が指摘され、その発生機序を明らかにする研究がその後展開されることになった。
特性
主に海馬CA1シナプスを対象とした研究から、LTPは以下の3つの特性を示すことが明らかになっている[4][5]。
- 協同性(cooperativity): LTPが誘導されるためには、ある一定数以上の入力線維が同時に活性化されなければならない。
- 入力特異性(input-specificity): 同一の細胞に複数の入力がある場合、刺激を受けた線維が形成するシナプスのみでLTPが誘導される。
- 連合性(associativity): LTPがおこらない程度の弱い高頻度刺激であっても、同時に別の強い入力が高頻度で加わった場合にはLTPが誘導されうる。
こうした特性を示すことから、LTPはヘブによって提唱された学習理論[6]、すなわち、「記憶や学習が成立する際のシナプス強度の変化は、シナプス前細胞とシナプス後細胞とが同時に活性化された場合に引き起こされる」に相当する現象であるとみなされ、このようなタイプの可塑性を示すシナプスはヘブ型シナプス(Hebbian synapse)、また誘導されるLTPはヘブ型LTP(Hebbian LTP)と呼ばれている。

A. 定常状態における神経伝達:シナプス前終末から放出されたグルタミン酸(●)が、シナプス後細胞に発現しているAMPA型グルタミン酸受容体を活性化することにより、ナトリウムイオンの流入、カリウムイオンの流出が起きる。放出されたグルタミン酸は、NMDA型グルタミン酸受容体にも結合するが、細胞外のマグネシウムイオン(●)により受容体チャネルがブロックされているため、イオンの移動は起きない。
B. 刺激によりシナプス後細胞が強く脱分極すると、NMDA型グルタミン酸受容体のマグネシウムブロックが外れ、ナトリウム、カリウムイオンの移動とともに、細胞内へとカルシウムイオンの流入がおきる。
機序
LTPの機序に関しては海馬シャッファー側枝-CA1シナプスに代表されるシナプス後性のヘブ型シナプスに関して研究が進んでいる。嗅内野貫通線維-海馬歯状回や大脳皮質興奮性神経細胞でも似た機序によりLTPが起こると考えられる。
一方、海馬苔状線維-CA3シナプスや小脳並行線維-プルキンエ細胞間シナプスでは、異なった機構によるLTPが発現する[7]ことも知られている。
シナプス後性LTP
シナプス前終末から放出された神経伝達物質に対するシナプス後細胞の感受性の増大が長期間持続する現象を指す。
誘導
最も代表的なシナプス後性のLTPは、海馬CA1領域の興奮性シナプス伝達のLTPである。実験的には、100Hz程度の高頻度のシナプス前線維の電気刺激(テタヌス刺激, tetanic stimulation)等により誘導される(図1)。その結果シナプスに最初に引き起こされる変化の過程を誘導 (induction)と呼ぶ。以下の一連の研究から、ヘブ型シナプスでのLTPの誘導には、①シナプス前部の活性化と、それに伴う②シナプス後細胞の脱分極、の2つが最低限必要であることがわかっている。
- シナプス後細胞に脱分極電流を注入すると、強いテタヌス刺激を加えたのと同様のLTP誘導効果を得ることができる[8][9]。
- シナプス後細胞を脱分極させただけでは不十分で、同時にシナプス入力がなければLTPは誘導されない[10]。
- テタヌス刺激時にシナプス後細胞を過分極させるか、あるいは電位固定により脱分極を起こさないようにするとLTPが阻害される[9][11]。
グルタミン酸受容体活性化
このシナプスでの神経伝達物質は、興奮性アミノ酸であるグルタミン酸で、LTPの誘導と発現には2種類のグルタミン酸受容体が関与している。通常のシナプス伝達はAMPA型グルタミン酸受容体により媒介されており、NMDA型グルタミン酸受容体は細胞外のマグネシウムイオンにより、阻害されている(図2A)。刺激によりシナプス後細胞が強く脱分極すると、NMDA型グルタミン酸受容体のマグネシウム阻害が外れ、ナトリウムイオンやカリウムイオンの移動とともに、カルシウムイオンの流入が引き起こされLTPが誘導される(図2B)。
NMDA型グルタミン酸受容体の選択的アンタゴニストであるD-APV存在下ではLTPが誘導されないこと[12]や、細胞内のカルシウムイオンをキレートすることによってLTPが阻害される[13]といった一連の研究から、膜の脱分極によってNMDA型グルタミン酸受容体を介して細胞内へとカルシウムイオンの流入がおきる[14][15]ことがLTP誘導に必須であることがあきらかになっている(図2B)。
カルシウムイオンの機能
細胞内へと流入したカルシウムイオンは、さまざまなシグナル伝達系を活性化するが、中でもLTPと密接に関連していると考えられているのが、カルシウム-カルモデュリン依存性キナーゼII(calcium-calmodulin-dependent kinase II: CaMKII)である[16]。CaMKIIの基質にはAMPA型グルタミン酸受容体も含まれており、CaMKIIによるAMPA型グルタミン酸受容体のリン酸化がシナプス後部への移行を制御しているといった報告[17][18](図3A)や、AMPA型グルタミン酸受容体のリン酸化により受容体の単一チャネルコンダクタンス(single-channel conductance)が上昇する(図3B)という報告もあるが[19][20]、CaMKIIには他にも数百に及ぶ基質が知られており[21]、いずれの基質がLTPに重要であるのかは現在も検討が続いている状況である[22]。
またCaMKIIは他のリン酸化酵素と異なり、シナプスでの発現量が非常に多く、その量はアクチンなどの細胞骨格に匹敵するほどであることに加え[23]、12-14量体構造をとるといった特徴を持つことから[24]、単にリン酸化酵素として機能するにとどまらず、構造タンパク質としての側面がLTP制御の上で重要な役割を果たしている可能性も近年指摘されている[22][25]。
発現
誘導後に起こるシナプスの変化を発現 (expression) と呼ぶ。シナプス伝達効率の持続的な増強を引き起こす基盤機構であるため、その変化がシナプスのどこで起きているのかが早くから関心を集め、盛んに研究が行われた。
部位をめぐる論争:シナプス前性か?シナプス後性か?
量子解析(quantal analysis)を用いた研究において、変動係数(coefficient of variation: CV)の変化、およびシナプス応答欠損(synaptic failure)の減少が確認されたことから、LTPはシナプス前終末からの神経伝達物質放出確率(release probability: Pr)の増加に起因するとの説が、当初有力であった[26][27]。確かにこれらの実験結果は複数の異なる研究グループによって再現性が確かめられてはいたものの、一方でLTPが主にAMPA型グルタミン酸受容体を介したシナプス応答に選択的に認められる現象であることや[28][29]、LTP中に実際にグルタミン酸放出が亢進しているという実験結果が得られなかったこと[30][31][32]などとは矛盾しており、グルタミン酸放出の増加ではLTPを十分に説明することができないとする考えも多くあった。
その後、synaptic failureの減少は必ずしも放出確率の増加を意味するのではなく、シナプス後細胞に新たに機能的なAMPA型グルタミン酸受容体が発現することによっても説明がつくとの見方が提示されたのち[30]、神経伝達物質の放出確率を薬理学的に評価する新たな方法を用いた研究でも、LTPに伴って放出確率は増加しないことが報告された[33]。
さらに、AMPA型グルタミン酸受容体を欠くサイレントシナプス(silent synapse)が発見され、LTP誘導によりこのシナプスに新たにAMPA型グルタミン酸受容体が挿入されること(unsilencing)が実験的に確かめられた[34][35]。また、LTP誘導前後の微小シナプス後電流(miniature excitatory postsynaptic currents: mEPSCs)の詳細な解析から、サイレントシナプスだけでなく、もともとAMPA型グルタミン酸受容体を発現しているシナプスにおいても、AMPA型グルタミン酸受容体の発現増加によるLTPがおきることが確かめられ[36][37]、LTP発現部位としてのシナプス後細胞の重要性が強く認識されることとなった。
AMPA型グルタミン酸受容体のシナプス集積
上記の一連の結果は主に電気生理学的手法により得られたものであったが、その後のさまざまな技術革新(遺伝子改変技術や、蛍光タンパク質によるシナプスの可視化、高性能顕微鏡の開発等)により、LTP発現機構の解明はさらにすすめられ、現在では、主として誘導刺激後、シナプス後部にAMPA型グルタミン酸受容体が集積することでシナプス後細胞における神経伝達物質感受性の亢進により引き起こされるといった考えが広く受け入れられている。
これはAMPA型グルタミン酸受容体をGFPで蛍光ラベルして可視化する手法[38][39]や、GluA1-ホモメリック受容体(通常発現しているGluA2含有AMPA型グルタミン酸受容体とは電流―電圧関係が異なり整流性を示すために、内在性のAMPA型グルタミン酸受容体と電気生理学的に区別することができる)を海馬ニューロンに過剰発現させ、この外来性AMPA型グルタミン酸受容体がLTP誘導後に実際にシナプスへと移行していることを確かめることによって明らかにされた[40]。
シナプスへと集積するAMPA型グルタミン酸受容体は、細胞内のプールからエクソサイトーシスによって活動依存的にシナプスへと発現する(図3A, 左)という説のほか[41][42][43]、シナプス外(extrasynaptic site)に発現しているAMPA型グルタミン酸受容体が側方拡散(lateral diffusion)によってシナプスへと移行するという説(図3A, 右)などが唱えられている[44][45]。
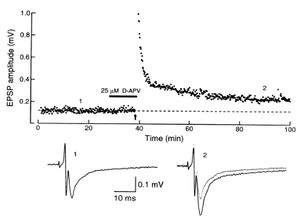
マウス海馬スライス標本の歯状回の細胞層にタングステン双極電極を刺入して顆粒細胞を電気刺激することにより苔状線維を発火させ、細胞外電位記録法によりCA3領域の透明層に刺入したガラス管記録電極で興奮性シナプス後電位(excitatory postsynaptic potential: EPSP)を記録している。0.1Hzでベースラインの反応を記録したあと、図中の上向き矢印の時点で100Hzの高頻度刺激を1秒間与え、その後、0.1Hzに戻してさらに1時間以上EPSPを記録しているが、シナプス応答が約2倍に増大し、持続している。高頻度刺激を与える際にNMDA受容体のアンタゴニストであるD-APVを灌流投与した(グラフ中の黒いバー)条件下でLTPが誘導されていることから、苔状線維シナプスでのLTP誘導にはシナプス後細胞の活動が不要であることを示している。
維持
シナプス伝達効率の持続的な増強の背景にある、何らかの継続的な生化学的変化のことを維持(maintenance)と呼ぶ。誘導や発現と比較すると、維持の分子機構は現在も不明な点が多い。
CaMKIIはカルシウム・カルモデュリンによる活性化を受けると、286番目のトレオニン残基(T286)が自己リン酸化され、持続活性型になるという性質をもつ。このことから、刺激による一過性のカルシウムイオン上昇を継続的な生化学的変化へと変換するキー分子としてLTPの維持においても重要な役割を果たしていると考えられてきた。しかし最近のFörster共鳴エネルギー移動(FRET)センサーを用いた、単一樹状突起スパインにおけるCaMKIIの活性化時間の評価によれば、CaMKIIの活性化は刺激後1分間程度と、従来想定されていたよりもはるかに短いことが報告されており[46][47][48]、維持の分子機構に関しては今後さらなる研究が必要である。
シナプス前性LTP
シナプス前終末からの神経伝達物質の放出が長期間にわたり増加する現象を指す。原理的には、ひとつのシナプス小胞内に含まれる神経伝達物質の量が増えることでもLTPが発現し得るが、ほとんどの場合は、シナプス小胞からの神経伝達物質の放出確率が長期的に増加することにより発現する。
シナプス前性LTPの代表は、海馬CA3領域苔状線維 (mossy fiber) シナプスでのLTPである[7][49]。CA3錐体細胞への入力線維である苔状線維に100Hz程度の高頻度刺激を与えると、その直後にはシナプス応答が10倍程度に増大し(図4A、矢印)、それ以降は急速に漸減するが、約30分程度で、もとのレベルの2倍~数倍程度増強された状態で安定する。この際、シナプス後細胞の活動は必要なく、シナプス前終末の活動だけで誘導されることから、いわゆるヘブ型(Hebbian LTP)と区別し、非ヘブ型LTP(non-Hebbian LTP)と呼ばれる。長期的な放出確率の増大にシナプス前終末内のサイクリックAMP (cAMP)が関与していると考えられている[50]。それに引き続く細胞内生化学過程についてはプロテインキナーゼAが関与するとの報告がある[51]。
関連項目
参考文献
- ↑ Lømo, T. (1966).
Frequency potentiation of excitatory synaptic activity in the dentate area of the hippocampal formation. Acta Physiol. Scand. 68 (Suppl. 277): 128 - ↑
Bliss, T.V., & Lomo, T. (1973).
Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. The Journal of physiology, 232(2), 331-56. [PubMed:4727084] [PMC] [WorldCat] [DOI] - ↑
Bliss, T.V., & Gardner-Medwin, A.R. (1973).
Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path. The Journal of physiology, 232(2), 357-74. [PubMed:4727085] [PMC] [WorldCat] [DOI] - ↑
Levy, W.B., & Steward, O. (1979).
Synapses as associative memory elements in the hippocampal formation. Brain research, 175(2), 233-45. [PubMed:487154] [WorldCat] [DOI] - ↑
McNaughton, B.L., Douglas, R.M., & Goddard, G.V. (1978).
Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain research, 157(2), 277-93. [PubMed:719524] [WorldCat] [DOI] - ↑ Hebb, D. O. (1949).
The Organization of Behavior: A Neuropsychological Theory. New York, Wiley & Sons</pubmed> - ↑ 7.0 7.1
Nicoll, R.A., & Schmitz, D. (2005).
Synaptic plasticity at hippocampal mossy fibre synapses. Nature reviews. Neuroscience, 6(11), 863-76. [PubMed:16261180] [WorldCat] [DOI] - ↑
Gustafsson, B., Wigström, H., Abraham, W.C., & Huang, Y.Y. (1987).
Long-term potentiation in the hippocampus using depolarizing current pulses as the conditioning stimulus to single volley synaptic potentials. The Journal of neuroscience : the official journal of the Society for Neuroscience, 7(3), 774-80. [PubMed:2881989] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Kelso, S.R., Ganong, A.H., & Brown, T.H. (1986).
Hebbian synapses in hippocampus. Proceedings of the National Academy of Sciences of the United States of America, 83(14), 5326-30. [PubMed:3460096] [PMC] [WorldCat] [DOI] - ↑
Malenka, R.C., Kauer, J.A., Perkel, D.J., & Nicoll, R.A. (1989).
The impact of postsynaptic calcium on synaptic transmission--its role in long-term potentiation. Trends in neurosciences, 12(11), 444-50. [PubMed:2479146] [WorldCat] [DOI] - ↑
Malinow, R., & Miller, J.P. (1986).
Postsynaptic hyperpolarization during conditioning reversibly blocks induction of long-term potentiation. Nature, 320(6062), 529-30. [PubMed:3008000] [WorldCat] [DOI] - ↑
Collingridge, G.L., Kehl, S.J., & McLennan, H. (1983).
Excitatory amino acids in synaptic transmission in the Schaffer collateral-commissural pathway of the rat hippocampus. The Journal of physiology, 334, 33-46. [PubMed:6306230] [PMC] [WorldCat] [DOI] - ↑
Lynch, G., Larson, J., Kelso, S., Barrionuevo, G., & Schottler, F. (1983).
Intracellular injections of EGTA block induction of hippocampal long-term potentiation. Nature, 305(5936), 719-21. [PubMed:6415483] [WorldCat] [DOI] - ↑
Ascher, P., & Nowak, L. (1988).
The role of divalent cations in the N-methyl-D-aspartate responses of mouse central neurones in culture. The Journal of physiology, 399, 247-66. [PubMed:2457089] [PMC] [WorldCat] [DOI] - ↑
MacDermott, A.B., Mayer, M.L., Westbrook, G.L., Smith, S.J., & Barker, J.L. (1986).
NMDA-receptor activation increases cytoplasmic calcium concentration in cultured spinal cord neurones. Nature, 321(6069), 519-22. [PubMed:3012362] [WorldCat] [DOI] - ↑
Lisman, J., Yasuda, R., & Raghavachari, S. (2012).
Mechanisms of CaMKII action in long-term potentiation. Nature reviews. Neuroscience, 13(3), 169-82. [PubMed:22334212] [PMC] [WorldCat] [DOI] - ↑
Henley, J.M., & Wilkinson, K.A. (2016).
Synaptic AMPA receptor composition in development, plasticity and disease. Nature reviews. Neuroscience, 17(6), 337-50. [PubMed:27080385] [WorldCat] [DOI] - ↑
Huganir, R.L., & Nicoll, R.A. (2013).
AMPARs and synaptic plasticity: the last 25 years. Neuron, 80(3), 704-17. [PubMed:24183021] [PMC] [WorldCat] [DOI] - ↑
Benke, T.A., Lüthi, A., Isaac, J.T., & Collingridge, G.L. (1998).
Modulation of AMPA receptor unitary conductance by synaptic activity. Nature, 393(6687), 793-7. [PubMed:9655394] [WorldCat] [DOI] - ↑
Derkach, V., Barria, A., & Soderling, T.R. (1999).
Ca2+/calmodulin-kinase II enhances channel conductance of alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate type glutamate receptors. Proceedings of the National Academy of Sciences of the United States of America, 96(6), 3269-74. [PubMed:10077673] [PMC] [WorldCat] [DOI] - ↑
Hornbeck, P.V., Zhang, B., Murray, B., Kornhauser, J.M., Latham, V., & Skrzypek, E. (2015).
PhosphoSitePlus, 2014: mutations, PTMs and recalibrations. Nucleic acids research, 43(Database issue), D512-20. [PubMed:25514926] [PMC] [WorldCat] [DOI] [URL] - ↑ 22.0 22.1
Hayashi, Y. (2022).
Molecular mechanism of hippocampal long-term potentiation - Towards multiscale understanding of learning and memory. Neuroscience research, 175, 3-15. [PubMed:34375719] [WorldCat] [DOI] - ↑
Erondu, N.E., & Kennedy, M.B. (1985).
Regional distribution of type II Ca2+/calmodulin-dependent protein kinase in rat brain. The Journal of neuroscience : the official journal of the Society for Neuroscience, 5(12), 3270-7. [PubMed:4078628] [PMC] [WorldCat] [DOI] - ↑
Hoelz, A., Nairn, A.C., & Kuriyan, J. (2003).
Crystal structure of a tetradecameric assembly of the association domain of Ca2+/calmodulin-dependent kinase II. Molecular cell, 11(5), 1241-51. [PubMed:12769848] [WorldCat] [DOI] - ↑
Nicoll, R.A., & Schulman, H. (2023).
Synaptic memory and CaMKII. Physiological reviews, 103(4), 2877-2925. [PubMed:37290118] [PMC] [WorldCat] [DOI] - ↑
Bekkers, J.M., & Stevens, C.F. (1990).
Presynaptic mechanism for long-term potentiation in the hippocampus. Nature, 346(6286), 724-9. [PubMed:2167454] [WorldCat] [DOI] - ↑
Malinow, R., & Tsien, R.W. (1990).
Presynaptic enhancement shown by whole-cell recordings of long-term potentiation in hippocampal slices. Nature, 346(6280), 177-80. [PubMed:2164158] [WorldCat] [DOI] - ↑
Kullmann, D.M. (1994).
Amplitude fluctuations of dual-component EPSCs in hippocampal pyramidal cells: implications for long-term potentiation. Neuron, 12(5), 1111-20. [PubMed:7910467] [WorldCat] [DOI] - ↑
Muller, D., Joly, M., & Lynch, G. (1988).
Contributions of quisqualate and NMDA receptors to the induction and expression of LTP. Science (New York, N.Y.), 242(4886), 1694-7. [PubMed:2904701] [WorldCat] [DOI] - ↑ 30.0 30.1
Manabe, T., Wyllie, D.J., Perkel, D.J., & Nicoll, R.A. (1993).
Modulation of synaptic transmission and long-term potentiation: effects on paired pulse facilitation and EPSC variance in the CA1 region of the hippocampus. Journal of neurophysiology, 70(4), 1451-9. [PubMed:7904300] [WorldCat] [DOI] - ↑
Diamond, J.S., Bergles, D.E., & Jahr, C.E. (1998).
Glutamate release monitored with astrocyte transporter currents during LTP. Neuron, 21(2), 425-33. [PubMed:9728923] [WorldCat] [DOI] - ↑
Lüscher, C., Malenka, R.C., & Nicoll, R.A. (1998).
Monitoring glutamate release during LTP with glial transporter currents. Neuron, 21(2), 435-41. [PubMed:9728924] [WorldCat] [DOI] - ↑
Manabe, T., & Nicoll, R.A. (1994).
Long-term potentiation: evidence against an increase in transmitter release probability in the CA1 region of the hippocampus. Science (New York, N.Y.), 265(5180), 1888-92. [PubMed:7916483] [WorldCat] [DOI] - ↑
Isaac, J.T., Nicoll, R.A., & Malenka, R.C. (1995).
Evidence for silent synapses: implications for the expression of LTP. Neuron, 15(2), 427-34. [PubMed:7646894] [WorldCat] [DOI] - ↑
Liao, D., Hessler, N.A., & Malinow, R. (1995).
Activation of postsynaptically silent synapses during pairing-induced LTP in CA1 region of hippocampal slice. Nature, 375(6530), 400-4. [PubMed:7760933] [WorldCat] [DOI] - ↑
Manabe, T., Renner, P., & Nicoll, R.A. (1992).
Postsynaptic contribution to long-term potentiation revealed by the analysis of miniature synaptic currents. Nature, 355(6355), 50-5. [PubMed:1346229] [WorldCat] [DOI] - ↑
Oliet, S.H., Malenka, R.C., & Nicoll, R.A. (1996).
Bidirectional control of quantal size by synaptic activity in the hippocampus. Science (New York, N.Y.), 271(5253), 1294-7. [PubMed:8638114] [WorldCat] [DOI] - ↑
Bosch, M., Castro, J., Saneyoshi, T., Matsuno, H., Sur, M., & Hayashi, Y. (2014).
Structural and molecular remodeling of dendritic spine substructures during long-term potentiation. Neuron, 82(2), 444-59. [PubMed:24742465] [PMC] [WorldCat] [DOI] - ↑
Shi, S.H., Hayashi, Y., Petralia, R.S., Zaman, S.H., Wenthold, R.J., Svoboda, K., & Malinow, R. (1999).
Rapid spine delivery and redistribution of AMPA receptors after synaptic NMDA receptor activation. Science (New York, N.Y.), 284(5421), 1811-6. [PubMed:10364548] [WorldCat] [DOI] - ↑
Hayashi, Y., Shi, S.H., Esteban, J.A., Piccini, A., Poncer, J.C., & Malinow, R. (2000).
Driving AMPA receptors into synapses by LTP and CaMKII: requirement for GluR1 and PDZ domain interaction. Science (New York, N.Y.), 287(5461), 2262-7. [PubMed:10731148] [WorldCat] [DOI] - ↑
Kennedy, M.J., & Ehlers, M.D. (2011).
Mechanisms and function of dendritic exocytosis. Neuron, 69(5), 856-75. [PubMed:21382547] [PMC] [WorldCat] [DOI] - ↑
Makino, H., & Malinow, R. (2009).
AMPA receptor incorporation into synapses during LTP: the role of lateral movement and exocytosis. Neuron, 64(3), 381-90. [PubMed:19914186] [PMC] [WorldCat] [DOI] - ↑
Patterson, M.A., Szatmari, E.M., & Yasuda, R. (2010).
AMPA receptors are exocytosed in stimulated spines and adjacent dendrites in a Ras-ERK-dependent manner during long-term potentiation. Proceedings of the National Academy of Sciences of the United States of America, 107(36), 15951-6. [PubMed:20733080] [PMC] [WorldCat] [DOI] - ↑
Choquet, D., & Triller, A. (2003).
The role of receptor diffusion in the organization of the postsynaptic membrane. Nature reviews. Neuroscience, 4(4), 251-65. [PubMed:12671642] [WorldCat] [DOI] - ↑
Opazo, P., Sainlos, M., & Choquet, D. (2012).
Regulation of AMPA receptor surface diffusion by PSD-95 slots. Current opinion in neurobiology, 22(3), 453-60. [PubMed:22051694] [WorldCat] [DOI] - ↑
Lee, S.J., Escobedo-Lozoya, Y., Szatmari, E.M., & Yasuda, R. (2009).
Activation of CaMKII in single dendritic spines during long-term potentiation. Nature, 458(7236), 299-304. [PubMed:19295602] [PMC] [WorldCat] [DOI] - ↑
Chang, J.Y., Parra-Bueno, P., Laviv, T., Szatmari, E.M., Lee, S.R., & Yasuda, R. (2017).
CaMKII Autophosphorylation Is Necessary for Optimal Integration of Ca2+ Signals during LTP Induction, but Not Maintenance. Neuron, 94(4), 800-808.e4. [PubMed:28521133] [PMC] [WorldCat] [DOI] - ↑
Saneyoshi, T., Matsuno, H., Suzuki, A., Murakoshi, H., Hedrick, N.G., Agnello, E., ..., & Hayashi, Y. (2019).
Reciprocal Activation within a Kinase-Effector Complex Underlying Persistence of Structural LTP. Neuron, 102(6), 1199-1210.e6. [PubMed:31078368] [PMC] [WorldCat] [DOI] - ↑
Zalutsky, R.A., & Nicoll, R.A. (1990).
Comparison of two forms of long-term potentiation in single hippocampal neurons. Science (New York, N.Y.), 248(4963), 1619-24. [PubMed:2114039] [WorldCat] [DOI] - ↑
Weisskopf, M.G., Castillo, P.E., Zalutsky, R.A., & Nicoll, R.A. (1994).
Mediation of hippocampal mossy fiber long-term potentiation by cyclic AMP. Science (New York, N.Y.), 265(5180), 1878-82. [PubMed:7916482] [WorldCat] [DOI] - ↑
Shahoha, M., Cohen, R., Ben-Simon, Y., & Ashery, U. (2022).
cAMP-Dependent Synaptic Plasticity at the Hippocampal Mossy Fiber Terminal. Frontiers in synaptic neuroscience, 14, 861215. [PubMed:35444523] [PMC] [WorldCat] [DOI]

