「膜電位センサー」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の25版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:voltage sensor、electric potential sensor | |||
[[Image:voltagesensor0.jpg|thumb|200px|<b>図1. 電位センサードメインの結晶構造</b>]] | |||
関連語: 電位依存性イオンチャネル | |||
=== 膜電位センサーとは === | |||
細胞内外の電位差([[膜電位]])を感知するセンサー。代表例として[[電位依存性イオンチャネル]]タンパク質の電位センサードメインが挙げられる。 | |||
=== | === 膜電位の概念 === | ||
[[Image: | [[Image:voltagesensor1.jpg|thumb|300px|<b>図2. 電位依存性イオンチャネルの基本構造</b>]] | ||
細胞は[[ | 細胞は[[wikipedia:ja:誘電体|誘電体]]である脂質二重膜([[細胞膜]])によって外界と内部を電気的に遮断している。膜により隔たれた組成の異なる溶液の間に発生する電位差を膜電位と言う。[[wikipedia:ja:ほ乳類|ほ乳類]]の[[wikipedia:ja:神経細胞|神経細胞]]の細胞膜には[[wikipedia:ja:Na+|Na<sup>+</sup>]]と[[wikipedia:ja:K+|K<sup>+</sup>]]を交換するポンプ([[Na+/K+ ATPase|Na<sup>+</sup>/K<sup>+</sup> ATPase]])が存在し、細胞内はK<sup>+</sup>が多くNa<sup>+</sup>が少なく、細胞外はNa<sup>+</sup>が多くK<sup>+</sup>が少ない、という細胞膜を隔てたイオン濃度勾配が存在する。イオン選択性を有するイオンチャネルの働きにより細胞膜はK<sup>+</sup>の透過性が高く、そのため細胞内電位が細胞外電位に対して-60~-80mV低い([[静止膜電位]])。化学的[[シナプス伝達]]や電気刺激などの種々の物理的刺激により、細胞膜のイオン透過性が変化し膜電位は変動する。主に[[電位依存性ナトリウムチャネル]]の働きにより、一過性にゼロを超える(オーバーシュート)自己再生的な膜電位の変動が見られる([[活動電位]])。このように神経細胞における膜電位はスパイク発火時に時々刻々と変化しており、その膜電位変化を感知するのが膜電位センサーである。電位依存性イオンチャネルの場合、膜電位変化を電位センサードメインが感知して、分子内で[[イオン透過ゲート]]を開く力に変換される、その結果、イオン透過量が膜電位に依存して変化する。 | ||
=== | === 膜電位センサー研究の歴史 === | ||
[[Image: | [[Image:voltagesensor2.jpg|thumb|300px|<b>図3. 電位センサードメイン(S4)のマルチプルアライン</b>]] | ||
18世紀中頃イタリアの医師[[ | 18世紀中頃イタリアの医師[[wikipedia:ja:ガルヴァーニ|ガルヴァーニ]]が、[[wikipedia:ja:カエル|カエル]]の[[wikipedia:ja:筋肉|筋肉]]がカミナリの[[wikipedia:ja:雷光|雷光]]により収縮することを発見してから、生命現象と電気的活動の関係を探る研究が今日に至るまで盛んに行われている。膜電位センサーの概念は1952年の[[wikipedia:ja:イカ|イカ]]の巨大[[軸索]]を使った[[wikipedia:ja:アラン・ロイド・ホジキン|Hodgkin]]-[[wikipedia:ja:アンドリュー・フィールディング・ハクスリー|Huxley]]の研究において初めて導入され、膜電位に依存して起こる神経の電気的興奮において膜電位センサーの存在が想定された<ref><pubmed> 14946712 </pubmed></ref>。1974年にArmstrong & Bezanillaによりイカの巨大軸索から電位依存性チャネルのゲート開口に伴う電荷の移動([[ゲート電流]])が初めて観測され、膜電位に依存する分子の挙動が反応速度論的に証明された<ref><pubmed> 4824995 </pubmed></ref>。 | ||
1980年代に、種々の[[電位依存性チャネル]]がクローニングされ<ref><pubmed> 6209577 </pubmed></ref><ref><pubmed> 3037387 </pubmed></ref><ref><pubmed> 2441471 </pubmed></ref> | 1980年代に、種々の[[電位依存性チャネル]]がクローニングされ<ref><pubmed> 6209577 </pubmed></ref><ref><pubmed> 3037387 </pubmed></ref><ref><pubmed> 2441471 </pubmed></ref>、保存されたアミノ酸配列として電荷を帯びた残基を有する膜貫通領域を中心とした電位センサードメインによる膜電位感知機構が想定された。クローニング以降、分子生物学的手法を組み合わせた電気生理学的機能解析が発展し、電位依存性イオンチャネルの電位センサードメインの作動機構に対して種々のモデルが提唱されている。2005年に[[電位依存性ホスファターゼ]](VSP)の発見により電位センサードメインを有する蛋白質がイオンチャネル以外にも存在し電位センサーが酵素活性の調節に対しても機能していることが明らかになった<ref><pubmed> 15902207 </pubmed></ref>。2003年に[[wikipedia:ja:古細菌|古細菌]]<ref><pubmed> 12721618 </pubmed></ref>、2005年にはほ乳類<ref><pubmed> 16002581 </pubmed></ref>の電位依存性チャネルの結晶構造が解かれ、電位センサードメインの機能解析が原子レベルで解析される形となった。また、電位センサーの概念が成熟した現在では、電位依存性チャネルの様な電位センサードメインを有さない膜蛋白質からも電位依存的な活性やゲート電流の観測が報告されている。 | ||
== | === 電位依存性イオンチャネルの膜電位センサーの構造と作動機構 === | ||
[[Image: | [[Image:voltagesensor4.jpg|thumb|300px|<b>図4. S4チャージの移動</b>]] | ||
電位依存性イオンチャネルの共通骨格は、S1-S6の6本の膜貫通ヘリックスから構成され、後半S5-S6をポアドメイン、前半S1-S4を電位センサードメインとして分類されている。S4には正電荷をおびた[[ | 電位依存性イオンチャネルの共通骨格は、S1-S6の6本の膜貫通ヘリックスから構成され、後半S5-S6をポアドメイン、前半S1-S4を電位センサードメインとして分類されている。S4には正電荷をおびた[[wikipedia:ja:アミノ酸|アミノ酸]]残基(主に[[wikipedia:ja:アルギニン|アルギニン]])が3残基おきに4-7個規則正しく存在し、S1、S2に存在する負電荷を帯びたアミノ酸残基と[[wikipedia:ja:塩橋|塩橋]]を構成することで、電位センサードメインのフォールディング<ref><pubmed> 16002581 </pubmed></ref>、膜へのトラフィッキングを維持している<ref><pubmed> 12556517 </pubmed></ref>。 | ||
S4の正電荷を帯びたアミノ酸残基は、膜電位変化を感知する中心的な役割を担っている。これら正電荷が膜電位変化に応答して細胞膜にかかる電場を横切って移動し、「ゲート電流」として観測される。実際には、これらの残基のうち細胞外側の4つが有効なゲーティングチャージ(~+4e)として働く事が知られている<ref><pubmed> 8562074 </pubmed></ref><ref><pubmed> 8663993 </pubmed></ref>。4リピート構造である通常の電位依存性イオンチャネルの場合は4つある電位センサーが作動して初めてチャネルが開口する仕組みを取っており、チャネルの[[開口確率]]は膜電位に対して急勾配の[[ | S4の正電荷を帯びたアミノ酸残基は、膜電位変化を感知する中心的な役割を担っている。これら正電荷が膜電位変化に応答して細胞膜にかかる電場を横切って移動し、「ゲート電流」として観測される。実際には、これらの残基のうち細胞外側の4つが有効なゲーティングチャージ(~+4e)として働く事が知られている<ref><pubmed> 8562074 </pubmed></ref><ref><pubmed> 8663993 </pubmed></ref>。4リピート構造である通常の電位依存性イオンチャネルの場合は4つある電位センサーが作動して初めてチャネルが開口する仕組みを取っており、チャネルの[[開口確率]]は膜電位に対して急勾配の[[wikipedia:ja:ボルツマン関数|ボルツマン関数]](+12e~+13e)となっており、[[wikipedia:ja:半導体|半導体]]素子の電位依存性(+1e)と比較しても極めてシャープな電位依存性を有する。これは、神経細胞において膜電位の有効レンジの幅(-60~+40mV)が電子機器類よりも狭いにも関わらずON/OFFを明確に区別する機能素子を作り出す上で有効な仕組みである<ref><pubmed> 12721605 </pubmed></ref>。電位センサードメインが2量体化した構造で機能するタンパク質である[[電位依存性H+チャネル|電位依存性H<sup>+</sup>チャネル]]<ref><pubmed> 16556803 </pubmed></ref><ref><pubmed> 16554753 </pubmed></ref>は、開く際に2量体間で協調が起こり、電位依存性を増強している<ref><pubmed> 20023639 </pubmed></ref><ref><pubmed> 22569364 </pubmed></ref>。電位センサーには細胞内外からくさび状に水が陥入し、実効膜電位は電位センサー中心部の疎水性バリアの部分に収束していることが想定されている<ref><pubmed> 9370423 </pubmed></ref><ref><pubmed> 15694325 </pubmed></ref>。このことも、最小限の構造変化で最大限の電荷の移動を生みだしている。 | ||
=== 電位センサーに作用する薬剤 === | |||
毒蜘蛛の一種[[wikipedia:ja:タランチュラ|タランチュラ]]の毒である[[wikipedia:ja:ハナトキシン|ハナトキシン]]は電位依存性チャネルの電位センサーに結合して阻害する<ref><pubmed> 9136774 </pubmed></ref>。 | |||
=== その他、膜電位依存的な活性を有する分子 === | |||
電位依存性イオンチャネル型の電位センサードメインを有していないイオンチャネルや膜蛋白質からも電位依存性な活性変化が報告されている<ref><pubmed> 19114637 </pubmed></ref><ref><pubmed> 20208975 </pubmed></ref><ref><pubmed> 16532008 </pubmed></ref><ref><pubmed> 7534411 </pubmed></ref>。[[内耳有毛細胞]]で膜電位に応答して伸び縮みする膜蛋白である[[プレスチン]]は電場内にCl-を保持し電位センサーとして使っている<ref><pubmed> 11423665 </pubmed></ref>。[[代謝型アセチルコリン受容体]](M1受容体)は電位依存的な[[リガンド]]親和性の変化を呈しゲート電流が観測される<ref><pubmed> 17065983 </pubmed></ref>。 | |||
=== 関連項目 === | |||
*[[静止膜電位]] | *[[静止膜電位]] | ||
*[[活動電位]] | *[[活動電位]] | ||
| 64行目: | 46行目: | ||
*[[ナトリウムチャネル]] | *[[ナトリウムチャネル]] | ||
*[[カルシウムチャネル]] | *[[カルシウムチャネル]] | ||
*[[膜電位感受性色素]] | *[[膜電位感受性色素]] | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:藤原祐一郎、岡村康司 担当編集委員:柚崎通介) | |||
2012年6月12日 (火) 13:39時点における版
英語名:voltage sensor、electric potential sensor
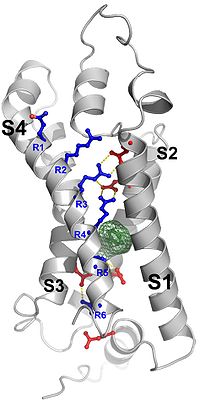
関連語: 電位依存性イオンチャネル
膜電位センサーとは
細胞内外の電位差(膜電位)を感知するセンサー。代表例として電位依存性イオンチャネルタンパク質の電位センサードメインが挙げられる。
膜電位の概念
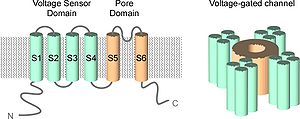
細胞は誘電体である脂質二重膜(細胞膜)によって外界と内部を電気的に遮断している。膜により隔たれた組成の異なる溶液の間に発生する電位差を膜電位と言う。ほ乳類の神経細胞の細胞膜にはNa+とK+を交換するポンプ(Na+/K+ ATPase)が存在し、細胞内はK+が多くNa+が少なく、細胞外はNa+が多くK+が少ない、という細胞膜を隔てたイオン濃度勾配が存在する。イオン選択性を有するイオンチャネルの働きにより細胞膜はK+の透過性が高く、そのため細胞内電位が細胞外電位に対して-60~-80mV低い(静止膜電位)。化学的シナプス伝達や電気刺激などの種々の物理的刺激により、細胞膜のイオン透過性が変化し膜電位は変動する。主に電位依存性ナトリウムチャネルの働きにより、一過性にゼロを超える(オーバーシュート)自己再生的な膜電位の変動が見られる(活動電位)。このように神経細胞における膜電位はスパイク発火時に時々刻々と変化しており、その膜電位変化を感知するのが膜電位センサーである。電位依存性イオンチャネルの場合、膜電位変化を電位センサードメインが感知して、分子内でイオン透過ゲートを開く力に変換される、その結果、イオン透過量が膜電位に依存して変化する。
膜電位センサー研究の歴史

18世紀中頃イタリアの医師ガルヴァーニが、カエルの筋肉がカミナリの雷光により収縮することを発見してから、生命現象と電気的活動の関係を探る研究が今日に至るまで盛んに行われている。膜電位センサーの概念は1952年のイカの巨大軸索を使ったHodgkin-Huxleyの研究において初めて導入され、膜電位に依存して起こる神経の電気的興奮において膜電位センサーの存在が想定された[1]。1974年にArmstrong & Bezanillaによりイカの巨大軸索から電位依存性チャネルのゲート開口に伴う電荷の移動(ゲート電流)が初めて観測され、膜電位に依存する分子の挙動が反応速度論的に証明された[2]。
1980年代に、種々の電位依存性チャネルがクローニングされ[3][4][5]、保存されたアミノ酸配列として電荷を帯びた残基を有する膜貫通領域を中心とした電位センサードメインによる膜電位感知機構が想定された。クローニング以降、分子生物学的手法を組み合わせた電気生理学的機能解析が発展し、電位依存性イオンチャネルの電位センサードメインの作動機構に対して種々のモデルが提唱されている。2005年に電位依存性ホスファターゼ(VSP)の発見により電位センサードメインを有する蛋白質がイオンチャネル以外にも存在し電位センサーが酵素活性の調節に対しても機能していることが明らかになった[6]。2003年に古細菌[7]、2005年にはほ乳類[8]の電位依存性チャネルの結晶構造が解かれ、電位センサードメインの機能解析が原子レベルで解析される形となった。また、電位センサーの概念が成熟した現在では、電位依存性チャネルの様な電位センサードメインを有さない膜蛋白質からも電位依存的な活性やゲート電流の観測が報告されている。
電位依存性イオンチャネルの膜電位センサーの構造と作動機構
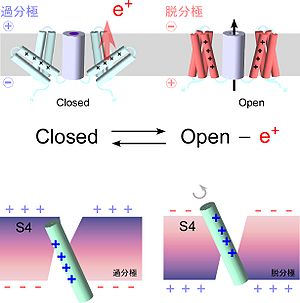
電位依存性イオンチャネルの共通骨格は、S1-S6の6本の膜貫通ヘリックスから構成され、後半S5-S6をポアドメイン、前半S1-S4を電位センサードメインとして分類されている。S4には正電荷をおびたアミノ酸残基(主にアルギニン)が3残基おきに4-7個規則正しく存在し、S1、S2に存在する負電荷を帯びたアミノ酸残基と塩橋を構成することで、電位センサードメインのフォールディング[9]、膜へのトラフィッキングを維持している[10]。
S4の正電荷を帯びたアミノ酸残基は、膜電位変化を感知する中心的な役割を担っている。これら正電荷が膜電位変化に応答して細胞膜にかかる電場を横切って移動し、「ゲート電流」として観測される。実際には、これらの残基のうち細胞外側の4つが有効なゲーティングチャージ(~+4e)として働く事が知られている[11][12]。4リピート構造である通常の電位依存性イオンチャネルの場合は4つある電位センサーが作動して初めてチャネルが開口する仕組みを取っており、チャネルの開口確率は膜電位に対して急勾配のボルツマン関数(+12e~+13e)となっており、半導体素子の電位依存性(+1e)と比較しても極めてシャープな電位依存性を有する。これは、神経細胞において膜電位の有効レンジの幅(-60~+40mV)が電子機器類よりも狭いにも関わらずON/OFFを明確に区別する機能素子を作り出す上で有効な仕組みである[13]。電位センサードメインが2量体化した構造で機能するタンパク質である電位依存性H+チャネル[14][15]は、開く際に2量体間で協調が起こり、電位依存性を増強している[16][17]。電位センサーには細胞内外からくさび状に水が陥入し、実効膜電位は電位センサー中心部の疎水性バリアの部分に収束していることが想定されている[18][19]。このことも、最小限の構造変化で最大限の電荷の移動を生みだしている。
電位センサーに作用する薬剤
毒蜘蛛の一種タランチュラの毒であるハナトキシンは電位依存性チャネルの電位センサーに結合して阻害する[20]。
その他、膜電位依存的な活性を有する分子
電位依存性イオンチャネル型の電位センサードメインを有していないイオンチャネルや膜蛋白質からも電位依存性な活性変化が報告されている[21][22][23][24]。内耳有毛細胞で膜電位に応答して伸び縮みする膜蛋白であるプレスチンは電場内にCl-を保持し電位センサーとして使っている[25]。代謝型アセチルコリン受容体(M1受容体)は電位依存的なリガンド親和性の変化を呈しゲート電流が観測される[26]。
関連項目
参考文献
- ↑
HODGKIN, A.L., HUXLEY, A.F., & KATZ, B. (1952).
Measurement of current-voltage relations in the membrane of the giant axon of Loligo. The Journal of physiology, 116(4), 424-48. [PubMed:14946712] [PMC] [WorldCat] [DOI] - ↑
Armstrong, C.M., & Bezanilla, F. (1974).
Charge movement associated with the opening and closing of the activation gates of the Na channels. The Journal of general physiology, 63(5), 533-52. [PubMed:4824995] [PMC] [WorldCat] [DOI] - ↑
Noda, M., Shimizu, S., Tanabe, T., Takai, T., Kayano, T., Ikeda, T., ..., & Minamino, N. (1984).
Primary structure of Electrophorus electricus sodium channel deduced from cDNA sequence. Nature, 312(5990), 121-7. [PubMed:6209577] [WorldCat] [DOI] - ↑
Tanabe, T., Takeshima, H., Mikami, A., Flockerzi, V., Takahashi, H., Kangawa, K., ..., & Numa, S. (1987).
Primary structure of the receptor for calcium channel blockers from skeletal muscle. Nature, 328(6128), 313-8. [PubMed:3037387] [WorldCat] [DOI] - ↑
Tempel, B.L., Papazian, D.M., Schwarz, T.L., Jan, Y.N., & Jan, L.Y. (1987).
Sequence of a probable potassium channel component encoded at Shaker locus of Drosophila. Science (New York, N.Y.), 237(4816), 770-5. [PubMed:2441471] [WorldCat] [DOI] - ↑
Murata, Y., Iwasaki, H., Sasaki, M., Inaba, K., & Okamura, Y. (2005).
Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor. Nature, 435(7046), 1239-43. [PubMed:15902207] [WorldCat] [DOI] - ↑
Jiang, Y., Lee, A., Chen, J., Ruta, V., Cadene, M., Chait, B.T., & MacKinnon, R. (2003).
X-ray structure of a voltage-dependent K+ channel. Nature, 423(6935), 33-41. [PubMed:12721618] [WorldCat] [DOI] - ↑
Long, S.B., Campbell, E.B., & Mackinnon, R. (2005).
Crystal structure of a mammalian voltage-dependent Shaker family K+ channel. Science (New York, N.Y.), 309(5736), 897-903. [PubMed:16002581] [WorldCat] [DOI] - ↑
Long, S.B., Campbell, E.B., & Mackinnon, R. (2005).
Crystal structure of a mammalian voltage-dependent Shaker family K+ channel. Science (New York, N.Y.), 309(5736), 897-903. [PubMed:16002581] [WorldCat] [DOI] - ↑
Sato, Y., Sakaguchi, M., Goshima, S., Nakamura, T., & Uozumi, N. (2003).
Molecular dissection of the contribution of negatively and positively charged residues in S2, S3, and S4 to the final membrane topology of the voltage sensor in the K+ channel, KAT1. The Journal of biological chemistry, 278(15), 13227-34. [PubMed:12556517] [WorldCat] [DOI] - ↑
Yang, N., George, A.L., & Horn, R. (1996).
Molecular basis of charge movement in voltage-gated sodium channels. Neuron, 16(1), 113-22. [PubMed:8562074] [WorldCat] [DOI] - ↑
Aggarwal, S.K., & MacKinnon, R. (1996).
Contribution of the S4 segment to gating charge in the Shaker K+ channel. Neuron, 16(6), 1169-77. [PubMed:8663993] [WorldCat] [DOI] - ↑
Sigworth, F.J. (2003).
Structural biology: Life's transistors. Nature, 423(6935), 21-2. [PubMed:12721605] [WorldCat] [DOI] - ↑
Sasaki, M., Takagi, M., & Okamura, Y. (2006).
A voltage sensor-domain protein is a voltage-gated proton channel. Science (New York, N.Y.), 312(5773), 589-92. [PubMed:16556803] [WorldCat] [DOI] - ↑
Ramsey, I.S., Moran, M.M., Chong, J.A., & Clapham, D.E. (2006).
A voltage-gated proton-selective channel lacking the pore domain. Nature, 440(7088), 1213-6. [PubMed:16554753] [PMC] [WorldCat] [DOI] - ↑
Gonzalez, C., Koch, H.P., Drum, B.M., & Larsson, H.P. (2010).
Strong cooperativity between subunits in voltage-gated proton channels. Nature structural & molecular biology, 17(1), 51-6. [PubMed:20023639] [PMC] [WorldCat] [DOI] - ↑
Fujiwara, Y., Kurokawa, T., Takeshita, K., Kobayashi, M., Okochi, Y., Nakagawa, A., & Okamura, Y. (2012).
The cytoplasmic coiled-coil mediates cooperative gating temperature sensitivity in the voltage-gated H(+) channel Hv1. Nature communications, 3, 816. [PubMed:22569364] [WorldCat] [DOI] - ↑
Yang, N., George, A.L., & Horn, R. (1997).
Probing the outer vestibule of a sodium channel voltage sensor. Biophysical journal, 73(5), 2260-8. [PubMed:9370423] [PMC] [WorldCat] [DOI] - ↑
Tombola, F., Pathak, M.M., & Isacoff, E.Y. (2005).
Voltage-sensing arginines in a potassium channel permeate and occlude cation-selective pores. Neuron, 45(3), 379-88. [PubMed:15694325] [WorldCat] [DOI] - ↑
Swartz, K.J., & MacKinnon, R. (1997).
Hanatoxin modifies the gating of a voltage-dependent K+ channel through multiple binding sites. Neuron, 18(4), 665-73. [PubMed:9136774] [WorldCat] [DOI] - ↑
Fujiwara, Y., Keceli, B., Nakajo, K., & Kubo, Y. (2009).
Voltage- and [ATP]-dependent gating of the P2X(2) ATP receptor channel. The Journal of general physiology, 133(1), 93-109. [PubMed:19114637] [PMC] [WorldCat] [DOI] - ↑
Kurata, H.T., Rapedius, M., Kleinman, M.J., Baukrowitz, T., & Nichols, C.G. (2010).
Voltage-dependent gating in a "voltage sensor-less" ion channel. PLoS biology, 8(2), e1000315. [PubMed:20208975] [PMC] [WorldCat] [DOI] - ↑
Cordero-Morales, J.F., Cuello, L.G., & Perozo, E. (2006).
Voltage-dependent gating at the KcsA selectivity filter. Nature structural & molecular biology, 13(4), 319-22. [PubMed:16532008] [WorldCat] [DOI] - ↑
Oiki, S., Koeppe, R.E., & Andersen, O.S. (1995).
Voltage-dependent gating of an asymmetric gramicidin channel. Proceedings of the National Academy of Sciences of the United States of America, 92(6), 2121-5. [PubMed:7534411] [PMC] [WorldCat] [DOI] - ↑
Oliver, D., He, D.Z., Klöcker, N., Ludwig, J., Schulte, U., Waldegger, S., ..., & Fakler, B. (2001).
Intracellular anions as the voltage sensor of prestin, the outer hair cell motor protein. Science (New York, N.Y.), 292(5525), 2340-3. [PubMed:11423665] [WorldCat] [DOI] - ↑
Ben-Chaim, Y., Chanda, B., Dascal, N., Bezanilla, F., Parnas, I., & Parnas, H. (2006).
Movement of 'gating charge' is coupled to ligand binding in a G-protein-coupled receptor. Nature, 444(7115), 106-9. [PubMed:17065983] [WorldCat] [DOI]
(執筆者:藤原祐一郎、岡村康司 担当編集委員:柚崎通介)