(3人の利用者による、間の16版が非表示) 1行目:
1行目: <div align="right">
神経科学において、モノアミンとは、主にセロトニン(インドールアミンの一種)、およびドーパミン、ノルアドレナリン、アドレナリン(この3つはカテコールアミンの一種)を主に指す。また、ヒスタミンもモノアミン神経伝達物質の一種である。これらは神経系において、神経伝達物質または神経修飾物質(neuromodulator)として働く。各物質についてはそれぞれの項を参照のこと。ここでは主要な共通する特徴、および補足事項を記す。
<font size="+1">[http://researchmap.jp/read0180056 井上 猛]</font>(抄録、ノルアドレナリン、ドーパミン、セロトニン)<br>
''北海道大学 大学院医学研究科精神医学分野''<br>
<font size="+1">[http://researchmap.jp/hirofumitokuoka 徳岡 宏文]、[http://researchmap.jp/hiroshiichinose 一瀬 宏]</font>(モノアミンとは、アドレナリン、ヒスタミン)<br>
''東京工業大学''<br>
DOI:<selfdoi /> 原稿受付日:2012年6月15日 原稿完成日:2012年11月16日 原稿更新日:2013年8月28日<br>
担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史]、[http://researchmap.jp/2rikenbsi 林 康紀]<br>(独立行政法人理化学研究所 脳科学総合研究センター)<br>
</div>
英語名:monoamine 独:Monoamine 仏:monoamine
== 構造 ==
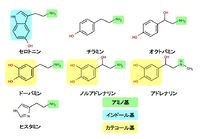
[[Image:4MA fig1.jpg|thumb|200px|'''図.モノアミン神経伝達物質''']]
{{box|text=
アミノ基 を一つ持つ(図)。セロトニンはインドール基をもつので、インドールアミンといえる。またドーパミン、ノルアドレナリン、アドレナリンはカテコール基をもつので、カテコールアミンとも呼ばれる。
[[モノアミン]]とは[[ドーパミン]]、[[ノルアドレナリン]]、[[アドレナリン]]、[[セロトニン]]、[[ヒスタミン]]などの[[神経伝達物質]]の総称である。いずれの神経伝達物質も一つのアミノ基が2つの炭素鎖により[[wikipedia:ja:芳香環|芳香環]]につながる化学構造を有する。[[wikipedia:ja:霊長類|霊長類]]、[[wikipedia:ja:齧歯類|齧歯類]]ではモノアミン含有神経細胞の細胞体は[[脳幹]]部にあり、ほぼ脳全体に[[神経軸索]]を投射するため、モノアミン神経系(モノアミン系)は広汎投射神経系としての特徴を有する。
}}
== Neuromodulatorとしての機能 ==
[[Image:4MA fig1.jpg|thumb|450px|'''図.モノアミン神経伝達物質''']]
モノアミン神経伝達物質は脳・神経機能を「修飾(modulate)」すると言われる。すなわち、例えば代表的な神経伝達物質であるグルタミン酸は、イオンチャンネル型グルタミン酸受容体を介して速い神経興奮を引き起こし、また短期・長期の可塑性を示す(シナプス可塑性)。一方、モノアミン神経伝達物質は、神経細胞の興奮生やシナプス可塑性を様々な経路を介して調節し、脳機能に影響を与えると考えられている。
==モノアミンとは==
== 精神疾患との関連 ==
神経科学において、モノアミンとは、主にセロトニン([[wikipedia:ja:インドール|インドール]]アミンの一種)、およびドーパミン、ノルアドレナリン、アドレナリン(この3つは[[カテコールアミン]]の一種)を主に指す。また、[[ヒスタミン]]もモノアミン神経伝達物質の一種である。これらは神経系において、[[神経伝達物質]]または[[神経修飾物質]](neuromodulator)として働く。[[wj:昆虫|昆虫]]やその他の[[wj:無脊椎動物|無脊椎動物]]では[[オクトパミン]]およびその[[wj:前駆物質|前駆物質]]である[[チラミン]]が神経系にて生理活性作用を持つ<ref name=refA><pubmed> 10515667 </pubmed></ref><ref name=refB><pubmed> 18725900 </pubmed></ref>。共通する主な特徴は以下の通りである<ref name=cooper>'''Cooper JR, Bloom FE, Roth RH''' (2003)<br>The Biochemical Basis of Neuropharmacology, 8th ed. <br>''Oxford University Press, New York.''<br>(邦訳 神経薬理学、樋口宗史監訳、メディカル・サイエンス・インターナショナル、東京、2005) </ref>。
=== 構造 ===
モノアミンが脳の精神的活動に重要とされる根拠の一つは、精神疾患に用いられる薬物の多くがモノアミン神経伝達を標的にしていることである。例えば、代表的な精神疾患である統合失調症に用いられる薬の多くは、ドーパミンD2受容体に対する阻害効果を示す。うつ病に用いられる薬、SSRIは、セロトニン再取り込みの阻害剤である。しかしながら、これらの精神疾患の発症においてモノアミン系神経伝達の異常が原因であるかは必ずしも明らかではない<ref name ="ref1">'''E R Kandel, J H Schwartz, T M Jessell'''<br> Principles of Neural Science, Fourth Edition<br>''Mc Graw Hill (New York)'':2000</ref><ref name ="ref2">'''N R Carlson'''<br> Physiology of Behavior, Tenth Edition<br>''Pearson Education (Boston )'':2009</ref>。
アミノ基 を一つ持つ(図)。セロトニンはインドール基をもつので、インドールアミンといえる。またドーパミン、ノルアドレナリン、アドレナリンはカテコール基をもつので、カテコールアミンとも呼ばれる。
===合成===
== その他 ==
カテコールアミンおよびインドールアミン(セロトニン、ドーパミン、ノルアドレナリン、アドレナリン)の合成には、[[テトラヒドロビオプテリン]](BH4)が必須である。すなわち、セロトニン生合成の律速酵素は[[トリプトファン水酸化酵素]]、またカテコールアミン生合成の律速酵素は[[チロシン水酸化酵素]]であるが、いずれもBH4を補酵素とする<ref name="ref3"><pubmed> 10727395 </pubmed></ref>。
===モノアミンの合成===
BH4はGTPより[[GTP cyclohydrolase 1]](GCH1)、[[6-Pyruvoyltetrahydrobiopterin synthase (PTS)]]、[[Sepiapterin reductase(SPR]])の3つの酵素により生合成される<ref name="ref3" />。
カテコールアミンおよびインドールアミン(セロトニン、ドーパミン、ノルアドレナリン、アドレナリン)の合成には、テトラヒドロビオプテリン(BH4)が必須である。すなわち、セロトニン生合成の律速酵素はトリプトファン水酸化酵素、またカテコールアミン生合成の律速酵素はチロシン水酸化酵素であるが、いずれもBH4を補酵素とする<ref name="ref3"><pubmed> 10727395 </pubmed></ref>。 BH4はGTPよりGTP cyclohydrolase 1(GCH1)、6 -Pyruvoyltetrahydrobiopterin synthase (PTS)、Sepiapterin reductase(SPR)の3つの酵素により生合成される <ref name="ref3" />。
===小胞性トランスポーター===
===小胞性トランスポーター===
モノアミンのシナプス小胞への取り込みは、[[小胞モノアミントランスポーター]] ([[vesicular monoamine transporter]], [[vMAT]])ファミリーが担う。[[vMAT1]]、[[vMAT2]]からなり、vMAT1はおもに[[副腎]]の[[クロム親和性細胞]]、vMAT2は神経細胞で発現している。vMATはH<sup>+</sup>との[[交換輸送]]によりモノアミンを小胞内に蓄積させる<ref name="ref4"><pubmed> 11099462 </pubmed></ref>。
モノアミンのシナプス小胞への取り込みは、vMAT (vesicular monoamine transporter)ファミリーが担う。vMAT1、vMAT2からなり、vMAT1はおもに副腎のクロム陽性細胞、vMAT2は神経細胞で発現している。vMATはH <sup>+</sup>との交換輸送によりモノアミンを小胞内に蓄積させる <ref name="ref4"><pubmed> 11099462 </pubmed></ref>。
===再取り込み===
===再取り込み===
細胞外のモノアミンの再取り込みは、[[セロトニントランスポーター]](SERT)、[[ドーパミントランスポーター]](DAT)、[[ノルエピネフリントランスポーター]](NET)などが行うが、各トランスポーターは他のモノアミンを取り込む能力も有する。シナプス間隙におけるモノアミン濃度の調節は、再取り込みの寄与が高い<ref name="ref5"><pubmed> 10769386 </pubmed></ref>。
細胞外のモノアミンの再取り込みは、セロトニントランスポーター(SERT)、ドーパミントランスポーター(DAT)、ノルエピネフリントランスポーター(NET)などが行うが、各トランスポーターは他のモノアミンを取り込む能力も有する。シナプス間隙におけるモノアミン濃度の調節は、再取り込みの寄与が高い <ref name="ref5"><pubmed> 10769386 </pubmed></ref>。
===代謝分解===
===代謝分解===
モノアミンの代謝分解においては、[[モノアミン酸化酵素]](monoamine oxidase, MAO)が共通して重要な酵素である。MAOはモノアミンの[[アミノ基]]を[[アルデヒド基]]に酸化する。MAOは[[ミトコンドリア]]外膜に局在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる<ref name="ref6"><pubmed> 16552415</pubmed></ref>。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる<ref name="ref6" />。
モノアミンの代謝分解においては、モノアミン酸化酵素(monoamine oxidase, MAO)が共通して重要な酵素である。MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる <ref name="ref6"><pubmed> 16552415</pubmed></ref>。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる<ref name="ref6" />。
===神経修飾因子としての機能 ===
モノアミン作動性神経細胞の[[細胞体]]は、一部例外を除くと、[[後脳]]または[[中脳]]にほぼ集中し、投射先は脳の広範な部位に及び、多様な調節効果を及ぼすのが特徴である。このためモノアミン神経伝達物質は脳・神経機能を「修飾(modulate)」すると言われる。すなわち、例えば代表的な神経伝達物質である[[グルタミン酸]]は、[[イオンチャンネル]]型[[グルタミン酸受容体]]を介して速い神経興奮を引き起こし、また短期・長期の可塑性を示す([[シナプス可塑性]])。一方、モノアミン神経伝達物質は、神経細胞の興奮性やシナプス可塑性を様々な経路を介して調節し、脳機能に影響を与えると考えられている。
=== 精神疾患との関連 ===
モノアミンが脳の精神的活動に重要とされる根拠の一つは、[[精神疾患]]に用いられる薬物の多くがモノアミン神経伝達を標的にしていることである。例えば、代表的な精神疾患である[[統合失調症]]に用いられる薬の多くは、[[ドーパミンD2受容体]]に対する阻害効果を示す。うつ病に用いられる薬、SSRIは、[[セロトニン再取り込みの阻害剤]]である。しかしながら、これらの精神疾患の発症において[[モノアミン系]]神経伝達の異常が原因であるかは必ずしも明らかではない<ref name="ref1">'''E R Kandel, J H Schwartz, T M Jessell'''<br> Principles of Neural Science, Fourth Edition<br>''Mc Graw Hill (New York)'':2000</ref><ref name="ref2">'''N R Carlson'''<br> Physiology of Behavior, Tenth Edition<br>''Pearson Education (Boston)'':2009</ref><ref name=inoue>'''井上 猛、中川 伸、小山 司''' (2009) <br>大うつ病性障害の薬理/抗うつ薬 .樋口輝彦,小山 司,神庭重信編,<br>臨床精神薬理ハンドブック(第二版)<br>''医学書院''、pp158-178.
</ref>。
=== 受容体 ===
===神経核の局在と投射 ===
モノアミンの[[受容体]]は[[イオンチャンネル型]]である[[セロトニン#受容体|5-HT<sub>3</sub>型受容体]]を除き、いずれも[[Gタンパク質共役型]]である。共役するG<sub>α</sub>タンパク質の種類により、下流のシグナル伝達経路が異なる。
モノアミン作動性神経細胞の細胞体は、一部例外を除くと、後脳または中脳にほぼ集中し、投射先は脳の広範な部位に及び、多様な調節効果を及ぼすのが特徴である。
== ドーパミン ==
===受容体= ==
''詳細は[[ドーパミン]]の項目参照。''
モノアミンの受容体はいずれもGタンパク質共役型であり、イオンチャンネル型ではない。共役するG <sub>α</sub>タンパク質の種類により、下流のシグナル伝達経路が異なる。
カテコールアミンの一つである。中枢神経系の伝達物質、及び末梢のシグナル分子として働く。
=== 神経解剖 ===
[[ドーパミン神経]]の長い投射系は大きく3つに分けることができる。起始核はいずれも脳幹部にあり、[[黒質]](A9)から[[線条体]]([[尾状核]]、[[被殻]])に投射する[[黒質線条体系]]ドーパミン投射、[[腹側被蓋]]ドーパミン細胞(腹側被蓋野A10)から[[辺縁系]][[皮質]]([[前頭前野]]、[[帯状回]]、[[嗅内領野]])に投射する[[中脳皮質系]]ドーパミン投射、[[腹側被蓋]]ドーパミン細胞([[赤核後野]]A8, [[腹側被蓋野]]A10)からそれ以外の辺縁系([[側坐核]]、[[中隔野]]、[[嗅結節]]、[[扁桃体]]、[[梨状葉皮質]])に投射する[[中脳辺縁系]]ドーパミン投射がある。黒質線条体系は[[運動系]]に、中脳皮質系は[[作業記憶]]などの[[認知機能]]に、中脳辺縁系は報酬系などに関連しているといわれている。
=== 合成・代謝 ===
ドーパミンの前駆物質であるチロシンは[[wikipedia:ja:必須アミノ酸|必須アミノ酸]]ではなく、食物からタンパク質として摂取される他、体内で必須アミノ酸である[[wikipedia:ja:フェニルアラニン|フェニルアラニン]]から変換される。チロシン水酸化酵素がドーパミン合成の律速段階である。ドーパミン合成はドーパミン作動性神経のインパルス量に依存し、さらに[[シナプス前]][[ドーパミン受容体]](自己受容体、[[D2受容体]])刺激によって抑制される。ドーパミンはMAOとCOMTにより主たる代謝産物である[[ホモバニリン酸]] (HVA)まで代謝される。
=== 放出の制御 ===
[[ストレス]]、[[運動]]などのドーパミン作動性神経のインパルス流量を増やす刺激により、シナプス小胞からシナプス間隙へのドーパミン放出が促進され、細胞外ドーパミン濃度は増加する。ストレスでは中脳皮質ドーパミン系が特に活発化し、運動では黒質線条体ドーパミン系が特に活発化する。いったん放出されたドーパミンは側坐核や線条体では主としてドーパミン作動性神経の神経終末にある[[ドーパミン・トランスポーター]](以前はドーパミン取り込み部位と呼ばれていた)というタンパク質により神経終末に再取り込みされ、シナプス間隙のドーパミン濃度は調節されている。[[ドーパミン再取り込み阻害薬]](抗うつ薬の[[ブプロピオン]]、[[ナルコレプシー]]の治療薬である[[メチルフェニデート]]、試薬の[[GBR12909]]、[[麻薬]]の[[コカイン]]、[[メタンフェタミン]]などがドーパミン再取り込み阻害作用を有する)やドーパミン放出促進薬(メタンフェタミン、メチルフェニデート)は前述した3つのドーパミン投射系(黒質線条体、中脳皮質、中脳辺縁系)で細胞外ドーパミン濃度を増加させる。特にメタンフェタミンによるドーパミン増加作用はブプロピオンに比べると顕著であり、ブプロピオンによる増加が2〜3倍程度なのに対して、メタンフェタミンによる増加は10〜20倍までになる。また、[[選択的セロトニン再取り込み阻害剤]] (SSRI)である[[セルトラリン]]も弱いながらドーパミン再取り込み阻害作用を有する。
[[三環系抗うつ薬]]、[[四環系抗うつ薬]]、[[SNRI]]などのノルアドレナリン再取り込み阻害作用を有する抗うつ薬の投与は、黒質線条体系と中脳辺縁系の神経終末領域の細胞外ドーパミン濃度には影響しないが、中脳皮質系([[前頭前野]]など)の細胞外ドーパミン濃度を増加させることが1990年代に発見された。これらの抗うつ薬はドーパミン再取り込み阻害作用を有さないのに、ドーパミン再取り込み阻害薬のように前頭前野で細胞外ドーパミン濃度を増やすことは興味深く、それまで抗うつ薬の作用機序から見逃されていた点であった。
その作用機序としては以下の2つの機序が考えられる。
#ノルアドレナリン作動性神経からノルアドレナリンがシナプス間隙に放出されるときに、[[wikipedia:ja:前駆物質|前駆物質]]であるドーパミンも一緒に放出される、
#ノルアドレナリン作動性神経とドーパミン作動性神経([[側坐核]]、[[線条体]]以外では前頭前野に投射している)から放出されるドーパミンはドーパミン・トランスポーターのみならず、ノルアドレナリン・トランスポーターからも神経細胞内に再取り込みされるため、ノルアドレナリン再取り込み阻害薬投与によりドーパミンのノルアドレナリン・トランスポーターへの取り込みが阻害される。
以上の2つの機序に加えて、前頭前野ではドーパミン作動性神経に比べて、ノルアドレナリン作動性神経の神経終末が比較的多いという解剖学的特徴が寄与して、ノルアドレナリン再取り込み阻害薬投与により前頭前野細胞外ドーパミン濃度が増加すると考えられる。一方、線条体や側坐核では、ドーパミン作動性神経の神経終末のほうがノルアドレナリン作動性神経の神経終末よりも圧倒的に多く、細胞外のドーパミンはほとんどドーパミン作動性神経終末にあるドーパミン・トランスポーターにより取り込まれる。
多くの[[抗精神病薬]]、三環系抗うつ薬、四環系抗うつ薬が有する[[セロトニン#5-HT2.E5.8F.97.E5.AE.B9.E4.BD.93|5-HT<sub>2C</sub>受容体]]遮断作用は3つのドーパミン投射系(黒質線条体、中脳皮質、中脳辺縁系)で細胞外ドーパミン濃度を増加させる。したがって、[[5-HT]]<sub>2C</sub>受容体はドーパミン作動性神経に対して、おそらく[[細胞体]]レベルで緊張性の抑制作用を有すると考えられる<ref name=inoue />。
===ドーパミン受容体 ===
ドーパミンが作用する受容体は[[ドーパミン受容体]]と呼ばれ、D<sub>1</sub>、D<sub>2</sub>、D<sub>3</sub>、D<sub>4</sub>、D<sub>5</sub>の5種類の受容体サブタイプがある。
== ノルアドレナリン ==
[[ノルエピネフリン]] (norepinephrine) とも呼ぶ。''詳細は[[ノルアドレナリン]]の項目参照。''
カテコールアミンの一つである。中枢並びに交感神経の神経伝達物質として働くほか、副腎髄質より放出されホルモンとして働く。
=== 神経解剖 ===
ノルアドレナリンを神経伝達物質とする神経([[ノルアドレナリン神経]])の細胞体は中枢神経系では主として[[橋中心灰白質]]内の[[青斑核]]にあり、そこから脳全体に投射する。
=== 合成・代謝 ===
ノルアドレナリンは[[wikipedia:ja:チロシン|チロシン]]からドーパミンを経由して合成される。[[チロシン水酸化酵素]]が律速段階で、ノルアドレナリン合成はノルアドレナリン作動性神経のインパルス量に依存し、さらにシナプス前[[ノルアドレナリン受容体]]([[自己受容体]]、[[Α2アドレナリン受容体|α<sub>2</sub>アドレナリン受容体]])刺激によって抑制される。ノルアドレナリンはMAOと[[カテコールO-メチル基転移酵素]](COMT)により主たる代謝産物である[[3-メトキシ-4-ヒドロキシフェニルグリコール]] (MHPG)まで代謝される。
=== 放出の制御 ===
[[ストレス]]などのノルアドレナリン作動性神経のインパルス流量を増やす刺激により、[[シナプス小胞]]から[[シナプス間隙]]へのノルアドレナリン放出が促進され、細胞外ノルアドレナリン濃度は増加する。いったん放出されたノルアドレナリンはノルアドレナリン作動性神経の[[神経終末]]にある[[ノルアドレナリン・トランスポーター]](以前はノルアドレナリン取り込み部位と呼ばれていた)というタンパク質により[[神経終末]]に再取り込みされ、シナプス間隙のノルアドレナリン濃度は調節されている。ノルアドレナリン再取り込み阻害薬(ほとんどの[[三環系抗うつ薬]]、[[四環系抗うつ薬]]、[[セロトニン・ノルアドレナリン再取り込み阻害剤]] (SNRI)のほか、2009年4月に[[注意欠陥/多動性障害]]ADHDの治療薬として承認された[[アトモキセチン]])投与はほぼ全脳で細胞外ノルアドレナリン濃度を増加させる。自己受容体であるα<sub>2</sub>アドレナリン受容体遮断は細胞外ノルアドレナリン濃度を増加させる。
===アドレナリン受容体 ===
ノルアドレナリンとアドレナリンが作用する受容体は[[アドレナリン受容体]]と呼ばれる(なお、中枢神経系ではアドレナリン作動性神経はノルアドレナリン作動性神経に比べてはるかに数は少ない)。アドレナリン受容体のサブタイプは[[Α1アドレナリン受容体|α<sub>1</sub>]]がA, B, Dの3種類、α<sub>2</sub>がA, B, Cの3種類、[[Βアドレナリン受容体|β]]が1,2,3の3種類あり、計9種類ある。そのうち、脳に多いのはα<sub>1A</sub>、α<sub>1B</sub>、α<sub>1D</sub>、α<sub>2A</sub>、α<sub>2C</sub>、β<sub>1</sub>といわれている。[[抗うつ薬]]服用によって増えた細胞外ノルアドレナリンがどの受容体サブタイプを介して抗うつ効果を惹起しているのかについてはまだわかっていない。
== アドレナリン ==
[[エピネフリン]] (norepinephrine) とも呼ぶ。''詳細は[[アドレナリン]]の項目参照。
カテコールアミンの一つである。中枢並びに交感神経の神経伝達物質として働くほか、副腎髄質より放出されホルモンとして働く。
===神経解剖===
アドレナリンを神経伝達物質とする神経(アドレナリン神経)の細胞体は、中枢神経系では、後脳延髄に存在し、そこから視床下部などへ上行性投射、および脊髄へ下降性投射を形成している。
===合成・代謝===
アドレナリンはチロシンからドーパミン、ノルアドレナリンを経て、最後にフェニルエタノールアミン-N-メチル基転移酵素(PNMT)により合成される。脳においてアドレナリンの多くは、ノルアドレナリンと同様、MAO、アルデヒド還元酵素、およびカテコールO-メチル基転移酵素(COMT)により3-methoxy-4-hydroxyphenylglycol(MHPG)へ代謝され、さらに3-methoxy-4-hydroxymandelic acid (VMA)となって尿中に排出される。
=== 受容体 ===
アドレナリンはノルアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる。より細かくは、α<sub>1A</sub>-α<sub>1D</sub>、α<sub>2A</sub>-α<sub>2C</sub>、β<sub>1</sub>、β<sub>2</sub>、β<sub>3</sub>、から構成されている。いずれも三量体Gタンパク質共役型の受容体である。[[モノアミン#アドレナリン受容体|ノルアドレナリンの節]]参照。
== セロトニン ==
''詳細は[[セロトニン]]の項目参照。''
インドールアミンの一つである。中枢神経系の伝達物質として働き脳機能の調節において重要な役割を果たす他、生体内の大部分(~95%)のセロトニンは末梢に存在し<ref><pubmed> 17241888 </pubmed></ref> <ref name=ref18471139><pubmed> 18471139 </pubmed></ref>、血管収縮、腸管蠕動運動、血小板凝縮などの調節因子として末梢でも多様な作用を持つ。
=== 神経解剖 ===
[[セロトニン神経]]の細胞体は[[橋]]や[[脳幹]]にある[[縫線核群]](B1〜B9)から[[大脳]]・[[小脳]]・[[脊髄]]全体に[[軸索]]を投射している。[[大脳皮質]]、扁桃体には[[背側縫線核]]から、[[海馬]]には[[正中縫線核]]から投射があり、それぞれの起始核は異なる。
=== 合成・代謝 ===
セロトニンは必須アミノ酸である[[wikipedia:ja:トリプトファン|トリプトファン]]から合成される。セロトニン合成の律速段階である[[トリプトファン水酸化酵素]]は基質によって飽和されていないため、トリプトファンの取り込み、血中の遊離トリプトファン濃度がセロトニン合成に影響を与える。トリプトファンの脳内への取り込みは能動的取り込み機構を介しているが、[[wikipedia:ja:芳香族アミノ酸|芳香族アミノ酸]]や[[wikipedia:ja:分枝鎖アミノ酸|分枝鎖アミノ酸]]によって阻害される。トリプトファンの過剰摂取はセロトニン合成を増加させる。また、トリプトファンは血中ではタンパク質に結合しており、トリプトファンのタンパク質結合を阻害する薬物(例えば[[バルプロ酸]])の投与により血中の遊離トリプトファン濃度は上昇するため、脳内セロトニン濃度は上昇する。セロトニンはMAO-Aによって5-HIAAに代謝されるが、MAO-Bによる代謝はうけない。興味深いことに、セロトニン作動性神経内に、MAO-Bは存在するが、MAO-Aは存在しない。したがって、セロトニンの代謝はセロトニン作動性神経内ではなく、それ以外の細胞で行われると考えられる。
=== 放出の制御 ===
ドーパミンやノルアドレナリンと同様に、ストレスによりセロトニン作動性神経のインパルス流量は増え、シナプス間隙へのセロトニン放出が促進され、細胞外セロトニン濃度は増加する。放出されたセロトニンはセロトニン作動性神経の神経終末にある[[セロトニン・トランスポーター]](以前はセロトニン取り込み部位と呼ばれていた)というタンパク質により神経終末に再取り込みされ、シナプス間隙のセロトニン濃度は調節されている。[[セロトニン再取り込み阻害薬]](3級アミンの三環系抗うつ薬と[[SSRI]])投与はほぼ全脳で細胞外セロトニン濃度を増加させる。
セロトニン作動性神経の自己受容体は3種類あり、細胞体に[[セロトニン#5-HT1.E5.8F.97.E5.AE.B9.E4.BD.93|5-HT<sub>1A</sub>]]受容体が、神経終末に5-HT<sub>1B</sub>受容体と5-HT<sub>1D</sub>受容体が存在する。これらの自己受容体はいずれもセロトニン作動性神経の発火とセロトニン放出を抑制する。5-HT<sub>1B</sub>受容体と5-HT<sub>1D</sub>受容体は相同性が高く、片方のアゴニストあるいはアンタゴニストは他方の受容体にも親和性を有することが多い。SSRIとの併用では、5-HT<sub>1B</sub>受容体アンタゴニストも5-HT<sub>1A</sub>受容体アンタゴニストも細胞外セロトニン濃度をさらに増加させ、両アンタゴニストの併用はより効果的であるという報告もある。動物実験ではSSRI急性投与による細胞外セロトニン濃度の増加は2〜3倍であり、反復投与によって低用量の効果は増強するが、高用量のSSRIによる細胞外セロトニン濃度増加の程度は反復投与によって増強しない。しかし、セロトニンの自己受容体アンタゴニスト(特に5-HT<sub>1A</sub>受容体アンタゴニスト)をSSRIと併用するとSSRIの細胞外セロトニン濃度に対する効果がさらに大きくなる。
5-HT<sub>1A</sub>受容体の自己受容体を介したネガティブ・フィードバックのみならず、セロトニン作動性神経が投射する神経細胞にある5-HT<sub>1A</sub>受容体を介したlong-loopネガティブ・フィードバックによってもセロトニン作動性神経は調節されている。
細胞外セロトニン濃度は異種受容体であるα<sub>2</sub>アドレナリン受容体による制御もうけており、α<sub>2</sub>アドレナリン受容体遮断薬のSSRIとの併用はセロトニン再取り込み阻害作用による細胞外セロトニン濃度増加作用を増強する。
===セロトニン受容体 ===
[[セロトニン#.E3.82.BB.E3.83.AD.E3.83.88.E3.83.8B.E3.83.B3.E5.8F.97.E5.AE.B9.E4.BD.93|セロトニン受容体]]サブタイプはドーパミン、アドレナリン受容体と比べてより多彩であり、1A、1B、1D、1E、1F、2A、2B、2C、3、4、5A、5B、6、7の14種類ある。
== ヒスタミン ==
== ヒスタミン ==
''詳細は[[ヒスタミン]]の項目参照。''
ヒスタミンは中枢神経系において神経伝達物質として働く<ref name="ref7"><pubmed> 11793338</pubmed></ref><ref name="ref8"><pubmed> 18626069</pubmed></ref>。ヒスタミン作動性神経細胞は、視床下部のtuberomammillary nucleusに存在する。投射は脳の広範囲に及ぶ。ヒスタミン受容体は H1からH4型が存在し、そのうちH1、H2、H3が脳で発現している。脳におけるヒスタミンの作用は、覚醒の維持を助けるものであると考えられている。また、抗アレルギー薬のもつ眠気の副作用は中枢神経系での作用であると考えられている。
ヒスタミンは末梢組織における炎症の重要なメディエーターであるが、中枢神経系においては神経伝達物質としても働く<ref name=cooper/><ref name="ref7"><pubmed> 18626069 </pubmed></ref><ref name="ref8"><pubmed> 21324537 </pubmed></ref>。脳におけるヒスタミンの作用は、[[覚醒]]の維持を助けるものであると考えられている。また、[[抗アレルギー薬]]のもつ眠気の副作用は中枢神経系での作用であると考えられている。
== 参考文献 = =
=== 神経解剖 ===
<references />
ヒスタミン作動性神経細胞は、[[視床下部]]の[[隆起乳頭体核]]に存在する。投射先は脳全域に及ぶが、その密度は低い。
===合成・代謝===
ヒスタミンは、ヒスチジンからヒスチジン脱炭酸酵素により生合成される。ヒスチジン脱炭酸酵素はピリドキサールリン酸を補酵素として必要とする。ほ乳類脳においてヒスタミンの多くはヒスタミンメチル基転移酵素によりメチル化され、さらにモノアミン酸化酵素B(MAOB)により酸化され、メチルイミダゾール酢酸となり排出される。
===ヒスタミン受容体 ===
[[ヒスタミン受容体]]はH<sub>1</sub>からH<sub>4</sub>型が存在し、現在はその全てが脳で発現しているとされる。H<sub>1</sub>受容体はホスホリパーゼCを活性化し、イノシトール三リン酸(IP3)およびジアシルグリセロール(DAG)を増加させる。H2受容体はcAMPカスケードを活性化、逆にH<sub>3</sub>受容体はcAMPカスケードを抑制する。H<sub>4</sub>受容体の作用についてはまだはっきりと分かっていない。H<sub>1</sub>およびH<sub>2</sub>受容体は神経細胞の興奮性や可塑性を調節する。H<sub>3</sub>受容体はヒスタミン作動性神経細胞や、特定の中枢神経細胞のプレシナプスに発現し、神経伝達物質の放出を抑制する働きがある<ref name=ref7/>。
(執筆者:徳岡宏文、一瀬宏 担当編集者:林康紀)
== 関連項目 ==
*[[アドレナリン]]
*[[ノルアドレナリン]]
*[[ドーパミン]]
*[[セロトニン]]
*[[ヒスタミン]]
*[[神経修飾物質]]
== 参考文献 ==
<references />
神経科学において、モノアミンとは、主にセロトニン(インドールアミンの一種)、およびドーパミン、ノルアドレナリン、アドレナリン(この3つはカテコールアミンの一種)を主に指す。また、ヒスタミンもモノアミン神経伝達物質の一種である。これらは神経系において、神経伝達物質または神経修飾物質(neuromodulator)として働く。各物質についてはそれぞれの項を参照のこと。ここでは主要な共通する特徴、および補足事項を記す。
構造 図.モノアミン神経伝達物質 アミノ基 を一つ持つ(図)。セロトニンはインドール基をもつので、インドールアミンといえる。またドーパミン、ノルアドレナリン、アドレナリンはカテコール基をもつので、カテコールアミンとも呼ばれる。
Neuromodulatorとしての機能 モノアミン神経伝達物質は脳・神経機能を「修飾(modulate)」すると言われる。すなわち、例えば代表的な神経伝達物質であるグルタミン酸は、イオンチャンネル型グルタミン酸受容体を介して速い神経興奮を引き起こし、また短期・長期の可塑性を示す(シナプス可塑性)。一方、モノアミン神経伝達物質は、神経細胞の興奮生やシナプス可塑性を様々な経路を介して調節し、脳機能に影響を与えると考えられている。
精神疾患との関連 モノアミンが脳の精神的活動に重要とされる根拠の一つは、精神疾患に用いられる薬物の多くがモノアミン神経伝達を標的にしていることである。例えば、代表的な精神疾患である統合失調症に用いられる薬の多くは、ドーパミンD2受容体に対する阻害効果を示す。うつ病に用いられる薬、SSRIは、セロトニン再取り込みの阻害剤である。しかしながら、これらの精神疾患の発症においてモノアミン系神経伝達の異常が原因であるかは必ずしも明らかではない[ 1] [ 2]
その他 モノアミンの合成 カテコールアミンおよびインドールアミン(セロトニン、ドーパミン、ノルアドレナリン、アドレナリン)の合成には、テトラヒドロビオプテリン(BH4)が必須である。すなわち、セロトニン生合成の律速酵素はトリプトファン水酸化酵素、またカテコールアミン生合成の律速酵素はチロシン水酸化酵素であるが、いずれもBH4を補酵素とする[ 3] [ 3]
小胞性トランスポーター モノアミンのシナプス小胞への取り込みは、vMAT (vesicular monoamine transporter)ファミリーが担う。vMAT1、vMAT2からなり、vMAT1はおもに副腎のクロム陽性細胞、vMAT2は神経細胞で発現している。vMATはH+ との交換輸送によりモノアミンを小胞内に蓄積させる[ 4]
再取り込み 細胞外のモノアミンの再取り込みは、セロトニントランスポーター(SERT)、ドーパミントランスポーター(DAT)、ノルエピネフリントランスポーター(NET)などが行うが、各トランスポーターは他のモノアミンを取り込む能力も有する。シナプス間隙におけるモノアミン濃度の調節は、再取り込みの寄与が高い[ 5]
代謝分解 モノアミンの代謝分解においては、モノアミン酸化酵素(monoamine oxidase, MAO)が共通して重要な酵素である。MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる[ 6] [ 6]
神経核の局在と投射 モノアミン作動性神経細胞の細胞体は、一部例外を除くと、後脳または中脳にほぼ集中し、投射先は脳の広範な部位に及び、多様な調節効果を及ぼすのが特徴である。
受容体 モノアミンの受容体はいずれもGタンパク質共役型であり、イオンチャンネル型ではない。共役するGα タンパク質の種類により、下流のシグナル伝達経路が異なる。
ヒスタミン ヒスタミンは中枢神経系において神経伝達物質として働く[ 7] [ 8]
参考文献
↑ E R Kandel, J H Schwartz, T M Jessell Mc Graw Hill (New York) :2000↑ N R Carlson Pearson Education (Boston) :2009↑ 3.0 3.1
Thöny, B., Auerbach, G., & Blau, N. (2000). The Biochemical journal , 347 Pt 1, 1-16.
[PubMed:10727395 ]
[PMC ]
[WorldCat ]
↑
Erickson, J.D., & Varoqui, H. (2000). FASEB journal : official publication of the Federation of American Societies for Experimental Biology , 14(15), 2450-8.
[PubMed:11099462 ]
[WorldCat ]
[DOI ]
↑
Xu, F., Gainetdinov, R.R., Wetsel, W.C., Jones, S.R., Bohn, L.M., Miller, G.W., ..., & Caron, M.G. (2000). Nature neuroscience , 3(5), 465-71.
[PubMed:10769386 ]
[WorldCat ]
[DOI ]
↑ 6.0 6.1
Youdim, M.B., Edmondson, D., & Tipton, K.F. (2006). Nature reviews. Neuroscience , 7(4), 295-309.
[PubMed:16552415 ]
[WorldCat ]
[DOI ]
↑
Vitalis, T., Fouquet, C., Alvarez, C., Seif, I., Price, D., Gaspar, P., & Cases, O. (2002). The Journal of comparative neurology , 442(4), 331-47.
[PubMed:11793338 ]
[WorldCat ]
[DOI ]
↑
Haas, H.L., Sergeeva, O.A., & Selbach, O. (2008). Physiological reviews , 88(3), 1183-241.
[PubMed:18626069 ]
[WorldCat ]
[DOI ]