「テタヌス毒素」の版間の差分
細編集の要約なし |
|||
| (2人の利用者による、間の21版が非表示) | |||
| 1行目: | 1行目: | ||
{{Infobox protein family | {{Infobox protein family | ||
| Symbol = | | Symbol = | ||
| Name = Peptidase_M27 | | Name = Peptidase_M27 | ||
| image = | | image = 1z7h_bio_r_500.jpg | ||
| width = | | width = | ||
| caption = | | caption = | ||
| Pfam = PF01742 | | Pfam = PF01742 | ||
| Pfam_clan = CL0126 | | Pfam_clan = CL0126 | ||
| 27行目: | 17行目: | ||
| CAZy = | | CAZy = | ||
| CDD = | | CDD = | ||
}} | }} 英:tetanus toxin、英語略: TeNT、独:Wundstarrkrampf | ||
同義語: tetanus neurotoxin、tetanospasmin | |||
テタヌス毒素とは、土壌中に棲息する[[wikipedia:ja:グラム陽性型|グラム陽性型]][[嫌気性細菌]]である[[wikipedia:ja:クロストリジウム属|クロストリジウム属]]の([[wikipedia:ja:破傷風菌|破傷風菌]])''Clostridium tetani''によって産出される世界最強のタンパク質毒素の1つである。 同属には([[wikipedia:ja:ボツリヌス菌|ボツリヌス菌]])''Clostridium botulinum''が産出する[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]があり、これらは共に分子量約50 kDaの軽鎖と100 kDaの重鎖の2本のポリペプチド鎖から構成される。テタヌス毒素の生体への毒素の作用機序としては、まず重鎖が神経細胞の膜にある[[wikipedia:ja:ガングリオシド|ガングリオシド]]に結合し、続いてテタヌス毒素分子の細胞内への侵入を起こす。侵入後、[[wikipedia:ja:亜鉛|亜鉛]]依存的なタンパク質分解活性をもつ軽鎖が、[[wikipedia:ja:神経伝達物質|神経伝達物質]]の[[wikipedia:ja:エキソサイトーシス|エキソサイトーシス]]を担う[[wikipedia:SNARE|SNARE]]タンパク質の1つであるVAMPを分解することで[[wikipedia:ja:神経伝達物質|神経伝達物質]]の放出が抑制される。その結果、テタヌス([[wikipedia:tetanus|tetanus]])と呼ばれる痙攣性[[wikipedia:ja:麻痺|麻痺]]が引き起こされる。 | |||
== テタヌス毒素とは == | |||
テタヌス(Tetanus)という用語は、それによって起きる強直([[wikipedia:ja:麻痺|麻痺]])を”tetanus”として定義したヒポクラテスにより、最初に医学用語に記された<ref>'''Ornella Rossetto and Cesare Montecucco'''<br>Handbook of Experimental Pharmacology 184,129-170<br>''Springer'':2008</ref>。そのテタヌス([[wikipedia:ja:破傷風|破傷風]])の原因であるテタヌス毒素 は、嫌気性細菌である([[wikipedia:ja:破傷風菌|破傷風菌]])(''Clostridium tetani '')により分子量150 kDaの不活性型の単純タンパク質として産出される。菌体外に放出される際に限定分解を受けた後、N端側の分子量約50 kDaの軽鎖(L)と、C端側の分子量約100 kDaの重鎖(H)の二本鎖が1つの[[wikipedia:ja:ジスルフィド結合|ジスルフィド結合]]と非共有結合によって架橋された4次構造を形成した活性型となる。テタヌス毒素の半数致死量[[wikipedia:ja:半数致死量|半数致死量]](LD<sub>50</sub>)は、マウスの[[wikipedia:ja:末梢神経|末梢神経]]へ投与した場合、1 kgあたり0.4 ngから1 ngの間である<ref><pubmed>6806598</pubmed></ref>。テタヌス([[wikipedia:ja:破傷風|破傷風]])の発症は、''Clostridium tetani ''([[wikipedia:ja:破傷風菌|破傷風菌]])の[[wikipedia:ja:胞子|胞子]]が、傷口から体内に侵入することにより感染が起こる。最初の感染から発症まで数日から4週間と異なるがこれは、(1)[[wikipedia:ja:胞子|胞子]]の出芽、(2) 毒素の産出と放出、(3) [[wikipedia:ja:脊椎|脊椎]]内の標的細胞への毒素の結合と輸送、に必要な時間に相当する。その結果、[[wikipedia:ja:中枢神経系|中枢神経系]]のシナプス終末から放出される[[wikipedia:ja:神経伝達物質|神経伝達物質]]の阻害を行い、痙性対[[wikipedia:ja:麻痺|麻痺]]を引き起こす。[[wikipedia:ja:破傷風|破傷風]]は通常、開口障害、[[wikipedia:ja:嚥下障害|嚥下障害]]そして項部硬直などの症状により始まる。[[wikipedia:ja:麻痺|麻痺]]は時間経過に伴い、胴体、腹部そして脚の筋肉へと下部へと広がっていく。。[[wikipedia:ja:破傷風|破傷風]]はしばしば致命的となり、全身倦怠、呼吸器系や[[wikipedia:ja:心不全|心不全]]の後、死に到る。致死率は近年の医学の進歩により減少しているが、高齢者の患者の場合では依然として高い。[[wikipedia:ja:破傷風|破傷風]]の[[wikipedia:ja:ワクチン|ワクチン]]化([[wikipedia:ja:ホルムアルデヒド|ホルムアルデヒド]]で処理した毒素)により、[[wikipedia:ja:破傷風|破傷風]]は先進国からはほとんど消失したが、[[wikipedia:ja:ワクチン|ワクチン]]化が進んでいない国々では依然として年間数十万人もの人々が亡くなっている。 | |||
== テタヌス毒素の構造 == | |||
テタヌス毒素の[[wikipedia:ja:遺伝子|遺伝子]]は、[[wikipedia:ja:破傷風菌|破傷風菌]](''Clostridium tetani '')において75 kbの[[wikipedia:ja:プラスミド|プラスミド]]上にコードされている<ref><pubmed> 3536478 </pubmed></ref>。合成された1本のポリペプチド鎖(1315アミノ酸)は不活性であるが、[[wikipedia:ja:トリプシン|トリプシン]]様のタンパク質分解酵素により457番目のAlaから461番目のAspまでの間で限定分解を受け、N末端側の分子量50 kDaの軽鎖(449アミノ酸)とC末端側の分子量100 kDaの重鎖(857アミノ酸)となり活性型となる。両鎖は、1つの[[wikipedia:ja:ジスルフィド結合|ジスルフィド結合]]と非共有結合により繋がっている。<br>テタヌス毒素の構造名称については、破傷風菌と同属である([[wikipedia:ja:ボツリヌス菌|ボツリヌス菌]])が産出する[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]で提唱された名称と、第8回国際破傷風会議(1987)で採択された名称とがある。前者の場合、軽鎖を(L)、重鎖を(H)とする。また重鎖(H)は、そのN末端側の50 kDaの[[wikipedia:ja:αヘリックス|αヘリックス]]ドメインを(H<sub>N</sub>)、そのC末端側(865-1315)にある50 kDaを(H<sub>C</sub>)とし、さらにH<sub>C</sub>には分子量25 kDaのH<sub>C</sub>NとH<sub>C</sub>Cのサブドメインに分けられる。一方後者の場合、テタヌス毒素を[[wikipedia:ja:パパイン|パパイン]]処理するとC末端側50 kDaのペプチド断片とN末端側100 kDaのペプチド断片に分離されたことから、重鎖のC末端側50 kDaをFragment C(Frg C)、N末端側50 kDaをFragment B (Frg B)、さらに軽鎖をFragment A (Frg A) と呼称している。テタヌス毒素と各血清型の[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]との遺伝子レベルでの比較では、全体の相同性が~35%と低い。各ドメインにはそれぞれ異なる機能があり、N末端側のLドメインは金属タンパク質分解活性をもち、H<sub>N</sub>ドメインは膜移行に、そしてH<sub>C</sub>ドメインは結合に、それぞれ関与している (図1)。 [[Image:図1.jpg|center|400px]] | |||
== | == 軽鎖(L)立体構造と機能 == | ||
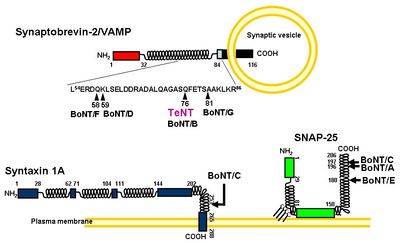
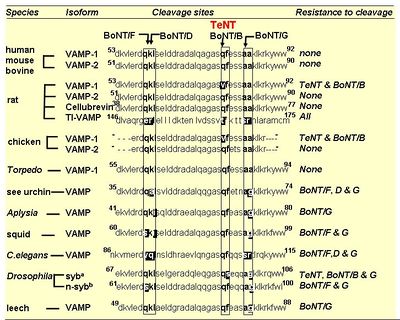
他の[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]の軽鎖(L)と同様に、テタヌス毒素の軽鎖(L)は、[[wikipedia:ja:亜鉛|亜鉛]]依存的な金属タンパク質分解酵素として作用し毒性を引き起こす。テタヌス毒素の軽鎖(L)は、[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]Bと同様にシナプス小胞の膜蛋白質のv-SNAREであるSynaptobrevin-2/vesicle-associated membrane protein (VAMP)のGln(76)とPhe(77)の間の限定分解を行う(図2)。その結果、シナプス小胞とシナプス前膜とのドッキングが阻害され、抑制性神経伝達物質であるGABAやGlycineなどの放出が抑制される。これがテタヌス毒素によるシナプス前抑制の分子機構である<ref><pubmed> 1331807 </pubmed></ref>。ただし、図3に示すようにSynaptobrevin-2/vesicle-associated membrane protein (VAMP)のアイソフォームの中には、テタヌス毒素に切断されないものもある<ref><pubmed> 10865130 </pubmed></ref>。テタヌス毒素の軽鎖(L)の触媒ドメインの二量体構造とその活性部位について右枠内に示す。テタヌス毒素の軽鎖(L)の活性部位は、基質となるタンパク質が近づきやすい溝の内部に位置し、[[wikipedia:ja:亜鉛|亜鉛]]に結合するモチーフであるHExxH(233-237)が中央部となるように正に荷電した[[wikipedia:ja:亜鉛|亜鉛]]と[[wikipedia:ja:配位結合|配位結合]]する。つまり、[[wikipedia:ja:亜鉛|亜鉛]]は2つのHisのイミダゾ-ル環(His(232)とHis(236))、そしてGlu(270)などのアミノ酸、さらにGlu(233)と強固な水素結合を形成する求核性の水分子、といった4つと相互作用している。特にこのモチーフ内にあるグルタミン酸は、それに結合している水分子が直接的にタンパク質の加水分解反応に関与するため特に重要である<ref><pubmed> 15895988 </pubmed></ref><ref><pubmed> 15904688 </pubmed></ref>。[[Image:yoshikatsuaikawa_fig_2.jpg|left|400px]] [[Image:yoshikatsuaikawa_fig_3.jpg|center|400px]] | |||
=== | == 重鎖(H)構造と機能 == | ||
テタヌス毒素の重鎖(H)は、2つのサブドメインH<sub>N</sub>とH<sub>C</sub>に分けられる。テタヌス毒素重鎖(H)N末端側のH<sub>N</sub>は、ベシクル膜から軽鎖(L)を移行させることに関与しているが、疎水性が極めて高く、容易に不溶化沈殿するためにその構造解析が進んでいない。H<sub>C</sub>ドメインは神経筋接合部での神経終末へのテタヌス毒素の特異的な結合とその後の内部への取り込みに関与する。その結合には、神経細胞膜上に特にみられるポリシアロ[[wikipedia:ja:ガングリオシド|ガングリオシド]]、グリコスフィンゴ[[wikipedia:ja:リン脂質|リン脂質]]、と複合体を形成する。テタヌス毒素重鎖(H)C末端側H<sub>C</sub>の立体構造を右枠の中に示す。H<sub>C</sub>ドメインには、さらに2つのサブドメイン構造のH<sub>C</sub>NとH<sub>C</sub>Cから構成される。H<sub>C</sub>Nサブドメインはいくつかの炭水化物結合タンパク質(マメ科植物の[[wikipedia:ja:レクチン|レクチン]]等)と似たようなjelly-rollモチーフ内にβストランド構造を含む。H<sub>C</sub>Nのアミノ酸配列は、クロストリジウム属の中でも高度に保存されている。H<sub>C</sub>CサブドメインはIL-1やFGFといったタンパク質の認識と結合に関与する[[wikipedia:ja:βシート|βシート]]が3つパックされたβ-trefoilという3つ葉状の構造を形成している。この配列はクロストリジウム属の中でも非常に保存性が低い。HCCサブドメインにはポリシアロ[[wikipedia:ja:ガングリオシド|ガングリオシド]](GD1bとGT1b)のオリゴ糖の部分に対して2つの結合部位があり、結合する部位(1281-1314)の中でもHis(1293)が関与する<ref><pubmed> 10722735 </pubmed></ref><ref><pubmed> 11418600 </pubmed></ref>。 | |||
== | == テタヌス毒素の作用機序 == | ||
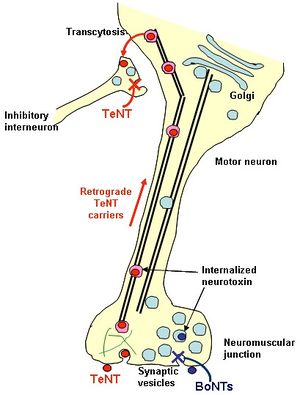
テタヌス毒素は神経筋接合部から神経終末膜を介して神経内に取り込まれる。テタヌス毒素は[[逆行性輸送]]され、[[wikipedia:ja:脊椎|脊椎]]前角に到達し、細胞膜を通過し[[wikipedia:ja:シナプス|シナプス]]前膜を通りさらに上位の中枢へと運搬される。そこで抑制性[[wikipedia:ja:シナプス|シナプス]]を遮断し、痙性麻痺を引き起こす。ついで興奮性[[wikipedia:ja:シナプス|シナプス]]も遮断し、筋は拘縮した状態となる。ちなみにこれは筋の弛緩を発生させる[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]の作用と逆となる。テタヌス毒素は、神経細胞に対して、(1) 毒素の結合、(2) 毒素の[[wikipedia:ja:エンドサイトーシス|エンドサイトーシス]]、(3) 膜からの細胞質への移行、(4) 標的タンパク質であるVAMPの分解、といった4段階を介して作用する(図4)<ref><pubmed> 13678859 </pubmed></ref>。現在もなおテタヌス毒素の受容体については不明であるが、テタヌス毒素のHcCドメインには、2つのガングリオシド結合部位がこれまでに同定され、ポリシアロ[[wikipedia:ja:ガングリオシド|ガングリオシド]]分子と糖タンパク質にそれぞれ結合することが考えられている。実際にテタヌス毒素は[[wikipedia:ja:GPI|GPI]]-アンカー型糖タンパク質と[[wikipedia:ja:脂質ラフト|脂質ラフト]]に結合する。図4に示したように、運動神経終末での形質膜上に発現する受容体を介した[[wikipedia:ja:エンドサイトーシス|エンドサイトーシス]]により取り込まれる[[wikipedia:ja:ボツリヌストキシン|ボツリヌストキシン]]とは異なり、テタヌス毒素は[[wikipedia:ja:脂質ラフト|脂質ラフト]]や[[wikipedia:ja:ガングリオシド|ガングリオシド]]であるGD1bを含む脂質タンパク質受容体複合体に結合する[[wikipedia:ja:クラスリン|クラスリン]]依存的なエンドサイトーシスにより内部に入る。[[wikipedia:ja:クラスリン|クラスリン]]被覆小胞によりいったん取り込まれたテタヌス毒素は、神経中枢の神経細胞体へ逆行性に運ばれ、さらに[[wikipedia:ja:シナプス|シナプス]]を越えて高次神経細胞の[[wikipedia:ja:シナプス|シナプス]]前部に到達する過程(Transcytosis)にHcが関与している。標識されたHcは取り込まれた後も中性を保ったコンパートメントで細胞体へと逆行性に運搬され、運動神経の[[wikipedia:ja:樹状突起|樹状突起]]に集積される。BDNFやGDNFなどの[[wikipedia:ja:神経栄養因子|神経栄養因子]]と比較すると、運搬速度や[[wikipedia:ja:樹状突起|樹状突起]]への集積速度は同じ(1 μm/sec)であるが、[[wikipedia:ja:シナプス|シナプス]]を越えて次の[[wikipedia:ja:シナプス|シナプス]]前部への移行はHcの方がほぼ倍の速度で行われることが明らかにされた。[[Image:図4.jpg|center|300px]] | |||
==関連項目 == | == 関連項目 == | ||
==参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2012年6月15日 (金) 23:44時点における版
| Peptidase_M27 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| ファイル:1z7h bio r 500.jpg | |||||||||
| Identifiers | |||||||||
| Symbol | ? | ||||||||
| Pfam | PF01742 | ||||||||
| Pfam clan | CL0126 | ||||||||
| PROSITE | PDOC00129 | ||||||||
| MEROPS | M27 | ||||||||
| SCOP | 3bta | ||||||||
| SUPERFAMILY | 3bta | ||||||||
| |||||||||
英:tetanus toxin、英語略: TeNT、独:Wundstarrkrampf
同義語: tetanus neurotoxin、tetanospasmin
テタヌス毒素とは、土壌中に棲息するグラム陽性型嫌気性細菌であるクロストリジウム属の(破傷風菌)Clostridium tetaniによって産出される世界最強のタンパク質毒素の1つである。 同属には(ボツリヌス菌)Clostridium botulinumが産出するボツリヌストキシンがあり、これらは共に分子量約50 kDaの軽鎖と100 kDaの重鎖の2本のポリペプチド鎖から構成される。テタヌス毒素の生体への毒素の作用機序としては、まず重鎖が神経細胞の膜にあるガングリオシドに結合し、続いてテタヌス毒素分子の細胞内への侵入を起こす。侵入後、亜鉛依存的なタンパク質分解活性をもつ軽鎖が、神経伝達物質のエキソサイトーシスを担うSNAREタンパク質の1つであるVAMPを分解することで神経伝達物質の放出が抑制される。その結果、テタヌス(tetanus)と呼ばれる痙攣性麻痺が引き起こされる。
テタヌス毒素とは
テタヌス(Tetanus)という用語は、それによって起きる強直(麻痺)を”tetanus”として定義したヒポクラテスにより、最初に医学用語に記された[1]。そのテタヌス(破傷風)の原因であるテタヌス毒素 は、嫌気性細菌である(破傷風菌)(Clostridium tetani )により分子量150 kDaの不活性型の単純タンパク質として産出される。菌体外に放出される際に限定分解を受けた後、N端側の分子量約50 kDaの軽鎖(L)と、C端側の分子量約100 kDaの重鎖(H)の二本鎖が1つのジスルフィド結合と非共有結合によって架橋された4次構造を形成した活性型となる。テタヌス毒素の半数致死量半数致死量(LD50)は、マウスの末梢神経へ投与した場合、1 kgあたり0.4 ngから1 ngの間である[2]。テタヌス(破傷風)の発症は、Clostridium tetani (破傷風菌)の胞子が、傷口から体内に侵入することにより感染が起こる。最初の感染から発症まで数日から4週間と異なるがこれは、(1)胞子の出芽、(2) 毒素の産出と放出、(3) 脊椎内の標的細胞への毒素の結合と輸送、に必要な時間に相当する。その結果、中枢神経系のシナプス終末から放出される神経伝達物質の阻害を行い、痙性対麻痺を引き起こす。破傷風は通常、開口障害、嚥下障害そして項部硬直などの症状により始まる。麻痺は時間経過に伴い、胴体、腹部そして脚の筋肉へと下部へと広がっていく。。破傷風はしばしば致命的となり、全身倦怠、呼吸器系や心不全の後、死に到る。致死率は近年の医学の進歩により減少しているが、高齢者の患者の場合では依然として高い。破傷風のワクチン化(ホルムアルデヒドで処理した毒素)により、破傷風は先進国からはほとんど消失したが、ワクチン化が進んでいない国々では依然として年間数十万人もの人々が亡くなっている。
テタヌス毒素の構造
テタヌス毒素の遺伝子は、破傷風菌(Clostridium tetani )において75 kbのプラスミド上にコードされている[3]。合成された1本のポリペプチド鎖(1315アミノ酸)は不活性であるが、トリプシン様のタンパク質分解酵素により457番目のAlaから461番目のAspまでの間で限定分解を受け、N末端側の分子量50 kDaの軽鎖(449アミノ酸)とC末端側の分子量100 kDaの重鎖(857アミノ酸)となり活性型となる。両鎖は、1つのジスルフィド結合と非共有結合により繋がっている。
テタヌス毒素の構造名称については、破傷風菌と同属である(ボツリヌス菌)が産出するボツリヌストキシンで提唱された名称と、第8回国際破傷風会議(1987)で採択された名称とがある。前者の場合、軽鎖を(L)、重鎖を(H)とする。また重鎖(H)は、そのN末端側の50 kDaのαヘリックスドメインを(HN)、そのC末端側(865-1315)にある50 kDaを(HC)とし、さらにHCには分子量25 kDaのHCNとHCCのサブドメインに分けられる。一方後者の場合、テタヌス毒素をパパイン処理するとC末端側50 kDaのペプチド断片とN末端側100 kDaのペプチド断片に分離されたことから、重鎖のC末端側50 kDaをFragment C(Frg C)、N末端側50 kDaをFragment B (Frg B)、さらに軽鎖をFragment A (Frg A) と呼称している。テタヌス毒素と各血清型のボツリヌストキシンとの遺伝子レベルでの比較では、全体の相同性が~35%と低い。各ドメインにはそれぞれ異なる機能があり、N末端側のLドメインは金属タンパク質分解活性をもち、HNドメインは膜移行に、そしてHCドメインは結合に、それぞれ関与している (図1)。
軽鎖(L)立体構造と機能
他のボツリヌストキシンの軽鎖(L)と同様に、テタヌス毒素の軽鎖(L)は、亜鉛依存的な金属タンパク質分解酵素として作用し毒性を引き起こす。テタヌス毒素の軽鎖(L)は、ボツリヌストキシンBと同様にシナプス小胞の膜蛋白質のv-SNAREであるSynaptobrevin-2/vesicle-associated membrane protein (VAMP)のGln(76)とPhe(77)の間の限定分解を行う(図2)。その結果、シナプス小胞とシナプス前膜とのドッキングが阻害され、抑制性神経伝達物質であるGABAやGlycineなどの放出が抑制される。これがテタヌス毒素によるシナプス前抑制の分子機構である[4]。ただし、図3に示すようにSynaptobrevin-2/vesicle-associated membrane protein (VAMP)のアイソフォームの中には、テタヌス毒素に切断されないものもある[5]。テタヌス毒素の軽鎖(L)の触媒ドメインの二量体構造とその活性部位について右枠内に示す。テタヌス毒素の軽鎖(L)の活性部位は、基質となるタンパク質が近づきやすい溝の内部に位置し、亜鉛に結合するモチーフであるHExxH(233-237)が中央部となるように正に荷電した亜鉛と配位結合する。つまり、亜鉛は2つのHisのイミダゾ-ル環(His(232)とHis(236))、そしてGlu(270)などのアミノ酸、さらにGlu(233)と強固な水素結合を形成する求核性の水分子、といった4つと相互作用している。特にこのモチーフ内にあるグルタミン酸は、それに結合している水分子が直接的にタンパク質の加水分解反応に関与するため特に重要である[6][7]。
重鎖(H)構造と機能
テタヌス毒素の重鎖(H)は、2つのサブドメインHNとHCに分けられる。テタヌス毒素重鎖(H)N末端側のHNは、ベシクル膜から軽鎖(L)を移行させることに関与しているが、疎水性が極めて高く、容易に不溶化沈殿するためにその構造解析が進んでいない。HCドメインは神経筋接合部での神経終末へのテタヌス毒素の特異的な結合とその後の内部への取り込みに関与する。その結合には、神経細胞膜上に特にみられるポリシアロガングリオシド、グリコスフィンゴリン脂質、と複合体を形成する。テタヌス毒素重鎖(H)C末端側HCの立体構造を右枠の中に示す。HCドメインには、さらに2つのサブドメイン構造のHCNとHCCから構成される。HCNサブドメインはいくつかの炭水化物結合タンパク質(マメ科植物のレクチン等)と似たようなjelly-rollモチーフ内にβストランド構造を含む。HCNのアミノ酸配列は、クロストリジウム属の中でも高度に保存されている。HCCサブドメインはIL-1やFGFといったタンパク質の認識と結合に関与するβシートが3つパックされたβ-trefoilという3つ葉状の構造を形成している。この配列はクロストリジウム属の中でも非常に保存性が低い。HCCサブドメインにはポリシアロガングリオシド(GD1bとGT1b)のオリゴ糖の部分に対して2つの結合部位があり、結合する部位(1281-1314)の中でもHis(1293)が関与する[8][9]。
テタヌス毒素の作用機序
テタヌス毒素は神経筋接合部から神経終末膜を介して神経内に取り込まれる。テタヌス毒素は逆行性輸送され、脊椎前角に到達し、細胞膜を通過しシナプス前膜を通りさらに上位の中枢へと運搬される。そこで抑制性シナプスを遮断し、痙性麻痺を引き起こす。ついで興奮性シナプスも遮断し、筋は拘縮した状態となる。ちなみにこれは筋の弛緩を発生させるボツリヌストキシンの作用と逆となる。テタヌス毒素は、神経細胞に対して、(1) 毒素の結合、(2) 毒素のエンドサイトーシス、(3) 膜からの細胞質への移行、(4) 標的タンパク質であるVAMPの分解、といった4段階を介して作用する(図4)[10]。現在もなおテタヌス毒素の受容体については不明であるが、テタヌス毒素のHcCドメインには、2つのガングリオシド結合部位がこれまでに同定され、ポリシアロガングリオシド分子と糖タンパク質にそれぞれ結合することが考えられている。実際にテタヌス毒素はGPI-アンカー型糖タンパク質と脂質ラフトに結合する。図4に示したように、運動神経終末での形質膜上に発現する受容体を介したエンドサイトーシスにより取り込まれるボツリヌストキシンとは異なり、テタヌス毒素は脂質ラフトやガングリオシドであるGD1bを含む脂質タンパク質受容体複合体に結合するクラスリン依存的なエンドサイトーシスにより内部に入る。クラスリン被覆小胞によりいったん取り込まれたテタヌス毒素は、神経中枢の神経細胞体へ逆行性に運ばれ、さらにシナプスを越えて高次神経細胞のシナプス前部に到達する過程(Transcytosis)にHcが関与している。標識されたHcは取り込まれた後も中性を保ったコンパートメントで細胞体へと逆行性に運搬され、運動神経の樹状突起に集積される。BDNFやGDNFなどの神経栄養因子と比較すると、運搬速度や樹状突起への集積速度は同じ(1 μm/sec)であるが、シナプスを越えて次のシナプス前部への移行はHcの方がほぼ倍の速度で行われることが明らかにされた。
関連項目
参考文献
- ↑ Ornella Rossetto and Cesare Montecucco
Handbook of Experimental Pharmacology 184,129-170
Springer:2008 - ↑
Gill, D.M. (1982).
Bacterial toxins: a table of lethal amounts. Microbiological reviews, 46(1), 86-94. [PubMed:6806598] [PMC] [WorldCat] - ↑
Eisel, U., Jarausch, W., Goretzki, K., Henschen, A., Engels, J., Weller, U., ..., & Niemann, H. (1986).
Tetanus toxin: primary structure, expression in E. coli, and homology with botulinum toxins. The EMBO journal, 5(10), 2495-502. [PubMed:3536478] [PMC] [WorldCat] - ↑
Schiavo, G., Benfenati, F., Poulain, B., Rossetto, O., Polverino de Laureto, P., DasGupta, B.R., & Montecucco, C. (1992).
Tetanus and botulinum-B neurotoxins block neurotransmitter release by proteolytic cleavage of synaptobrevin. Nature, 359(6398), 832-5. [PubMed:1331807] [WorldCat] [DOI] - ↑
Humeau, Y., Doussau, F., Grant, N.J., & Poulain, B. (2000).
How botulinum and tetanus neurotoxins block neurotransmitter release. Biochimie, 82(5), 427-46. [PubMed:10865130] [WorldCat] [DOI] - ↑
Breidenbach, M.A., & Brunger, A.T. (2005).
2.3 A crystal structure of tetanus neurotoxin light chain. Biochemistry, 44(20), 7450-7. [PubMed:15895988] [WorldCat] [DOI] - ↑
Rao, K.N., Kumaran, D., Binz, T., & Swaminathan, S. (2005).
Structural analysis of the catalytic domain of tetanus neurotoxin. Toxicon : official journal of the International Society on Toxinology, 45(7), 929-39. [PubMed:15904688] [WorldCat] [DOI] - ↑
Emsley, P., Fotinou, C., Black, I., Fairweather, N.F., Charles, I.G., Watts, C., ..., & Isaacs, N.W. (2000).
The structures of the H(C) fragment of tetanus toxin with carbohydrate subunit complexes provide insight into ganglioside binding. The Journal of biological chemistry, 275(12), 8889-94. [PubMed:10722735] [WorldCat] [DOI] - ↑
Fotinou, C., Emsley, P., Black, I., Ando, H., Ishida, H., Kiso, M., ..., & Isaacs, N.W. (2001).
The crystal structure of tetanus toxin Hc fragment complexed with a synthetic GT1b analogue suggests cross-linking between ganglioside receptors and the toxin. The Journal of biological chemistry, 276(34), 32274-81. [PubMed:11418600] [WorldCat] [DOI] - ↑
Lalli, G., Bohnert, S., Deinhardt, K., Verastegui, C., & Schiavo, G. (2003).
The journey of tetanus and botulinum neurotoxins in neurons. Trends in microbiology, 11(9), 431-7. [PubMed:13678859] [WorldCat] [DOI]