「電気穿孔法」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
< | 英:electroporation <br> 同義語:エレクトロポレーション | ||
< | [[Image:図1−電気穿孔法.jpg|thumb|right|250px|'''図1 in vivo electroporation'''<br>子宮をピンセット型電極で挟み、マウス胎仔脳へ電気パルスを与える<ref name="ref1"><pubmed>11784059</pubmed></ref>。]] | ||
'' | [[Image:図2−電気穿孔法.jpg|thumb|right|400px|'''図2 マウス脳の電気穿孔の例'''<br>生後5日の大脳皮質。A 胎生13.5日に''DsRed-mito''を導入、B 胎生15.5日に''EYFP''を導入、C 胎生13.5日に''Ds-Red-mito''と胎生15.5日に''EYFP''の2回の電気穿孔で遺伝子導入<ref name="ref2"><pubmed>15750183</pubmed></ref>。]] | ||
</ | |||
電気穿孔法とは、電気パルスで細胞膜の透過性を上げることにより、DNAなどの分子を真核生物や原核生物の細胞に導入する方法である。高い導入効率が容易に得られるため、多くの種類の細胞に用いられる。培養細胞のみならず、マウスなどの胎仔に利用できる生体内電気穿孔法(in vivo electroporation)が確立され、遺伝子の解析が個体レベルで飛躍的に進んでいる。 | |||
== 歴史 == | == 歴史 == | ||
電気穿孔の端緒は、1950年代に膜電位の測定法が研究されていた時期、あるレベル以上の電気パルスをランビエ絞輪に与えると膜電位が失われる発見に遡る<ref name="ref3"><pubmed>13461864</pubmed></ref>。ほぼ10年後、強い電気パルスが大腸菌を殺し、菌からβ−ガラクトシダーゼを溶出させることが観察され、電気パルスは細胞膜を破壊できると考えられるようになった<ref name="ref4"><pubmed>4969954</pubmed></ref>。その後、電気パルスで赤血球からヘモグロビンを溶出させる実験などが進み、適切な条件下では細胞膜は一度壊れた後でも機能を回復できることがわかった<ref name="ref5"><pubmed>13222</pubmed></ref>。さらに、電気パルスを与えた赤血球に外からスクロースなどを入れることに成功し、電気パルスは細胞膜に穴(pore)を空け、穴が閉じることにより元に戻るとの概念が登場した<ref name="ref6"><pubmed>895849</pubmed></ref>。また、赤血球にDNAやRNAを入れる実験なども行われた<ref name="ref7"><pubmed>184398</pubmed></ref>。実際に細胞膜に穴が空いた像は、低浸透圧の条件下、赤血球を用いて電子顕微鏡で観察された<ref name="ref8"><pubmed>2383626</pubmed></ref>。しかし、等張液でも同様の穴が空くかには疑問が呈されている<ref name="ref9"><pubmed>19016008</pubmed></ref>。<br> 1982年、Neumannらは電気パルスを用い、培養細胞のマウスL細胞にチミジンキナーゼ遺伝子を導入することに成功した<ref name="ref10"><pubmed>6329708</pubmed></ref>。続いて、他の研究者が植物のプロトプラスト<ref name="ref11"><pubmed>3862099</pubmed></ref>や大腸菌<ref name="ref12"><pubmed>3286620</pubmed></ref>にも遺伝子導入できることを示した。初期には、温度や電圧、パルスの幅や回数に加え、減衰波や矩形波のパルスなどいろいろと試されたが、減衰波のパルスを生む装置は比較的簡単に作れることもあり、減衰波パルスが主流となった。ES細胞など培養細胞への遺伝子導入には、過去のデータが集積しているなどの理由で、減衰波パルスが用いられることが多い。<br> しかし、減衰波パルスを用いる実験系で至適な遺伝子導入効率を得るためには、ある程度の細胞死を避けることはできない。一方、Takahashiらによりパルス幅の長い低電圧の矩形波を用いれば、細胞の高い生存率と遺伝子導入効率の両方を実現できることが示された<ref name="ref13"><pubmed>1907340</pubmed></ref>。この条件をMuramatsuらは応用し、ニワトリ胚に遺伝子導入できることを初めて示した<ref name="ref14"><pubmed>9016787</pubmed></ref>。さらに、ピンセット型の電極を用いることにより、子宮や卵黄囊の外側から電気パルスを与えることでマウス胎仔にも遺伝子導入できることが示された<ref name="ref1"><pubmed>11784059</pubmed></ref><ref name="ref15">'''Tetsuichiro Saito'''<br>Analysis of mammalian neuronal diversity using in vivo electroporation. ''The 607th National Institute of Genetics Colloquium, Mishima, Japan'':1999</ref>。 | |||
しかし、減衰波パルスを用いる実験系で至適な遺伝子導入効率を得るためには、ある程度の細胞死を避けることはできない。一方、Takahashiらによりパルス幅の長い低電圧の矩形波を用いれば、細胞の高い生存率と遺伝子導入効率の両方を実現できることが示された<ref name="ref13"><pubmed>1907340</pubmed></ref> | |||
== 適用例と手法 == | == 適用例と手法 == | ||
DNAやRNAなどの核酸を培養細胞や胎仔内の細胞など広く様々な細胞に導入するために使われる。膜を透過できない抗がん剤などの薬剤を細胞へ入れる方法としても検討されている。<br> 実験系は、導入される細胞が培養細胞などの単離された細胞か生体内もしくは組織内の細胞かで2つに大別される。 | |||
=== 単離細胞の電気穿孔法 === | === 単離細胞の電気穿孔法 === | ||
培養皿や生体組織などから単離した細胞の懸濁液を核酸とともにキュベットに入れ、浮遊状態で電気パルスを与える。通常、高電圧で単一の減衰波パルスを用い、Bio-Rad社のジーンパルサーなどの装置が使われる。過去の多くのデータがあり、業者のプロトコールに従い、遺伝子導入を容易に行えるのが利点である。高い導入効率を得ようとすると、細胞の生存率が下がる点が欠点となる。<br> 動物細胞は500 microF, 240 Vなど、大腸菌では25 microF, 2000 Vなどの条件が用いられる。<br> 最も単純なパルス作製装置は、コンデンサーに蓄電した電気をスィッチの切替でキュベット内に放出させる仕組みであり<ref name="ref10"><pubmed>21963197</pubmed></ref>、初期には研究室で自作された。 | |||
動物細胞は500 microF, 240 Vなど、大腸菌では25 microF, 2000 Vなどの条件が用いられる。 | |||
=== 胎仔や組織の細胞の電気穿孔法 === | === 胎仔や組織の細胞の電気穿孔法 === | ||
子宮内のマウス胎仔やニワトリ胚、体外培養胚などの細胞に関しては、核酸を注入後、ピンセット型電極やニードル電極などで胎仔や組織を挟み、低電圧で長時間の矩形波パルスを複数回与える。例えば、胎生13.5日のマウス胎仔には40 V, 50 | 子宮内のマウス胎仔やニワトリ胚、体外培養胚などの細胞に関しては、核酸を注入後、ピンセット型電極やニードル電極などで胎仔や組織を挟み、低電圧で長時間の矩形波パルスを複数回与える。例えば、胎生13.5日のマウス胎仔には40 V, 50 msecの矩形波パルスを1秒に1回ずつ5回与えるなどの条件が使われ、至適電圧は胎仔の発生のステージで異なる。ほとんど全てのマウス胎仔に遺伝子導入できる条件でも、電気穿孔で細胞死が増加しないことが確認されている<ref name="ref2"><pubmed>15750183</pubmed></ref><ref name="ref16"><pubmed>17406448</pubmed></ref>。電極と遺伝子導入される細胞が近接している必要はなく、子宮の外側から電気パルスを与えても脳内などへの遺伝子導入が可能である。パルス作製装置にはBEX社のCUY21などが用いられる。siRNAなどのRNAを導入することにより、標的タンパク質の発現を生体内で効率よく抑えることにも用いられる<ref name="ref17"><pubmed>18723012</pubmed></ref>。<br> 生体内の細胞への電気穿孔はin vivo electroporationと呼ばれる。生体組織を取り出し体外培養の前などに行われる電気穿孔はex vivo electroporationと呼ばれることもある。マウス胎仔のin vivo electroporationでは、子宮の外からDNAなどを注入し、子宮の外側を電極で挟むことで電気穿孔するin utero electroporationが一般的である。in utero electroporation後の胎仔は子宮とともに母体に戻せば、生育でき出産も可能である<ref name="ref1"><pubmed>21963197</pubmed></ref>。一方、胎生12.5日以前では子宮の外から胎仔が見にくいなどの理由により、子宮壁を切開後にDNAなどを注入し、胎仔の入った卵黄囊を電極で挟み電気穿孔するexo utero electroporationも用いられる<ref name="ref1"><pubmed>11784059</pubmed></ref><ref name="ref18"><pubmed>12657654</pubmed></ref>。exo utero electroporationを施した胎仔は子宮壁を縫わずに母体に戻すことで生育可能であるが、出産後の仔マウスが必要な場合、母マウスは自力で出産できないため出産期に帝王切開を要する。<br> 脳室に注入された分子は、脳室から漏れ出なければ拡散による希釈が限定的であるため、脳室の周囲の細胞への導入は比較的容易である。胎仔期の神経幹細胞や神経前駆細胞は脳室に接しており、遺伝子導入の格好の標的となる。大脳などでは、発生の時期により神経幹細胞から生み出される神経細胞の種類が異なるため、時期を選ぶことにより特定の種類の神経細胞のみで遺伝子を発現することが可能となる<ref name="ref1"><pubmed>21963197</pubmed></ref><ref name="ref2"><pubmed>21963197</pubmed></ref>。同一の胎仔に異なる時期で2回電気穿孔することもできる<ref name="ref2"><pubmed>15750183</pubmed></ref>。<br> | ||
電極には、マウス胎仔で多用されるピンセット型電極<ref name="ref1"><pubmed>11784059</pubmed></ref><ref name="ref15">'''Tetsuichiro Saito'''<br>Analysis of mammalian neuronal diversity using in vivo electroporation. ''The 607th National Institute of Genetics Colloquium, Mishima, Japan'':1999</ref><ref name="ref19"><pubmed>11301197</pubmed></ref>、ニワトリ胚などで使われるニードル型電極<ref name="ref14"><pubmed>9016787</pubmed></ref>、導入部位を限定させるために核酸の注入針と電極を組み合わせた電極<ref name="ref20"><pubmed>21880813</pubmed></ref>などがある。<br> | |||
ニワトリやマウス以外にもアフリカツメガエル<ref name="ref20"><pubmed>21880813</pubmed></ref>など多くの動物に応用されており、大脳皮質の他にも間脳<ref name="ref1"><pubmed>21963197</pubmed></ref>や中脳<ref name="ref1"><pubmed>21963197</pubmed></ref>、脊髄<ref name="ref18"><pubmed>12657654</pubmed></ref>、小脳<ref name="ref17"><pubmed>18723012</pubmed></ref>、網膜<ref name="ref21"><pubmed>14603031</pubmed></ref>、筋肉<ref name="ref22"><pubmed>9743122</pubmed></ref>、精巣<ref name="ref23"><pubmed>11150518</pubmed></ref>など多くの組織でin vivo electroporationを用いた遺伝子導入に成功している。<br> | |||
電極には、マウス胎仔で多用されるピンセット型電極<ref name="ref1"><pubmed>11784059</pubmed></ref><ref name="ref15">'''Tetsuichiro Saito'''<br>Analysis of mammalian neuronal diversity using in vivo electroporation. ''The 607th National Institute of Genetics Colloquium, Mishima, Japan'':1999</ref><ref name="ref19"><pubmed>11301197</pubmed></ref> | |||
胎仔や組織のレベルで遺伝子を解析できる点が最大の長所であり、熟練すればマウス胎仔で9割近い生存率と9割を越える遺伝子導入効率が得られるが、技術的に注意を要する点がある。遺伝子は陽極側の細胞のみに限定的に導入される特長を有するため、陰極側の遺伝子導入されない部位との比較が容易であり、遺伝子の機能や発現制御機構の解析に威力を発揮する。 | 胎仔や組織のレベルで遺伝子を解析できる点が最大の長所であり、熟練すればマウス胎仔で9割近い生存率と9割を越える遺伝子導入効率が得られるが、技術的に注意を要する点がある。遺伝子は陽極側の細胞のみに限定的に導入される特長を有するため、陰極側の遺伝子導入されない部位との比較が容易であり、遺伝子の機能や発現制御機構の解析に威力を発揮する。 | ||
== 原理 == | == 原理 == | ||
培養細胞から個体まで広く使われる手法であるが、原理には不明な点が多い。単離細胞で使われる単一の減衰波パルスによる電気穿孔と、胎仔などで用いられる複数回の矩形波パルスによる電気穿孔では、メカニズムが異なる可能性がある。後者では、遺伝子導入される細胞が陽極側に限定されることなどから、単に細胞膜に穴が空くというより、電気パルスによる細胞膜の活性化と電気泳動と類似の核酸の移動の両者が総合的に働いて遺伝子が細胞内に導入されると考えられている<ref name=" | 培養細胞から個体まで広く使われる手法であるが、原理には不明な点が多い。単離細胞で使われる単一の減衰波パルスによる電気穿孔と、胎仔などで用いられる複数回の矩形波パルスによる電気穿孔では、メカニズムが異なる可能性がある。後者では、遺伝子導入される細胞が陽極側に限定されることなどから、単に細胞膜に穴が空くというより、電気パルスによる細胞膜の活性化と電気泳動と類似の核酸の移動の両者が総合的に働いて遺伝子が細胞内に導入されると考えられている<ref name="ref7"><pubmed>21963197</pubmed></ref>。また、単一の減衰波パルスの場合においても、低浸透圧下の赤血球で観察されたのと同様な穴が等張液の条件で作られるのかは不明であり、electroporationよりもelectropermeabilizationという言葉を使うべきとの議論もある<ref name="ref7"><pubmed>21963197</pubmed></ref>。 | ||
== 関連項目 == | == 関連項目 == | ||
| 61行目: | 33行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | |||
<references /> | |||
<br> | |||
(執筆者:斎藤哲一郎、担当編集委員:村上富士夫) | |||
2012年7月10日 (火) 15:07時点における版
英:electroporation
同義語:エレクトロポレーション
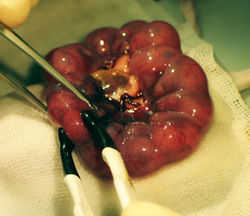
子宮をピンセット型電極で挟み、マウス胎仔脳へ電気パルスを与える[1]。
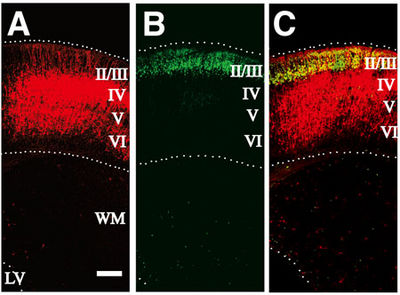
生後5日の大脳皮質。A 胎生13.5日にDsRed-mitoを導入、B 胎生15.5日にEYFPを導入、C 胎生13.5日にDs-Red-mitoと胎生15.5日にEYFPの2回の電気穿孔で遺伝子導入[2]。
電気穿孔法とは、電気パルスで細胞膜の透過性を上げることにより、DNAなどの分子を真核生物や原核生物の細胞に導入する方法である。高い導入効率が容易に得られるため、多くの種類の細胞に用いられる。培養細胞のみならず、マウスなどの胎仔に利用できる生体内電気穿孔法(in vivo electroporation)が確立され、遺伝子の解析が個体レベルで飛躍的に進んでいる。
歴史
電気穿孔の端緒は、1950年代に膜電位の測定法が研究されていた時期、あるレベル以上の電気パルスをランビエ絞輪に与えると膜電位が失われる発見に遡る[3]。ほぼ10年後、強い電気パルスが大腸菌を殺し、菌からβ−ガラクトシダーゼを溶出させることが観察され、電気パルスは細胞膜を破壊できると考えられるようになった[4]。その後、電気パルスで赤血球からヘモグロビンを溶出させる実験などが進み、適切な条件下では細胞膜は一度壊れた後でも機能を回復できることがわかった[5]。さらに、電気パルスを与えた赤血球に外からスクロースなどを入れることに成功し、電気パルスは細胞膜に穴(pore)を空け、穴が閉じることにより元に戻るとの概念が登場した[6]。また、赤血球にDNAやRNAを入れる実験なども行われた[7]。実際に細胞膜に穴が空いた像は、低浸透圧の条件下、赤血球を用いて電子顕微鏡で観察された[8]。しかし、等張液でも同様の穴が空くかには疑問が呈されている[9]。
1982年、Neumannらは電気パルスを用い、培養細胞のマウスL細胞にチミジンキナーゼ遺伝子を導入することに成功した[10]。続いて、他の研究者が植物のプロトプラスト[11]や大腸菌[12]にも遺伝子導入できることを示した。初期には、温度や電圧、パルスの幅や回数に加え、減衰波や矩形波のパルスなどいろいろと試されたが、減衰波のパルスを生む装置は比較的簡単に作れることもあり、減衰波パルスが主流となった。ES細胞など培養細胞への遺伝子導入には、過去のデータが集積しているなどの理由で、減衰波パルスが用いられることが多い。
しかし、減衰波パルスを用いる実験系で至適な遺伝子導入効率を得るためには、ある程度の細胞死を避けることはできない。一方、Takahashiらによりパルス幅の長い低電圧の矩形波を用いれば、細胞の高い生存率と遺伝子導入効率の両方を実現できることが示された[13]。この条件をMuramatsuらは応用し、ニワトリ胚に遺伝子導入できることを初めて示した[14]。さらに、ピンセット型の電極を用いることにより、子宮や卵黄囊の外側から電気パルスを与えることでマウス胎仔にも遺伝子導入できることが示された[1][15]。
適用例と手法
DNAやRNAなどの核酸を培養細胞や胎仔内の細胞など広く様々な細胞に導入するために使われる。膜を透過できない抗がん剤などの薬剤を細胞へ入れる方法としても検討されている。
実験系は、導入される細胞が培養細胞などの単離された細胞か生体内もしくは組織内の細胞かで2つに大別される。
単離細胞の電気穿孔法
培養皿や生体組織などから単離した細胞の懸濁液を核酸とともにキュベットに入れ、浮遊状態で電気パルスを与える。通常、高電圧で単一の減衰波パルスを用い、Bio-Rad社のジーンパルサーなどの装置が使われる。過去の多くのデータがあり、業者のプロトコールに従い、遺伝子導入を容易に行えるのが利点である。高い導入効率を得ようとすると、細胞の生存率が下がる点が欠点となる。
動物細胞は500 microF, 240 Vなど、大腸菌では25 microF, 2000 Vなどの条件が用いられる。
最も単純なパルス作製装置は、コンデンサーに蓄電した電気をスィッチの切替でキュベット内に放出させる仕組みであり[10]、初期には研究室で自作された。
胎仔や組織の細胞の電気穿孔法
子宮内のマウス胎仔やニワトリ胚、体外培養胚などの細胞に関しては、核酸を注入後、ピンセット型電極やニードル電極などで胎仔や組織を挟み、低電圧で長時間の矩形波パルスを複数回与える。例えば、胎生13.5日のマウス胎仔には40 V, 50 msecの矩形波パルスを1秒に1回ずつ5回与えるなどの条件が使われ、至適電圧は胎仔の発生のステージで異なる。ほとんど全てのマウス胎仔に遺伝子導入できる条件でも、電気穿孔で細胞死が増加しないことが確認されている[2][16]。電極と遺伝子導入される細胞が近接している必要はなく、子宮の外側から電気パルスを与えても脳内などへの遺伝子導入が可能である。パルス作製装置にはBEX社のCUY21などが用いられる。siRNAなどのRNAを導入することにより、標的タンパク質の発現を生体内で効率よく抑えることにも用いられる[17]。
生体内の細胞への電気穿孔はin vivo electroporationと呼ばれる。生体組織を取り出し体外培養の前などに行われる電気穿孔はex vivo electroporationと呼ばれることもある。マウス胎仔のin vivo electroporationでは、子宮の外からDNAなどを注入し、子宮の外側を電極で挟むことで電気穿孔するin utero electroporationが一般的である。in utero electroporation後の胎仔は子宮とともに母体に戻せば、生育でき出産も可能である[1]。一方、胎生12.5日以前では子宮の外から胎仔が見にくいなどの理由により、子宮壁を切開後にDNAなどを注入し、胎仔の入った卵黄囊を電極で挟み電気穿孔するexo utero electroporationも用いられる[1][18]。exo utero electroporationを施した胎仔は子宮壁を縫わずに母体に戻すことで生育可能であるが、出産後の仔マウスが必要な場合、母マウスは自力で出産できないため出産期に帝王切開を要する。
脳室に注入された分子は、脳室から漏れ出なければ拡散による希釈が限定的であるため、脳室の周囲の細胞への導入は比較的容易である。胎仔期の神経幹細胞や神経前駆細胞は脳室に接しており、遺伝子導入の格好の標的となる。大脳などでは、発生の時期により神経幹細胞から生み出される神経細胞の種類が異なるため、時期を選ぶことにより特定の種類の神経細胞のみで遺伝子を発現することが可能となる[1][2]。同一の胎仔に異なる時期で2回電気穿孔することもできる[2]。
電極には、マウス胎仔で多用されるピンセット型電極[1][15][19]、ニワトリ胚などで使われるニードル型電極[14]、導入部位を限定させるために核酸の注入針と電極を組み合わせた電極[20]などがある。
ニワトリやマウス以外にもアフリカツメガエル[20]など多くの動物に応用されており、大脳皮質の他にも間脳[1]や中脳[1]、脊髄[18]、小脳[17]、網膜[21]、筋肉[22]、精巣[23]など多くの組織でin vivo electroporationを用いた遺伝子導入に成功している。
胎仔や組織のレベルで遺伝子を解析できる点が最大の長所であり、熟練すればマウス胎仔で9割近い生存率と9割を越える遺伝子導入効率が得られるが、技術的に注意を要する点がある。遺伝子は陽極側の細胞のみに限定的に導入される特長を有するため、陰極側の遺伝子導入されない部位との比較が容易であり、遺伝子の機能や発現制御機構の解析に威力を発揮する。
原理
培養細胞から個体まで広く使われる手法であるが、原理には不明な点が多い。単離細胞で使われる単一の減衰波パルスによる電気穿孔と、胎仔などで用いられる複数回の矩形波パルスによる電気穿孔では、メカニズムが異なる可能性がある。後者では、遺伝子導入される細胞が陽極側に限定されることなどから、単に細胞膜に穴が空くというより、電気パルスによる細胞膜の活性化と電気泳動と類似の核酸の移動の両者が総合的に働いて遺伝子が細胞内に導入されると考えられている[7]。また、単一の減衰波パルスの場合においても、低浸透圧下の赤血球で観察されたのと同様な穴が等張液の条件で作られるのかは不明であり、electroporationよりもelectropermeabilizationという言葉を使うべきとの議論もある[7]。
関連項目
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7
Saito, T., & Nakatsuji, N. (2001).
Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental biology, 240(1), 237-46. [PubMed:11784059] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref1"が異なる内容で複数回定義されています - ↑ 2.0 2.1 2.2 2.3
Mizutani, K., & Saito, T. (2005).
Progenitors resume generating neurons after temporary inhibition of neurogenesis by Notch activation in the mammalian cerebral cortex. Development (Cambridge, England), 132(6), 1295-304. [PubMed:15750183] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref2"が異なる内容で複数回定義されています - ↑
STAMPFLI, R., & WILLI, M. (1957).
Membrane potential of a Ranvier node measured after electrical destruction of its membrane. Experientia, 13(7), 297-8. [PubMed:13461864] [WorldCat] [DOI] - ↑
Sale, A.J., & Hamilton, W.A. (1968).
Effects of high electric fields on micro-organisms. 3. Lysis of erythrocytes and protoplasts. Biochimica et biophysica acta, 163(1), 37-43. [PubMed:4969954] [WorldCat] [DOI] - ↑
Zimmermann, U., Pilwat, G., Holzapfel, C., & Rosenheck, K. (1976).
Electrical hemolysis of human and bovine red blood cells. The Journal of membrane biology, 30(2), 135-52. [PubMed:13222] [WorldCat] [DOI] - ↑
Kinosita, K., & Tsong, T.Y. (1977).
Formation and resealing of pores of controlled sizes in human erythrocyte membrane. Nature, 268(5619), 438-41. [PubMed:895849] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Auer, D., Brandner, G., & Bodemer, W. (1976).
Dielectric breakdown of the red blood cell membrane and uptake of SV 40 DNA and mammalian cell RNA. Die Naturwissenschaften, 63(8), 391. [PubMed:184398] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref7"が異なる内容で複数回定義されています - ↑
Chang, D.C., & Reese, T.S. (1990).
Changes in membrane structure induced by electroporation as revealed by rapid-freezing electron microscopy. Biophysical journal, 58(1), 1-12. [PubMed:2383626] [PMC] [WorldCat] [DOI] - ↑
Escoffre, J.M., Portet, T., Wasungu, L., Teissié, J., Dean, D., & Rols, M.P. (2009).
What is (still not) known of the mechanism by which electroporation mediates gene transfer and expression in cells and tissues. Molecular biotechnology, 41(3), 286-95. [PubMed:19016008] [WorldCat] [DOI] - ↑ 10.0 10.1
Neumann, E., Schaefer-Ridder, M., Wang, Y., & Hofschneider, P.H. (1982).
Gene transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal, 1(7), 841-5. [PubMed:6329708] [PMC] [WorldCat] 引用エラー: 無効な<ref>タグ; name "ref10"が異なる内容で複数回定義されています - ↑
Fromm, M., Taylor, L.P., & Walbot, V. (1985).
Expression of genes transferred into monocot and dicot plant cells by electroporation. Proceedings of the National Academy of Sciences of the United States of America, 82(17), 5824-8. [PubMed:3862099] [PMC] [WorldCat] [DOI] - ↑
Calvin, N.M., & Hanawalt, P.C. (1988).
High-efficiency transformation of bacterial cells by electroporation. Journal of bacteriology, 170(6), 2796-801. [PubMed:3286620] [PMC] [WorldCat] [DOI] - ↑
Takahashi, M., Furukawa, T., Saitoh, H., Aoki, A., Koike, T., Moriyama, Y., & Shibata, A. (1991).
Gene transfer into human leukemia cell lines by electroporation: experience with exponentially decaying and square wave pulse. Leukemia research, 15(6), 507-13. [PubMed:1907340] [WorldCat] [DOI] - ↑ 14.0 14.1
Muramatsu, T., Mizutani, Y., Ohmori, Y., & Okumura, J. (1997).
Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochemical and biophysical research communications, 230(2), 376-80. [PubMed:9016787] [WorldCat] [DOI] - ↑ 15.0 15.1 Tetsuichiro Saito
Analysis of mammalian neuronal diversity using in vivo electroporation. The 607th National Institute of Genetics Colloquium, Mishima, Japan:1999 - ↑
Saito, T. (2006).
In vivo electroporation in the embryonic mouse central nervous system. Nature protocols, 1(3), 1552-8. [PubMed:17406448] [WorldCat] [DOI] - ↑ 17.0 17.1
Kawauchi, D., & Saito, T. (2008).
Transcriptional cascade from Math1 to Mbh1 and Mbh2 is required for cerebellar granule cell differentiation. Developmental biology, 322(2), 345-54. [PubMed:18723012] [WorldCat] [DOI] - ↑ 18.0 18.1
Saba, R., Nakatsuji, N., & Saito, T. (2003).
Mammalian BarH1 confers commissural neuron identity on dorsal cells in the spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(6), 1987-91. [PubMed:12657654] [PMC] [WorldCat] - ↑
Tabata, H., & Nakajima, K. (2001).
Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience, 103(4), 865-72. [PubMed:11301197] [WorldCat] [DOI] - ↑ 20.0 20.1
Liu, X.F., & Haas, K. (2011).
Single-cell electroporation in Xenopus. Cold Spring Harbor protocols, 2011(9). [PubMed:21880813] [WorldCat] [DOI] - ↑
Matsuda, T., & Cepko, C.L. (2004).
Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proceedings of the National Academy of Sciences of the United States of America, 101(1), 16-22. [PubMed:14603031] [PMC] [WorldCat] [DOI] - ↑
Aihara, H., & Miyazaki, J. (1998).
Gene transfer into muscle by electroporation in vivo. Nature biotechnology, 16(9), 867-70. [PubMed:9743122] [WorldCat] [DOI] - ↑
Huang, Z., Tamura, M., Sakurai, T., Chuma, S., Saito, T., & Nakatsuji, N. (2000).
In vivo transfection of testicular germ cells and transgenesis by using the mitochondrially localized jellyfish fluorescent protein gene. FEBS letters, 487(2), 248-51. [PubMed:11150518] [WorldCat] [DOI]
(執筆者:斎藤哲一郎、担当編集委員:村上富士夫)