「プレパルス・インヒビション」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の9版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:prepulse inhibition 英語略名:PPI 独:Präpulsinhibition 仏:prepulse inhibition | 英語名:prepulse inhibition 英語略名:PPI 独:Präpulsinhibition 仏:prepulse inhibition | ||
驚愕刺激(パルス)の直前に微弱な刺激(プレパルス)が先行することにより驚愕反応が大幅に抑制される現象をプレパルス・インヒビションという。人と動物の両方で測定することができ、関連する脳部位や遺伝子多型など基礎的・臨床的研究が世界的に行われている。統合失調症患者および統合失調症の動物モデルの両方で低下が見られることから、統合失調症の[[エンドフェノタイプ]]として用いられることがある。 | |||
[[ファイル: 脳科学事典PPI.jpg|thumb|300px|'''図.聴覚性驚愕刺激による瞬目反射のプレパルス・インヒビション'''<br />驚愕刺激(パルス)の直前に微弱な刺激(プレパルス)が先行することにより驚愕反応が大幅に抑制される現象をプレパルス・インヒビションという。]] | [[ファイル: 脳科学事典PPI.jpg|thumb|300px|'''図.聴覚性驚愕刺激による瞬目反射のプレパルス・インヒビション'''<br />驚愕刺激(パルス)の直前に微弱な刺激(プレパルス)が先行することにより驚愕反応が大幅に抑制される現象をプレパルス・インヒビションという。]] | ||
==プレパルス・インヒビションとは== | ==プレパルス・インヒビションとは== | ||
突然に強い[[感覚]]刺激を動物に与えることで生じる[[瞬目反射]]などの[[驚愕反応]]が、その強い刺激の直前(30-300msec程度、通常60-120msec)に比較的弱い刺激を先行させることで、抑制される現象をいう<ref name=ref1>< | 突然に強い[[感覚]]刺激を動物に与えることで生じる[[瞬目反射]]などの[[驚愕反応]]が、その強い刺激の直前(30-300msec程度、通常60-120msec)に比較的弱い刺激を先行させることで、抑制される現象をいう<ref name=ref1> ''' Takahashi H, Hashimoto R, Iwase M, Ishii R, Kamio Y, Takeda M '''<br> Prepulse Inhibition of Startle Response: Recent Advances in Human Studies of Psychiatric Disease. <br>'' Clinical Psychopharmacology and Neuroscience '': 2011, 9(3); 102-110</ref><ref name=ref2><pubmed> 18568339 </pubmed></ref>。PPIは、先行する小さな刺激の情報を直後の強大な刺激から保護するための自動的、[[不随意]]的な抑制システムであるsensorimotor gatingの指標と考えられている。PPIは、単純な非言語性の刺激を用いるため年齢・人種に関係なく施行でき、[[エンドフェノタイプ]]と[[wikipedia:JA:遺伝子|遺伝子]]との関連解析に必要な多数のサンプルを集めやすいという利点がある。さらに、[[wikipedia:JA:ヒト|ヒト]]以外の動物にも認められ、類似のパラダイムを用いて評価が可能であり、1960年代にPPIが発見されて以後[[wikipedia:JA:マウス|マウス]]<ref name=ref3><pubmed> 19397931 </pubmed></ref>などのモデル動物やヒト<ref name=ref4><pubmed> 17197371</pubmed></ref>を対象に世界的に遺伝子や薬理学的研究など、神経生物学的研究が活発に行われている。PPIは[[視覚]]刺激、[[聴覚]]刺激、[[触覚]]刺激などあらゆる感覚刺激で認められるが、通常、実験などでは聴覚刺激が用いられることが多く、ヒトにおいては聴覚性の瞬目反射における[[wikipedia:JA:眼輪筋|眼輪筋]]の[[wikipedia:JA:筋電図|筋電図]]を用いて評価されることが多い<ref name=ref5><pubmed> 15720576 </pubmed></ref>。 | ||
==影響する因子== | ==影響する因子== | ||
| 33行目: | 22行目: | ||
==遺伝子多型 == | ==遺伝子多型 == | ||
近年PPIと[[遺伝子多型]]との関連について多くの報告があり、これらには[[ | 近年PPIと[[遺伝子多型]]との関連について多くの報告があり、これらには[[カテコールO-メチル基転移酵素]](COMT) Val158Met、ドーパミンD3受容体(DRD3) Ser9Gly、[[ニューレグリン]]1(NRG1) Arg38Gln、[[セロトニン#5-HT2.E5.8F.97.E5.AE.B9.E4.BD.93|セロトニン<sub>2A</sub>受容体]](5-HT<sub>2A</sub>) A1438G/T102C、[[ニコチン性アセチルコリン受容体]](nAChR)のα3サブユニット(CHRNA3)、v-rel avian reticuloendotheliosis viral oncogene homolog A (RELA) geneなど、多くの遺伝子多型が含まれる。これらの報告は、PPIが複数の神経系に関連したpolygenetic traitであること、およびgenetic studyにおけるエンドフェノタイプの使用が有用であることを支持していると考えられる<ref name=ref1 />。 | ||
==統合失調症とPPI== | ==統合失調症とPPI== | ||
| 44行目: | 33行目: | ||
PPIの障害は、[[強迫性障害]]や[[心的外傷後ストレス障害]] (posttraumatic stress disorder, PTSD)においても報告されている<ref name=ref3 />。[[自閉症スペクトラム障害]]の聴覚性驚愕反射のPPIは、児童期においては定型発達と有意な差を認めなかったが、成人期では定型発達に比べて減弱していると報告されている<ref name=ref1 />。聴覚性驚愕反射のPPIは8歳頃に成人と同程度まで成熟すると報告されており、児童期からみられる精神障害の場合、PPIの発達的変化についても検討する必要がある。 | PPIの障害は、[[強迫性障害]]や[[心的外傷後ストレス障害]] (posttraumatic stress disorder, PTSD)においても報告されている<ref name=ref3 />。[[自閉症スペクトラム障害]]の聴覚性驚愕反射のPPIは、児童期においては定型発達と有意な差を認めなかったが、成人期では定型発達に比べて減弱していると報告されている<ref name=ref1 />。聴覚性驚愕反射のPPIは8歳頃に成人と同程度まで成熟すると報告されており、児童期からみられる精神障害の場合、PPIの発達的変化についても検討する必要がある。 | ||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
(執筆者:高橋秀俊 担当編集委員:加藤忠史) | |||
2012年8月13日 (月) 15:04時点における版
英語名:prepulse inhibition 英語略名:PPI 独:Präpulsinhibition 仏:prepulse inhibition
驚愕刺激(パルス)の直前に微弱な刺激(プレパルス)が先行することにより驚愕反応が大幅に抑制される現象をプレパルス・インヒビションという。人と動物の両方で測定することができ、関連する脳部位や遺伝子多型など基礎的・臨床的研究が世界的に行われている。統合失調症患者および統合失調症の動物モデルの両方で低下が見られることから、統合失調症のエンドフェノタイプとして用いられることがある。
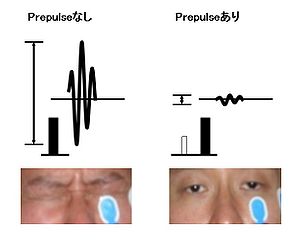
驚愕刺激(パルス)の直前に微弱な刺激(プレパルス)が先行することにより驚愕反応が大幅に抑制される現象をプレパルス・インヒビションという。
プレパルス・インヒビションとは
突然に強い感覚刺激を動物に与えることで生じる瞬目反射などの驚愕反応が、その強い刺激の直前(30-300msec程度、通常60-120msec)に比較的弱い刺激を先行させることで、抑制される現象をいう[1][2]。PPIは、先行する小さな刺激の情報を直後の強大な刺激から保護するための自動的、不随意的な抑制システムであるsensorimotor gatingの指標と考えられている。PPIは、単純な非言語性の刺激を用いるため年齢・人種に関係なく施行でき、エンドフェノタイプと遺伝子との関連解析に必要な多数のサンプルを集めやすいという利点がある。さらに、ヒト以外の動物にも認められ、類似のパラダイムを用いて評価が可能であり、1960年代にPPIが発見されて以後マウス[3]などのモデル動物やヒト[4]を対象に世界的に遺伝子や薬理学的研究など、神経生物学的研究が活発に行われている。PPIは視覚刺激、聴覚刺激、触覚刺激などあらゆる感覚刺激で認められるが、通常、実験などでは聴覚刺激が用いられることが多く、ヒトにおいては聴覚性の瞬目反射における眼輪筋の筋電図を用いて評価されることが多い[5]。
影響する因子
ヒトのPPIは測定毎のばらつきが少ない安定した指標と考えられているが、性別(とくに女性の場合、月経周期) [6]や喫煙[1]などの影響を受けることも知られている。女性は男性に比べ、PPIが減弱しており、性周期による変動が見られ、卵胞期は男性と変わらないが黄体期に男性より低くなる。喫煙によりPPIが増強するが、喫煙10分後には有意な増強効果を認めなくなる。
PPIに関しては、薬物、特に抗精神病薬の影響も多く研究されている[2]。動物にドーパミン作動薬を投与するとPPIが低下し、抗精神病薬で回復することから、PPIは抗精神病薬のスクリーニングテストとして前臨床試験の重要な指標と考えられ、動物を用いた研究が多くなされており、ドーパミン神経系・セロトニン神経系・グルタミン酸系・コリン系など複数の神経系がPPIに関連していることが報告されている。統合失調症患者を対象とした研究では、抗精神病薬、特に非定型抗精神病薬の投与により統合失調症患者のPPIの障害が改善するという報告が多い。
他にも、カフェインや大麻、アンフェタミンなどの影響も報告されている[1]。
脳部位
動物を使った多数の基礎的研究から、PPIを構成する神経回路網が同定されている[7]。聴覚性驚愕反射は、聴覚神経から尾側橋網様体核を介して脊髄運動神経核に伝えられことで引き起こされ、先行音による信号は、辺縁系皮質―線条体―淡蒼球―橋より尾側橋網様体核に至る神経回路を介して後続する驚愕音刺激に対する驚愕反射を抑制する。最近、positron emission tomography (PET) や anatomical/functional magnetic resonance imaging (MRI)などを用いてヒトのPPIに関する脳画像研究も行われており、前頭葉―線条体―視床回路がヒトのPPIと関連していると考えられる[1]。
遺伝子多型
近年PPIと遺伝子多型との関連について多くの報告があり、これらにはカテコールO-メチル基転移酵素(COMT) Val158Met、ドーパミンD3受容体(DRD3) Ser9Gly、ニューレグリン1(NRG1) Arg38Gln、セロトニン2A受容体(5-HT2A) A1438G/T102C、ニコチン性アセチルコリン受容体(nAChR)のα3サブユニット(CHRNA3)、v-rel avian reticuloendotheliosis viral oncogene homolog A (RELA) geneなど、多くの遺伝子多型が含まれる。これらの報告は、PPIが複数の神経系に関連したpolygenetic traitであること、およびgenetic studyにおけるエンドフェノタイプの使用が有用であることを支持していると考えられる[1]。
統合失調症とPPI
統合失調症のPPIに関する研究は1978年に初めて報告されて以後さかんに行われており、PPIは、統合失調症のエンドフェノタイプとして、最もよく用いられる精神生理学的指標の一つである[2]。統合失調症患者におけるPPIの低下は、一貫して報告されている。服薬歴のない初発の患者群や患者の第一度親族で症状のない家族、統合失調症型人格障害患者でもPPIの減弱を認めている。PPIのheritability(遺伝力)は32-50%と報告されている。ヨーロッパ系人種とアジア系人種、アフリカ系人種との間に、PPIを含む聴覚性驚愕反射の制御機構のプロフィールが異なるという報告があるが、最近、アジア系人種を対象にした研究が行われており、いずれも統合失調症患者のPPIは健常群より減弱していた。また、欧米の研究同様、日本人においても健常者のPPIはschizotypal personalityと負の相関を認めた。統合失調症のPPIの障害は、人種を超えて存在すると考えられる。
最近は、精神病状態の前駆期あるいはultra-high risk (UHR) を対象にした研究も増えており、PPIは、精神病状態の前駆期あるいはUHRに関連し、早期発見などに有用な指標の一つとなる可能性が示唆される[1]。
その他の精神疾患におけるPPI
PPIの障害は、強迫性障害や心的外傷後ストレス障害 (posttraumatic stress disorder, PTSD)においても報告されている[3]。自閉症スペクトラム障害の聴覚性驚愕反射のPPIは、児童期においては定型発達と有意な差を認めなかったが、成人期では定型発達に比べて減弱していると報告されている[1]。聴覚性驚愕反射のPPIは8歳頃に成人と同程度まで成熟すると報告されており、児童期からみられる精神障害の場合、PPIの発達的変化についても検討する必要がある。
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Takahashi H, Hashimoto R, Iwase M, Ishii R, Kamio Y, Takeda M
Prepulse Inhibition of Startle Response: Recent Advances in Human Studies of Psychiatric Disease.
Clinical Psychopharmacology and Neuroscience : 2011, 9(3); 102-110 - ↑ 2.0 2.1 2.2
Swerdlow, N.R., Weber, M., Qu, Y., Light, G.A., & Braff, D.L. (2008).
Realistic expectations of prepulse inhibition in translational models for schizophrenia research. Psychopharmacology, 199(3), 331-88. [PubMed:18568339] [PMC] [WorldCat] [DOI] - ↑ 3.0 3.1
Powell, S.B., Zhou, X., & Geyer, M.A. (2009).
Prepulse inhibition and genetic mouse models of schizophrenia. Behavioural brain research, 204(2), 282-94. [PubMed:19397931] [PMC] [WorldCat] [DOI] - ↑
Geyer, M.A. (2006).
The family of sensorimotor gating disorders: comorbidities or diagnostic overlaps? Neurotoxicity research, 10(3-4), 211-20. [PubMed:17197371] [PMC] [WorldCat] - ↑
Blumenthal, T.D., Cuthbert, B.N., Filion, D.L., Hackley, S., Lipp, O.V., & van Boxtel, A. (2005).
Committee report: Guidelines for human startle eyeblink electromyographic studies. Psychophysiology, 42(1), 1-15. [PubMed:15720576] [WorldCat] [DOI] - ↑
Kumari, V. (2011).
Sex differences and hormonal influences in human sensorimotor gating: implications for schizophrenia. Current topics in behavioral neurosciences, 8, 141-54. [PubMed:21374020] [WorldCat] [DOI] - ↑
Swerdlow, N.R., Geyer, M.A., & Braff, D.L. (2001).
Neural circuit regulation of prepulse inhibition of startle in the rat: current knowledge and future challenges. Psychopharmacology, 156(2-3), 194-215. [PubMed:11549223] [WorldCat] [DOI]
(執筆者:高橋秀俊 担当編集委員:加藤忠史)