「Signal Transducers and Activator of Transcription 3」の版間の差分
細 シグナル伝達兼転写活性化因子3へのリダイレクト |
Kinichinakashima (トーク | 投稿記録) 細編集の要約なし |
||
| (他の1人の利用者による、間の36版が非表示) | |||
| 1行目: | 1行目: | ||
== STAT3 == | |||
英:Signal Transducers and Activator of Transcription3、英略語:STAT3 | |||
シグナル伝達と転写活性化を行うことで、分化や生存、増殖などを調節するタンパク質の一群、STATファミリーの一つ。STATファミリー分子として報告されているのはSTAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6の7種類<ref name="ref1"><pubmed> 8608586 </pubmed></ref><ref><pubmed> 9418183 </pubmed></ref>。STAT3は非活性化状態時では細胞質に局在するが、Janus kinase(JAK)が活性化されることによってリン酸化を受け、核内移行し目的遺伝子を活性化する転写因子となる。この活性化経路はJAK/STAT経路と呼ばれている。悪性腫瘍形成の初期の過程などにおいて、JAK/STAT経路の制御不全が見られており、免疫抑制や腫瘍の生存延長、血管新生などを引き起こす。 | |||
== 活性化のメカニズム == | |||
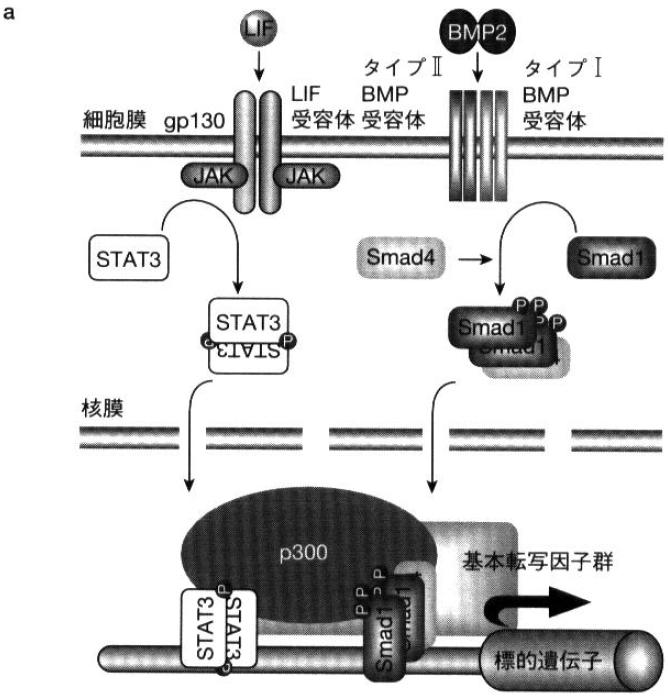
免疫系に作用するサイトカインとして同定された、L-6ファミリーサイトカイン(LIFなど)が細胞膜上のサイトカイン受容体複合体中のサイトカイン特異的結合鎖と結合することで、膜たんぱく質gp130を含む信号伝達鎖の二量体化がおこり、信号伝達鎖の細胞内領域に会合するJAKが活性化され、信号伝達鎖の細胞内領域中のチロシン残基をリン酸化する。リン酸化されたチロシン残基に、転写因子STAT3が自身のSH2(src homology 2)ドメインを介して会合、近接したJAKによりチロシンリン酸化(チロシン705)を受けることで活性化する<ref name="ref2"><pubmed> 9685167 </pubmed></ref>。チロシンリン酸化されたSTAT3分子はホモないしヘテロ二量体を形成し核へ移行した後、目的遺伝子の転写を制御する。 | |||
== 脳内での働き①:アストロサイト分化誘導 == | |||
STAT3二量体は転写活性化因子として目的遺伝子、グリア線維酸性タンパク質glial fibrillary acidic protein (GFAP)のプロモーターに結合し、転写を促進する。GFAPはアストロサイトの指標であり、神経幹細胞Neural stem cell(NSC)の培養系にLIFを添加し、JAK/STAT3経路を促進することでアストロサイトへの分化が増加することが明らかとなっている<ref name="ref3"><pubmed> 10486560 </pubmed></ref>。 | |||
また、STAT3をシグナル経路下流の転写因子とするLIFなどのサイトカイン群と、smadをシグナル経路下流の転写因子とするBMP2などのサイトカイン群(TGF-βスーパーファミリー)の両者は別々の受容体システムを介し、互いに協調的にクロストークして相乗的アストロサイト分化誘導<ref name="ref4"><pubmed> 10205054 </pubmed></ref>することが明らかにされている。 | |||
== 脳内での働き②:神経幹細胞増殖制御 == | |||
通常のSTAT3遺伝子欠損(ノックアウト, KO)は胎生致死に至るので、脳内におけるKOの影響は解析できない<ref name="ref5"><pubmed> 9108058 </pubmed></ref>。 | |||
そこで、神経系細胞特異的にSTAT3遺伝子を欠損(コンディショナルノックアウト, cKO)するトランスジェニックマウスを用いて、解析した結果、STAT3c KOマウスの海馬歯状回におけるNSCの数が減少することが明らかになった。このことから、ニューロンに対する栄養因子活性を有する毛様体神経栄養因子ciliary neurotrophic factor (CNTF)はサイトカイン受容体と結合し、下流のJAK/STAT3経路を活性化することで、NSCの自己増殖を制御することが示された<ref name="ref6"><pubmed> 19023034 </pubmed></ref>。しかし詳細なメカニズムは明らかにされていない。 | |||
== 脳内での働き③:てんかん発作誘導性神経細胞死への保護作用 == | |||
生体マウスにおいて興奮性アミノ酸の一種、カイニン酸kainic acid (KA)投与によるてんかん誘導に際し、抗てんかん薬として知られるcarbamazepine (CBZ)を投与すると、海馬のCA3領域のニューロンの死亡の割合がKA投与のみの個体に比べ、KA+CBZの個体で低いことが分かった。また、CA3のニューロン内で、STAT3の発現レベルがmRNA、タンパク質どちらにおいても上昇し、リン酸化STAT3も増加していた。加えて、神経保護タンパク質B-cell lymphoma-extra large (Bcl-xl)の共発現レベルが高まっていることから、CBZのシグナルを受けてJAK/STAT3経路が活性化し、Bcl-xlなどの発現を上昇させることで、てんかんによるニューロンの死への保護効果を発生させていることが示唆された<ref name="ref6"><pubmed> 22772901 </pubmed></ref>。だが、具体的なメカニズムはいまだ明らかにされていない。 | |||
また免疫・造血系制御に重要な役割を持つ、TGF-βスーパーファミリー(BMP2など)に属するサイトカインが、セリン/スレオニンキナーゼドメインを細胞内領域に持つタイプⅠとタイプⅡ受容体の二分子ずつのヘテロ四量体に結合し、受容体を活性化する。活性化受容体は、特異的転写因子群smadのセリン残基をリン酸化し、それらを活性化する。BMPの刺激で活性化される特異型smad(smad1,5,8)は共有型smadであるsmad4とヘテロオリゴマーを形成、核へ移行し、目的遺伝子の転写を制御する<ref><pubmed> 9393997 </pubmed></ref><ref><pubmed> 10733523 </pubmed></ref>。 | |||
上記の通り、STATとsmadは別々のサイトカイン受容体システムを通じて活性化を受ける転写因子である。しかし、それらの協調作用により、神経幹細胞のアストロサイトへの分化が劇的に誘導される<ref name="ref1" />。転写活性化の補助的役割を果たす核内転写共役因子p300がサイトカイン刺激に応答して、自身のN末端側を二量体化したSTAT3と、自身のC末端側をヘテロオリゴマー化したsmad1と、それぞれ同時に結合しSTAT3/p300/smad1複合体が形成される。これにより二種類サイトカインシグナルが核内で統合され、目的遺伝子GFAPの相乗的発現が起こる<ref name="ref1" />。そしてGFAPの発現によりアストロサイトへの分化が誘導される。(図a参照<ref name="ref3">'''中島欽一、滝沢琢己'''<br>免疫2000・01 P88-97<br>''中山書店'':2000</ref>) | |||
<br> | |||
<br> | |||
[[Image:無題1.jpg|RTENOTITLE]] | |||
<br> | |||
== 参考文献 == | |||
<references /> | |||
2012年9月12日 (水) 21:35時点における版
STAT3
英:Signal Transducers and Activator of Transcription3、英略語:STAT3
シグナル伝達と転写活性化を行うことで、分化や生存、増殖などを調節するタンパク質の一群、STATファミリーの一つ。STATファミリー分子として報告されているのはSTAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6の7種類[1][2]。STAT3は非活性化状態時では細胞質に局在するが、Janus kinase(JAK)が活性化されることによってリン酸化を受け、核内移行し目的遺伝子を活性化する転写因子となる。この活性化経路はJAK/STAT経路と呼ばれている。悪性腫瘍形成の初期の過程などにおいて、JAK/STAT経路の制御不全が見られており、免疫抑制や腫瘍の生存延長、血管新生などを引き起こす。
活性化のメカニズム
免疫系に作用するサイトカインとして同定された、L-6ファミリーサイトカイン(LIFなど)が細胞膜上のサイトカイン受容体複合体中のサイトカイン特異的結合鎖と結合することで、膜たんぱく質gp130を含む信号伝達鎖の二量体化がおこり、信号伝達鎖の細胞内領域に会合するJAKが活性化され、信号伝達鎖の細胞内領域中のチロシン残基をリン酸化する。リン酸化されたチロシン残基に、転写因子STAT3が自身のSH2(src homology 2)ドメインを介して会合、近接したJAKによりチロシンリン酸化(チロシン705)を受けることで活性化する[3]。チロシンリン酸化されたSTAT3分子はホモないしヘテロ二量体を形成し核へ移行した後、目的遺伝子の転写を制御する。
脳内での働き①:アストロサイト分化誘導
STAT3二量体は転写活性化因子として目的遺伝子、グリア線維酸性タンパク質glial fibrillary acidic protein (GFAP)のプロモーターに結合し、転写を促進する。GFAPはアストロサイトの指標であり、神経幹細胞Neural stem cell(NSC)の培養系にLIFを添加し、JAK/STAT3経路を促進することでアストロサイトへの分化が増加することが明らかとなっている[4]。 また、STAT3をシグナル経路下流の転写因子とするLIFなどのサイトカイン群と、smadをシグナル経路下流の転写因子とするBMP2などのサイトカイン群(TGF-βスーパーファミリー)の両者は別々の受容体システムを介し、互いに協調的にクロストークして相乗的アストロサイト分化誘導[5]することが明らかにされている。
脳内での働き②:神経幹細胞増殖制御
通常のSTAT3遺伝子欠損(ノックアウト, KO)は胎生致死に至るので、脳内におけるKOの影響は解析できない[6]。 そこで、神経系細胞特異的にSTAT3遺伝子を欠損(コンディショナルノックアウト, cKO)するトランスジェニックマウスを用いて、解析した結果、STAT3c KOマウスの海馬歯状回におけるNSCの数が減少することが明らかになった。このことから、ニューロンに対する栄養因子活性を有する毛様体神経栄養因子ciliary neurotrophic factor (CNTF)はサイトカイン受容体と結合し、下流のJAK/STAT3経路を活性化することで、NSCの自己増殖を制御することが示された[7]。しかし詳細なメカニズムは明らかにされていない。
脳内での働き③:てんかん発作誘導性神経細胞死への保護作用
生体マウスにおいて興奮性アミノ酸の一種、カイニン酸kainic acid (KA)投与によるてんかん誘導に際し、抗てんかん薬として知られるcarbamazepine (CBZ)を投与すると、海馬のCA3領域のニューロンの死亡の割合がKA投与のみの個体に比べ、KA+CBZの個体で低いことが分かった。また、CA3のニューロン内で、STAT3の発現レベルがmRNA、タンパク質どちらにおいても上昇し、リン酸化STAT3も増加していた。加えて、神経保護タンパク質B-cell lymphoma-extra large (Bcl-xl)の共発現レベルが高まっていることから、CBZのシグナルを受けてJAK/STAT3経路が活性化し、Bcl-xlなどの発現を上昇させることで、てんかんによるニューロンの死への保護効果を発生させていることが示唆された[7]。だが、具体的なメカニズムはいまだ明らかにされていない。
また免疫・造血系制御に重要な役割を持つ、TGF-βスーパーファミリー(BMP2など)に属するサイトカインが、セリン/スレオニンキナーゼドメインを細胞内領域に持つタイプⅠとタイプⅡ受容体の二分子ずつのヘテロ四量体に結合し、受容体を活性化する。活性化受容体は、特異的転写因子群smadのセリン残基をリン酸化し、それらを活性化する。BMPの刺激で活性化される特異型smad(smad1,5,8)は共有型smadであるsmad4とヘテロオリゴマーを形成、核へ移行し、目的遺伝子の転写を制御する[8][9]。
上記の通り、STATとsmadは別々のサイトカイン受容体システムを通じて活性化を受ける転写因子である。しかし、それらの協調作用により、神経幹細胞のアストロサイトへの分化が劇的に誘導される[1]。転写活性化の補助的役割を果たす核内転写共役因子p300がサイトカイン刺激に応答して、自身のN末端側を二量体化したSTAT3と、自身のC末端側をヘテロオリゴマー化したsmad1と、それぞれ同時に結合しSTAT3/p300/smad1複合体が形成される。これにより二種類サイトカインシグナルが核内で統合され、目的遺伝子GFAPの相乗的発現が起こる[1]。そしてGFAPの発現によりアストロサイトへの分化が誘導される。(図a参照[4])
参考文献
- ↑ 1.0 1.1 1.2
Ihle, J.N. (1996).
STATs: signal transducers and activators of transcription. Cell, 84(3), 331-4. [PubMed:8608586] [WorldCat] [DOI] - ↑
O'Shea, J.J., Notarangelo, L.D., Johnston, J.A., & Candotti, F. (1997).
Advances in the understanding of cytokine signal transduction: the role of Jaks and STATs in immunoregulation and the pathogenesis of immunodeficiency. Journal of clinical immunology, 17(6), 431-47. [PubMed:9418183] [WorldCat] [DOI] - ↑
Nakashima, K., & Taga, T. (1998).
gp130 and the IL-6 family of cytokines: signaling mechanisms and thrombopoietic activities. Seminars in hematology, 35(3), 210-21. [PubMed:9685167] [WorldCat] - ↑ 4.0 4.1
Nakashima, K., Yanagisawa, M., Arakawa, H., & Taga, T. (1999).
Astrocyte differentiation mediated by LIF in cooperation with BMP2. FEBS letters, 457(1), 43-6. [PubMed:10486560] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref3"が異なる内容で複数回定義されています - ↑
Nakashima, K., Yanagisawa, M., Arakawa, H., Kimura, N., Hisatsune, T., Kawabata, M., ..., & Taga, T. (1999).
Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science (New York, N.Y.), 284(5413), 479-82. [PubMed:10205054] [WorldCat] [DOI] - ↑
Takeda, K., Noguchi, K., Shi, W., Tanaka, T., Matsumoto, M., Yoshida, N., ..., & Akira, S. (1997).
Targeted disruption of the mouse Stat3 gene leads to early embryonic lethality. Proceedings of the National Academy of Sciences of the United States of America, 94(8), 3801-4. [PubMed:9108058] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Müller, S., Chakrapani, B.P., Schwegler, H., Hofmann, H.D., & Kirsch, M. (2009).
Neurogenesis in the dentate gyrus depends on ciliary neurotrophic factor and signal transducer and activator of transcription 3 signaling. Stem cells (Dayton, Ohio), 27(2), 431-41. [PubMed:19023034] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "ref6"が異なる内容で複数回定義されています - ↑
Heldin, C.H., Miyazono, K., & ten Dijke, P. (1997).
TGF-beta signalling from cell membrane to nucleus through SMAD proteins. Nature, 390(6659), 465-71. [PubMed:9393997] [WorldCat] [DOI] - ↑
Massagué, J., & Chen, Y.G. (2000).
Controlling TGF-beta signaling. Genes & development, 14(6), 627-44. [PubMed:10733523] [WorldCat]