「膜容量測定法」の版間の差分
細編集の要約なし |
細 ページの作成:「英語名:membrane capacitance measurement, <br>独Membran Kapazitätsmessung, <br>仏 mesure de la capacité membranaire 一般に、膜電位固定法では、測定...」 |
||
| (3人の利用者による、間の20版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:membrane capacitance measurement, <br>独Membran Kapazitätsmessung, <br>仏 mesure de la capacité membranaire | |||
[[Image: | 一般に、膜電位固定法では、測定する膜電流成分のイオン性の成分と膜容量成分を分離することができる。特に、NeherとMartyはパッチクランプ法と正弦波膜電位固定法を用いて、膜容量成分の微細な変化を記録する手法を1982年に確立した<ref><pubmed>6959149</pubmed></ref>。開口放出やエンドサイトーシスは膜面積の変化を伴うので、膜容量からこれらの現象を電気的に推定することができる。<br>[[Image:図_1.png|thumb|’’’図1 細胞膜の等価回路’’’<br>]]<br>==膜容量測定法の原理==<br>全細胞記録(whole-cell clamp recording)の電気的等価回路モデルには、アクセスコンダクタンス(Gs)、膜コンダクタンス(Gm)、膜容量(Cm)の3つの定数がある。これらの定数は、正弦波状の膜電位固定を行った時、電流記録の、振幅、位相、保持電流の3つの定数から推定することができる。市販されているパッチクランプ増幅器の ”sine+DC” 法を用いると、この測定は正確かつ自動的に行われる<ref><pubmed>10764227</pubmed></ref>。一方、オンセル記録(cell-attached patch recording) では小胞膜容量(Cm)と融合細孔のコンダクタンス(g)の2つのパラメータを、正弦波膜電流の大きさと位相の2つから求めることができる<ref><pubmed>2442614</pubmed></ref>。この場合、単一小胞に由来する小さな膜容量変化を捉えるために高周波(10-50kHz)で膜電位固定をして、ロックインアンプで微小な変化を記録する。 | ||
==膜容量測定法の長所と短所== | |||
= | |||
単位膜面積当たりの膜容量は一定(約1 μF/cm2)であることを仮定すれば、膜容量から膜面積を推定できることになる。この測定は、電気的であるために、ミリ秒近くの速さや0.1 fFの微小な変化も測定可能である。実際、単一小胞の開口放出やエンドサイトーシスがステップ状に計測される場合、その大きさが分泌小胞やエンドサイトーシスに関わる小胞の電子顕微鏡的な大きさと一致する。その様な場合、膜融合や分裂の際に形成される安定な中間段階と考えられている融合細孔の性質を調べることができる。また、シナプスのミリ秒の開口放出の定量化も可能である。膜容量測定の原理からすると理想的な空間的膜電位固定(space clamp)がかかっている必要があるが、軸索終末への応用も試みられている<ref><pubmed>19279571</pubmed></ref>。この場合、高周波正弦波の軸索での減衰から、単一終末の開口放出やエンドサイトーシスを記録することが可能である。<br> 一方、測定は開口放出による膜面積の増大とエンドサイトーシスによる膜面積の減少の和を見ており、これらを分離することは原理的に不可能である。また、単一小胞のステップが見えない場合には、小胞の種類を特定することができない<ref><pubmed>16150796</pubmed></ref>。膜面積当たりの膜容量一定の仮定がどれだけ厳密に成り立っているのか検証する方法がない。そして、画像による開口放出の検出と異なり、開口放出の最終段階のみ、エンドサイトーシスの初期段階のみが測定可能である。この様な短所はあるものの、電気生理学固有のSNの良さや時間分解の高さがあり、開口放出やエンドサイトーシスの研究の一手法として今後も用いられていくであろう。 | |||
== | ==関連項目==<br>[[アクティブゾーン]]<br>[[神経伝達]] | ||
<br>==参考文献==<br><references /> | |||
(執筆者:高橋倫子、河西春郎、担当編集委員:柚崎通介)<br> | |||
< | |||
2012年9月16日 (日) 22:52時点における版
英語名:membrane capacitance measurement,
独Membran Kapazitätsmessung,
仏 mesure de la capacité membranaire
一般に、膜電位固定法では、測定する膜電流成分のイオン性の成分と膜容量成分を分離することができる。特に、NeherとMartyはパッチクランプ法と正弦波膜電位固定法を用いて、膜容量成分の微細な変化を記録する手法を1982年に確立した<ref><pubmed>6959149</pubmed></ref>。開口放出やエンドサイトーシスは膜面積の変化を伴うので、膜容量からこれらの現象を電気的に推定することができる。
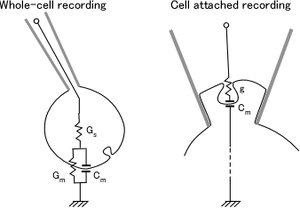
==膜容量測定法の原理==
全細胞記録(whole-cell clamp recording)の電気的等価回路モデルには、アクセスコンダクタンス(Gs)、膜コンダクタンス(Gm)、膜容量(Cm)の3つの定数がある。これらの定数は、正弦波状の膜電位固定を行った時、電流記録の、振幅、位相、保持電流の3つの定数から推定することができる。市販されているパッチクランプ増幅器の ”sine+DC” 法を用いると、この測定は正確かつ自動的に行われる<ref><pubmed>10764227</pubmed></ref>。一方、オンセル記録(cell-attached patch recording) では小胞膜容量(Cm)と融合細孔のコンダクタンス(g)の2つのパラメータを、正弦波膜電流の大きさと位相の2つから求めることができる<ref><pubmed>2442614</pubmed></ref>。この場合、単一小胞に由来する小さな膜容量変化を捉えるために高周波(10-50kHz)で膜電位固定をして、ロックインアンプで微小な変化を記録する。
膜容量測定法の長所と短所
単位膜面積当たりの膜容量は一定(約1 μF/cm2)であることを仮定すれば、膜容量から膜面積を推定できることになる。この測定は、電気的であるために、ミリ秒近くの速さや0.1 fFの微小な変化も測定可能である。実際、単一小胞の開口放出やエンドサイトーシスがステップ状に計測される場合、その大きさが分泌小胞やエンドサイトーシスに関わる小胞の電子顕微鏡的な大きさと一致する。その様な場合、膜融合や分裂の際に形成される安定な中間段階と考えられている融合細孔の性質を調べることができる。また、シナプスのミリ秒の開口放出の定量化も可能である。膜容量測定の原理からすると理想的な空間的膜電位固定(space clamp)がかかっている必要があるが、軸索終末への応用も試みられている<ref><pubmed>19279571</pubmed></ref>。この場合、高周波正弦波の軸索での減衰から、単一終末の開口放出やエンドサイトーシスを記録することが可能である。
一方、測定は開口放出による膜面積の増大とエンドサイトーシスによる膜面積の減少の和を見ており、これらを分離することは原理的に不可能である。また、単一小胞のステップが見えない場合には、小胞の種類を特定することができない<ref><pubmed>16150796</pubmed></ref>。膜面積当たりの膜容量一定の仮定がどれだけ厳密に成り立っているのか検証する方法がない。そして、画像による開口放出の検出と異なり、開口放出の最終段階のみ、エンドサイトーシスの初期段階のみが測定可能である。この様な短所はあるものの、電気生理学固有のSNの良さや時間分解の高さがあり、開口放出やエンドサイトーシスの研究の一手法として今後も用いられていくであろう。
==参考文献==
<references />
(執筆者:高橋倫子、河西春郎、担当編集委員:柚崎通介)