「エクソサイトーシス」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の26版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:exocytosis 独: Exocytose 仏: exocytose <br> | |||
同義語: 開口放出、分泌、開口分泌 | |||
細胞からの分泌現象は開口放出により起きることが、電子顕微鏡でシナプス小胞や分泌小胞が発見されたことから提唱された。その要素過程は膜融合という超微細構造変化にある点が難しい。しかし、現在では、様々の機能的測定や分子生物学的手法により、その解明が進んできた。 | |||
== 定義 | ==定義== | ||
細胞質の分泌小胞の膜が細胞膜に融合することにより、小胞内腔と細胞外液が交通し、分泌小胞の内容物が細胞外に放出される現象を開口放出(exocytosis)という。速い神経伝達物質放出はシナプス小胞の、神経ペプチドの分泌は大型有芯小胞の開口放出により起きる。開口放出に伴い小胞の膜や蛋白質が細胞膜に運ばれ、これを回収するため、エンドサイトーシスが引き続き起きることが多い。開口放出は概念的には調節性と構成的なものに分けられる。調節性の場合、細胞に対する刺激で開口放出が起きるが、その刺激は細胞内Ca2+やcAMPの濃度上昇を起こすことが多い。 | |||
== 多様性 | ==多様性== | ||
[[Image:PVR fig 1.png|400px|thumb|開口放出の速さの多様性 ]] | |||
調節性開口放出の場合には、刺激から開口放出が起きるまでの時間が1ミリ秒以下から100秒以上と10万倍以上に及ぶ。この開口放出時定数は開口放出を特徴づける大きな機能的指標であり(図1)、分子機構とも深く関連する。1-100ミリ秒で起きる速い開口放出の場合には、小胞と細胞膜が予め近接(ドック)している必要があり、更に、分泌関連蛋白がある程度会合していることが予想される。特に、1ミリ秒以下で開口放出の起きる超高速開口放出(ultrafast exocytosis)はシナプス前終末のアクティブゾーンでしか見られない。一方、100ミリ秒より遅い分泌については、分泌関連蛋白は会合している必要はなく、また刺激後に小胞がドックするのでも十分間に合う。実際、大型有芯小胞の場合、刺激後に小胞がドックし、分泌関連蛋白が会合するのが観察される。シナプス小胞の開口放出でも、持続的な反復刺激に対しては、細胞質に浮いている小胞のリサイクリングが開口放出を率速し、活動電位と開口放出のミリ秒の同期は消失する(図1)。この場合、持続的な細胞内Ca2+上昇が細胞質に浮いている小胞を刺激して開口放出を起こしていることになる。シナプス後部でも、長期増強(LTP)刺激の際には、樹状突起細胞質にある小胞の開口放出によりグルタミン酸受容体の細胞膜への秒単位の挿入が起きる。 | |||
内分泌細胞、外分泌細胞や血液細胞の場合には、表面の小胞の細胞膜への融合だけでなく、膜融合が複数の小胞で複合的に進行することにより(複合型開口放出)、細胞質深層にある小胞がそのままの位置で細胞膜まで運ばれることなく開口放出し、貯蔵された小胞を効率よく放出する現象が見られる。これには、逐次的に内部に進行する様式(逐次開口放出)と先行して細胞質で融合してから開口放出に至る様式(多小胞性開口放出)がある。いずれも、神経でも用いられている可能性が指摘されている。 | |||
開口放出の初発過程は小胞膜と細胞膜という二つの脂質二重膜の融合であり、この時に形成される脂質二重膜でできた小胞と細胞外を繋ぐ通り道のことを融合細孔(fusion pore)という。初期融合細孔は直径0.4nm位と推定され、ミリ秒の安定性を持ち、時々、再閉鎖、再開口したり、再閉鎖した結果そのまま小胞がエンドサイトーシスされることもある。直径50nm以下のシナプス小胞の場合、この初期融合細孔の数ミリ秒の開口で、神経伝達物質が放出されると推定される。これに対して、大型有芯小胞からのペプチドの分泌では、初期細孔を通ることはできずに、融合細孔が拡大し、最終的には小胞が細胞膜に平滑化する、完全融合が起きる。 | |||
==分子機構== | |||
[[Image:PVR figu 8.png|400px|thumb|開口放出の多様性<br> cisSNARE複合体のNSFによる解離から、開口放出に至る分子過程とエネルギー地図と各分子の関与 ]] | |||
開口放出の根本過程は細胞膜にあるt-SNARE分子と小胞にあるv-SNAREの会合による(図2)。神経の代表的SNARE分子には、v-SNAREとしてVAMP2、t-SNAREとしてsyntaxin1とSNAP25がある。ボツリヌス毒素や破傷風毒素はSNAREを特異的に切断する活性を持ち、切断が起きると速い神経伝達はほぼ完全に阻害される。神経や分泌細胞でもSNAREの他のサブタイプが発現しており、遅い開口放出に関係している。複合化したSNAREは安定で、細胞膜に残りcis-SNARE複合体を形成する。NSFがSNAPを補因子としてATP依存的にSNARE分子を脱解離させる。こうして、遊離SNARE分子は会合するエネルギーを持って準備している。 | |||
これらのSNARE分子の生理的な会合には、Munc18や Munc13の2つの分子が神経でも分泌細胞でも必須である。Munc18はsyntaxinと高親和性に結合し、syntaxinの分子シャペロンとして働く。この結合状態ではsyntaxinは他のSNAREと結合できない。一方、Munc13はsyntaxinとMunc18の強い結合を解き、SNARE複合体の形成を促進する因子と考えられる。この作用様式がMunc13のサブタイプ(Munc13-1,2,3,4)により異なり、これがシナプスや分泌細胞の応答特異性に影響している可能性がある。Munc18はSNARE複合体とも結合し、そのサブタイプ(Munc18-a,b,c)によりSNAREサブタイプ特異的に結合能が異なり、SNAREサブタイプ間の結合特異性を決める因子として働く。SNARE分子の会合を促進する因子はプライミング分子を呼ばれる。Munc13、 Munc18の他に、CAPS, snapin, complexinなどが知られている。これらの分子は刺激前に働いて準備状態を作ることも、後に働らき開口放出の誘発に関係することもある。 | |||
開口放出にカルシウム感受性を付与する分子(カルシウムセンサー)としては、synaptotagminやDoc2などのC2ドメインを持つ分子の関与が濃厚である。特に、超高速開口放出にはsynaptotagmin1,2が関係している。これらの分子は、脂質2重膜との間でCa2+依存的な結合をする。Ca2+依存的な結合が、膜融合の直接的な引き金となっている可能性が高い。これらのCa2+センサーはcomplexinを介してSNAREと相互作用する。 | |||
アクティブゾーンには更に幾つかの分子(Rim, ELKS/CAST, liprin, bassoon, piccolo, neurexinなど) が集積しており、この超分子的な集積がアクティブゾーンとしての微細構造を作っていると考えられる。中でも、Rimは膜電位依存性カルシウムチャネルの集積に関係し、チャネル開口部にできる高濃度カルシウム領域(カルシウムドメイン)による開口放出の高速調節に必須と考えられる。アクティブゾーンで見られる超高速開口放出には、SNARE分子が拡散的に会合する余裕はなく、既に近接してtrans-SNARE複合体を形成していると考えられる。一方、SNAREが既に会合しきっていたのでは、刺激後に膜融合に必要な力が説明されないので、SNAREは特有な不安定な複合体状態をとっており、そのために超分子構造が使われていると考えられる。 | |||
シナプスの超高速開口放出では、刺激後放出に至る時間が短いので、小胞はアクティブゾーン細胞膜にドックし、次に、プライミングという分子過程を経て、分泌準備完了状態となり、Ca2+刺激で膜融合が起きると考えるのが自然である。この分子的準備完了状態は正確にはどういうものか未解明である。この超高速開口放出が開口放出がモデルとして用いられ、普通の遅い開口放出も同一機転で起きることが想定されることが多い。しかしながら、100ミリ秒より遅い普通の開口放出については、SNAREが拡散的に会合する時間があり、遅い開口放出は、刺激後にSNAREの拡散的な会合が起きれば、最も自然に説明される。刺激前の状態としては、t-SNAREだけ複合化した状態(binary-SNARE状態)やSNARE分子が全部分離した状態(unitary-SNARE状態)、更には、cis-SNAREである状態が考えられている(図2)。この場合もCa2+依存性はsynaptotagminと細胞膜の結合によりSNARE分子が会合し複合体を形成しやすくない機構が関与し得る。更に、SNAREのリン酸化により、複合化が調節されている場合や、cAMPやCa2+刺激により、細胞質の小胞の運動性が増す。シナプス小胞の持続的分泌や自発的分泌では後者の機構の関与が考えられる。 | |||
==関連項目== | |||
[[アクティブゾーン]]<br> | |||
[[神経伝達]]<br> | |||
=== | ==参考文献== | ||
<references /> | |||
(執筆者:高橋倫子、河西春郎、担当編集委員:尾藤晴彦) | |||
2012年9月18日 (火) 21:33時点における版
英語名:exocytosis 独: Exocytose 仏: exocytose
同義語: 開口放出、分泌、開口分泌
細胞からの分泌現象は開口放出により起きることが、電子顕微鏡でシナプス小胞や分泌小胞が発見されたことから提唱された。その要素過程は膜融合という超微細構造変化にある点が難しい。しかし、現在では、様々の機能的測定や分子生物学的手法により、その解明が進んできた。
定義
細胞質の分泌小胞の膜が細胞膜に融合することにより、小胞内腔と細胞外液が交通し、分泌小胞の内容物が細胞外に放出される現象を開口放出(exocytosis)という。速い神経伝達物質放出はシナプス小胞の、神経ペプチドの分泌は大型有芯小胞の開口放出により起きる。開口放出に伴い小胞の膜や蛋白質が細胞膜に運ばれ、これを回収するため、エンドサイトーシスが引き続き起きることが多い。開口放出は概念的には調節性と構成的なものに分けられる。調節性の場合、細胞に対する刺激で開口放出が起きるが、その刺激は細胞内Ca2+やcAMPの濃度上昇を起こすことが多い。
多様性

調節性開口放出の場合には、刺激から開口放出が起きるまでの時間が1ミリ秒以下から100秒以上と10万倍以上に及ぶ。この開口放出時定数は開口放出を特徴づける大きな機能的指標であり(図1)、分子機構とも深く関連する。1-100ミリ秒で起きる速い開口放出の場合には、小胞と細胞膜が予め近接(ドック)している必要があり、更に、分泌関連蛋白がある程度会合していることが予想される。特に、1ミリ秒以下で開口放出の起きる超高速開口放出(ultrafast exocytosis)はシナプス前終末のアクティブゾーンでしか見られない。一方、100ミリ秒より遅い分泌については、分泌関連蛋白は会合している必要はなく、また刺激後に小胞がドックするのでも十分間に合う。実際、大型有芯小胞の場合、刺激後に小胞がドックし、分泌関連蛋白が会合するのが観察される。シナプス小胞の開口放出でも、持続的な反復刺激に対しては、細胞質に浮いている小胞のリサイクリングが開口放出を率速し、活動電位と開口放出のミリ秒の同期は消失する(図1)。この場合、持続的な細胞内Ca2+上昇が細胞質に浮いている小胞を刺激して開口放出を起こしていることになる。シナプス後部でも、長期増強(LTP)刺激の際には、樹状突起細胞質にある小胞の開口放出によりグルタミン酸受容体の細胞膜への秒単位の挿入が起きる。
内分泌細胞、外分泌細胞や血液細胞の場合には、表面の小胞の細胞膜への融合だけでなく、膜融合が複数の小胞で複合的に進行することにより(複合型開口放出)、細胞質深層にある小胞がそのままの位置で細胞膜まで運ばれることなく開口放出し、貯蔵された小胞を効率よく放出する現象が見られる。これには、逐次的に内部に進行する様式(逐次開口放出)と先行して細胞質で融合してから開口放出に至る様式(多小胞性開口放出)がある。いずれも、神経でも用いられている可能性が指摘されている。
開口放出の初発過程は小胞膜と細胞膜という二つの脂質二重膜の融合であり、この時に形成される脂質二重膜でできた小胞と細胞外を繋ぐ通り道のことを融合細孔(fusion pore)という。初期融合細孔は直径0.4nm位と推定され、ミリ秒の安定性を持ち、時々、再閉鎖、再開口したり、再閉鎖した結果そのまま小胞がエンドサイトーシスされることもある。直径50nm以下のシナプス小胞の場合、この初期融合細孔の数ミリ秒の開口で、神経伝達物質が放出されると推定される。これに対して、大型有芯小胞からのペプチドの分泌では、初期細孔を通ることはできずに、融合細孔が拡大し、最終的には小胞が細胞膜に平滑化する、完全融合が起きる。
分子機構
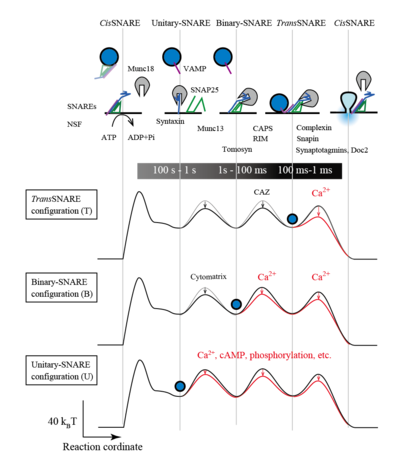
cisSNARE複合体のNSFによる解離から、開口放出に至る分子過程とエネルギー地図と各分子の関与
開口放出の根本過程は細胞膜にあるt-SNARE分子と小胞にあるv-SNAREの会合による(図2)。神経の代表的SNARE分子には、v-SNAREとしてVAMP2、t-SNAREとしてsyntaxin1とSNAP25がある。ボツリヌス毒素や破傷風毒素はSNAREを特異的に切断する活性を持ち、切断が起きると速い神経伝達はほぼ完全に阻害される。神経や分泌細胞でもSNAREの他のサブタイプが発現しており、遅い開口放出に関係している。複合化したSNAREは安定で、細胞膜に残りcis-SNARE複合体を形成する。NSFがSNAPを補因子としてATP依存的にSNARE分子を脱解離させる。こうして、遊離SNARE分子は会合するエネルギーを持って準備している。
これらのSNARE分子の生理的な会合には、Munc18や Munc13の2つの分子が神経でも分泌細胞でも必須である。Munc18はsyntaxinと高親和性に結合し、syntaxinの分子シャペロンとして働く。この結合状態ではsyntaxinは他のSNAREと結合できない。一方、Munc13はsyntaxinとMunc18の強い結合を解き、SNARE複合体の形成を促進する因子と考えられる。この作用様式がMunc13のサブタイプ(Munc13-1,2,3,4)により異なり、これがシナプスや分泌細胞の応答特異性に影響している可能性がある。Munc18はSNARE複合体とも結合し、そのサブタイプ(Munc18-a,b,c)によりSNAREサブタイプ特異的に結合能が異なり、SNAREサブタイプ間の結合特異性を決める因子として働く。SNARE分子の会合を促進する因子はプライミング分子を呼ばれる。Munc13、 Munc18の他に、CAPS, snapin, complexinなどが知られている。これらの分子は刺激前に働いて準備状態を作ることも、後に働らき開口放出の誘発に関係することもある。
開口放出にカルシウム感受性を付与する分子(カルシウムセンサー)としては、synaptotagminやDoc2などのC2ドメインを持つ分子の関与が濃厚である。特に、超高速開口放出にはsynaptotagmin1,2が関係している。これらの分子は、脂質2重膜との間でCa2+依存的な結合をする。Ca2+依存的な結合が、膜融合の直接的な引き金となっている可能性が高い。これらのCa2+センサーはcomplexinを介してSNAREと相互作用する。
アクティブゾーンには更に幾つかの分子(Rim, ELKS/CAST, liprin, bassoon, piccolo, neurexinなど) が集積しており、この超分子的な集積がアクティブゾーンとしての微細構造を作っていると考えられる。中でも、Rimは膜電位依存性カルシウムチャネルの集積に関係し、チャネル開口部にできる高濃度カルシウム領域(カルシウムドメイン)による開口放出の高速調節に必須と考えられる。アクティブゾーンで見られる超高速開口放出には、SNARE分子が拡散的に会合する余裕はなく、既に近接してtrans-SNARE複合体を形成していると考えられる。一方、SNAREが既に会合しきっていたのでは、刺激後に膜融合に必要な力が説明されないので、SNAREは特有な不安定な複合体状態をとっており、そのために超分子構造が使われていると考えられる。
シナプスの超高速開口放出では、刺激後放出に至る時間が短いので、小胞はアクティブゾーン細胞膜にドックし、次に、プライミングという分子過程を経て、分泌準備完了状態となり、Ca2+刺激で膜融合が起きると考えるのが自然である。この分子的準備完了状態は正確にはどういうものか未解明である。この超高速開口放出が開口放出がモデルとして用いられ、普通の遅い開口放出も同一機転で起きることが想定されることが多い。しかしながら、100ミリ秒より遅い普通の開口放出については、SNAREが拡散的に会合する時間があり、遅い開口放出は、刺激後にSNAREの拡散的な会合が起きれば、最も自然に説明される。刺激前の状態としては、t-SNAREだけ複合化した状態(binary-SNARE状態)やSNARE分子が全部分離した状態(unitary-SNARE状態)、更には、cis-SNAREである状態が考えられている(図2)。この場合もCa2+依存性はsynaptotagminと細胞膜の結合によりSNARE分子が会合し複合体を形成しやすくない機構が関与し得る。更に、SNAREのリン酸化により、複合化が調節されている場合や、cAMPやCa2+刺激により、細胞質の小胞の運動性が増す。シナプス小胞の持続的分泌や自発的分泌では後者の機構の関与が考えられる。
関連項目
参考文献
(執筆者:高橋倫子、河西春郎、担当編集委員:尾藤晴彦)