「リアノジン受容体」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の42版が非表示) | |||
| 1行目: | 1行目: | ||
リアノジン受容体 | |||
英語名:Ryanodine | 英語名:Ryanodine receptor 英語略名:RyR | ||
リアノジン受容体(Ryanodine receptor; RyR)は細胞内Ca<sup>2+</sup>貯蔵部位である小胞体膜上に存在するCa<sup>2+</sup>チャネルであり、その名は、植物アルカロイドであるリアノジンが結合することに由来する。小胞体からのCa<sup>2+</sup>放出を担うことから、同じく小胞体膜上に存在するCa<sup>2+</sup>チャネルであるイノシトール1,4,5-三リン酸受容体(inositol 1,4,5-trisphosphate receptor; IP<sub>3</sub>R)とともに、Ca<sup>2+</sup>放出チャネルとも呼ばれ、細胞内Ca<sup>2+</sup>濃度調節に関与する。RyRには三種類のサブタイプが存在し、それぞれ異なった分布を示すが、脳においては三種類全ての発現が見られる。 脳におけるサブタイプ発現の重複、および遺伝子欠損マウスの致死性などにより、脳におけるリアノジン受容体の機能的役割の解明は、十分であるとは言えない。本稿ではリアノジン受容体に関して、先ず分子レベルでの基本的性質について触れ、その後で脳機能に関連する知見について解説する。 | |||
== 歴史<ref><pubmed>12777839</pubmed></ref> == | |||
カルシウムイオン(Ca<sup>2+</sup>)は普遍的かつ基本的なシグナル伝達を担うセカンドメッセンジャーであり、極めて多くの生命現象に関与する。細胞内におけるCa<sup>2+</sup>シグナル形成は、細胞膜に存在するCa<sup>2+</sup>チャネルを介して細胞外から細胞内へのCa<sup>2+</sup>の流入によるものと、細胞内Ca<sup>2+</sup>ストア(小胞体)からCa<sup>2+</sup>放出チャネルを介して細胞質へ放出される2通りの経路による。Ca<sup>2+</sup>誘発性Ca<sup>2+</sup>放出(Ca<sup>2+</sup>-induced Ca<sup>2+</sup> release; CICR)は、細胞質側のCa<sup>2+</sup>濃度上昇が細胞内ストアから細胞質へのCa<sup>2+</sup> 放出を促進する現象であり、骨格筋で最初に見出された<ref><pubmed>5456208</pubmed></ref>。その後、同様の現象が多くの興奮性細胞において見られたことから、CICRは細胞内Ca<sup>2+</sup>シグナルを増幅するための普遍的な機構であると考えられるようになり、CICRの分子実体であるCICRチャネルの薬理学的性質が調べられた。その結果、植物アルカロイドであるリアノジンがCICRチャネルに特異的に結合し、低濃度ではチャネルを開口状態に固定する薬物であることが示された。 | |||
引き続き、標識リアノジンを用いた結合活性を指標に、骨格筋よりCICRチャネル、即ちリアノジン受容体(RyR)が精製された<ref><pubmed>2448641</pubmed></ref>。 その後の遺伝子クローニングにより、少なくとも硬骨魚類以上の脊椎動物では、別々の遺伝子にコードされる3種類のRyRサブタイプが存在することが判明し、それぞれ、1型/骨格筋型(RyR1)、2型/心筋型(RyR2)、3型/脳型(RyR3)と呼ばれる<ref><pubmed>9137551</pubmed></ref>。各サブタイプは互いに65%程度のアミノ酸配列相同性を示すが、異なる組織分布・脳内分布を示す<ref><pubmed>1330694</pubmed></ref><ref><pubmed>7876312</pubmed></ref>。一方、センチュウ<ref><pubmed>9135117</pubmed></ref>、ショウジョウバエ<ref><pubmed>8276118</pubmed></ref>においては、どのタイプにも属さないRyR相同物が同定されており、無脊椎動物においては単一遺伝子にコードされていたものが、脊椎動物において組織分布や機能的役割が異なる3種のサブタイプに分子進化したと推測されている。 | |||
<br> | |||
== 分子構造 == | == 分子構造<ref name="ref9"><pubmed>17506640</pubmed></ref><ref name="ref10"><pubmed>20961976</pubmed></ref> == | ||
RyRは約5,000アミノ酸残基より構成される分子量約550kDaの巨大蛋白質であり、そのホモ4量体により機能的なCa<sup>2+</sup>放出チャネルが形成される。RyR分子内では、アミノ末端側約4,500アミノ酸が細胞質側に大きく張り出した、いわゆるfoot構造に対応する領域を形成し、4本の推定膜貫通セグメントを含む残りのカルボキシル末端がチャネル領域を形成する(右図、「リアノジン受容体の三次元構造」参照)[[Image:RyR-3D.jpg|right|リアノジン受容体の三次元構造]]。同じくCa<sup>2+</sup>放出チャネルであるIP<sub>3</sub>受容体とRyRは、カルボキシル末端の膜貫通セグメントを含む約200アミノ酸において特に高い配列相同性を示し、この部分がCa<sup>2+</sup>放出チャネルとして共通するイオン透過性に関連した機能に関与していると推測される。実際に、RyR1のカルボキシル末側の約1,000アミノ酸残基よりなる領域のみでリアノジン感受性を有する基本的なCa<sup>2+</sup>チャネルが形成されることが、脂質二重膜を用いた再構築実験により示されている。この再構築系においてC末端領域が形成するチャネルは、陽イオン選択性、細胞質側Ca<sup>2+</sup>による活性化機構、リアノジン感受性を保持する一方で、全長RyR1チャネルに見られる高濃度のCa<sup>2+</sup>による不活性化機構を欠く。また、RyRサブタイプ間での一次構造の比較により、D1、D2、D3と呼ばれる相同性が顕著に低い領域が見られる。RyR1のcDNA発現実験系を用いた研究により、CICRによるチャネル活性化のCa<sup>2+</sup>結合部位はD1領域、チャネルを不活性化する高濃度Ca<sup>2+</sup>の結合部位はD3領域に存在するとされている(右図、「リアノジン受容体の一次構造」参照)[[Image:RyR-AA.jpg|right|リアノジン受容体の一次構造]]。 | |||
< | == 各サブタイプの体内分布<ref name="ref11"><pubmed>20214899</pubmed></ref> == | ||
</ | |||
=== RyR1 === | === RyR1 === | ||
骨格筋において極めて高レベルの発現が見られる。また、小脳プルキンエ細胞を始めとする脳内各部位でも発現が見られる他、食道、精巣でも他の部位に比較して高レベルの発現が見られる。RyR1:小脳プルキンエ細胞においては、高レベルの発現が見られるとともに3つのサブタイプの中でも最も発現量が多い。海馬歯状回でも高レベルの発現が見られるが、歯状回においてはRyR2の発現量が最も多い。さらに、線条体、嗅球僧帽細胞などでも、他の領域と比較して高レベルの発現が見られる。 | |||
===RyR2 === | ===RyR2 === | ||
心筋細胞で極めて高レベルの発現が見られる他、平滑筋・肺・脳でも高レベルの発現が見られる。脳内の様々な部位において広く発現が見られるが、特に海馬(歯状回・CA領域)、大脳皮質、小脳顆粒細胞層、嗅球顆粒細胞層などで高レベルの発現が見られる。<br> | |||
=== RyR3 === | === RyR3 === | ||
RyR3は脳cDNAライブラリーからのクローニングにより存在が明らかになったが、脳以外にも平滑筋、骨格筋、一部の上皮細胞やリンパ球培養細胞などにおいて低レベルの発現が見られる。海馬CA領域で高レベルの発現が見られる。海馬歯状回、線条体などでも比較的発現レベルが高い。<br> | |||
== 活性調節因子<ref name="ref9" /><ref name="ref10" /><ref><pubmed>15618481</pubmed></ref> == | |||
== | ===カルシウムイオン === | ||
細胞質に存在するCa<sup>2+</sup>イオンは、濃度依存的に全てのRyRサブタイプに共通して作用する調節因子である。サブμMからμMの範囲における細胞質側Ca<sup>2+</sup>はRyRを開口させ細胞内Ca<sup>2+</sup>ストアである小胞体からCa<sup>2+</sup>を遊離させる、いわゆるCa<sup>2+</sup>依存性(誘発性)Ca<sup>2+</sup>放出(CICR)現象をお引き起こす。一方、より高濃度のmMレベルのCa<sup>2+</sup>はチャネル活性を抑制する。また、小胞体内腔側のCa<sup>2+</sup>による活性化も見られる。心筋では、脱分極によるL型Ca<sup>2+</sup>チャネル(Cv1.2)の開口により細胞外からCa<sup>2+</sup>が流入し、RyR2を開口させCa<sup>2+</sup>放出を引き起こし、細胞内Ca<sup>2+</sup>シグナルを増幅するが、中枢神経系においても、小脳プルキンエ細胞では電位依存性のP/Q型Ca<sup>2+</sup>チャネル、海馬錐体細胞ではNMDA型グルタミン酸受容体を介するCa<sup>2+</sup>流入によりRyRが活性化されCa<sup>2+</sup>放出が誘導されることが示唆されている。 | |||
=== 脱分極 === | === 脱分極 === | ||
骨格筋においてはL型Ca<sup>2+</sup>チャネル(Cv1.1)とRyR1が機械的にカップリングし、興奮収縮連関において細胞膜が脱分極するとL型Ca<sup>2+</sup>チャネルのコンフォーメーションが変化し、蛋白質-蛋白質相互作用を介してRyR1が活性化されると考えられている。一方、中枢神経系における機械的なカップリングに関しては、多くの点が不明である。 | |||
=== 生理活性物質 === | === 生理活性物質 === | ||
RyRの内在性の因子による活性調節として、カルモジュリンによる濃度依存的な活性化と不活性化、ATPを含むアデニンヌクレオチド、プロテインキナーゼAなどのリン酸化酵素、cADPリボースなどによる活性化、および免疫抑制薬であるFK506の結合蛋白質FKBP12によるRyR2チャネルの静止および開口状態を安定化する作用が示唆されている。さらに一酸化窒素(NO)によるS-ニトロシル化がRyR1の開口確率を上昇させることが''in vitro''の実験系により示されていたが、つい最近、小脳プルキンエ細胞において内因性NOの作用によりRyR1を介したCa<sup>2+</sup>放出が誘導されることが示された(一酸化窒素依存的カルシウム放出の項 参照)。 | |||
=== 薬物 === | === 薬物 === | ||
リアノジンは低濃度では開状態のRyRに結合し、サブコンダクタンス状態に開口固定しCa<sup>2+</sup>遊離を引き起こすが、高濃度ではRyR活性を抑制する。また、カフェインによるRyRの活性化、ダントロレン dantrolene による抑制(主にRyR1、RyR3に対する作用)が知られている。 | |||
== 機能 == | == 機能 == | ||
薬理学的な刺激により、脳における機能的RyRの存在、あるいはRyRを介するCa2+放出の存在を示した報告は、現在では多数存在する。しかし、生理的な刺激によるRyRの活性化を示した報告は、薬理学的刺激による報告に比べると遥かに少なく、さらに、シナプス可塑性や個体の行動の様な機能的役割と関連付けたものは限られたものになり、RyRの脳における機能的役割は、未だ解明の途上にあると言える。 | |||
RyRの機能的役割解明を困難なものにしている主要な原因として、遺伝子欠損動物の致死性が挙げられる。上述の通り、哺乳類の脳の多くの領域では、複数のRyRサブタイプが重複して発現しているが、RyR1欠損マウス、RyR2欠損マウスはそれぞれ単独で、出生致死、胎生致死を示す。したがって、複数のRyRサブタイプ遺伝子の二重もしくは三重欠損マウスが成熟しないことは自明であり、全身レベルでの遺伝子欠損マウスを用いたアプローチによっては、脳におけるRyRの機能は困難である。しかし、RyR3欠損マウスは生後も生存・成熟するため、その解析結果の報告が存在する。また、脳型ジャンクトフィリン遺伝子欠損マウスも同様に出生後も生存・成熟可能であり、このマウスを用いた研究により、脳におけるRyRの機能的役割が明らかにされつつある。<br>7.1 RyR3欠損マウスの解析 RyR3欠損マウスは、RyR1欠損マウスが出生致死、RyR2マウスが胎生致死を示すのとは対照的に、出生後も生育し、成熟するため、成熟個体を用いた解析が行われてきた。これまでに、RyR3欠損マウスにおける自発運動活性の亢進、社会的接触行動の減少、恐怖条件付け反応の低下が、個体レベルでの機能への影響として報告されている。また、RyR3欠損マウスの海馬CA1領域において、穏やかな刺激で誘導されたLTPの維持が阻害されるとの報告がある一方で、同じく海馬領域におけるLTPの誘導閾値が低下するとの報告もある。<br>7.2 脳型ジャンクトフィリン欠損マウスの解析 ジャンクトフィリン (junctophilin; JP)は、筋細胞などの興奮性細胞における細胞膜と小胞体膜との隣接構造である「結合膜構造」に深く寄与する分子として同定された。哺乳類では異なる遺伝子に由来する4種のJPサブタイプが存在し、骨格筋特異的なJP1、筋細胞全般に分布するJP2、神経細胞特異的なJP3、JP4が同定されている。JPは分子量72-90 kDa程度のタンパク質で、C末端に小胞体膜貫通セグメントを有し、残りの部分は細胞質側に配向する。この細胞質側の領域にMORNモチーフと呼ばれる14アミノ酸残基よりなる相同配列が8回繰り返され、MORNモチーフとリン脂質との相互作用によりJPは細胞膜に直接結合すると考えられている。JP1欠損マウスは出生致死、JP2欠損マウスは胎生致死を示す一方で、JP3、JP4単独欠損マウスには顕著な異常は観察されず、またJP3とJP4の発現分布に重複が見られることから、両サブタイプ間の機能補完作用が推測される。JP3、JP4二重欠損(JP-DKO)マウスは、通常飼育条件下では離乳時期に衰弱し死亡するが、固形飼料でなくペースト状飼料で飼育すると、ほぼ正常に生育する。JP-DKO成熟個体では、海馬依存的な記憶学習試験における成績低下、小脳依存的な運動学習脳・運動協調の低下が見られる。さらに、これらの個体レベルでの異常に対応するかのように、海馬CA1シナプスにおける長期増強の阻害、小脳平行線維-プルキンエ細胞シナプスにおける長期抑圧の異常(長期抑圧誘導刺激による長期増強の誘導)が見られる。さらに、海馬CA1錐体細胞、プルキンエ細胞では、興奮後過分極(afterhyperpolarization、AHP)の阻害が見られるが、これはRyRを介して放出されるCa2+による小コンダクタンスCa2+依存性K+チャネル(SKチャネル)の活性化の阻害によるものであり、小脳プルキンエ細胞では、slow AHPの阻害によりLTDがLTP化することが示されている。したがって、海馬錐体細胞、小脳プルキンエ細胞などの中枢神経系細胞では、RyRはJPが媒介するSKチャネルとの機能的共役を介して細胞の興奮性、ひいては、シナプス可塑性、記憶学習機能に関与することが示された。<br>7.3 シナプス前終末における機能 海馬CA3領域の苔状線維軸索(シナプス前終末よりも軸索起始部寄りの部分)においては、電位依存性Ca2+チャネルによるCa2+シグナルがRyR1によるCICR機構を介して増幅されることにより、高頻度刺激に神経伝達物資の放出が増強されることが示されており、シナプス前終末における可塑性へのRyRの関与も示唆されている<br>7.4 一酸化窒素依存的Ca2+放出 脂質二重膜に発現させたRyR1の開口確率がNOの作用により上昇することは以前より知られていたが、この現象が生細胞で内因性のNOの作用により起こること、およびその機能的意義については長いこと不明であった。しかし、小脳平行線維-プルキンエ細胞シナプスにおけるNO依存的LTPがプルキンエ細胞内の細胞内Ca2+シグナルにも依存的であることが判明したことから、プルキンエ細胞内でのNOとCa2+との関連性について解明が進み、神経活動によって産生放出された内因性のNOがRyR1を活性化することでCa2+放出が誘導される現象、NO依存的Ca2+放出(NO-induced Ca2+ release; NICR)が発見された。このNICRはウサギRyR1における3635位のシステイン(マウスでは3636位に相当)がNOによりS-ニトロシル化されることで誘導されると推測されている。また、NO合成酵素の発現は平行線維では見られるがプルキンエ細胞では見られないことから、平行線維活動により産生放出されたNOがプルキンエ細胞内のRyR1を活性化すると考えられている。これまでに、NICRの小脳平行線維-プルキンエ細胞シナプスにおけるLTPへの関与、および、中大脳動脈の虚血再灌流による大脳皮質の神経細胞死への関与が示唆されている。 | |||
ノックアウトマウスの表現型 | |||
RyR1欠損マウスは横隔膜の骨格筋細胞の機能不全に起因すると考えられる呼吸不全により、生後全く動くことなく出生致死の表現型を示す。 | |||
RyR2:RyR2欠損マウスは、心拍動の開始直後の胎生10日ごろに心筋細胞の小胞体Ca2+過剰負荷により心不全となり死亡する。 | |||
RyR3:RyR3欠損マウスはほぼ正常に発育し重篤な異常は認められないが、これまでに自発的運動活性の亢進、社会的接触行動の減少、恐怖条件付け反応の低下、海馬CA1領域におけるシナプス長期増強(LTP)の低下などが報告され、その神経系での重要性が示唆されている。ただし、RyR3欠損マウスの軽度な中枢機能異常に関しては、重複して発現する他のサブタイプによる補完作用を考慮する必要がある。 <br> | |||
== 疾患との関連<ref name="ref9" /><ref name="ref10" /> == | |||
悪性高熱症(malignant hyperthermia; MH):骨格筋においてRyR1は上述のように脱分極によるCav1.1の活性化をトリガーとして活性化するが、特殊条件下ではCICR機構によるチャネル開口も起こし得る。MHはハロタンなどの吸入全身麻酔により発生する全身性の筋硬縮と発熱を特徴とする、RyR1によるCICR機構が著しく亢進した病態である。MHの原因となる変異型RyR1は、通常よりも低い細胞質Ca<sup>2+</sup>濃度においてCICR機構によるチャネルの活性化が生じる。したがって、RyRへの刺激作用を有する吸入麻酔薬に敏感に反応することで小胞体Ca<sup>2+</sup>放出が誘導され、その結果、全身の筋組織が硬縮し熱を産生する。MHのアミノ酸点変異は、RyR1のCICRチャネルとしてのCa<sup>2+</sup>感受性をより高める変異であり、世界各地で発症した悪性高熱症についての様々な点変異が報告されている。 | |||
カテコールアミン誘発性多形性心室頻拍(catecholaminergic polymorphic ventricular tachycardia; CPVT) 本症候群は精神的または身体的ストレス時に交感神経活動が亢進することにより誘発される多形性心室頻拍の反復出現を特徴とする疾患である。このCPVP家系には急死例が多く、常染色体性優性遺伝形式をとり、その原因遺伝子として心臓RyR2の変異が関与する。交感神経によるβ受容体刺激の心臓収縮の増強作用の機序の1つとして、心筋細胞内でcAMP依存性リン酸化酵素によるRyR2のリン酸化・活性化を介して小胞体Ca<sup>2+</sup>放出を亢進することが知られている。悪性高熱症と同様に、CPVP家系で見出される遺伝子変異はRyR2をより活性型に誘導する変異であると考えられ、β受容体刺激時に過剰にRyR2が活性化することが致死的な頻拍を誘導することが示唆されている。欧米各国での発症例についてRyR2上での様々な点変異が報告されている。 | |||
RyR1とRyR2の一次構造上にMHとCPVPにて報告された遺伝子変異をマップすると、アミノ末端部位、中央部位およびカルボキシル末端部位に集中することが判る。基本的なCICRチャネル機能を内蔵するカルボキシル末端部位に加えて、両症候群の変異が集約されるアミノ末端部位と中央部位もRyRチャネルの開閉制御に極めて重要な機能を有することが示されている。 | |||
== 関連項目 == | |||
=== | |||
*[[ジャンクトフィリン]] | *[[ジャンクトフィリン]] | ||
*[[IP3受容体]] | *[[IP3受容体]] | ||
| 123行目: | 78行目: | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
(執筆者: 柿澤 昌 担当編集委員: 林 康紀) | |||
2012年9月26日 (水) 00:44時点における版
リアノジン受容体
英語名:Ryanodine receptor 英語略名:RyR
リアノジン受容体(Ryanodine receptor; RyR)は細胞内Ca2+貯蔵部位である小胞体膜上に存在するCa2+チャネルであり、その名は、植物アルカロイドであるリアノジンが結合することに由来する。小胞体からのCa2+放出を担うことから、同じく小胞体膜上に存在するCa2+チャネルであるイノシトール1,4,5-三リン酸受容体(inositol 1,4,5-trisphosphate receptor; IP3R)とともに、Ca2+放出チャネルとも呼ばれ、細胞内Ca2+濃度調節に関与する。RyRには三種類のサブタイプが存在し、それぞれ異なった分布を示すが、脳においては三種類全ての発現が見られる。 脳におけるサブタイプ発現の重複、および遺伝子欠損マウスの致死性などにより、脳におけるリアノジン受容体の機能的役割の解明は、十分であるとは言えない。本稿ではリアノジン受容体に関して、先ず分子レベルでの基本的性質について触れ、その後で脳機能に関連する知見について解説する。
歴史[1]
カルシウムイオン(Ca2+)は普遍的かつ基本的なシグナル伝達を担うセカンドメッセンジャーであり、極めて多くの生命現象に関与する。細胞内におけるCa2+シグナル形成は、細胞膜に存在するCa2+チャネルを介して細胞外から細胞内へのCa2+の流入によるものと、細胞内Ca2+ストア(小胞体)からCa2+放出チャネルを介して細胞質へ放出される2通りの経路による。Ca2+誘発性Ca2+放出(Ca2+-induced Ca2+ release; CICR)は、細胞質側のCa2+濃度上昇が細胞内ストアから細胞質へのCa2+ 放出を促進する現象であり、骨格筋で最初に見出された[2]。その後、同様の現象が多くの興奮性細胞において見られたことから、CICRは細胞内Ca2+シグナルを増幅するための普遍的な機構であると考えられるようになり、CICRの分子実体であるCICRチャネルの薬理学的性質が調べられた。その結果、植物アルカロイドであるリアノジンがCICRチャネルに特異的に結合し、低濃度ではチャネルを開口状態に固定する薬物であることが示された。
引き続き、標識リアノジンを用いた結合活性を指標に、骨格筋よりCICRチャネル、即ちリアノジン受容体(RyR)が精製された[3]。 その後の遺伝子クローニングにより、少なくとも硬骨魚類以上の脊椎動物では、別々の遺伝子にコードされる3種類のRyRサブタイプが存在することが判明し、それぞれ、1型/骨格筋型(RyR1)、2型/心筋型(RyR2)、3型/脳型(RyR3)と呼ばれる[4]。各サブタイプは互いに65%程度のアミノ酸配列相同性を示すが、異なる組織分布・脳内分布を示す[5][6]。一方、センチュウ[7]、ショウジョウバエ[8]においては、どのタイプにも属さないRyR相同物が同定されており、無脊椎動物においては単一遺伝子にコードされていたものが、脊椎動物において組織分布や機能的役割が異なる3種のサブタイプに分子進化したと推測されている。
分子構造[9][10]
RyRは約5,000アミノ酸残基より構成される分子量約550kDaの巨大蛋白質であり、そのホモ4量体により機能的なCa2+放出チャネルが形成される。RyR分子内では、アミノ末端側約4,500アミノ酸が細胞質側に大きく張り出した、いわゆるfoot構造に対応する領域を形成し、4本の推定膜貫通セグメントを含む残りのカルボキシル末端がチャネル領域を形成する(右図、「リアノジン受容体の三次元構造」参照)
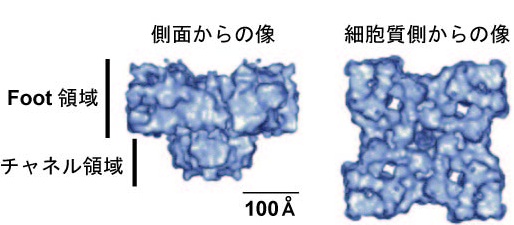
。同じくCa2+放出チャネルであるIP3受容体とRyRは、カルボキシル末端の膜貫通セグメントを含む約200アミノ酸において特に高い配列相同性を示し、この部分がCa2+放出チャネルとして共通するイオン透過性に関連した機能に関与していると推測される。実際に、RyR1のカルボキシル末側の約1,000アミノ酸残基よりなる領域のみでリアノジン感受性を有する基本的なCa2+チャネルが形成されることが、脂質二重膜を用いた再構築実験により示されている。この再構築系においてC末端領域が形成するチャネルは、陽イオン選択性、細胞質側Ca2+による活性化機構、リアノジン感受性を保持する一方で、全長RyR1チャネルに見られる高濃度のCa2+による不活性化機構を欠く。また、RyRサブタイプ間での一次構造の比較により、D1、D2、D3と呼ばれる相同性が顕著に低い領域が見られる。RyR1のcDNA発現実験系を用いた研究により、CICRによるチャネル活性化のCa2+結合部位はD1領域、チャネルを不活性化する高濃度Ca2+の結合部位はD3領域に存在するとされている(右図、「リアノジン受容体の一次構造」参照)
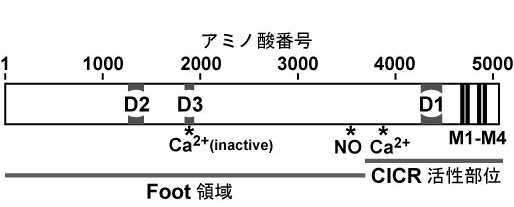
。
各サブタイプの体内分布[11]
RyR1
骨格筋において極めて高レベルの発現が見られる。また、小脳プルキンエ細胞を始めとする脳内各部位でも発現が見られる他、食道、精巣でも他の部位に比較して高レベルの発現が見られる。RyR1:小脳プルキンエ細胞においては、高レベルの発現が見られるとともに3つのサブタイプの中でも最も発現量が多い。海馬歯状回でも高レベルの発現が見られるが、歯状回においてはRyR2の発現量が最も多い。さらに、線条体、嗅球僧帽細胞などでも、他の領域と比較して高レベルの発現が見られる。
RyR2
心筋細胞で極めて高レベルの発現が見られる他、平滑筋・肺・脳でも高レベルの発現が見られる。脳内の様々な部位において広く発現が見られるが、特に海馬(歯状回・CA領域)、大脳皮質、小脳顆粒細胞層、嗅球顆粒細胞層などで高レベルの発現が見られる。
RyR3
RyR3は脳cDNAライブラリーからのクローニングにより存在が明らかになったが、脳以外にも平滑筋、骨格筋、一部の上皮細胞やリンパ球培養細胞などにおいて低レベルの発現が見られる。海馬CA領域で高レベルの発現が見られる。海馬歯状回、線条体などでも比較的発現レベルが高い。
活性調節因子[9][10][12]
カルシウムイオン
細胞質に存在するCa2+イオンは、濃度依存的に全てのRyRサブタイプに共通して作用する調節因子である。サブμMからμMの範囲における細胞質側Ca2+はRyRを開口させ細胞内Ca2+ストアである小胞体からCa2+を遊離させる、いわゆるCa2+依存性(誘発性)Ca2+放出(CICR)現象をお引き起こす。一方、より高濃度のmMレベルのCa2+はチャネル活性を抑制する。また、小胞体内腔側のCa2+による活性化も見られる。心筋では、脱分極によるL型Ca2+チャネル(Cv1.2)の開口により細胞外からCa2+が流入し、RyR2を開口させCa2+放出を引き起こし、細胞内Ca2+シグナルを増幅するが、中枢神経系においても、小脳プルキンエ細胞では電位依存性のP/Q型Ca2+チャネル、海馬錐体細胞ではNMDA型グルタミン酸受容体を介するCa2+流入によりRyRが活性化されCa2+放出が誘導されることが示唆されている。
脱分極
骨格筋においてはL型Ca2+チャネル(Cv1.1)とRyR1が機械的にカップリングし、興奮収縮連関において細胞膜が脱分極するとL型Ca2+チャネルのコンフォーメーションが変化し、蛋白質-蛋白質相互作用を介してRyR1が活性化されると考えられている。一方、中枢神経系における機械的なカップリングに関しては、多くの点が不明である。
生理活性物質
RyRの内在性の因子による活性調節として、カルモジュリンによる濃度依存的な活性化と不活性化、ATPを含むアデニンヌクレオチド、プロテインキナーゼAなどのリン酸化酵素、cADPリボースなどによる活性化、および免疫抑制薬であるFK506の結合蛋白質FKBP12によるRyR2チャネルの静止および開口状態を安定化する作用が示唆されている。さらに一酸化窒素(NO)によるS-ニトロシル化がRyR1の開口確率を上昇させることがin vitroの実験系により示されていたが、つい最近、小脳プルキンエ細胞において内因性NOの作用によりRyR1を介したCa2+放出が誘導されることが示された(一酸化窒素依存的カルシウム放出の項 参照)。
薬物
リアノジンは低濃度では開状態のRyRに結合し、サブコンダクタンス状態に開口固定しCa2+遊離を引き起こすが、高濃度ではRyR活性を抑制する。また、カフェインによるRyRの活性化、ダントロレン dantrolene による抑制(主にRyR1、RyR3に対する作用)が知られている。
機能
薬理学的な刺激により、脳における機能的RyRの存在、あるいはRyRを介するCa2+放出の存在を示した報告は、現在では多数存在する。しかし、生理的な刺激によるRyRの活性化を示した報告は、薬理学的刺激による報告に比べると遥かに少なく、さらに、シナプス可塑性や個体の行動の様な機能的役割と関連付けたものは限られたものになり、RyRの脳における機能的役割は、未だ解明の途上にあると言える。
RyRの機能的役割解明を困難なものにしている主要な原因として、遺伝子欠損動物の致死性が挙げられる。上述の通り、哺乳類の脳の多くの領域では、複数のRyRサブタイプが重複して発現しているが、RyR1欠損マウス、RyR2欠損マウスはそれぞれ単独で、出生致死、胎生致死を示す。したがって、複数のRyRサブタイプ遺伝子の二重もしくは三重欠損マウスが成熟しないことは自明であり、全身レベルでの遺伝子欠損マウスを用いたアプローチによっては、脳におけるRyRの機能は困難である。しかし、RyR3欠損マウスは生後も生存・成熟するため、その解析結果の報告が存在する。また、脳型ジャンクトフィリン遺伝子欠損マウスも同様に出生後も生存・成熟可能であり、このマウスを用いた研究により、脳におけるRyRの機能的役割が明らかにされつつある。
7.1 RyR3欠損マウスの解析 RyR3欠損マウスは、RyR1欠損マウスが出生致死、RyR2マウスが胎生致死を示すのとは対照的に、出生後も生育し、成熟するため、成熟個体を用いた解析が行われてきた。これまでに、RyR3欠損マウスにおける自発運動活性の亢進、社会的接触行動の減少、恐怖条件付け反応の低下が、個体レベルでの機能への影響として報告されている。また、RyR3欠損マウスの海馬CA1領域において、穏やかな刺激で誘導されたLTPの維持が阻害されるとの報告がある一方で、同じく海馬領域におけるLTPの誘導閾値が低下するとの報告もある。
7.2 脳型ジャンクトフィリン欠損マウスの解析 ジャンクトフィリン (junctophilin; JP)は、筋細胞などの興奮性細胞における細胞膜と小胞体膜との隣接構造である「結合膜構造」に深く寄与する分子として同定された。哺乳類では異なる遺伝子に由来する4種のJPサブタイプが存在し、骨格筋特異的なJP1、筋細胞全般に分布するJP2、神経細胞特異的なJP3、JP4が同定されている。JPは分子量72-90 kDa程度のタンパク質で、C末端に小胞体膜貫通セグメントを有し、残りの部分は細胞質側に配向する。この細胞質側の領域にMORNモチーフと呼ばれる14アミノ酸残基よりなる相同配列が8回繰り返され、MORNモチーフとリン脂質との相互作用によりJPは細胞膜に直接結合すると考えられている。JP1欠損マウスは出生致死、JP2欠損マウスは胎生致死を示す一方で、JP3、JP4単独欠損マウスには顕著な異常は観察されず、またJP3とJP4の発現分布に重複が見られることから、両サブタイプ間の機能補完作用が推測される。JP3、JP4二重欠損(JP-DKO)マウスは、通常飼育条件下では離乳時期に衰弱し死亡するが、固形飼料でなくペースト状飼料で飼育すると、ほぼ正常に生育する。JP-DKO成熟個体では、海馬依存的な記憶学習試験における成績低下、小脳依存的な運動学習脳・運動協調の低下が見られる。さらに、これらの個体レベルでの異常に対応するかのように、海馬CA1シナプスにおける長期増強の阻害、小脳平行線維-プルキンエ細胞シナプスにおける長期抑圧の異常(長期抑圧誘導刺激による長期増強の誘導)が見られる。さらに、海馬CA1錐体細胞、プルキンエ細胞では、興奮後過分極(afterhyperpolarization、AHP)の阻害が見られるが、これはRyRを介して放出されるCa2+による小コンダクタンスCa2+依存性K+チャネル(SKチャネル)の活性化の阻害によるものであり、小脳プルキンエ細胞では、slow AHPの阻害によりLTDがLTP化することが示されている。したがって、海馬錐体細胞、小脳プルキンエ細胞などの中枢神経系細胞では、RyRはJPが媒介するSKチャネルとの機能的共役を介して細胞の興奮性、ひいては、シナプス可塑性、記憶学習機能に関与することが示された。
7.3 シナプス前終末における機能 海馬CA3領域の苔状線維軸索(シナプス前終末よりも軸索起始部寄りの部分)においては、電位依存性Ca2+チャネルによるCa2+シグナルがRyR1によるCICR機構を介して増幅されることにより、高頻度刺激に神経伝達物資の放出が増強されることが示されており、シナプス前終末における可塑性へのRyRの関与も示唆されている
7.4 一酸化窒素依存的Ca2+放出 脂質二重膜に発現させたRyR1の開口確率がNOの作用により上昇することは以前より知られていたが、この現象が生細胞で内因性のNOの作用により起こること、およびその機能的意義については長いこと不明であった。しかし、小脳平行線維-プルキンエ細胞シナプスにおけるNO依存的LTPがプルキンエ細胞内の細胞内Ca2+シグナルにも依存的であることが判明したことから、プルキンエ細胞内でのNOとCa2+との関連性について解明が進み、神経活動によって産生放出された内因性のNOがRyR1を活性化することでCa2+放出が誘導される現象、NO依存的Ca2+放出(NO-induced Ca2+ release; NICR)が発見された。このNICRはウサギRyR1における3635位のシステイン(マウスでは3636位に相当)がNOによりS-ニトロシル化されることで誘導されると推測されている。また、NO合成酵素の発現は平行線維では見られるがプルキンエ細胞では見られないことから、平行線維活動により産生放出されたNOがプルキンエ細胞内のRyR1を活性化すると考えられている。これまでに、NICRの小脳平行線維-プルキンエ細胞シナプスにおけるLTPへの関与、および、中大脳動脈の虚血再灌流による大脳皮質の神経細胞死への関与が示唆されている。
ノックアウトマウスの表現型
RyR1欠損マウスは横隔膜の骨格筋細胞の機能不全に起因すると考えられる呼吸不全により、生後全く動くことなく出生致死の表現型を示す。
RyR2:RyR2欠損マウスは、心拍動の開始直後の胎生10日ごろに心筋細胞の小胞体Ca2+過剰負荷により心不全となり死亡する。
RyR3:RyR3欠損マウスはほぼ正常に発育し重篤な異常は認められないが、これまでに自発的運動活性の亢進、社会的接触行動の減少、恐怖条件付け反応の低下、海馬CA1領域におけるシナプス長期増強(LTP)の低下などが報告され、その神経系での重要性が示唆されている。ただし、RyR3欠損マウスの軽度な中枢機能異常に関しては、重複して発現する他のサブタイプによる補完作用を考慮する必要がある。
疾患との関連[9][10]
悪性高熱症(malignant hyperthermia; MH):骨格筋においてRyR1は上述のように脱分極によるCav1.1の活性化をトリガーとして活性化するが、特殊条件下ではCICR機構によるチャネル開口も起こし得る。MHはハロタンなどの吸入全身麻酔により発生する全身性の筋硬縮と発熱を特徴とする、RyR1によるCICR機構が著しく亢進した病態である。MHの原因となる変異型RyR1は、通常よりも低い細胞質Ca2+濃度においてCICR機構によるチャネルの活性化が生じる。したがって、RyRへの刺激作用を有する吸入麻酔薬に敏感に反応することで小胞体Ca2+放出が誘導され、その結果、全身の筋組織が硬縮し熱を産生する。MHのアミノ酸点変異は、RyR1のCICRチャネルとしてのCa2+感受性をより高める変異であり、世界各地で発症した悪性高熱症についての様々な点変異が報告されている。
カテコールアミン誘発性多形性心室頻拍(catecholaminergic polymorphic ventricular tachycardia; CPVT) 本症候群は精神的または身体的ストレス時に交感神経活動が亢進することにより誘発される多形性心室頻拍の反復出現を特徴とする疾患である。このCPVP家系には急死例が多く、常染色体性優性遺伝形式をとり、その原因遺伝子として心臓RyR2の変異が関与する。交感神経によるβ受容体刺激の心臓収縮の増強作用の機序の1つとして、心筋細胞内でcAMP依存性リン酸化酵素によるRyR2のリン酸化・活性化を介して小胞体Ca2+放出を亢進することが知られている。悪性高熱症と同様に、CPVP家系で見出される遺伝子変異はRyR2をより活性型に誘導する変異であると考えられ、β受容体刺激時に過剰にRyR2が活性化することが致死的な頻拍を誘導することが示唆されている。欧米各国での発症例についてRyR2上での様々な点変異が報告されている。
RyR1とRyR2の一次構造上にMHとCPVPにて報告された遺伝子変異をマップすると、アミノ末端部位、中央部位およびカルボキシル末端部位に集中することが判る。基本的なCICRチャネル機能を内蔵するカルボキシル末端部位に加えて、両症候群の変異が集約されるアミノ末端部位と中央部位もRyRチャネルの開閉制御に極めて重要な機能を有することが示されている。
関連項目
参考文献
- ↑
Takeshima, H. (2003).
Ryanodine receptor and junctional membrane structure. Nihon yakurigaku zasshi. Folia pharmacologica Japonica, 121(4), 203-10. [PubMed:12777839] [WorldCat] [DOI] - ↑
Endo, M., Tanaka, M., & Ogawa, Y. (1970).
Calcium induced release of calcium from the sarcoplasmic reticulum of skinned skeletal muscle fibres. Nature, 228(5266), 34-6. [PubMed:5456208] [WorldCat] [DOI] - ↑
Lai, F.A., Erickson, H.P., Rousseau, E., Liu, Q.Y., & Meissner, G. (1988).
Purification and reconstitution of the calcium release channel from skeletal muscle. Nature, 331(6154), 315-9. [PubMed:2448641] [WorldCat] [DOI] - ↑
Takeshima, H. (1993).
Primary structure and expression from cDNAs of the ryanodine receptor. Annals of the New York Academy of Sciences, 707, 165-77. [PubMed:9137551] [WorldCat] [DOI] - ↑
Hakamata, Y., Nakai, J., Takeshima, H., & Imoto, K. (1992).
Primary structure and distribution of a novel ryanodine receptor/calcium release channel from rabbit brain. FEBS letters, 312(2-3), 229-35. [PubMed:1330694] [WorldCat] [DOI] - ↑
Giannini, G., Conti, A., Mammarella, S., Scrobogna, M., & Sorrentino, V. (1995).
The ryanodine receptor/calcium channel genes are widely and differentially expressed in murine brain and peripheral tissues. The Journal of cell biology, 128(5), 893-904. [PubMed:7876312] [PMC] [WorldCat] [DOI] - ↑
Sakube, Y., Ando, H., & Kagawa, H. (1997).
An abnormal ketamine response in mutants defective in the ryanodine receptor gene ryr-1 (unc-68) of Caenorhabditis elegans. Journal of molecular biology, 267(4), 849-64. [PubMed:9135117] [WorldCat] [DOI] - ↑
Takeshima, H., Nishi, M., Iwabe, N., Miyata, T., Hosoya, T., Masai, I., & Hotta, Y. (1994).
Isolation and characterization of a gene for a ryanodine receptor/calcium release channel in Drosophila melanogaster. FEBS letters, 337(1), 81-7. [PubMed:8276118] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Zalk, R., Lehnart, S.E., & Marks, A.R. (2007).
Modulation of the ryanodine receptor and intracellular calcium. Annual review of biochemistry, 76, 367-85. [PubMed:17506640] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Lanner, J.T., Georgiou, D.K., Joshi, A.D., & Hamilton, S.L. (2010).
Ryanodine receptors: structure, expression, molecular details, and function in calcium release. Cold Spring Harbor perspectives in biology, 2(11), a003996. [PubMed:20961976] [PMC] [WorldCat] [DOI] - ↑
Kushnir, A., Betzenhauser, M.J., & Marks, A.R. (2010).
Ryanodine receptor studies using genetically engineered mice. FEBS letters, 584(10), 1956-65. [PubMed:20214899] [PMC] [WorldCat] [DOI] - ↑
Verkhratsky, A. (2005).
Physiology and pathophysiology of the calcium store in the endoplasmic reticulum of neurons. Physiological reviews, 85(1), 201-79. [PubMed:15618481] [WorldCat] [DOI]
(執筆者: 柿澤 昌 担当編集委員: 林 康紀)