「ミリストイル化」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の59版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:myristoylation | |||
タンパク質のミリストイル化はN末端グリシンに14炭素鎖飽和脂肪酸であるミリスチン酸がアミド結合により付加する不可逆的な脂質修飾である(''N''-ミリストイル化)。典型的には''N''-ミリストイル化は''N''-ミリストイルトランスフェラーゼ(NMT)により共翻訳時におこなわれる。''N''-ミリストイル化によりタンパク質の疎水性が上昇し、細胞膜への親和性が向上する。その結果、''N''-ミリストイル化はタンパク質の輸送、タンパク質-脂質相互作用、タンパク質-タンパク質相互作用において重要な役割を果たす。SrcキナーゼファミリーやGタンパク質αサブユニットなどのシグナル伝達タンパク質の多くが''N''-ミリストイル化を受けることが知られており、細胞の外界環境への適応や恒常性維持に重要であるとともに、ミリストイル化機構の異常は癌や神経疾患、感染症など多岐にわたる病理現象の原因としても注目されている。近年、アポトーシスの際にカスパーゼにより切断され露出したN末端グリシンに対しても''N''-ミリストイル化が進行することが明らかになり、翻訳後修飾としての''N''-ミリストイル化も盛んに研究が進められている。 | |||
<br> | |||
== タンパク質の脂質修飾 == | == タンパク質の脂質修飾 == | ||
タンパク質の脂質修飾(protein lipidation)は脂質付加により細胞質タンパク質の細胞膜近傍への輸送、膜タンパク質の局所構造への側方輸送、タンパク質の構造安定化、脂質-タンパク質相互作用の向上を担う翻訳後修飾群の総称であり、リン酸化にならび細胞の秩序維持に不可欠である。脂質修飾は大きく分けて1)脂肪酸アシル化(fatty acylation)、2)プレニル化(prenylation)、3)グリコシルホスファチジルイノシトール(GPI)化(glypiation)、4)コレステロール化(cholesteroylation)に分類される。脂肪酸アシル化の代表例として''N''-ミリストイル化(''N''-myristoylation)と''S''-パルミトイル化(''S''-palmitoylation)があげられる。次節以降に詳述するが、''N''-ミリストイル化の多くは共翻訳時修飾であるが、広義の翻訳後修飾として分類される。脂質修飾全般に関しては<ref><pubmed>17892486</pubmed></ref>が参考になる。 <br><br> | |||
== 歴史 == | == 歴史 == | ||
''N''- | ''N''-ミリストイル化は1980年代エドマン分解によるタンパク質の配列解析が盛んにおこなわれる中、cAMP依存タンパク質キナーゼ(cyclic AMP-dependent protein kinase)触媒サブユニット、およびカルシニューリンB(calcineurin B)のエドマン分解を阻害する因子として存在が明らかになり、質量分析から構造が同定された<ref><pubmed>6959104</pubmed></ref><ref><pubmed>7160476</pubmed></ref>。この発見を皮切りにシグナル伝達タンパク質、カルシウム結合タンパク質、膜関連タンパク質、ウィルス構成タンパク質など幅広く見出されている。1987年に''N''-ミリストイル化酵素が同定され、基質特異性、反応機構の解析が進められた<ref><pubmed>3100524</pubmed></ref>。当初は『共翻訳時修飾(co-translational modification)』として研究が進められたが、2000年にアポトーシス促進タンパク質であるBID(BH3 interacting domain death agonist)がカスパーゼ-8(caspase-8)による部分分解後に『翻訳後修飾(post-translational modification)』として''N''-ミリストイル化を受けることが明らかになり<ref><pubmed>11099414</pubmed></ref>、その後続々とアポトーシス関連タンパク質が''N''-ミリストイル化タンパク質として同定された。 | ||
<br><br> | |||
== 構造 == | == 構造 == | ||
''N''-ミリストイル化は14炭素鎖飽和脂肪酸であるミリスチン酸(図1A)がタンパク質N末端グリシンに不可逆的にアミド結合で付加する脂質修飾である(図1B)。14炭素鎖飽和脂肪酸(C14:0)が一般的であるが、網膜のタンパク質ではC14:1 n-9やC14:2 n-6など不飽和脂肪酸がヘテロに組み込まれることも知られている。また、インシュリン受容体(insulin receptor)やインターロイキン-1(interleukin-1)など一部のタンパク質では例外的にリシンの側鎖のアミノ基に付加することが報告されている。本稿では図1Bで示した飽和脂肪酸C14:0のN末端グリシンへの付加を''N''-ミリストイル化と呼ぶことにする。 | |||
[[Image:Myristoylation Fig1.png|thumb|left|300px|図1 構造]] <br><br><br><br> | |||
<br> | |||
<br><br> | |||
<br> | |||
<br> | |||
<br> | |||
''N''- | == ''N''-ミリストイル化タンパク質 == | ||
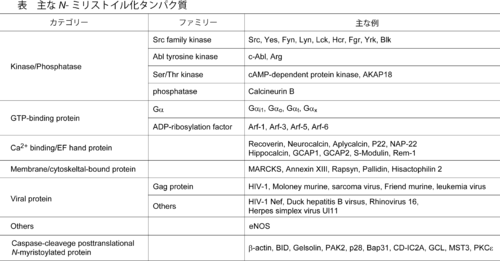
''N''-ミリストイル化を受けるタンパク質は非常に多岐にわたる。Srcキナーゼファミリー、ホスファターゼ、GTP結合タンパク質、カルシウム結合タンパク質、膜結合タンパク質などが同定されている。また、ウィルス構成タンパク質やバクテリア由来タンパク質も''N''-ミリストイル化を受けることが知られている。主な''N''-ミリストイル化タンパク質を表に示す。<br> 近年、アポトーシスの際にカスパーゼによる切断後に''N''-ミリストイル化されるタンパク質の同定が盛んに進められている。アポトーシス促進因子であるBIDや細胞骨格のβ-アクチン(β-actin)はこれらに属する。カスパーゼにより誘導される主な''N''-ミリストイル化タンパク質を表の下段に示す。<br> ''N''-ミリストイル化タンパク質はインターネット上でデータベース化されており、MYRbase (http://mendel.imp.ac.at/myristate/ ) から閲覧可能である。また、MYRbaseでは''N''-ミリストイル化タンパク質の予測をおこなうことができるので参照されたい。 | |||
[[Image:Myristoylation Table.png|thumb|left|500px]]<br><br><br> | |||
<br> | |||
<br> | |||
<br> | |||
<br> | |||
<br><br><br><br><br><br><br><br><br> | |||
== ''N''-ミリストイル化酵素 == | == ''N''-ミリストイル化酵素 == | ||
タンパク質の''N''-ミリストイル化はGCN5 ''N''-アセチルトランスフェラーゼ (GNAT)スーパーファミリーに属する''N''-ミリストイルトランスフェラーゼ(''N''-myristoyl transferase;NMT)が担っている<ref | タンパク質の''N''-ミリストイル化はGCN5 ''N''-アセチルトランスフェラーゼ (GNAT)スーパーファミリーに属する''N''-ミリストイルトランスフェラーゼ(''N''-myristoyl transferase;NMT)が担っている<sup>[4]</sup>。NMTは真核生物間で保存され、哺乳類ではNMT1およびNMT2の2種類が同定されている。NMT1/2は各組織に普遍的に発現が認められる。両者は基質特異性(6節を参照)を共有しているものの、NMT1ノックアウトマウスは胚発生時に致死となることからNMT2の代償作用は得られず、両者の間には厳密な役割分担があると考えられている。<br> NMTの触媒メカニズムは酵母''S. cerevisiae'' NMTの解析から明らかにされた<ref><pubmed>2198291</pubmed></ref>。NMTはミリストイル-CoAを選択的に捕捉し、ペプチド基質がNMTに結合した後にミリスチン酸がN末端グリシンに移行して、CoAおよびミリストイル化基質が放出される。<br> 細胞内においてNMTの活性は熱ショックタンパク質NIP71(NMT inhibitor protein 71またはHSC70)および糖分解酵素エノラーゼ(enolase)によって制御される。また、NMTの活性はNMTのリン酸化によっても制御されることが知られている。 | ||
<br> | |||
== ''N''-ミリストイル化機構 == | |||
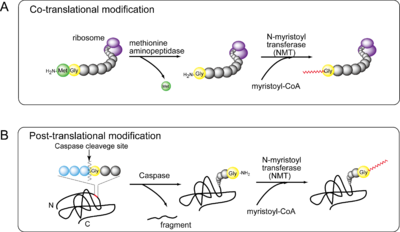
''N''-ミリストイル化コンセンサス配列は多数の合成ペプチドを用いた酵母''S. cerevisiae'' NMTの基質特異性解析から明らかにされている<ref><pubmed>3123478</pubmed></ref>。<br> H<sub>2</sub>N-Met<sub>1</sub>-Gly<sub>2</sub>-Xaa<sub>3</sub>-Xaa<sub>4</sub>-Xaa<sub>5</sub>-(Ser/Cys/Thr)<sub>6</sub>-Xaa<sub>7</sub><br>Xaa<sub>3</sub>はプロリン、芳香族アミノ酸および荷電アミノ酸は適さない。Xaa<sub>4</sub>およびXaa<sub>5</sub>は任意のアミノ酸、Xaa<sub>7</sub>はプロリンを除くすべてのアミノ酸が可能である。ヒトNMTでも酵母''S. cerevisiae''同様にモチーフは共有されているが、厳密にはXaa部分のアミノ酸で両者の特異性が異なることが報告されている <ref><pubmed>8486723</pubmed></ref>。『共翻訳時修飾』ではまず、ペプチド鎖がリボソームに結合した状態でメチオニンアミノペプチダーゼ(methionine aminopeptidase)によりN末端メチオニン残基が除去され、露出したグリシンのアミノ基にNMTがミリスチン酸を付加する(図2A)。一方、カスパーゼを介する『翻訳後修飾』ではカスパーゼによるタンパク分解後、N末端に新たに露出したグリシンおよびモチーフに対してNMTがミリスチン酸を付加する(図2B)。 <br>[[Image:Myristoylation Fig2.png|thumb|left|400px|図2 NMTによるN-ミリストイル化機構]] | |||
<br> | |||
<br> | |||
<br> | |||
<br> | |||
<br> | |||
<br> | |||
<br> | |||
<br><br><br><br><br><br> | |||
<br> | |||
<br> | |||
== 機能 == | == 機能 == | ||
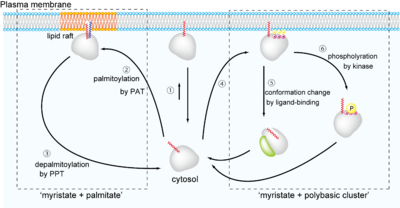
多くの''N''-ミリストイル化タンパク質はミリスチン酸付加により、疎水性が上昇し、細胞膜への親和性が向上する(図3)。しかしながら、膜表面にタンパク質を安定に繋ぎとめるためにはミリスチン酸の効果だけでは充分ではない(図3①)。多くの場合、安定な膜結合性を獲得するための第2の機構を有しており、これらが不可逆的修飾である''N''-ミリストイル化タンパク質の可逆的な細胞膜-細胞質間輸送を可能にしている。主に『ミリストイル化+パルミトイル化』と『ミリストイル化+ポリ塩基性クラスター』の2つの機構からなる。 | |||
前者は細胞質において、もうひとつの主要な脂肪酸アシル化修飾である''S''-パルミトイル化を受けるもので、二重の脂質修飾(dual acylation)により疎水性が著しく向上し細胞膜へと輸送される。この場合には、まず''N''-ミリストイル化がおこり、その後近傍のシステイン残基が''S''-パルミトイル化を受ける(パルミトイル化の項を参照)。不可逆的な''N''-ミリストイル化に対して、''S''-パルミトイル化は酵素依存的なダイナミックの修飾サイクルを有し、タンパク質パルミトイルトランスフェラーゼ(PAT; palmitoyl acyl transferase)によるパルミチン酸の付加(②)とタンパク質パルミトイルチオエステラーゼ(PPT; protein palmitoyl thioesterase) による脱パルミトイル化からなる(③)。ミリストイル化タンパク質は''S''-パルミトイル化サイクルを利用して可逆的な細胞質-細胞膜サイクルを獲得しているのである。また、多くの場合''S''-パルミトイル化タンパク質は脂質ラフト/カベオラへ輸送されることが示唆されており、機能性膜ドメイン形成に重要な役割を果たしていると考えられている。詳しくはパルミトイル化の項を参照されたい。二重脂質修飾を受けるタンパク質の例としてSrcファミリータンパク質(Yes、Fyn、Lyn、Lck、Hcr、Fgr、Yrk)やGαサブユニット(Gα<sub>i1</sub>、Gα<sub>o</sub>、Gα<sub>z</sub>など)、eNOS(endothelial nitric oxide synthase)などが挙げられる。 | |||
後者の『ミリストイル化+ポリ塩基性アミノ酸クラスター』はミリストイル化タンパク質自体がもつ物理化学的特徴を利用した機構で、ミリストイル化タンパク質の塩基性アミノ酸クラスターと細胞膜の酸性リン脂質(ホスファチジルセリン、ホスファチジルイノシトールなど)の間の電荷的相互作用により膜への親和性を向上させている(④)。Srcが代表例である。膜からの脱離にはいくつかのパターンが報告されているが、リガンド結合によるコンフォーメーション変化によりミリストイル基がタンパク質内部に埋め込まれる機構(⑤)や、タンパク質キナーゼによるリン酸基の負電荷による斥力による機構(⑥)があり、「ミリストイルスイッチ」と呼ばれる。リガンド結合型のスイッチには、カルシウムセンサータンパク質レコヴェリン(recoverin)-カルシウムイオン相互作用がよく知られている。リン酸化型スイッチでは、MARCKS(myristoylated alanine-rich C kinase substrate)が代表例として知られている。興味深いことにSrcはその塩基性アミノ酸モチーフと細胞膜リン脂質との相互作用が強いため、モノリン酸化のみでは膜から脱離しないことが明らかになっている<ref><pubmed>9485361</pubmed></ref>。 | |||
[[Image:Myristoylation Fig3.png|thumb|left|400px|図3 N-ミリストイル化タンパク質の膜結合機構]]<br><br><br><br><br><br><br><br><br><br><br><br><br> | |||
<br><br><br> | |||
== ''N''-ミリストイル化タンパク質の検出方法 == | == ''N''-ミリストイル化タンパク質の検出方法 == | ||
[[ | プロテアーゼによるタンパク質分解後の『翻訳後修飾』としての''N''-ミリストイル化が発見されて以来、新規ミリストイル化基質の探索が進められている。 | ||
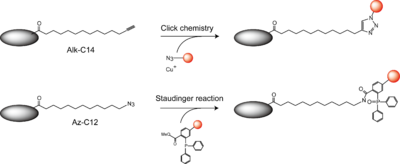
''N''-ミリストイル化タンパク質の検出には古くから[<sup>3</sup>H]-あるいは [<sup>125</sup>I]-ミリスチン酸を用いた代謝標識法が用いられている。しかしながら、検出感度が低く存在量の少ないタンパク質に関しては検出が難しい。近年''N''-ミリストイル化のプローブとして代謝ラベル可能なミリスチン酸誘導体が開発されている。末端アルキルを有するミリスチン酸誘導体Alk-C14やアジド基を導入したAz-C12がその代表例である(図4)。前者はclick chemistryを利用して、後者はclick chemistryあるいはStaudinger反応を利用してビオチンなどのタグを導入することができ、各種アフィニティビーズでの精製、酵素消化の後に質量分析により、''N''-ミリストイル化タンパク質を同定することが可能である。また、蛍光色素を導入することで細胞内イメージングに利用することも可能である。詳しくは総説<ref><pubmed>20559317</pubmed></ref>が参考になる。 [[Image:Myristoylation Fig4.png|thumb|left|400px|図4 N-ミリストイル化タンパク質の検出方法]] | |||
<br><br> | |||
<br> | |||
<br> | |||
<br> | |||
<br><br><br><br><br> | |||
<br> | |||
== 病理的意義 == | == 病理的意義 == | ||
| 121行目: | 111行目: | ||
=== 癌 === | === 癌 === | ||
癌遺伝子であるSrcキナーゼファミリーは''N''-ミリストイル化によりキナーゼ活性が亢進することから、''N''-ミリストイル化すなわちNMTの活性は癌と密接に関係している。これまでいくつかの腫瘍形成モデルからNMTが結腸癌亢進において重要な役割を果たすことが明らかにされている。また、NMTの発現量の増加(特にNMT2)は癌の亢進を引き起こすことが示唆されている。このことから、NMTは結腸癌のマーカーとして用いられている。 | |||
=== 神経関連疾患 === | === 神経関連疾患 === | ||
N- | N-ミリストイル化はてんかんを含む神経関連疾患にもおいても重要である。SrcやFynはNMDA型グルタミン受容体のチロシンリン酸化を担う。SrcとNMDA型受容体の会合には、Srcのミリストイル化が重要であることが示唆されている。てんかん発症患者において、通常中枢神経系ではほとんど発現が見られないNMT2が多く発現する一方、NMTの阻害タンパク質であるNIP71(HSC70)の発現量が減少する例が知られている。 | ||
=== 感染症 === | === 感染症 === | ||
''N''- | ''N''-ミリストイル化修飾は真核生物の細胞内タンパク質に限らず、ウィルスやバクテリア由来のタンパク質にも見られる。ウィルスやバクテリアはNMTをコードする遺伝子を有していないため、これらのタンパク質はホストである真核生物のNMTにより''N''-ミリストイル化を受ける。ウィルス構成タンパク質の''N''-ミリストイル化は、カプシド構造形成におけるタンパク質間会合やホスト細胞への侵入などにおいて重要な役割を有している。 | ||
バクテリアのIII型分泌機構でホスト細胞に感染するタンパク質もホストのNMTによりミリストイル化修飾を受ける。これらバクテリア由来タンパク質は''N''-ミリストイル化によりホストの細胞膜に局在化し、強い毒性を発揮する。すなわち病原細菌がホスト細胞を攻撃するための一つのプロセスをN-ミリストイル化が担っているのである。 | |||
=== ヌーナン症候群 === | === ヌーナン症候群 === | ||
ヌーナン(Noonan)症候群は低身長、先天性心疾患、発達遅滞を特徴とする疾患で、SHOC2を原因遺伝子とする。本来SHOC2はミリストイル化を受けないが、ヌーナン症候群患者ではSer2Glyの変異がみられ、''N''-ミリストイル化を受けることで膜へ輸送され本来の機能が欠落することが疾患の一因であることが報告されている。 | |||
<br> | |||
== NMT阻害剤 == | == NMT阻害剤 == | ||
上述したようにNTMによるタンパク質の''N''- | 上述したようにNTMによるタンパク質の''N''-ミリストイル化は細胞の恒常性維持において不可欠であり、疾患との関連性も強く示唆される。そのためNMT阻害剤は余剰なNMTの活性が原因となる癌などの疾患の治療薬となりうる。また、同時にNMTの阻害剤は抗真菌製剤として期待されている。6節で述べたように、NMTはミリストイル化モチーフを真核生物種間で共有しているものの、認識アミノ酸配列は種間で違いがある<sup>[8]</sup>。そのためカンジダ菌など真菌のNMTに選択的な阻害剤は抗真菌製剤として応用可能であり、開発が進められている。現在までにミリスチン酸誘導体、ペプチドミメティックス、ベンゾフラン誘導体、アミノベンゾチアゾール誘導体などが報告されている。詳細は<ref><pubmed>12150705</pubmed></ref>を参照されたい。 <br><br> | ||
== 参考文献 == | == 参考文献 == | ||
| 147行目: | 139行目: | ||
<br> | <br> | ||
(執筆者:関谷敦志、深田優子、深田正紀 担当編集委員:林康紀) | |||
2012年1月15日 (日) 15:42時点における版
英語名:myristoylation
タンパク質のミリストイル化はN末端グリシンに14炭素鎖飽和脂肪酸であるミリスチン酸がアミド結合により付加する不可逆的な脂質修飾である(N-ミリストイル化)。典型的にはN-ミリストイル化はN-ミリストイルトランスフェラーゼ(NMT)により共翻訳時におこなわれる。N-ミリストイル化によりタンパク質の疎水性が上昇し、細胞膜への親和性が向上する。その結果、N-ミリストイル化はタンパク質の輸送、タンパク質-脂質相互作用、タンパク質-タンパク質相互作用において重要な役割を果たす。SrcキナーゼファミリーやGタンパク質αサブユニットなどのシグナル伝達タンパク質の多くがN-ミリストイル化を受けることが知られており、細胞の外界環境への適応や恒常性維持に重要であるとともに、ミリストイル化機構の異常は癌や神経疾患、感染症など多岐にわたる病理現象の原因としても注目されている。近年、アポトーシスの際にカスパーゼにより切断され露出したN末端グリシンに対してもN-ミリストイル化が進行することが明らかになり、翻訳後修飾としてのN-ミリストイル化も盛んに研究が進められている。
タンパク質の脂質修飾
タンパク質の脂質修飾(protein lipidation)は脂質付加により細胞質タンパク質の細胞膜近傍への輸送、膜タンパク質の局所構造への側方輸送、タンパク質の構造安定化、脂質-タンパク質相互作用の向上を担う翻訳後修飾群の総称であり、リン酸化にならび細胞の秩序維持に不可欠である。脂質修飾は大きく分けて1)脂肪酸アシル化(fatty acylation)、2)プレニル化(prenylation)、3)グリコシルホスファチジルイノシトール(GPI)化(glypiation)、4)コレステロール化(cholesteroylation)に分類される。脂肪酸アシル化の代表例としてN-ミリストイル化(N-myristoylation)とS-パルミトイル化(S-palmitoylation)があげられる。次節以降に詳述するが、N-ミリストイル化の多くは共翻訳時修飾であるが、広義の翻訳後修飾として分類される。脂質修飾全般に関しては[1]が参考になる。
歴史
N-ミリストイル化は1980年代エドマン分解によるタンパク質の配列解析が盛んにおこなわれる中、cAMP依存タンパク質キナーゼ(cyclic AMP-dependent protein kinase)触媒サブユニット、およびカルシニューリンB(calcineurin B)のエドマン分解を阻害する因子として存在が明らかになり、質量分析から構造が同定された[2][3]。この発見を皮切りにシグナル伝達タンパク質、カルシウム結合タンパク質、膜関連タンパク質、ウィルス構成タンパク質など幅広く見出されている。1987年にN-ミリストイル化酵素が同定され、基質特異性、反応機構の解析が進められた[4]。当初は『共翻訳時修飾(co-translational modification)』として研究が進められたが、2000年にアポトーシス促進タンパク質であるBID(BH3 interacting domain death agonist)がカスパーゼ-8(caspase-8)による部分分解後に『翻訳後修飾(post-translational modification)』としてN-ミリストイル化を受けることが明らかになり[5]、その後続々とアポトーシス関連タンパク質がN-ミリストイル化タンパク質として同定された。
構造
N-ミリストイル化は14炭素鎖飽和脂肪酸であるミリスチン酸(図1A)がタンパク質N末端グリシンに不可逆的にアミド結合で付加する脂質修飾である(図1B)。14炭素鎖飽和脂肪酸(C14:0)が一般的であるが、網膜のタンパク質ではC14:1 n-9やC14:2 n-6など不飽和脂肪酸がヘテロに組み込まれることも知られている。また、インシュリン受容体(insulin receptor)やインターロイキン-1(interleukin-1)など一部のタンパク質では例外的にリシンの側鎖のアミノ基に付加することが報告されている。本稿では図1Bで示した飽和脂肪酸C14:0のN末端グリシンへの付加をN-ミリストイル化と呼ぶことにする。
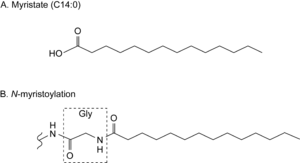
N-ミリストイル化タンパク質
N-ミリストイル化を受けるタンパク質は非常に多岐にわたる。Srcキナーゼファミリー、ホスファターゼ、GTP結合タンパク質、カルシウム結合タンパク質、膜結合タンパク質などが同定されている。また、ウィルス構成タンパク質やバクテリア由来タンパク質もN-ミリストイル化を受けることが知られている。主なN-ミリストイル化タンパク質を表に示す。
近年、アポトーシスの際にカスパーゼによる切断後にN-ミリストイル化されるタンパク質の同定が盛んに進められている。アポトーシス促進因子であるBIDや細胞骨格のβ-アクチン(β-actin)はこれらに属する。カスパーゼにより誘導される主なN-ミリストイル化タンパク質を表の下段に示す。
N-ミリストイル化タンパク質はインターネット上でデータベース化されており、MYRbase (http://mendel.imp.ac.at/myristate/ ) から閲覧可能である。また、MYRbaseではN-ミリストイル化タンパク質の予測をおこなうことができるので参照されたい。
N-ミリストイル化酵素
タンパク質のN-ミリストイル化はGCN5 N-アセチルトランスフェラーゼ (GNAT)スーパーファミリーに属するN-ミリストイルトランスフェラーゼ(N-myristoyl transferase;NMT)が担っている[4]。NMTは真核生物間で保存され、哺乳類ではNMT1およびNMT2の2種類が同定されている。NMT1/2は各組織に普遍的に発現が認められる。両者は基質特異性(6節を参照)を共有しているものの、NMT1ノックアウトマウスは胚発生時に致死となることからNMT2の代償作用は得られず、両者の間には厳密な役割分担があると考えられている。
NMTの触媒メカニズムは酵母S. cerevisiae NMTの解析から明らかにされた[6]。NMTはミリストイル-CoAを選択的に捕捉し、ペプチド基質がNMTに結合した後にミリスチン酸がN末端グリシンに移行して、CoAおよびミリストイル化基質が放出される。
細胞内においてNMTの活性は熱ショックタンパク質NIP71(NMT inhibitor protein 71またはHSC70)および糖分解酵素エノラーゼ(enolase)によって制御される。また、NMTの活性はNMTのリン酸化によっても制御されることが知られている。
N-ミリストイル化機構
N-ミリストイル化コンセンサス配列は多数の合成ペプチドを用いた酵母S. cerevisiae NMTの基質特異性解析から明らかにされている[7]。
H2N-Met1-Gly2-Xaa3-Xaa4-Xaa5-(Ser/Cys/Thr)6-Xaa7
Xaa3はプロリン、芳香族アミノ酸および荷電アミノ酸は適さない。Xaa4およびXaa5は任意のアミノ酸、Xaa7はプロリンを除くすべてのアミノ酸が可能である。ヒトNMTでも酵母S. cerevisiae同様にモチーフは共有されているが、厳密にはXaa部分のアミノ酸で両者の特異性が異なることが報告されている [8]。『共翻訳時修飾』ではまず、ペプチド鎖がリボソームに結合した状態でメチオニンアミノペプチダーゼ(methionine aminopeptidase)によりN末端メチオニン残基が除去され、露出したグリシンのアミノ基にNMTがミリスチン酸を付加する(図2A)。一方、カスパーゼを介する『翻訳後修飾』ではカスパーゼによるタンパク分解後、N末端に新たに露出したグリシンおよびモチーフに対してNMTがミリスチン酸を付加する(図2B)。
機能
多くのN-ミリストイル化タンパク質はミリスチン酸付加により、疎水性が上昇し、細胞膜への親和性が向上する(図3)。しかしながら、膜表面にタンパク質を安定に繋ぎとめるためにはミリスチン酸の効果だけでは充分ではない(図3①)。多くの場合、安定な膜結合性を獲得するための第2の機構を有しており、これらが不可逆的修飾であるN-ミリストイル化タンパク質の可逆的な細胞膜-細胞質間輸送を可能にしている。主に『ミリストイル化+パルミトイル化』と『ミリストイル化+ポリ塩基性クラスター』の2つの機構からなる。
前者は細胞質において、もうひとつの主要な脂肪酸アシル化修飾であるS-パルミトイル化を受けるもので、二重の脂質修飾(dual acylation)により疎水性が著しく向上し細胞膜へと輸送される。この場合には、まずN-ミリストイル化がおこり、その後近傍のシステイン残基がS-パルミトイル化を受ける(パルミトイル化の項を参照)。不可逆的なN-ミリストイル化に対して、S-パルミトイル化は酵素依存的なダイナミックの修飾サイクルを有し、タンパク質パルミトイルトランスフェラーゼ(PAT; palmitoyl acyl transferase)によるパルミチン酸の付加(②)とタンパク質パルミトイルチオエステラーゼ(PPT; protein palmitoyl thioesterase) による脱パルミトイル化からなる(③)。ミリストイル化タンパク質はS-パルミトイル化サイクルを利用して可逆的な細胞質-細胞膜サイクルを獲得しているのである。また、多くの場合S-パルミトイル化タンパク質は脂質ラフト/カベオラへ輸送されることが示唆されており、機能性膜ドメイン形成に重要な役割を果たしていると考えられている。詳しくはパルミトイル化の項を参照されたい。二重脂質修飾を受けるタンパク質の例としてSrcファミリータンパク質(Yes、Fyn、Lyn、Lck、Hcr、Fgr、Yrk)やGαサブユニット(Gαi1、Gαo、Gαzなど)、eNOS(endothelial nitric oxide synthase)などが挙げられる。
後者の『ミリストイル化+ポリ塩基性アミノ酸クラスター』はミリストイル化タンパク質自体がもつ物理化学的特徴を利用した機構で、ミリストイル化タンパク質の塩基性アミノ酸クラスターと細胞膜の酸性リン脂質(ホスファチジルセリン、ホスファチジルイノシトールなど)の間の電荷的相互作用により膜への親和性を向上させている(④)。Srcが代表例である。膜からの脱離にはいくつかのパターンが報告されているが、リガンド結合によるコンフォーメーション変化によりミリストイル基がタンパク質内部に埋め込まれる機構(⑤)や、タンパク質キナーゼによるリン酸基の負電荷による斥力による機構(⑥)があり、「ミリストイルスイッチ」と呼ばれる。リガンド結合型のスイッチには、カルシウムセンサータンパク質レコヴェリン(recoverin)-カルシウムイオン相互作用がよく知られている。リン酸化型スイッチでは、MARCKS(myristoylated alanine-rich C kinase substrate)が代表例として知られている。興味深いことにSrcはその塩基性アミノ酸モチーフと細胞膜リン脂質との相互作用が強いため、モノリン酸化のみでは膜から脱離しないことが明らかになっている[9]。
N-ミリストイル化タンパク質の検出方法
プロテアーゼによるタンパク質分解後の『翻訳後修飾』としてのN-ミリストイル化が発見されて以来、新規ミリストイル化基質の探索が進められている。
N-ミリストイル化タンパク質の検出には古くから[3H]-あるいは [125I]-ミリスチン酸を用いた代謝標識法が用いられている。しかしながら、検出感度が低く存在量の少ないタンパク質に関しては検出が難しい。近年N-ミリストイル化のプローブとして代謝ラベル可能なミリスチン酸誘導体が開発されている。末端アルキルを有するミリスチン酸誘導体Alk-C14やアジド基を導入したAz-C12がその代表例である(図4)。前者はclick chemistryを利用して、後者はclick chemistryあるいはStaudinger反応を利用してビオチンなどのタグを導入することができ、各種アフィニティビーズでの精製、酵素消化の後に質量分析により、N-ミリストイル化タンパク質を同定することが可能である。また、蛍光色素を導入することで細胞内イメージングに利用することも可能である。詳しくは総説[10]が参考になる。
病理的意義
癌
癌遺伝子であるSrcキナーゼファミリーはN-ミリストイル化によりキナーゼ活性が亢進することから、N-ミリストイル化すなわちNMTの活性は癌と密接に関係している。これまでいくつかの腫瘍形成モデルからNMTが結腸癌亢進において重要な役割を果たすことが明らかにされている。また、NMTの発現量の増加(特にNMT2)は癌の亢進を引き起こすことが示唆されている。このことから、NMTは結腸癌のマーカーとして用いられている。
神経関連疾患
N-ミリストイル化はてんかんを含む神経関連疾患にもおいても重要である。SrcやFynはNMDA型グルタミン受容体のチロシンリン酸化を担う。SrcとNMDA型受容体の会合には、Srcのミリストイル化が重要であることが示唆されている。てんかん発症患者において、通常中枢神経系ではほとんど発現が見られないNMT2が多く発現する一方、NMTの阻害タンパク質であるNIP71(HSC70)の発現量が減少する例が知られている。
感染症
N-ミリストイル化修飾は真核生物の細胞内タンパク質に限らず、ウィルスやバクテリア由来のタンパク質にも見られる。ウィルスやバクテリアはNMTをコードする遺伝子を有していないため、これらのタンパク質はホストである真核生物のNMTによりN-ミリストイル化を受ける。ウィルス構成タンパク質のN-ミリストイル化は、カプシド構造形成におけるタンパク質間会合やホスト細胞への侵入などにおいて重要な役割を有している。
バクテリアのIII型分泌機構でホスト細胞に感染するタンパク質もホストのNMTによりミリストイル化修飾を受ける。これらバクテリア由来タンパク質はN-ミリストイル化によりホストの細胞膜に局在化し、強い毒性を発揮する。すなわち病原細菌がホスト細胞を攻撃するための一つのプロセスをN-ミリストイル化が担っているのである。
ヌーナン症候群
ヌーナン(Noonan)症候群は低身長、先天性心疾患、発達遅滞を特徴とする疾患で、SHOC2を原因遺伝子とする。本来SHOC2はミリストイル化を受けないが、ヌーナン症候群患者ではSer2Glyの変異がみられ、N-ミリストイル化を受けることで膜へ輸送され本来の機能が欠落することが疾患の一因であることが報告されている。
NMT阻害剤
上述したようにNTMによるタンパク質のN-ミリストイル化は細胞の恒常性維持において不可欠であり、疾患との関連性も強く示唆される。そのためNMT阻害剤は余剰なNMTの活性が原因となる癌などの疾患の治療薬となりうる。また、同時にNMTの阻害剤は抗真菌製剤として期待されている。6節で述べたように、NMTはミリストイル化モチーフを真核生物種間で共有しているものの、認識アミノ酸配列は種間で違いがある[8]。そのためカンジダ菌など真菌のNMTに選択的な阻害剤は抗真菌製剤として応用可能であり、開発が進められている。現在までにミリスチン酸誘導体、ペプチドミメティックス、ベンゾフラン誘導体、アミノベンゾチアゾール誘導体などが報告されている。詳細は[11]を参照されたい。
参考文献
- ↑
Nadolski, M.J., & Linder, M.E. (2007).
Protein lipidation. The FEBS journal, 274(20), 5202-10. [PubMed:17892486] [WorldCat] [DOI] - ↑
Carr, S.A., Biemann, K., Shoji, S., Parmelee, D.C., & Titani, K. (1982).
n-Tetradecanoyl is the NH2-terminal blocking group of the catalytic subunit of cyclic AMP-dependent protein kinase from bovine cardiac muscle. Proceedings of the National Academy of Sciences of the United States of America, 79(20), 6128-31. [PubMed:6959104] [PMC] [WorldCat] [DOI] - ↑
Aitken, A., Cohen, P., Santikarn, S., Williams, D.H., Calder, A.G., Smith, A., & Klee, C.B. (1982).
Identification of the NH2-terminal blocking group of calcineurin B as myristic acid. FEBS letters, 150(2), 314-8. [PubMed:7160476] [WorldCat] [DOI] - ↑
Towler, D.A., Eubanks, S.R., Towery, D.S., Adams, S.P., & Glaser, L. (1987).
Amino-terminal processing of proteins by N-myristoylation. Substrate specificity of N-myristoyl transferase. The Journal of biological chemistry, 262(3), 1030-6. [PubMed:3100524] [WorldCat] - ↑
Zha, J., Weiler, S., Oh, K.J., Wei, M.C., & Korsmeyer, S.J. (2000).
Posttranslational N-myristoylation of BID as a molecular switch for targeting mitochondria and apoptosis. Science (New York, N.Y.), 290(5497), 1761-5. [PubMed:11099414] [WorldCat] [DOI] - ↑
Rudnick, D.A., McWherter, C.A., Adams, S.P., Ropson, I.J., Duronio, R.J., & Gordon, J.I. (1990).
Structural and functional studies of Saccharomyces cerevisiae myristoyl-CoA:protein N-myristoyltransferase produced in Escherichia coli. Evidence for an acyl-enzyme intermediate. The Journal of biological chemistry, 265(22), 13370-8. [PubMed:2198291] [WorldCat] - ↑
Towler, D.A., Adams, S.P., Eubanks, S.R., Towery, D.S., Jackson-Machelski, E., Glaser, L., & Gordon, J.I. (1988).
Myristoyl CoA:protein N-myristoyltransferase activities from rat liver and yeast possess overlapping yet distinct peptide substrate specificities. The Journal of biological chemistry, 263(4), 1784-90. [PubMed:3123478] [WorldCat] - ↑
Rocque, W.J., McWherter, C.A., Wood, D.C., & Gordon, J.I. (1993).
A comparative analysis of the kinetic mechanism and peptide substrate specificity of human and Saccharomyces cerevisiae myristoyl-CoA:protein N-myristoyltransferase. The Journal of biological chemistry, 268(14), 9964-71. [PubMed:8486723] [WorldCat] - ↑
Murray, D., Hermida-Matsumoto, L., Buser, C.A., Tsang, J., Sigal, C.T., Ben-Tal, N., ..., & McLaughlin, S. (1998).
Electrostatics and the membrane association of Src: theory and experiment. Biochemistry, 37(8), 2145-59. [PubMed:9485361] [WorldCat] [DOI] - ↑
Hannoush, R.N., & Sun, J. (2010).
The chemical toolbox for monitoring protein fatty acylation and prenylation. Nature chemical biology, 6(7), 498-506. [PubMed:20559317] [WorldCat] [DOI] - ↑
Georgopapadakou, N.H. (2002).
Antifungals targeted to protein modification: focus on protein N-myristoyltransferase. Expert opinion on investigational drugs, 11(8), 1117-25. [PubMed:12150705] [WorldCat] [DOI]
(執筆者:関谷敦志、深田優子、深田正紀 担当編集委員:林康紀)