「アセチル化」の版間の差分
Kinichinakashima (トーク | 投稿記録) 細編集の要約なし |
|||
| (3人の利用者による、間の34版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Acetylation 独:Acetylierung 仏:Acétylation[[Image:Nm-Kinichinakashima fig 1.png|thumb|350px|'''図1 代表的なアセチル化反応'''<br>代表的なアセチル化反応であるアスピリンの合成反応を示した。円で囲われたサリチル酸の水酸基が無水酢酸との反応によりアセチル基に置換され、アスピリンが合成される。]]<br> | |||
アセチル化(Acetylation)とは、有機化合物の水酸基(-OH)やアミノ基(-NH2)などの水素原子をアセチル基(-CH3CO)で置換することである(図1)。IUPAC命名法ではエタノイル化という。逆に、有機化合物からアセチル基が除かれる反応は脱アセチル化という。代表的なアセチル化剤として、無水酢酸、塩化アセチル、酢酸メチル、N-メチルアセトアミドなどが使われている。 | |||
'' | |||
==タンパク質のアセチル化== | |||
[[Image:Nm-Kinichinakashima fig 2.png|thumb|400px|'''図2 ヒストンのアセチル化、脱アセチル化による転写活性状態の変化'''<br>ヒストンがHATによりアセチル化された状態ではヒストン-DNA間の結合が緩むことで、TFやPolⅡの結合が可能となり、転写は活性化される。逆にHDACにより、ヒストンが脱アセチル化されるとTF、PolⅡが結合出来ないため転写は抑制される。<br>GTF:general transcription factor:基本転写因子群、Ac:acetylation:アセチル化]]タンパク質のアセチル化は、クロマチンの構造制御や転写活性制御に重要な働きをしている。転写活性化に働く補因子の多くがアセチル化酵素活性を持っており、逆に転写抑制に働く補因子の多くは脱アセチル化酵素活性を有する。代表的なアセチル化酵素(HAT、histone acetyltransferase)として、CBP/p300(CREB binding protein)やPCAF(p300/CBP-associated factor)などが存在し、脱アセチル化酵素(HDAC、histone deacetylase)としてHDAC1~11、SIRT1~7(sirtuin1~7)が存在している。これらの酵素を含む複合体は、様々なシグナル経路に応答して、DNA に結合する転写因子(Transcription factor:TF)と強調して働くことが知られている。<br> | |||
タンパク質のアセチル化において最も多く報告されているのがヒストンのアセチル化及び脱アセチル化である。これらは遺伝子の発現制御に密接に関わっている。ヒストンはアセチル化されることでヒストン中の特定のリジン残基のアミノ基(-NH2(-NH3+))をアミド(-NHCOCH3)に変換することにより電荷を中和し、ヒストン-DNA間の結合を部分的に弱める。これにより、DNA鎖に対して転写因子やRNAポリメラーゼ(PolⅡ)がより結合しやすい状態になり、結果として転写が活性化される。逆に、ヒストンが脱アセチル化されるとアセチル基が加水分解により除去され、元のアミノ基に戻ることによりヒストンへのDNAの巻きつきが強められ転写が抑制される(図2)。<br> | |||
その他にも、p53 、E2F、MyoD、STAT3など数多くの非ヒストンタンパク質もまた、部位特異的にアセチル化されることが知られている<ref><pubmed>18804549</pubmed></ref>(表1、2)。アセチル化により、これらタンパク質の安定性や分解をはじめ、活性や局在、特異的相互作用などが制御され、転写、増殖、アポトーシス、分化など、細胞の様々な過程がコントロールされている。現在では、ヒストンおよび非ヒストンタンパク質のアセチル化が、メチル化やリン酸化など他の修飾とクロストークし、最終的なシグナル発現に重要な働きをしていることが明らかとなっている。いくつかの修飾がある決まった順序で組み合わさることが、ある機能発現には必要であり、一方では、互いに阻害し合うこともある。このように組み合わせを変えることで、細胞内情報伝達のネットワークの多様性を生み出している[2]。 | |||
<b>表1:代表的なアセチル化酵素[2][3]</b><br> | |||
ACTR、ATF-2、CBP、CDY、CLOCK、EWI、Elp3、GCN5L、GRIP、HAT1、HBO1、<br> MCM3AP、MORF、MOZ、p300、PCAF、p/CIP、SRC-1、hTAF,,250、TFIIB、Tip60 | |||
<b>表2:代表的なアセチル化される非ヒストンタンパク質[2][3]</b><br> | |||
Acetyl-CoA Synthetase、ACTR、AP endonuclease、AR、ATM、Brm、E2F1, -2, -3、EKLF、ERα、FoxO1, 2, 3、GATA1、<br> HIF-1α、Histones、HMG A1、HSP90、Importin-α、INFR、Ku70、MEF2A、MHG17、Mitochondrial proteins、MyoD、<br> c-Myb、c-Myc、NF-κB、p21、p53、p73、p300、PCNA、PGC-1α、PR、STAT3 | |||
{| border="1" cellpadding="1" style="width:100%" | {| border="1" cellpadding="1" style="width:100%" | ||
|+ ''' | |+ '''表3:非ヒストンタンパク質のアセチル化と種々の生物学的変化[2]''' | ||
|- | |- | ||
| colspan="2" style="text-align:center" | '''タンパク質の安定性''' | |colspan="2" style="text-align:center" | '''タンパク質の安定性''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | 増加 | | style="text-align:center; width:50%" | 増加 | ||
| style="text-align:center" | 減少 | | style="text-align:center" | 減少 | ||
|- | |- | ||
| style="text-align:center" | p53, p73, | | style="text-align:center" | p53, p73, Smad7, c-Myc, Runx3, AR, H2A.z, E2F1, NF-E4, ER81, SREBP1a, HNF6, BACE1 | ||
| style="text-align:center" | | | style="text-align:center" | GATA1, HIF-1α, pRb | ||
|- | |- | ||
| colspan="2" style="text-align:center" | '''DNAへの結合''' | |colspan="2" style="text-align:center" | '''DNAへの結合''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | | | style="text-align:center; width:50%" | 結合の増加 | ||
| style="text-align:center" | | | style="text-align:center" | 結合の減少 | ||
|- | |- | ||
| style="text-align:center" | p53, | | style="text-align:center" | p53, SRY, STAT3, GATA, E2F1, p50 (NF-κB), ERα, p65 (NF-κB), c-Myb, MyoD, HNF-4, AML1, BETA2, NF-E2, KLF13, TAL1/SCL, TAF(I)68, AP endonuclease | ||
| style="text-align:center" | | | style="text-align:center" | YY1, HMG-A1, HMG-N2, p65 (NF-κB), DEK, KLF13, Fen-1 | ||
|- | |- | ||
| colspan="2" style="text-align:center" | '''遺伝子の発現''' | |colspan="2" style="text-align:center" | '''遺伝子の発現''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | 転写活性化 | | style="text-align:center; width:50%" | 転写活性化 | ||
| style="text-align:center" | 転写抑制 | | style="text-align:center" | 転写抑制 | ||
|- | |- | ||
| style="text-align:center" | p53, | | style="text-align:center" | p53, HMG-A1, STAT3, AR, ERα (basal), GATA, EKLF, MyoD, E2F1, p65 (NF-κB), GR, p73, PGC1α, MEF2D, GCMa, PLAG1, PLAG2, Bcl-6, β-Catenin, KLF5, Sp1, BETA2, Cart1, RIP140, TAF(I)68 | ||
| style="text-align:center" | | | style="text-align:center" | Erα (ligand-bound), HIF-1α, STAT1, FOXO1, FOXO4, RIP140 | ||
|- | |- | ||
| colspan="2" style="text-align:center" | '''タンパク質との相互作用''' | |colspan="2" style="text-align:center" | '''タンパク質との相互作用''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | 亢進 | | style="text-align:center; width:50%" | 亢進 | ||
| style="text-align:center" | 抑制 | | style="text-align:center" | 抑制 | ||
|- | |- | ||
| style="text-align:center" | STAT3, AR, | | style="text-align:center" | STAT3, AR, EKLF, Importin A, STAT1, TFIIB, α-Tubulin, actin, cortactin | ||
| style="text-align:center" | | | style="text-align:center" | p65 (RelA), Ku70, HSP90 | ||
|- | |- | ||
| colspan="2" style="text-align:center" | '''局在化''' | |colspan="2" style="text-align:center" | '''局在化''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | アセチル化→核 | | style="text-align:center; width:50%" | アセチル化→核 | ||
| style="text-align:center" | アセチル化→細胞質ゾル | | style="text-align:center" | アセチル化→細胞質ゾル | ||
|- | |- | ||
| style="text-align:center" | PCAF, SRY, | | style="text-align:center" | PCAF, SRY, CtBP2, POP-1, HNF-4, PCNA | ||
| style="text-align:center" | | | style="text-align:center" | c-Abl, p300, PAP | ||
|- | |- | ||
| colspan="2" style="text-align:center" | ''' | |colspan="2" style="text-align:center" | '''mRNAの安定性''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | 増加 | | style="text-align:center; width:50%" | 増加 | ||
| style="text-align:center" | 減少 | | style="text-align:center" | 減少 | ||
|- | |- | ||
| style="text-align:center" | | | style="text-align:center" | p21, Brm | ||
| style="text-align:center" | | | style="text-align:center" | Tyrosinhydrolase (Th), eNOS | ||
|- | |- | ||
| colspan="2" style="text-align:center" | '''酵素活性''' | |colspan="2" style="text-align:center" | '''酵素活性''' | ||
|- | |- | ||
| style="text-align:center; width:50%" | 増加 | | style="text-align:center; width:50%" | 増加 | ||
| style="text-align:center" | 減少 | | style="text-align:center" | 減少 | ||
|- | |- | ||
| style="text-align:center" | p300, | | style="text-align:center" | p300, ATM | ||
| style="text-align:center" | | | style="text-align:center" | PTEN, HDAC1, Mdm2, ACS, Neil2, Polβ | ||
|- | |||
|} | |} | ||
==神経系でのタンパク質アセチル化== | |||
アセチル化は神経機能にも関与している。特にヒストンのアセチル化、脱アセチル化は神経幹細胞の分化や神経機能、神経系疾患に密接に関わっていることが報告されている。神経幹細胞の分化は「ヒストン」の項を参考にして頂き、ここではヒストンアセチル化と神経機能、及び神経系疾患に着目する。 | |||
=== | ===ヒストンアセチル化と神経機能=== | ||
哺乳類においてヒストンのアセチル化、脱アセチル化、及びHAT、HDACの活性はシナプスの可塑性や記憶の形成に関与する。NMDA型グルタミン酸受容体の活性化及びそれに伴うPKA(protein kinase A)、PKC(protein kinase C)経路の活性化はヒストンH3のアセチル化を誘導し[3]、海馬神経のKClによる脱分極はヒストンH2Bのアセチル化を促進する[4]。さらに、マウスでの記憶学習訓練もヒストンH3のアセチル化を誘導することが知られている[3][5]。また、恐怖条件付けが脳由来神経栄養因子(brain-derived neurotrophic factor:BDNF)プロモーター領域のヒストンH3のアセチル化とホスホアセチル化を亢進することが報告されている[6][7]。ヒストンH3のアセチル化亢進は記憶の再固定や想起の際に誘導されることも明らかになっており、ヒストンのアセチル化が記憶に密接に関わっていることが示されている[8]。同様にHDACやHATの活性も神経機能に重要である。HDACの阻害は、シナプス間での神経伝達物質の伝達効率の指標であり、学習・記憶に重要とされる長期増強(long-term potentiation:LTP)や記憶形成を増強させ[9][10]、恐怖条件付けによる恐怖の消去を促進させる[6][11]。代表的なHATであるCBPの変異マウスはLTP及び記憶形成が障害を受け[12]、抑制性の切断型p300のトランスジェニックマウスやPCAF欠損マウスでは記憶障害が起こることが報告されている[13][14]。さらに、重度の脳萎縮、及び神経脱落を起こしたマウスにHDAC阻害剤を投与すると、樹状突起の再形成とシナプスの増加が観察され、学習能力や長期記憶が回復することが明らかになっている[15]。これらのように、シナプス可塑性(LTP)や記憶形成においてヒストンのアセチル化とそれを制御する酵素は非常に重要な役割を果たしている。 | |||
===ヒストンアセチル化と神経疾患=== | |||
[[Image:Nm-Kinichinakashima fig 3.png|thumb|300px|'''図3 神経変性状態でのHDAC阻害剤の働き'''<br>HDAC阻害剤は神経変性状態におけるヒストンの低アセチル化状態を改善し、結果的に種々のタンパク質の発現を上昇させる。また、微小管タンパク質を高アセチル化状態にすることで微小管輸送を上昇させ、BDNFの細胞外放出を促進させる。これらによりHDAC阻害剤は神経保護、神経栄養、抗炎症、学習記憶の上昇等を示し、神経変性状態を改善する。<br>Bcl-2:B-cell lymphoma 2:B細胞リンパ腫2、BDNF:brain-derived neurotrophic factor:脳由来神経栄養因子、GAPDH:glycelaldehyde-3-phosphate dehydrogenase:グリセルアルデヒド3リン酸脱水素酵素、GDNF:glial cell line-derived neurotrophic factor:グリア細胞由来神経栄養因子、HSP70:heat shock protein 70:熱ショックタンパク質70]]HDACはヒストンタンパク質のアセチル化状態の恒常性を維持することで転写等の細胞の基本的な活性を制御するのに重要な役割を果たしており、多くの脳疾患でタンパク質のアセチル化レベルが不均衡となっていることが知られている。このような点からも種々のHDAC阻害剤が新たな脳疾患治療薬として有用である可能性が示唆されている。HDAC阻害剤は神経保護、神経栄養性、及び抗炎症の特徴を有し、学習記憶や脳疾患にみられる他の表現型などを改善できることが示されている[16][17](図3)。具体的には、脳卒中、ハンチントン病、筋萎縮性側索硬化症、脊髄性筋委縮症、パーキンソン病、アルツハイマー病、ルビンシュタイン・テイビ症候群、レット症候群、フリードリッヒ運動失調症、多発性硬化症などが挙げられ、多くの脳疾患でヒストンの低アセチル化及び転写の機能障害が起こっている。HDACには5つのファミリーがあり、それぞれCLASSⅠ(HDAC1、2、3、8)、CLASSⅡa(HDAC4、5、7、9)、CLASSⅡb(HDAC6、10)、CLASSⅢ(SIRT1~7)、CLASSⅣ(HDAC11)である。HDAC阻害剤も多く存在し、代表的なものとして、バルプロ酸(Valproic acid:VPA)、酪酸ナトリウム(Sodium butyrate:SB)、トリコスタチンA(Trichostatin A:TSA)、スベロイルアニリドヒドロキサム酸(suberoylanilide hydroxamic acid:SAHA)が知られている。 | |||
ヒストンのアセチル化が関与する脳疾患の例を以下に示す。 | |||
====ルビンシュタイン・テイビ症候群==== | |||
ルビンシュタイン・テイビ症候群はHATとしての機能をもつCBPやp300の変異により引き起こされ、精神遅滞や記憶障害を示す脳疾患である[18]。CBPのヘテロ欠損マウスは発達遅滞や骨格異常がみられ[19]、クロマチンのアセチル化の欠損、及びLTPの障害などを示す[20]。近年の研究により、HDAC阻害剤であるTSAを投与することでLTPの障害による長期記憶能低下の改善、及びシナプス可塑性の回復がみられることが明らかになっている[21]。このような研究結果から、HDAC阻害剤がルビンシュタイン・テイビ症候群治療の選択肢のひとつとして考えられている。 | |||
==== | ====パーキンソン病==== | ||
パーキンソン病は神経変性疾患で、黒質でのドーパミン神経の選択的欠損に伴う運動機能障害を特徴としている。パーキンソン病の大部分は孤発性である。ドーパミン毒素によりパーキンソン病様症状を呈したモデル動物に、HDAC阻害剤のフェニルブチレートを投与すると、黒質でのドーパミンの欠乏とドーパミンの生合成酵素であるチロシンヒドロキシラーゼを発現する神経の減少が抑制される[22]。また、HDAC阻害剤の投与により中脳のアストロサイトで誘導されるグリア細胞由来神経栄養因子(glial cell line-derived neurotrophic factor:GDNF)は、ドーパミン神経特異的に生存と軸索伸長に作用する因子である(図3)。そのため、HDAC阻害剤投与はパーキンソン病を含む神経変性疾患の治療において有望な治療法となると考えられている[23]。<br> | |||
家族性のパーキンソン病ではシナプス前タンパク質であるα-シヌクレインの遺伝子変異が原因のひとつとされている。ヒト神経芽腫細胞において、α-シヌクレインはヒストンに結合し、HATであるCBPやp300、PCAFを不活性化することでヒストンの低アセチル化、及びアポトーシスを引き起こすことが示されている[24]。現在までの研究により、HDAC阻害剤のSBやSAHAの投与が、in vitro、in vivo両方においてα-シヌクレインの過剰発現による神経細胞死を減弱させることが明らかとなっている[25]。これらのことも、パーキンソン病においてHDAC阻害剤が治療に有効であると考えられる根拠となっている。 | |||
====脳卒中==== | |||
脳卒中は急性の神経変性疾患であり日本では死因の第三位を占めている。脳卒中の大部分は脳虚血により引き起こされるため、脳卒中のモデル動物は中大脳動脈閉塞術(midle cerebral artery occlusion:MCAO)により作成することができる。ラット及びマウスのMCAOモデルでは、虚血脳全体のヒストンのリジン残基でアセチル化が抑制されるが、この変化はHDAC阻害剤の投与により梗塞体積の減少と共に回復される[25][26][27]。ラットのMCAOモデルでは傷害後のVPA、SB、TSAの投与により、状態の改善がみられることが示されている[25][26]。SBを投与したMCAOラットでは虚血脳で、神経新生の増加が確認されるが、これはBDNF-TrkBの経路を遮断すると消失してしまう[28]。さらに、マウスへのフェニルブチレートの投与はeIF2α(eukaryotic translation initiation factor2α)のリン酸化減少とeIF2αに制御されるCHOP(C/EBP homologous protein)の発現によってERストレス(endoplasmic reticulum stress)から虚血脳を保護できることが報告されている[29]。HDAC阻害剤の投与は虚血によって引き起こされるp53の発現上昇を抑制し、HSP70(heat-shock protein 70)の発現を誘導することが知られている[24][25][26](図3)。HSP70はマウスMCAOモデルでHSP70- I-κBα- NF-κB(nuclear factor-kappa B)の安定な複合体を形成することにより、 NF-κBを不活性化することで抗炎症作用を示すことが明らかにされている[30]。<br> | |||
細胞骨格タンパク質の発現は虚血条件においてHDAC阻害による神経保護効果と関連している。例としてHDACの阻害はアクチンフィラメントの構成に重要なゲルソリンタンパク質を増加させ、虚血傷害から神経を保護する[31]。加えてVPAはHDAC阻害と転写活性化、及びFas-L(fas ligand protein)、IL-6(interleukin-6)、MMP-9(matrix metalloproteinase-9)を含む炎症誘発性因子の発現を抑制して抗炎症効果を示すことにより、脳卒中の脳内出血モデルにおいて神経保護を示す[32]。以上の報告より、急性の神経疾患においてもHDACの阻害が効果的であることが示されている。 | |||
本文では以上3つの例を紹介したが、これらの例からも、脳機能においてヒストンのアセチル化は重要な役割を担い、HDAC阻害剤は脳疾患治療薬として有用であると考えられる。 | 本文では以上3つの例を紹介したが、これらの例からも、脳機能においてヒストンのアセチル化は重要な役割を担い、HDAC阻害剤は脳疾患治療薬として有用であると考えられる。 | ||
== 非ヒストンタンパク質のアセチル化と神経機能・神経疾患 | ==非ヒストンタンパク質のアセチル化と神経機能・神経疾患== | ||
上述してきたように、一般にHDACの阻害は脳疾患治療に有用であると思われる。しかし、HDAC6のようにHDACの働きが脳機能に重要であることも知られており、HDACの阻害が常によい方向に働くとは限らない。HDAC6は脳で高く発現しており、ヒストンのみならずα-tubulin、HSP90、コルタクチンを脱アセチル化する。なかでもHDAC6の主要な基質はα-tubulinであり、α-tubulinのアセチル化レベルを制御することで微小管の安定性をコントロールし、その輸送等に重要な役割を果たすことが報告されている[33][34]。微小管のアセチル化が促進されると、神経細胞において微小管とキネシン-1との結合が促進され、JNK-interacting Protein 1やBDNFなどのキネシン-1のカーゴタンパク質の極性輸送が促進される[35]。HDAC6による微小管の安定性制御は神経細胞におけるキネシン-1によるミトコンドリアの輸送にも重要であり[34][36]、異常なミトコンドリア輸送は、アルツハイマー病、パーキンソン病、ハンチントン病、筋委縮性側鎖硬化症などの脳疾患に関係することが知られている[37]。また、HDAC6は軸索の末端領域に局在することで軸索の伸長にも重要な役割を果たしており、TSAなどのHDAC阻害剤によるtubulinの脱アセチル化阻害は軸索の伸長を阻害することが報告されている[38]。<br> | |||
上述してきたように、一般にHDACの阻害は脳疾患治療に有用であると思われる。しかし、HDAC6のようにHDACの働きが脳機能に重要であることも知られており、HDACの阻害が常によい方向に働くとは限らない。HDAC6は脳で高く発現しており、ヒストンのみならずα- | |||
しかし逆に、HDAC6はマウスの情動行動に関与し、HDAC6の欠損やHDAC6阻害剤が運動亢進、不安の軽減などの抗うつ様の行動を誘導することで、うつ病等の治療によい影響を与えることも明らかになっている。HDAC6は、気分障害等の精神疾患に深く関与するセロトニン神経細胞の豊富な中脳の縫線核、青斑核、黒質の神経細胞に多く存在している。しかし、HDAC6の欠損マウスにおいて、セロトニンの量、及び既存の抗うつ薬である選択的セロトニン再取り込み阻害薬/セロトニン・ノルアドレナリン再取り込み阻害薬(Selective Serotonin Reuptake Inhibitors/ Serotonin & Norepinephrine Reuptake Inhibitors:SSRI/SNRI)に対する応答性には変化がなく、SSRI/SNRIの急性投与による大幅なうつ様行動の改善はHDAC6の欠損マウスと野生型マウスで同程度である。このことからHDAC6阻害剤による抗うつ作用メカニズムは既存の抗うつ薬とは異なると考えられており、HDAC6の阻害はうつ病の病態解明や新規抗うつ薬の開発につながる可能性が示唆されている[39]。 | |||
上記の例に加えて、タンパク質のアセチル化と脳機能に関しては多くの報告がなされている。これらのことから、ヒストンのアセチル化や非ヒストンタンパク質のアセチル化は脳の発達や機能にさまざまな役割を果たしており、脳において重要な機構であるといえる。 | |||
==参考文献== | |||
<references /> | |||
(執筆者:村尾直哉、中島欽一 担当編集委員:村上富士夫) | |||
2012年10月6日 (土) 20:29時点における版
英語名:Acetylation 独:Acetylierung 仏:Acétylation

代表的なアセチル化反応であるアスピリンの合成反応を示した。円で囲われたサリチル酸の水酸基が無水酢酸との反応によりアセチル基に置換され、アスピリンが合成される。
アセチル化(Acetylation)とは、有機化合物の水酸基(-OH)やアミノ基(-NH2)などの水素原子をアセチル基(-CH3CO)で置換することである(図1)。IUPAC命名法ではエタノイル化という。逆に、有機化合物からアセチル基が除かれる反応は脱アセチル化という。代表的なアセチル化剤として、無水酢酸、塩化アセチル、酢酸メチル、N-メチルアセトアミドなどが使われている。
タンパク質のアセチル化
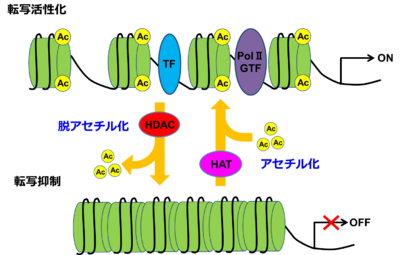
ヒストンがHATによりアセチル化された状態ではヒストン-DNA間の結合が緩むことで、TFやPolⅡの結合が可能となり、転写は活性化される。逆にHDACにより、ヒストンが脱アセチル化されるとTF、PolⅡが結合出来ないため転写は抑制される。
GTF:general transcription factor:基本転写因子群、Ac:acetylation:アセチル化
タンパク質のアセチル化は、クロマチンの構造制御や転写活性制御に重要な働きをしている。転写活性化に働く補因子の多くがアセチル化酵素活性を持っており、逆に転写抑制に働く補因子の多くは脱アセチル化酵素活性を有する。代表的なアセチル化酵素(HAT、histone acetyltransferase)として、CBP/p300(CREB binding protein)やPCAF(p300/CBP-associated factor)などが存在し、脱アセチル化酵素(HDAC、histone deacetylase)としてHDAC1~11、SIRT1~7(sirtuin1~7)が存在している。これらの酵素を含む複合体は、様々なシグナル経路に応答して、DNA に結合する転写因子(Transcription factor:TF)と強調して働くことが知られている。
タンパク質のアセチル化において最も多く報告されているのがヒストンのアセチル化及び脱アセチル化である。これらは遺伝子の発現制御に密接に関わっている。ヒストンはアセチル化されることでヒストン中の特定のリジン残基のアミノ基(-NH2(-NH3+))をアミド(-NHCOCH3)に変換することにより電荷を中和し、ヒストン-DNA間の結合を部分的に弱める。これにより、DNA鎖に対して転写因子やRNAポリメラーゼ(PolⅡ)がより結合しやすい状態になり、結果として転写が活性化される。逆に、ヒストンが脱アセチル化されるとアセチル基が加水分解により除去され、元のアミノ基に戻ることによりヒストンへのDNAの巻きつきが強められ転写が抑制される(図2)。
その他にも、p53 、E2F、MyoD、STAT3など数多くの非ヒストンタンパク質もまた、部位特異的にアセチル化されることが知られている[1](表1、2)。アセチル化により、これらタンパク質の安定性や分解をはじめ、活性や局在、特異的相互作用などが制御され、転写、増殖、アポトーシス、分化など、細胞の様々な過程がコントロールされている。現在では、ヒストンおよび非ヒストンタンパク質のアセチル化が、メチル化やリン酸化など他の修飾とクロストークし、最終的なシグナル発現に重要な働きをしていることが明らかとなっている。いくつかの修飾がある決まった順序で組み合わさることが、ある機能発現には必要であり、一方では、互いに阻害し合うこともある。このように組み合わせを変えることで、細胞内情報伝達のネットワークの多様性を生み出している[2]。
表1:代表的なアセチル化酵素[2][3]
ACTR、ATF-2、CBP、CDY、CLOCK、EWI、Elp3、GCN5L、GRIP、HAT1、HBO1、
MCM3AP、MORF、MOZ、p300、PCAF、p/CIP、SRC-1、hTAF,,250、TFIIB、Tip60
表2:代表的なアセチル化される非ヒストンタンパク質[2][3]
Acetyl-CoA Synthetase、ACTR、AP endonuclease、AR、ATM、Brm、E2F1, -2, -3、EKLF、ERα、FoxO1, 2, 3、GATA1、
HIF-1α、Histones、HMG A1、HSP90、Importin-α、INFR、Ku70、MEF2A、MHG17、Mitochondrial proteins、MyoD、
c-Myb、c-Myc、NF-κB、p21、p53、p73、p300、PCNA、PGC-1α、PR、STAT3
| タンパク質の安定性 | |
| 増加 | 減少 |
| p53, p73, Smad7, c-Myc, Runx3, AR, H2A.z, E2F1, NF-E4, ER81, SREBP1a, HNF6, BACE1 | GATA1, HIF-1α, pRb |
| DNAへの結合 | |
| 結合の増加 | 結合の減少 |
| p53, SRY, STAT3, GATA, E2F1, p50 (NF-κB), ERα, p65 (NF-κB), c-Myb, MyoD, HNF-4, AML1, BETA2, NF-E2, KLF13, TAL1/SCL, TAF(I)68, AP endonuclease | YY1, HMG-A1, HMG-N2, p65 (NF-κB), DEK, KLF13, Fen-1 |
| 遺伝子の発現 | |
| 転写活性化 | 転写抑制 |
| p53, HMG-A1, STAT3, AR, ERα (basal), GATA, EKLF, MyoD, E2F1, p65 (NF-κB), GR, p73, PGC1α, MEF2D, GCMa, PLAG1, PLAG2, Bcl-6, β-Catenin, KLF5, Sp1, BETA2, Cart1, RIP140, TAF(I)68 | Erα (ligand-bound), HIF-1α, STAT1, FOXO1, FOXO4, RIP140 |
| タンパク質との相互作用 | |
| 亢進 | 抑制 |
| STAT3, AR, EKLF, Importin A, STAT1, TFIIB, α-Tubulin, actin, cortactin | p65 (RelA), Ku70, HSP90 |
| 局在化 | |
| アセチル化→核 | アセチル化→細胞質ゾル |
| PCAF, SRY, CtBP2, POP-1, HNF-4, PCNA | c-Abl, p300, PAP |
| mRNAの安定性 | |
| 増加 | 減少 |
| p21, Brm | Tyrosinhydrolase (Th), eNOS |
| 酵素活性 | |
| 増加 | 減少 |
| p300, ATM | PTEN, HDAC1, Mdm2, ACS, Neil2, Polβ |
神経系でのタンパク質アセチル化
アセチル化は神経機能にも関与している。特にヒストンのアセチル化、脱アセチル化は神経幹細胞の分化や神経機能、神経系疾患に密接に関わっていることが報告されている。神経幹細胞の分化は「ヒストン」の項を参考にして頂き、ここではヒストンアセチル化と神経機能、及び神経系疾患に着目する。
ヒストンアセチル化と神経機能
哺乳類においてヒストンのアセチル化、脱アセチル化、及びHAT、HDACの活性はシナプスの可塑性や記憶の形成に関与する。NMDA型グルタミン酸受容体の活性化及びそれに伴うPKA(protein kinase A)、PKC(protein kinase C)経路の活性化はヒストンH3のアセチル化を誘導し[3]、海馬神経のKClによる脱分極はヒストンH2Bのアセチル化を促進する[4]。さらに、マウスでの記憶学習訓練もヒストンH3のアセチル化を誘導することが知られている[3][5]。また、恐怖条件付けが脳由来神経栄養因子(brain-derived neurotrophic factor:BDNF)プロモーター領域のヒストンH3のアセチル化とホスホアセチル化を亢進することが報告されている[6][7]。ヒストンH3のアセチル化亢進は記憶の再固定や想起の際に誘導されることも明らかになっており、ヒストンのアセチル化が記憶に密接に関わっていることが示されている[8]。同様にHDACやHATの活性も神経機能に重要である。HDACの阻害は、シナプス間での神経伝達物質の伝達効率の指標であり、学習・記憶に重要とされる長期増強(long-term potentiation:LTP)や記憶形成を増強させ[9][10]、恐怖条件付けによる恐怖の消去を促進させる[6][11]。代表的なHATであるCBPの変異マウスはLTP及び記憶形成が障害を受け[12]、抑制性の切断型p300のトランスジェニックマウスやPCAF欠損マウスでは記憶障害が起こることが報告されている[13][14]。さらに、重度の脳萎縮、及び神経脱落を起こしたマウスにHDAC阻害剤を投与すると、樹状突起の再形成とシナプスの増加が観察され、学習能力や長期記憶が回復することが明らかになっている[15]。これらのように、シナプス可塑性(LTP)や記憶形成においてヒストンのアセチル化とそれを制御する酵素は非常に重要な役割を果たしている。
ヒストンアセチル化と神経疾患
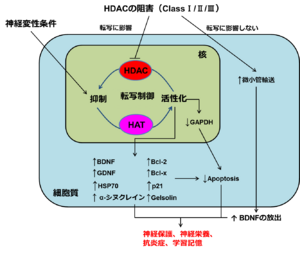
HDAC阻害剤は神経変性状態におけるヒストンの低アセチル化状態を改善し、結果的に種々のタンパク質の発現を上昇させる。また、微小管タンパク質を高アセチル化状態にすることで微小管輸送を上昇させ、BDNFの細胞外放出を促進させる。これらによりHDAC阻害剤は神経保護、神経栄養、抗炎症、学習記憶の上昇等を示し、神経変性状態を改善する。
Bcl-2:B-cell lymphoma 2:B細胞リンパ腫2、BDNF:brain-derived neurotrophic factor:脳由来神経栄養因子、GAPDH:glycelaldehyde-3-phosphate dehydrogenase:グリセルアルデヒド3リン酸脱水素酵素、GDNF:glial cell line-derived neurotrophic factor:グリア細胞由来神経栄養因子、HSP70:heat shock protein 70:熱ショックタンパク質70
HDACはヒストンタンパク質のアセチル化状態の恒常性を維持することで転写等の細胞の基本的な活性を制御するのに重要な役割を果たしており、多くの脳疾患でタンパク質のアセチル化レベルが不均衡となっていることが知られている。このような点からも種々のHDAC阻害剤が新たな脳疾患治療薬として有用である可能性が示唆されている。HDAC阻害剤は神経保護、神経栄養性、及び抗炎症の特徴を有し、学習記憶や脳疾患にみられる他の表現型などを改善できることが示されている[16][17](図3)。具体的には、脳卒中、ハンチントン病、筋萎縮性側索硬化症、脊髄性筋委縮症、パーキンソン病、アルツハイマー病、ルビンシュタイン・テイビ症候群、レット症候群、フリードリッヒ運動失調症、多発性硬化症などが挙げられ、多くの脳疾患でヒストンの低アセチル化及び転写の機能障害が起こっている。HDACには5つのファミリーがあり、それぞれCLASSⅠ(HDAC1、2、3、8)、CLASSⅡa(HDAC4、5、7、9)、CLASSⅡb(HDAC6、10)、CLASSⅢ(SIRT1~7)、CLASSⅣ(HDAC11)である。HDAC阻害剤も多く存在し、代表的なものとして、バルプロ酸(Valproic acid:VPA)、酪酸ナトリウム(Sodium butyrate:SB)、トリコスタチンA(Trichostatin A:TSA)、スベロイルアニリドヒドロキサム酸(suberoylanilide hydroxamic acid:SAHA)が知られている。
ヒストンのアセチル化が関与する脳疾患の例を以下に示す。
ルビンシュタイン・テイビ症候群
ルビンシュタイン・テイビ症候群はHATとしての機能をもつCBPやp300の変異により引き起こされ、精神遅滞や記憶障害を示す脳疾患である[18]。CBPのヘテロ欠損マウスは発達遅滞や骨格異常がみられ[19]、クロマチンのアセチル化の欠損、及びLTPの障害などを示す[20]。近年の研究により、HDAC阻害剤であるTSAを投与することでLTPの障害による長期記憶能低下の改善、及びシナプス可塑性の回復がみられることが明らかになっている[21]。このような研究結果から、HDAC阻害剤がルビンシュタイン・テイビ症候群治療の選択肢のひとつとして考えられている。
パーキンソン病
パーキンソン病は神経変性疾患で、黒質でのドーパミン神経の選択的欠損に伴う運動機能障害を特徴としている。パーキンソン病の大部分は孤発性である。ドーパミン毒素によりパーキンソン病様症状を呈したモデル動物に、HDAC阻害剤のフェニルブチレートを投与すると、黒質でのドーパミンの欠乏とドーパミンの生合成酵素であるチロシンヒドロキシラーゼを発現する神経の減少が抑制される[22]。また、HDAC阻害剤の投与により中脳のアストロサイトで誘導されるグリア細胞由来神経栄養因子(glial cell line-derived neurotrophic factor:GDNF)は、ドーパミン神経特異的に生存と軸索伸長に作用する因子である(図3)。そのため、HDAC阻害剤投与はパーキンソン病を含む神経変性疾患の治療において有望な治療法となると考えられている[23]。
家族性のパーキンソン病ではシナプス前タンパク質であるα-シヌクレインの遺伝子変異が原因のひとつとされている。ヒト神経芽腫細胞において、α-シヌクレインはヒストンに結合し、HATであるCBPやp300、PCAFを不活性化することでヒストンの低アセチル化、及びアポトーシスを引き起こすことが示されている[24]。現在までの研究により、HDAC阻害剤のSBやSAHAの投与が、in vitro、in vivo両方においてα-シヌクレインの過剰発現による神経細胞死を減弱させることが明らかとなっている[25]。これらのことも、パーキンソン病においてHDAC阻害剤が治療に有効であると考えられる根拠となっている。
脳卒中
脳卒中は急性の神経変性疾患であり日本では死因の第三位を占めている。脳卒中の大部分は脳虚血により引き起こされるため、脳卒中のモデル動物は中大脳動脈閉塞術(midle cerebral artery occlusion:MCAO)により作成することができる。ラット及びマウスのMCAOモデルでは、虚血脳全体のヒストンのリジン残基でアセチル化が抑制されるが、この変化はHDAC阻害剤の投与により梗塞体積の減少と共に回復される[25][26][27]。ラットのMCAOモデルでは傷害後のVPA、SB、TSAの投与により、状態の改善がみられることが示されている[25][26]。SBを投与したMCAOラットでは虚血脳で、神経新生の増加が確認されるが、これはBDNF-TrkBの経路を遮断すると消失してしまう[28]。さらに、マウスへのフェニルブチレートの投与はeIF2α(eukaryotic translation initiation factor2α)のリン酸化減少とeIF2αに制御されるCHOP(C/EBP homologous protein)の発現によってERストレス(endoplasmic reticulum stress)から虚血脳を保護できることが報告されている[29]。HDAC阻害剤の投与は虚血によって引き起こされるp53の発現上昇を抑制し、HSP70(heat-shock protein 70)の発現を誘導することが知られている[24][25][26](図3)。HSP70はマウスMCAOモデルでHSP70- I-κBα- NF-κB(nuclear factor-kappa B)の安定な複合体を形成することにより、 NF-κBを不活性化することで抗炎症作用を示すことが明らかにされている[30]。
細胞骨格タンパク質の発現は虚血条件においてHDAC阻害による神経保護効果と関連している。例としてHDACの阻害はアクチンフィラメントの構成に重要なゲルソリンタンパク質を増加させ、虚血傷害から神経を保護する[31]。加えてVPAはHDAC阻害と転写活性化、及びFas-L(fas ligand protein)、IL-6(interleukin-6)、MMP-9(matrix metalloproteinase-9)を含む炎症誘発性因子の発現を抑制して抗炎症効果を示すことにより、脳卒中の脳内出血モデルにおいて神経保護を示す[32]。以上の報告より、急性の神経疾患においてもHDACの阻害が効果的であることが示されている。
本文では以上3つの例を紹介したが、これらの例からも、脳機能においてヒストンのアセチル化は重要な役割を担い、HDAC阻害剤は脳疾患治療薬として有用であると考えられる。
非ヒストンタンパク質のアセチル化と神経機能・神経疾患
上述してきたように、一般にHDACの阻害は脳疾患治療に有用であると思われる。しかし、HDAC6のようにHDACの働きが脳機能に重要であることも知られており、HDACの阻害が常によい方向に働くとは限らない。HDAC6は脳で高く発現しており、ヒストンのみならずα-tubulin、HSP90、コルタクチンを脱アセチル化する。なかでもHDAC6の主要な基質はα-tubulinであり、α-tubulinのアセチル化レベルを制御することで微小管の安定性をコントロールし、その輸送等に重要な役割を果たすことが報告されている[33][34]。微小管のアセチル化が促進されると、神経細胞において微小管とキネシン-1との結合が促進され、JNK-interacting Protein 1やBDNFなどのキネシン-1のカーゴタンパク質の極性輸送が促進される[35]。HDAC6による微小管の安定性制御は神経細胞におけるキネシン-1によるミトコンドリアの輸送にも重要であり[34][36]、異常なミトコンドリア輸送は、アルツハイマー病、パーキンソン病、ハンチントン病、筋委縮性側鎖硬化症などの脳疾患に関係することが知られている[37]。また、HDAC6は軸索の末端領域に局在することで軸索の伸長にも重要な役割を果たしており、TSAなどのHDAC阻害剤によるtubulinの脱アセチル化阻害は軸索の伸長を阻害することが報告されている[38]。
しかし逆に、HDAC6はマウスの情動行動に関与し、HDAC6の欠損やHDAC6阻害剤が運動亢進、不安の軽減などの抗うつ様の行動を誘導することで、うつ病等の治療によい影響を与えることも明らかになっている。HDAC6は、気分障害等の精神疾患に深く関与するセロトニン神経細胞の豊富な中脳の縫線核、青斑核、黒質の神経細胞に多く存在している。しかし、HDAC6の欠損マウスにおいて、セロトニンの量、及び既存の抗うつ薬である選択的セロトニン再取り込み阻害薬/セロトニン・ノルアドレナリン再取り込み阻害薬(Selective Serotonin Reuptake Inhibitors/ Serotonin & Norepinephrine Reuptake Inhibitors:SSRI/SNRI)に対する応答性には変化がなく、SSRI/SNRIの急性投与による大幅なうつ様行動の改善はHDAC6の欠損マウスと野生型マウスで同程度である。このことからHDAC6阻害剤による抗うつ作用メカニズムは既存の抗うつ薬とは異なると考えられており、HDAC6の阻害はうつ病の病態解明や新規抗うつ薬の開発につながる可能性が示唆されている[39]。
上記の例に加えて、タンパク質のアセチル化と脳機能に関しては多くの報告がなされている。これらのことから、ヒストンのアセチル化や非ヒストンタンパク質のアセチル化は脳の発達や機能にさまざまな役割を果たしており、脳において重要な機構であるといえる。
参考文献
- ↑
Spange, S., Wagner, T., Heinzel, T., & Krämer, O.H. (2009).
Acetylation of non-histone proteins modulates cellular signalling at multiple levels. The international journal of biochemistry & cell biology, 41(1), 185-98. [PubMed:18804549] [WorldCat] [DOI]
(執筆者:村尾直哉、中島欽一 担当編集委員:村上富士夫)