「塩素チャネル」の版間の差分
細 →種類 |
細編集の要約なし |
||
| (3人の利用者による、間の93版が非表示) | |||
| 1行目: | 1行目: | ||
塩素チャネル | |||
英語名: chloride | 英語名: chloride channel、 同義語/関連語: アニオンチャネル、塩素イオンチャネル、クロライドイオンチャネル、Cl<sup>-</sup>チャネル | ||
塩素チャネルとは、細胞膜に組み込まれたイオンチャネルの一種である。塩素チャネルは主に塩化物イオン(Cl<sup>-</sup>)を受動的に透過させる。塩素チャネルは、多くの小さなアニオン(Br<sup>-</sup>, I<sup>-</sup>, NO<sub>3</sub><sup>-</sup>、HCO<sub>3</sub><sup>-</sup>、SCN-)にも透過性を示し、アニオンチャネルとも呼ばれる。細胞膜の電位・細胞容量・細胞内カルシウムイオン濃度の変化やcAMP依存性のリン酸化反応に応答して開口する塩素チャネルがある。特異的な阻害薬がほとんど無いため、他のイオンチャネルに比べてチャネルの研究が遅れている。その役割は、膜電位や細胞容積の調節などの細胞の基本機能の調節に広く関与する。神経系において最もよく知られた塩素チャネルは、神経細胞の興奮・抑制調節に関与するリガンド作動性塩素チャネル(GABA<sub>A</sub>受容体、GABA<sub>C</sub>受容体、グリシン受容体)であるが、このチャネルについては他項目(グリシン受容体、GABA受容体)を参照されたい。 | |||
目次 | |||
(以下の目次は見出しが有る場合、自動的に作成されます) | |||
= <br>種類 = | |||
哺乳類の神経系にある塩素チャネルは機能的に以下の5つに大別される。 | |||
== | == 電位感受性塩素チャネル(voltage-sensitive chloride channels) == | ||
細胞膜の電位変化に伴い開口する塩素チャネルである。ClCチャネルが属する。ClC-1, -2, -Ka, Kbは形質膜に分布して実際に電位感受性塩素チャネルとして機能するが、細胞内小胞膜に存在するClC-3, -4, -5, -6, -7は、チャネルというよりは、むしろCl<sup>-</sup>/H<sup>+</sup>-交換輸送体として機能する。 | |||
{| border="1" cellspacing="1" cellpadding="1" | == カルシウム依存性塩素チャネル(calcium-activated chloride channels) == | ||
細胞内カルシウムイオン濃度の上昇によって活性化される塩素チャネルである。細胞内カルシウムイオン濃度の上昇や脱分極刺激によりチャネルの開口確率が亢進する。 代表的なカルシウム依存性塩素チャネルとしてCLCAチャネルが知られる。bestrophinファミリーやanoctamin/TMEM16ファミリーの一部、tweetyファミリーもカルシウム依存性塩素チャネルに属する。 | |||
== CFTR(Cystic fibrosis transmembrane conductance regulator) == | |||
CFTRは構造上ABC(ATP-binding cassette)トランスポーター・スーパーファミリーに属するが、トランスポーターとしては機能せずcAMP依存性のCl<sup>-</sup>チャネルとして働く。 | |||
== 容量感受性塩素チャネル (volume-sensitive chloride channels) == | |||
細胞容積の変化に伴い開口する塩素チャネルである。細胞容積調節の際、細胞膨張後の調節性容積減少(regulatory volume decrease)時に開口するチャネルであり、電気生理学的な特徴から容積感受性外向整流性(volume-sensitive outwardly rectifying, VSOR) 塩素チャネルと呼ばれるが、分子実体は明らかになっていない。ClCチャネルの一部が、このチャネルに属すると考えられてきたが、否定的な見解が多い。 | |||
== リガンド作動性塩素チャネル == | |||
他項目(グリシン受容体、GABA受容体)を参照 | |||
= <br>構造 = | |||
== 電位依存性塩素チャネル(ClCチャネル) == | |||
ClCチャネルをコードする遺伝子は、Jentschらによりシビレエイ(学名 ''Torpedo marmorata'')の発電器官からクローニングされ、Clc-0と命名された(Jentsch et al, 1990, Nature<ref><pubmed>2174129</pubmed></ref>)。現在ほ乳類では9種類の遺伝子(ヒト:''CLCN1, CLCN2, CLCN3, CLCN4, CLCN5, CLCN6, CLCN7, CLCNKA, CLCNKB'')が同定されている。 | |||
[[Image:ClC.JPG|right|623x182px|図1. ClCチャネル]] | |||
X線結晶構造解析から同定された全てのClCチャネルの基本構造(右図)は共通し、18のセグメントで構成された複雑なトポロジーを持つ。ClCチャネルは、1つのポアをもつサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するDouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、他方のポアの開閉状態に関わらず独立して開閉する。一方で2つのポアは同時にも機能しうる。真核生物のClCタンパク質のC末端には、タンパク質-タンパク質相互作用やチャネルの活性に重要な役割を持つ2つのcystathionine-&beta-synthase (CBS) ドメインが存在する。 | |||
== カルシウム依存性塩素チャネル == | |||
[[Image:CaCC.JPG|right|245x249px|図2. カルシウム依存性塩素チャネルの一つAno1 (TMEM16A)チャネルの構造]] | |||
=== CLCAチャネル === | |||
ヒトでは4種類のCLCAチャネルをコードする遺伝子 (''CLCA1, CLCA2, CLCA3, CLCA4'')が同定されている。この遺伝子ファミリーのメンバーは、染色体1p31-p32の同じ領域にマップされ、サイズ、遺伝子配列、予想される構造に相同性が高い。 | |||
=== bestrophinファミリー === | |||
ヒトでは4種類のbestrophinチャネルをコードする遺伝子 (''BEST1, BEST2, BEST3, BEST4'')が同定されている。C末端側に酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるカルシウム結合部位がある。ヒトBest1はカルシウムイオン結合後にN末とC末領域の相互作用が起こり活性化する。 | |||
=== anoctamin/TMEM16ファミリー === | |||
anoctamin/TMEM16ファミリーは近年カルシウム依存性塩素チャネルの候補として同定された塩素チャネルである。Ano1(TMEM16A)およびAno2 (TMEM16B)はカルシウム依存的に塩化物イオンを透過させる性質を持つことが証明されている。 | |||
=== tweetyファミリー === | |||
ショウジョウバエ(Drosophila)の''flightless''遺伝子座に存在するTweety遺伝子のヒトホモログ遺伝子として同定されたtweetyファミリー(ヒト:''TTYH1, TTYH2, TTYH3'') もカルシウム依存的に塩化物イオンを透過させる性質を持つ。 | |||
== CFTR == | |||
[[Image:CFTR.JPG|right|623x183px|図3. CFTRチャネル]] CFTRは12回膜貫通型糖タンパク質であり、6 個の疎水性膜貫通構造と 2 個の ATP 結合部(nucleotide-binding domain, NBD)および PKA によるリン酸化を受ける調節(R)ドメインの繰り返しモチーフから構成される。Rドメインがリン酸化を受けた状態でNBDの二量体化に伴ってチャネルゲートが開き、NBD二量体の解離によってチャネルゲートが閉じると考えられている。 | |||
= <br>機能 = | |||
神経系において塩素チャネルは、細胞内外の塩化物イオンを電気化学的な勾配に沿って透過させることにより、細胞容積調節、静止膜電位の形成や安定化、細胞の興奮性を調節する。容積依存性塩素チャネルは、神経細胞やグリア細胞からATPやグルタミン酸、アスパラギン酸、タウリンなどの低分子物質を放出するメカニズムに関与する。塩素チャネルは、これらの調節を介して細胞周期・細胞移動・形態形成(突起伸展など)・細胞死の調節など多様な細胞機能に寄与する。 | |||
== 電位依存性塩素チャネル(ClCチャネル) == | |||
これまでに神経系で発現しチャネルとして機能することが報告されているClCチャネルの生理機能とその役割について紹介する。 | |||
=== ClC-2 === | |||
ClC-2は、細胞膨張時や膜電位の過分極時、細胞外pHの減少によって活性化される内向き整流性塩素チャネルである。神経細胞の興奮性を調節することが示唆されている。ヒトCLCN-2の遺伝子異常は特発性全般性てんかんの原因となることが報告されている。 | |||
=== ClC-3 === | |||
外向き整流性塩素チャネルであるClC-3は一般的にはCl<sup>-</sup>/H<sup>+</sup>-交換輸送体として機能して(小胞内にH<sup>+</sup>を蓄積して)、神経伝達物質の放出に関与することが知られる。細胞の種類によっては形質膜で塩素チャネルとして働き、神経細胞の活動を制御する可能性を示唆する報告もある(報告例:海馬神経細胞, Wang et al., 2006, Neuron)。 | |||
== カルシウム依存性塩素チャネル == | |||
嗅球の感覚神経の嗅毛ではカルシウム依存性塩素チャネルが、におい物質により惹起される脱分極性の電流の発生に関与することが知られる。このGタンパク質共役型受容体の刺激に伴って活性化される塩素チャネルとしてAno1とAno2が重要な役割を担う(Stephan et al, 2009, PNAS)。 近年小脳バーグマングリアからGABAを放出して小脳顆粒細胞のtonic GABA作用を生じさせる分子もbestrophinファミリーに属する塩素チャネルであることが報告された (Lee et al, 2010, Science<ref><pubmed>20929730</pubmed></ref>)。 | |||
== CFTR == | |||
脳の神経系においてCFTRの生理的な機能についてはよく分かっていない。 | |||
== 容量感受性塩素チャネル == | |||
容積感受性外向整流性(VSOR) 塩素チャネルは、細胞膨張後の調節性容積減少(regulatory volume decrease)に関与する。この塩素チャネルは外向き整流性でI<sup>-</sup>の方がCl<sup>-</sup>より高いイオン透過選択性を示すが、この特性を持つ塩素チャネルの分子実体はまだ同定されていない。 | |||
= 発現 = | |||
基本的に塩素チャネルは齧歯類の脳でユビキタスに発現する。ClC-2は大脳皮質、海馬、嗅球や小脳における大型ニューロンに強く発現する(Clayton et al, 1998)。ClC-3は海馬、小脳、嗅球に強く発現する(Kawasaki et al, 1994)。マウスClCaファミリーは嗅球に特徴的な強い発現がみられる(Piirsoo et al, 2009) 。 | |||
{| border="1" cellspacing="1" cellpadding="1" width="1000" | |||
|- | |- | ||
| | |||
| 遮断薬(阻害剤) | |||
| シングルチャネル<br>コンダクタンス (pS) | |||
| イオン選択性<br> | |||
| 関連するヒトの疾患 | |||
|- | |- | ||
| | | CFTR | ||
| | | CFTR(inh)-172<br>グリベンクラミド<br>ロニダミン<br>DPC | ||
| | | 5-8 | ||
| Br- > Cl- > I- | |||
| | | 嚢胞性線維症 | ||
|- | |- | ||
| | | CLCA | ||
| | | タルニフルメート<br>ジチオスレイトール<br>DIDS<br>ニフルミン酸<br>タモキシフェン | ||
| | | 1-10 | ||
| I- > Br- > Cl- | |||
| | | | ||
|- | |- | ||
| | | CLC | ||
| | | 9AC<br>CPP<br>クロロトキシン<br>ジフェニルホスフィン酸クロリド<br>DIDS<br>IAA-94<br>NPPB<br>ニフルミン酸<br>タモキシフェン<br> | ||
| | | 1-9 | ||
| Cl- > Br- > I- | |||
| | | CLCN1:筋強直症<br>CLCN2:若年性ミオクロニーてんかん<br>CLCNKB:バーター症候群<br>CLCN5:遺伝性腎疾患(Dent病、低リン血症性くる病、X染色体連鎖劣性腎結石症)<br>CLCN7:大理石骨病 | ||
|- | |- | ||
| | | VSOR塩素チャネル | ||
| DCPIB<br>DNDS<br>DIDS<br>NPPB<br>SITS<br>タモキシフェン | |||
| | |||
| I- > Cl- | |||
| | |||
| | |||
| | |||
|} | |} | ||
※ 注釈 9AC:9-アントラセンカルボン酸 (9-anthracene-carboxylic acid) CPP:3-(4-クロロフェノキシ)プロパン酸 (p-chlorophenoxy-propionic acid) DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid DIDS:4,4-ジイソチオシアナトスチルベン-2,2-ジスルホン酸, 二ナトリウム塩(4,4′-Diisothiocyanatostilbene-2,2′-disulfonic acid disodium salt hydrate) DNDS:4,4'-ジニトロスチルベン-2,2'-ジスルホン酸二ナトリウム(4,4'-dinitrostilbene-2,2'-disulfonate) NPPB:2-[(3-フェニルプロピル)アミノ]-5-ニトロ安息香 (Nitro-2-(3-phenylpropylamino)benzoic acid) SITS:4-アセチルアミノ-4'-イソチオシアナトスチルベン-2,2'-ジスルホン酸ジナトリウム(4-Acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid disodium salt hydrate) THIP:4,5,6,7-テトラヒドロイソオキサゾロ[5,4-c]ピリジン-3(2H)-オン•塩酸塩(4,5,6,7-Tetrahydroisoxazolo[5,4-c]pyridin-3-ol hydrochloride) TPMPA:(1,2,5,6-テトラヒドロピリジン-4-イル)メチルホスフィン酸((1,2,5,6-Tetrahydropyridin-4-yl)methylphosphinic acid) | |||
< | <br>参考文献 | ||
2012年11月8日 (木) 22:36時点における版
塩素チャネル
英語名: chloride channel、 同義語/関連語: アニオンチャネル、塩素イオンチャネル、クロライドイオンチャネル、Cl-チャネル
塩素チャネルとは、細胞膜に組み込まれたイオンチャネルの一種である。塩素チャネルは主に塩化物イオン(Cl-)を受動的に透過させる。塩素チャネルは、多くの小さなアニオン(Br-, I-, NO3-、HCO3-、SCN-)にも透過性を示し、アニオンチャネルとも呼ばれる。細胞膜の電位・細胞容量・細胞内カルシウムイオン濃度の変化やcAMP依存性のリン酸化反応に応答して開口する塩素チャネルがある。特異的な阻害薬がほとんど無いため、他のイオンチャネルに比べてチャネルの研究が遅れている。その役割は、膜電位や細胞容積の調節などの細胞の基本機能の調節に広く関与する。神経系において最もよく知られた塩素チャネルは、神経細胞の興奮・抑制調節に関与するリガンド作動性塩素チャネル(GABAA受容体、GABAC受容体、グリシン受容体)であるが、このチャネルについては他項目(グリシン受容体、GABA受容体)を参照されたい。
目次
(以下の目次は見出しが有る場合、自動的に作成されます)
種類
哺乳類の神経系にある塩素チャネルは機能的に以下の5つに大別される。
電位感受性塩素チャネル(voltage-sensitive chloride channels)
細胞膜の電位変化に伴い開口する塩素チャネルである。ClCチャネルが属する。ClC-1, -2, -Ka, Kbは形質膜に分布して実際に電位感受性塩素チャネルとして機能するが、細胞内小胞膜に存在するClC-3, -4, -5, -6, -7は、チャネルというよりは、むしろCl-/H+-交換輸送体として機能する。
カルシウム依存性塩素チャネル(calcium-activated chloride channels)
細胞内カルシウムイオン濃度の上昇によって活性化される塩素チャネルである。細胞内カルシウムイオン濃度の上昇や脱分極刺激によりチャネルの開口確率が亢進する。 代表的なカルシウム依存性塩素チャネルとしてCLCAチャネルが知られる。bestrophinファミリーやanoctamin/TMEM16ファミリーの一部、tweetyファミリーもカルシウム依存性塩素チャネルに属する。
CFTR(Cystic fibrosis transmembrane conductance regulator)
CFTRは構造上ABC(ATP-binding cassette)トランスポーター・スーパーファミリーに属するが、トランスポーターとしては機能せずcAMP依存性のCl-チャネルとして働く。
容量感受性塩素チャネル (volume-sensitive chloride channels)
細胞容積の変化に伴い開口する塩素チャネルである。細胞容積調節の際、細胞膨張後の調節性容積減少(regulatory volume decrease)時に開口するチャネルであり、電気生理学的な特徴から容積感受性外向整流性(volume-sensitive outwardly rectifying, VSOR) 塩素チャネルと呼ばれるが、分子実体は明らかになっていない。ClCチャネルの一部が、このチャネルに属すると考えられてきたが、否定的な見解が多い。
リガンド作動性塩素チャネル
他項目(グリシン受容体、GABA受容体)を参照
構造
電位依存性塩素チャネル(ClCチャネル)
ClCチャネルをコードする遺伝子は、Jentschらによりシビレエイ(学名 Torpedo marmorata)の発電器官からクローニングされ、Clc-0と命名された(Jentsch et al, 1990, Nature<ref><pubmed>2174129</pubmed></ref>)。現在ほ乳類では9種類の遺伝子(ヒト:CLCN1, CLCN2, CLCN3, CLCN4, CLCN5, CLCN6, CLCN7, CLCNKA, CLCNKB)が同定されている。
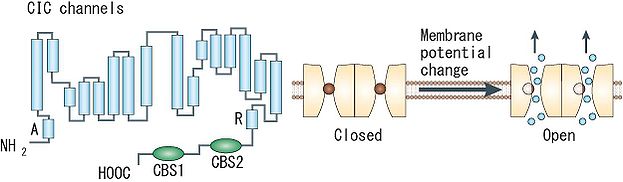
X線結晶構造解析から同定された全てのClCチャネルの基本構造(右図)は共通し、18のセグメントで構成された複雑なトポロジーを持つ。ClCチャネルは、1つのポアをもつサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するDouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、他方のポアの開閉状態に関わらず独立して開閉する。一方で2つのポアは同時にも機能しうる。真核生物のClCタンパク質のC末端には、タンパク質-タンパク質相互作用やチャネルの活性に重要な役割を持つ2つのcystathionine-&beta-synthase (CBS) ドメインが存在する。
カルシウム依存性塩素チャネル
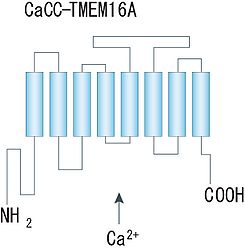
CLCAチャネル
ヒトでは4種類のCLCAチャネルをコードする遺伝子 (CLCA1, CLCA2, CLCA3, CLCA4)が同定されている。この遺伝子ファミリーのメンバーは、染色体1p31-p32の同じ領域にマップされ、サイズ、遺伝子配列、予想される構造に相同性が高い。
bestrophinファミリー
ヒトでは4種類のbestrophinチャネルをコードする遺伝子 (BEST1, BEST2, BEST3, BEST4)が同定されている。C末端側に酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるカルシウム結合部位がある。ヒトBest1はカルシウムイオン結合後にN末とC末領域の相互作用が起こり活性化する。
anoctamin/TMEM16ファミリー
anoctamin/TMEM16ファミリーは近年カルシウム依存性塩素チャネルの候補として同定された塩素チャネルである。Ano1(TMEM16A)およびAno2 (TMEM16B)はカルシウム依存的に塩化物イオンを透過させる性質を持つことが証明されている。
tweetyファミリー
ショウジョウバエ(Drosophila)のflightless遺伝子座に存在するTweety遺伝子のヒトホモログ遺伝子として同定されたtweetyファミリー(ヒト:TTYH1, TTYH2, TTYH3) もカルシウム依存的に塩化物イオンを透過させる性質を持つ。
CFTR
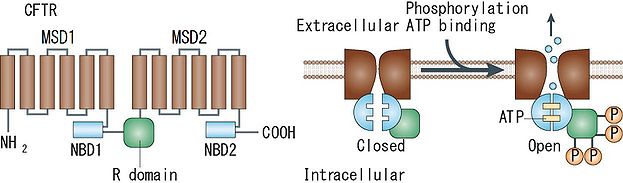
CFTRは12回膜貫通型糖タンパク質であり、6 個の疎水性膜貫通構造と 2 個の ATP 結合部(nucleotide-binding domain, NBD)および PKA によるリン酸化を受ける調節(R)ドメインの繰り返しモチーフから構成される。Rドメインがリン酸化を受けた状態でNBDの二量体化に伴ってチャネルゲートが開き、NBD二量体の解離によってチャネルゲートが閉じると考えられている。
機能
神経系において塩素チャネルは、細胞内外の塩化物イオンを電気化学的な勾配に沿って透過させることにより、細胞容積調節、静止膜電位の形成や安定化、細胞の興奮性を調節する。容積依存性塩素チャネルは、神経細胞やグリア細胞からATPやグルタミン酸、アスパラギン酸、タウリンなどの低分子物質を放出するメカニズムに関与する。塩素チャネルは、これらの調節を介して細胞周期・細胞移動・形態形成(突起伸展など)・細胞死の調節など多様な細胞機能に寄与する。
電位依存性塩素チャネル(ClCチャネル)
これまでに神経系で発現しチャネルとして機能することが報告されているClCチャネルの生理機能とその役割について紹介する。
ClC-2
ClC-2は、細胞膨張時や膜電位の過分極時、細胞外pHの減少によって活性化される内向き整流性塩素チャネルである。神経細胞の興奮性を調節することが示唆されている。ヒトCLCN-2の遺伝子異常は特発性全般性てんかんの原因となることが報告されている。
ClC-3
外向き整流性塩素チャネルであるClC-3は一般的にはCl-/H+-交換輸送体として機能して(小胞内にH+を蓄積して)、神経伝達物質の放出に関与することが知られる。細胞の種類によっては形質膜で塩素チャネルとして働き、神経細胞の活動を制御する可能性を示唆する報告もある(報告例:海馬神経細胞, Wang et al., 2006, Neuron)。
カルシウム依存性塩素チャネル
嗅球の感覚神経の嗅毛ではカルシウム依存性塩素チャネルが、におい物質により惹起される脱分極性の電流の発生に関与することが知られる。このGタンパク質共役型受容体の刺激に伴って活性化される塩素チャネルとしてAno1とAno2が重要な役割を担う(Stephan et al, 2009, PNAS)。 近年小脳バーグマングリアからGABAを放出して小脳顆粒細胞のtonic GABA作用を生じさせる分子もbestrophinファミリーに属する塩素チャネルであることが報告された (Lee et al, 2010, Science<ref><pubmed>20929730</pubmed></ref>)。
CFTR
脳の神経系においてCFTRの生理的な機能についてはよく分かっていない。
容量感受性塩素チャネル
容積感受性外向整流性(VSOR) 塩素チャネルは、細胞膨張後の調節性容積減少(regulatory volume decrease)に関与する。この塩素チャネルは外向き整流性でI-の方がCl-より高いイオン透過選択性を示すが、この特性を持つ塩素チャネルの分子実体はまだ同定されていない。
発現
基本的に塩素チャネルは齧歯類の脳でユビキタスに発現する。ClC-2は大脳皮質、海馬、嗅球や小脳における大型ニューロンに強く発現する(Clayton et al, 1998)。ClC-3は海馬、小脳、嗅球に強く発現する(Kawasaki et al, 1994)。マウスClCaファミリーは嗅球に特徴的な強い発現がみられる(Piirsoo et al, 2009) 。
| 遮断薬(阻害剤) | シングルチャネル コンダクタンス (pS) |
イオン選択性 |
関連するヒトの疾患 | |
| CFTR | CFTR(inh)-172 グリベンクラミド ロニダミン DPC |
5-8 | Br- > Cl- > I- | 嚢胞性線維症 |
| CLCA | タルニフルメート ジチオスレイトール DIDS ニフルミン酸 タモキシフェン |
1-10 | I- > Br- > Cl- | |
| CLC | 9AC CPP クロロトキシン ジフェニルホスフィン酸クロリド DIDS IAA-94 NPPB ニフルミン酸 タモキシフェン |
1-9 | Cl- > Br- > I- | CLCN1:筋強直症 CLCN2:若年性ミオクロニーてんかん CLCNKB:バーター症候群 CLCN5:遺伝性腎疾患(Dent病、低リン血症性くる病、X染色体連鎖劣性腎結石症) CLCN7:大理石骨病 |
| VSOR塩素チャネル | DCPIB DNDS DIDS NPPB SITS タモキシフェン |
I- > Cl- |
※ 注釈 9AC:9-アントラセンカルボン酸 (9-anthracene-carboxylic acid) CPP:3-(4-クロロフェノキシ)プロパン酸 (p-chlorophenoxy-propionic acid) DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid DIDS:4,4-ジイソチオシアナトスチルベン-2,2-ジスルホン酸, 二ナトリウム塩(4,4′-Diisothiocyanatostilbene-2,2′-disulfonic acid disodium salt hydrate) DNDS:4,4'-ジニトロスチルベン-2,2'-ジスルホン酸二ナトリウム(4,4'-dinitrostilbene-2,2'-disulfonate) NPPB:2-[(3-フェニルプロピル)アミノ]-5-ニトロ安息香 (Nitro-2-(3-phenylpropylamino)benzoic acid) SITS:4-アセチルアミノ-4'-イソチオシアナトスチルベン-2,2'-ジスルホン酸ジナトリウム(4-Acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid disodium salt hydrate) THIP:4,5,6,7-テトラヒドロイソオキサゾロ[5,4-c]ピリジン-3(2H)-オン•塩酸塩(4,5,6,7-Tetrahydroisoxazolo[5,4-c]pyridin-3-ol hydrochloride) TPMPA:(1,2,5,6-テトラヒドロピリジン-4-イル)メチルホスフィン酸((1,2,5,6-Tetrahydropyridin-4-yl)methylphosphinic acid)
参考文献