「有髄線維」の版間の差分
細 →脱髄性疾患 |
細編集の要約なし |
||
| (4人の利用者による、間の39版が非表示) | |||
| 1行目: | 1行目: | ||
英語名: myelinated nerve, medullated nerve | |||
[[髄鞘]]([[ミエリン]])を有する[[軸索]]のことを有髄線維あるいは有髄神経線維という。髄鞘は[[中枢神経系]]では[[稀突起膠細胞]](あるいは[[オリゴデンドロサイト]][oligodendrocyte])、[[末梢神経系]]では[[シュワン細胞]](Schwann cell)という[[グリア細胞]]が形成する。軸索は樹状突起と比べると細く平滑な細胞突起である。[[ミエリン鞘]]は等間隔にある[[ランヴィエ絞輪]](node of Ranvier)によって区切られており、軸索中の[[電位依存性ナトリウムチャネル]]はランヴィエ絞輪に集積している。 | |||
髄鞘は[[リン脂質]]に富んだ[[wikipedia:ja:タンパク質|タンパク質]]で層構造を形成しているため、非常に良い[[絶縁体]]の役割を果たす。さらに、活動電位を発生させる電位依存性ナトリウムチャネルがランヴィエ絞輪に集積しているために、活動電位を軸索に沿って[[跳躍伝導]]させることができる。また、単に絶縁体としての働きだけではなく、軸索との間に物質交換を行うことによって神経軸索の栄養・保護などさまざまな神経機能を調節している。主要構成タンパク質は[[ミエリン塩基性タンパク質]](myelin basic protein; MBP)、[[ミエリンプロテオリピドプロテイン]](myelin proteolipid protein; PLP)であり、その他に[[ミエリン関連糖タンパク質]](myelin associated glycoprotein; MAG)、[[ミエリンオリゴデンドロサイト糖タンパク質]](myelin oligodendrocyte glycoprotein; MOG)、[[2',3'-環状ヌクレオチドホスホジエステラーゼ]](2',3'-cyclic-nucleotide phosphodiesterase; CNPase)などを含む。 | |||
髄鞘は[[リン脂質]]に富んだ[[wikipedia:ja:タンパク質|タンパク質]]で層構造を形成しているため、非常に良い[[絶縁体]] | |||
== 神経の分類と髄鞘の有無 == | == 神経の分類と髄鞘の有無 == | ||
大脳における投射神経の軸索はほとんどが有髄線維であり軸索は長く太いものが多い。末梢神経の神経線維は髄鞘の有無、直径、伝導速度等で分類される。有髄線維と無髄線維では有髄線維が、同じ種類の線維間では直径の大きい方が伝導速度が速い。前者は跳躍伝導により、後者の[[電気緊張電位]]の広がりを利用した伝導よりも速い伝導速度を得ている。一般に[[wikipedia:ja:骨格筋|骨格筋]]運動と付随する[[固有感覚]]、部位のはっきりした[[皮膚感覚]]は伝導速度の速い線維を、[[交感神経]]活動や[[鈍痛]]などは伝導速度の遅い線維を利用して伝えられる。 | |||
[[ファイル:伝導速度.png|400px|thumb|right|表1.神経線維の分類]] | |||
[[ファイル:分類改.png|400px|thumb|right|表2.神経線維の受容器の分類とその様式]] | |||
| | |||
| | |||
| | |||
| | |||
| | |||
'''表1.神経線維の分類と髄鞘の有無''' | |||
'''表2.神経線維の受容器の分類とその様式''' | |||
<ref>Principles of neural science fifth edition 475-480 Eric R. Kandel et al.</ref> | |||
== | == 有髄神経の構造 == | ||
[[Image:Node of Ranvier.png|thumb|350px|<b> | [[Image:Node of Ranvier.png|thumb|350px|<b>図1.有髄神経の構造とサブドメイン</b>]] | ||
髄鞘は細胞形質膜の多層構造体であるため、細胞形質膜や細胞内小胞膜などの他の多くの細胞と比べてタンパク質成分が少なく、脂質が約8割程度を占め、残りがタンパク質である。髄鞘を構成する主な脂質は糖脂質[[wikipedia:ja:ガラクトセレブロシド|ガラクトセレブロシド]](Galactocerebroside)とその硫酸化誘導体[[wikipedia:ja:スルファチド|スルファチド]](Sulfatide)である<ref><pubmed>9530920</pubmed></ref>。神経軸索の髄鞘と髄鞘の隙間は特別な名称がつけられており、非常に特異な構造をしている。[[ノード]](node)に電位作動型ナトリウムチャネル[[ナトリウムチャネル#.CE.B1.E3.82.B5.E3.83.96.E3.83.A6.E3.83.8B.E3.83.83.E3.83.88|Nav1.2]]や[[ナトリウムチャネル#.CE.B1.E3.82.B5.E3.83.96.E3.83.A6.E3.83.8B.E3.83.83.E3.83.88|Nav1.6]]、[[アンキリン]]G(Ankyrin G)などが、[[パラノード]](paranode)には[[Caspr]]など、[[ジャクスタパラノード]](jaxtaparanode)には[[カリウムチャネル#遅延整流性カリウム電流|Kv1.2]]などの[[カリウムチャネル]]などが分布する<ref><pubmed>18803321</pubmed></ref>。発達とともにこれらのチャネルやそのアイソフォームの分布が変化する<ref><pubmed>9880595</pubmed></ref>。また、病態時にもチャネルの分布は変化する<ref><pubmed>12898531</pubmed></ref> <ref><pubmed>10739574</pubmed></ref>。 | |||
中枢神経系(オリゴデンドロサイト)と末梢神経系(シュワン細胞)で髄鞘の巻き方が異なる。オリゴデンドロサイトは離れた複数の軸索個々に髄鞘を形成するのに対し、シュワン細胞はいくつかの軸索を抱え込むようにして包んだ後、1本の軸索を選別して、その周りに髄鞘を形成する<ref><pubmed>22192173</pubmed></ref>。髄鞘を構成するタンパク質も異なる。中枢神経系では髄鞘の主要構成タンパク質はPLP,MBPである。一方、末梢神経系では[[P0]](ピーゼロ)と[[P2]] | 中枢神経系(オリゴデンドロサイト)と末梢神経系(シュワン細胞)で髄鞘の巻き方が異なる。オリゴデンドロサイトは離れた複数の軸索個々に髄鞘を形成するのに対し、シュワン細胞はいくつかの軸索を抱え込むようにして包んだ後、1本の軸索を選別して、その周りに髄鞘を形成する<ref><pubmed>22192173</pubmed></ref>。髄鞘を構成するタンパク質も異なる。中枢神経系では髄鞘の主要構成タンパク質はPLP,MBPである。一方、末梢神経系では[[P0]](ピーゼロ)と[[P2]]が主要構成タンパク質である。その他のタンパク質は中枢神経系ではCNPase、MOG、MAGなどがあり、末梢神経系では[[PMP22]]、MAG、MOGなどが発現している。 | ||
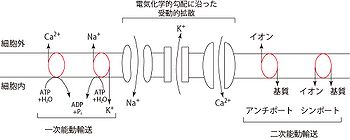
[[Image:受動輸送と能動輸送(改).jpg|thumb|350px|'''図2.興奮伝達(活動電位の伝達) | [[Image:受動輸送と能動輸送(改).jpg|thumb|350px|'''図2.興奮伝達(活動電位の伝達)''']] | ||
== 跳躍伝導== | == 跳躍伝導== | ||
[[Image:跳躍伝導(有髄).png|thumb|350px|'''図3.跳躍伝導'''<br>髄鞘が絶縁体の役割を果たし、活動電位の伝達が早くなる。]] | [[Image:跳躍伝導(有髄).png|thumb|350px|'''図3.跳躍伝導'''<br>髄鞘が絶縁体の役割を果たし、活動電位の伝達が早くなる。]] | ||
それぞれのイオンが受動的に流失し、電気化学的平衡が失われた場合、それを補償する能動的輸送が必要となる。この能動的輸送にはエネルギーが必要とされる。一般的には一次と二次能動輸送という二種類の重要な能動輸送がある(図2)。 | |||
神経軸索の起始部で髄鞘に覆われていない部分は[[初節]](axon initial segment; AISと略される)とよばれ、電位依存性ナトリウムチャネルが高密度に集積しており、通常[[活動電位]]が最初に発火する<ref><pubmed>20631711</pubmed></ref>。AISで発現するチャネルは発達に伴い、あるいは病態時にその発現や分布が変化する<ref><pubmed>22103418</pubmed></ref>。AIS以降の軸索では、ほぼ等間隔にランヴィエ絞輪が現れる。AISやランヴィエ絞輪で発生した活動電位は、受動的伝播(電気緊張電位)によって次のランヴィエ絞輪に伝わる。髄鞘の絶縁性が高いために電位変化の減衰度合いは小さく押さえられる。そのため無髄軸索よりも離れた距離でも臨界脱分極を越える。またランヴィエ絞輪では電位依存性ナトリウムチャネルが集積しているため、活動電位が発生しやすい。この2つの効果によって跳躍伝導(saltatory conduction)が起こる。跳躍伝導は、活動電位の伝導速度を速く保つとともに、活動電位発生がランヴィエ絞輪に限局されるために、代謝エネルギーの節約にもなる。 | 神経軸索の起始部で髄鞘に覆われていない部分は[[初節]](axon initial segment; AISと略される)とよばれ、電位依存性ナトリウムチャネルが高密度に集積しており、通常[[活動電位]]が最初に発火する<ref><pubmed>20631711</pubmed></ref>。AISで発現するチャネルは発達に伴い、あるいは病態時にその発現や分布が変化する<ref><pubmed>22103418</pubmed></ref>。AIS以降の軸索では、ほぼ等間隔にランヴィエ絞輪が現れる。AISやランヴィエ絞輪で発生した活動電位は、受動的伝播(電気緊張電位)によって次のランヴィエ絞輪に伝わる。髄鞘の絶縁性が高いために電位変化の減衰度合いは小さく押さえられる。そのため無髄軸索よりも離れた距離でも臨界脱分極を越える。またランヴィエ絞輪では電位依存性ナトリウムチャネルが集積しているため、活動電位が発生しやすい。この2つの効果によって跳躍伝導(saltatory conduction)が起こる。跳躍伝導は、活動電位の伝導速度を速く保つとともに、活動電位発生がランヴィエ絞輪に限局されるために、代謝エネルギーの節約にもなる。 | ||
== 脱髄性疾患== | == 脱髄性疾患== | ||
正常な発生における髄鞘形成がなされたのち、神経軸索から髄鞘が脱落することを脱髄という<ref><pubmed>18558866</pubmed></ref>。[[脱髄性疾患]](demyelinating disease)では、髄鞘の消失により神経伝導速度が遅くなり、さまざまな神経症状が引き起こされる。脱髄が起こる場所により症状はさまざまである。[[ | 正常な発生における髄鞘形成がなされたのち、神経軸索から髄鞘が脱落することを脱髄という<ref><pubmed>18558866</pubmed></ref>。[[脱髄性疾患]](demyelinating disease)では、髄鞘の消失により神経伝導速度が遅くなり、さまざまな神経症状が引き起こされる。脱髄が起こる場所により症状はさまざまである。[[wikipedia:ja:運動麻痺|運動麻痺]]、[[wikipedia:ja:感覚麻痺|感覚麻痺]]、[[wikipedia:ja:視力障害|視力障害]]などが起こる。 | ||
中枢性脱髄疾患の中では[[多発性硬化症]]( | 中枢性脱髄疾患の中では[[多発性硬化症]](Multiple sclerosis;MS)が最も多くみられる。日本での有病率は2006年では10万人あたり8 - 9人程度と推定されている。若年成人での神経障害の主な原因である。約80-90%のMS患者が二十代後半で再発-[[寛解]]型になり、寛解期には共通して、ある一定程度神経障害が一過的に回復する。発病から数年後、多くの患者が実質上機能回復はなくなり第二ステージに移り、病状は進行型になる。そして、あとの残り10-20%の患者は初めから寛解を経験することのない進行型である<ref name=ref10><pubmed>22189514</pubmed></ref>。[[カルシウムチャネル]]ブロッカーである[[Fampridine]](Fampyra)はMS治療において初めて機能回復に成功した経口投与薬であるが、転倒する、背中が痛む、[[めまい]]がする、[[不眠]]、[[疲労感]]、[[悪心]]、[[平衡障害]]が副作用を伴うことが知られている<ref><pubmed>7354839</pubmed></ref> <ref><pubmed>6631441</pubmed></ref> <ref><pubmed>3001584</pubmed></ref> <ref><pubmed>2435223</pubmed></ref>。[[wikipedia:ja:インターフェロン|インターフェロン]]β(Interferon β)と[[wikipedia:ja:グラチマラー酢酸塩|グラチマラー酢酸塩]](Glatiramer acetate)が現在もっともよく用いられている。これらの薬剤は根本治療法であるが、おもに再発-寛解型の患者に用いられている<ref name=ref10 />。 | ||
また、末梢神経系では[[ギラン・バレー症候群]]( | また、末梢神経系では[[ギラン・バレー症候群]](Guillain-Barré syndrome)や[[慢性炎症脱髄性疾患多発神経炎]](Chronic inflammatory demyelinating polyneuropathy; CIDP)、などがある。また、最近の研究により[[統合失調症]]との関連が示唆されている<ref><pubmed>18538868</pubmed></ref> <ref><pubmed>20216548</pubmed></ref>。髄鞘形成が不完全な[[髄鞘形成不全疾患]](dysmyelinating disease)とは区別される。 | ||
{| width="583" cellspacing="1" cellpadding="1" border="1" | {| width="583" cellspacing="1" cellpadding="1" border="1" | ||
| 255行目: | 61行目: | ||
| [[橋中心髄鞘破壊症]] | | [[橋中心髄鞘破壊症]] | ||
|- | |- | ||
| [[ | | [[wikipedia:ja:ビタミンB12|ビタミンB12]]欠乏症 | ||
|- | |- | ||
| 血管性 | | 血管性 | ||
| 267行目: | 73行目: | ||
|} | |} | ||
''' | '''表2 代表的な脱髄性疾患''' | ||
大きく分けて中枢神経系と末梢神経系の疾患がある。(編集部コメント:箇条書きになっていたものを編集部で表に致しました。御確認下さい。病因によって分類出来ないでしょうか。) | |||
== 関連語 == | == 関連語 == | ||
| 285行目: | 91行目: | ||
<references /> | <references /> | ||
(執筆者:清水崇弘、池中一裕 担当編集委員:柚崎通介) | |||
2012年11月17日 (土) 19:04時点における版
英語名: myelinated nerve, medullated nerve
髄鞘(ミエリン)を有する軸索のことを有髄線維あるいは有髄神経線維という。髄鞘は中枢神経系では稀突起膠細胞(あるいはオリゴデンドロサイト[oligodendrocyte])、末梢神経系ではシュワン細胞(Schwann cell)というグリア細胞が形成する。軸索は樹状突起と比べると細く平滑な細胞突起である。ミエリン鞘は等間隔にあるランヴィエ絞輪(node of Ranvier)によって区切られており、軸索中の電位依存性ナトリウムチャネルはランヴィエ絞輪に集積している。
髄鞘はリン脂質に富んだタンパク質で層構造を形成しているため、非常に良い絶縁体の役割を果たす。さらに、活動電位を発生させる電位依存性ナトリウムチャネルがランヴィエ絞輪に集積しているために、活動電位を軸索に沿って跳躍伝導させることができる。また、単に絶縁体としての働きだけではなく、軸索との間に物質交換を行うことによって神経軸索の栄養・保護などさまざまな神経機能を調節している。主要構成タンパク質はミエリン塩基性タンパク質(myelin basic protein; MBP)、ミエリンプロテオリピドプロテイン(myelin proteolipid protein; PLP)であり、その他にミエリン関連糖タンパク質(myelin associated glycoprotein; MAG)、ミエリンオリゴデンドロサイト糖タンパク質(myelin oligodendrocyte glycoprotein; MOG)、2',3'-環状ヌクレオチドホスホジエステラーゼ(2',3'-cyclic-nucleotide phosphodiesterase; CNPase)などを含む。
神経の分類と髄鞘の有無
大脳における投射神経の軸索はほとんどが有髄線維であり軸索は長く太いものが多い。末梢神経の神経線維は髄鞘の有無、直径、伝導速度等で分類される。有髄線維と無髄線維では有髄線維が、同じ種類の線維間では直径の大きい方が伝導速度が速い。前者は跳躍伝導により、後者の電気緊張電位の広がりを利用した伝導よりも速い伝導速度を得ている。一般に骨格筋運動と付随する固有感覚、部位のはっきりした皮膚感覚は伝導速度の速い線維を、交感神経活動や鈍痛などは伝導速度の遅い線維を利用して伝えられる。
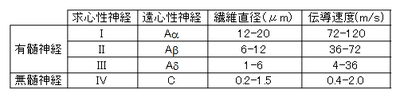
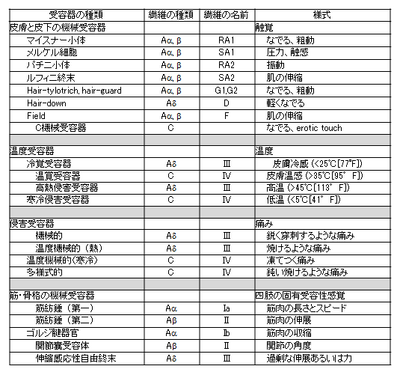
表1.神経線維の分類と髄鞘の有無 表2.神経線維の受容器の分類とその様式 [1]
有髄神経の構造
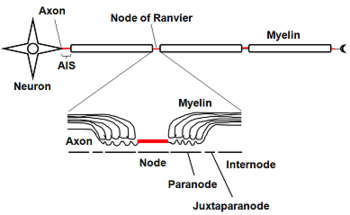
髄鞘は細胞形質膜の多層構造体であるため、細胞形質膜や細胞内小胞膜などの他の多くの細胞と比べてタンパク質成分が少なく、脂質が約8割程度を占め、残りがタンパク質である。髄鞘を構成する主な脂質は糖脂質ガラクトセレブロシド(Galactocerebroside)とその硫酸化誘導体スルファチド(Sulfatide)である[2]。神経軸索の髄鞘と髄鞘の隙間は特別な名称がつけられており、非常に特異な構造をしている。ノード(node)に電位作動型ナトリウムチャネルNav1.2やNav1.6、アンキリンG(Ankyrin G)などが、パラノード(paranode)にはCasprなど、ジャクスタパラノード(jaxtaparanode)にはKv1.2などのカリウムチャネルなどが分布する[3]。発達とともにこれらのチャネルやそのアイソフォームの分布が変化する[4]。また、病態時にもチャネルの分布は変化する[5] [6]。
中枢神経系(オリゴデンドロサイト)と末梢神経系(シュワン細胞)で髄鞘の巻き方が異なる。オリゴデンドロサイトは離れた複数の軸索個々に髄鞘を形成するのに対し、シュワン細胞はいくつかの軸索を抱え込むようにして包んだ後、1本の軸索を選別して、その周りに髄鞘を形成する[7]。髄鞘を構成するタンパク質も異なる。中枢神経系では髄鞘の主要構成タンパク質はPLP,MBPである。一方、末梢神経系ではP0(ピーゼロ)とP2が主要構成タンパク質である。その他のタンパク質は中枢神経系ではCNPase、MOG、MAGなどがあり、末梢神経系ではPMP22、MAG、MOGなどが発現している。
跳躍伝導
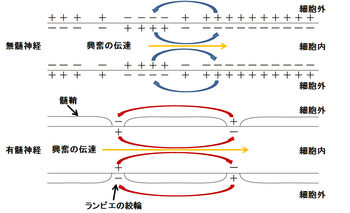
髄鞘が絶縁体の役割を果たし、活動電位の伝達が早くなる。
それぞれのイオンが受動的に流失し、電気化学的平衡が失われた場合、それを補償する能動的輸送が必要となる。この能動的輸送にはエネルギーが必要とされる。一般的には一次と二次能動輸送という二種類の重要な能動輸送がある(図2)。 神経軸索の起始部で髄鞘に覆われていない部分は初節(axon initial segment; AISと略される)とよばれ、電位依存性ナトリウムチャネルが高密度に集積しており、通常活動電位が最初に発火する[8]。AISで発現するチャネルは発達に伴い、あるいは病態時にその発現や分布が変化する[9]。AIS以降の軸索では、ほぼ等間隔にランヴィエ絞輪が現れる。AISやランヴィエ絞輪で発生した活動電位は、受動的伝播(電気緊張電位)によって次のランヴィエ絞輪に伝わる。髄鞘の絶縁性が高いために電位変化の減衰度合いは小さく押さえられる。そのため無髄軸索よりも離れた距離でも臨界脱分極を越える。またランヴィエ絞輪では電位依存性ナトリウムチャネルが集積しているため、活動電位が発生しやすい。この2つの効果によって跳躍伝導(saltatory conduction)が起こる。跳躍伝導は、活動電位の伝導速度を速く保つとともに、活動電位発生がランヴィエ絞輪に限局されるために、代謝エネルギーの節約にもなる。
脱髄性疾患
正常な発生における髄鞘形成がなされたのち、神経軸索から髄鞘が脱落することを脱髄という[10]。脱髄性疾患(demyelinating disease)では、髄鞘の消失により神経伝導速度が遅くなり、さまざまな神経症状が引き起こされる。脱髄が起こる場所により症状はさまざまである。運動麻痺、感覚麻痺、視力障害などが起こる。
中枢性脱髄疾患の中では多発性硬化症(Multiple sclerosis;MS)が最も多くみられる。日本での有病率は2006年では10万人あたり8 - 9人程度と推定されている。若年成人での神経障害の主な原因である。約80-90%のMS患者が二十代後半で再発-寛解型になり、寛解期には共通して、ある一定程度神経障害が一過的に回復する。発病から数年後、多くの患者が実質上機能回復はなくなり第二ステージに移り、病状は進行型になる。そして、あとの残り10-20%の患者は初めから寛解を経験することのない進行型である[11]。カルシウムチャネルブロッカーであるFampridine(Fampyra)はMS治療において初めて機能回復に成功した経口投与薬であるが、転倒する、背中が痛む、めまいがする、不眠、疲労感、悪心、平衡障害が副作用を伴うことが知られている[12] [13] [14] [15]。インターフェロンβ(Interferon β)とグラチマラー酢酸塩(Glatiramer acetate)が現在もっともよく用いられている。これらの薬剤は根本治療法であるが、おもに再発-寛解型の患者に用いられている[11]。
また、末梢神経系ではギラン・バレー症候群(Guillain-Barré syndrome)や慢性炎症脱髄性疾患多発神経炎(Chronic inflammatory demyelinating polyneuropathy; CIDP)、などがある。また、最近の研究により統合失調症との関連が示唆されている[16] [17]。髄鞘形成が不完全な髄鞘形成不全疾患(dysmyelinating disease)とは区別される。
| 中枢神経系 | 原発性 | 多発性硬化症 | 同心円硬化症(Balo病) |
| 急性散在性脳脊髄炎(ADEM) | |||
| 炎症性広汎性硬化症(Schilder病) | |||
| 感染性 | 亜急性硬化症全脳炎(SSPE) | ||
| 進行性多巣性白質脳症(PML) | |||
| 中毒・代謝性 | 低酸素脳症 | ||
| 橋中心髄鞘破壊症 | |||
| ビタミンB12欠乏症 | |||
| 血管性 | Binswanger病 | ||
| 末梢神経系 | ギラン・バレー症候群 | フィッシャー症候群 | |
| 慢性炎症性脱髄性多発神経炎 | |||
表2 代表的な脱髄性疾患
大きく分けて中枢神経系と末梢神経系の疾患がある。(編集部コメント:箇条書きになっていたものを編集部で表に致しました。御確認下さい。病因によって分類出来ないでしょうか。)
関連語
参考文献
- ↑ Principles of neural science fifth edition 475-480 Eric R. Kandel et al.
- ↑
Coetzee, T., Suzuki, K., & Popko, B. (1998).
New perspectives on the function of myelin galactolipids. Trends in neurosciences, 21(3), 126-30. [PubMed:9530920] [WorldCat] [DOI] - ↑
Salzer, J.L., Brophy, P.J., & Peles, E. (2008).
Molecular domains of myelinated axons in the peripheral nervous system. Glia, 56(14), 1532-40. [PubMed:18803321] [WorldCat] [DOI] - ↑
Vabnick, I., Trimmer, J.S., Schwarz, T.L., Levinson, S.R., Risal, D., & Shrager, P. (1999).
Dynamic potassium channel distributions during axonal development prevent aberrant firing patterns. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(2), 747-58. [PubMed:9880595] [PMC] [WorldCat] - ↑
Rasband, M.N., Kagawa, T., Park, E.W., Ikenaka, K., & Trimmer, J.S. (2003).
Dysregulation of axonal sodium channel isoforms after adult-onset chronic demyelination. Journal of neuroscience research, 73(4), 465-70. [PubMed:12898531] [WorldCat] [DOI] - ↑
Rasband, M.N., Trimmer, J.S., Peles, E., Levinson, S.R., & Shrager, P. (2000).
K+ channel distribution and clustering in developing and hypomyelinated axons of the optic nerve. Journal of neurocytology, 28(4-5), 319-31. [PubMed:10739574] [WorldCat] [DOI] - ↑
Pereira, J.A., Lebrun-Julien, F., & Suter, U. (2012).
Molecular mechanisms regulating myelination in the peripheral nervous system. Trends in neurosciences, 35(2), 123-34. [PubMed:22192173] [WorldCat] [DOI] - ↑
Rasband, M.N. (2010).
The axon initial segment and the maintenance of neuronal polarity. Nature reviews. Neuroscience, 11(8), 552-62. [PubMed:20631711] [WorldCat] [DOI] - ↑
Buffington, S.A., & Rasband, M.N. (2011).
The axon initial segment in nervous system disease and injury. The European journal of neuroscience, 34(10), 1609-19. [PubMed:22103418] [PMC] [WorldCat] [DOI] - ↑
Nave, K.A., & Trapp, B.D. (2008).
Axon-glial signaling and the glial support of axon function. Annual review of neuroscience, 31, 535-61. [PubMed:18558866] [WorldCat] [DOI] - ↑ 11.0 11.1
Nakahara, J., Maeda, M., Aiso, S., & Suzuki, N. (2012).
Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy. Clinical reviews in allergy & immunology, 42(1), 26-34. [PubMed:22189514] [WorldCat] [DOI] - ↑
Sherratt, R.M., Bostock, H., & Sears, T.A. (1980).
Effects of 4-aminopyridine on normal and demyelinated mammalian nerve fibres. Nature, 283(5747), 570-2. [PubMed:7354839] [WorldCat] [DOI] - ↑
Jones, R.E., Heron, J.R., Foster, D.H., Snelgar, R.S., & Mason, R.J. (1983).
Effects of 4-aminopyridine in patients with multiple sclerosis. Journal of the neurological sciences, 60(3), 353-62. [PubMed:6631441] [WorldCat] [DOI] - ↑
Kocsis, J.D., Bowe, C.M., & Waxman, S.G. (1986).
Different effects of 4-aminopyridine on sensory and motor fibers: pathogenesis of paresthesias. Neurology, 36(1), 117-20. [PubMed:3001584] [WorldCat] [DOI] - ↑
Stefoski, D., Davis, F.A., Faut, M., & Schauf, C.L. (1987).
4-Aminopyridine improves clinical signs in multiple sclerosis. Annals of neurology, 21(1), 71-7. [PubMed:2435223] [WorldCat] [DOI] - ↑
Fields, R.D. (2008).
White matter in learning, cognition and psychiatric disorders. Trends in neurosciences, 31(7), 361-70. [PubMed:18538868] [PMC] [WorldCat] [DOI] - ↑
Nave, K.A. (2010).
Myelination and the trophic support of long axons. Nature reviews. Neuroscience, 11(4), 275-83. [PubMed:20216548] [WorldCat] [DOI]
(執筆者:清水崇弘、池中一裕 担当編集委員:柚崎通介)