「結合定数」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の8版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:Binding constant | 英語名:Binding constant | ||
同義語:会合定数 Association constant、親和定数 Affinity constant | 同義語:会合定数 Association constant、親和定数 Affinity constant | ||
結合定数とは、ある分子Aと別の分子Bが非共有結合(水素結合、疎水結合、イオン結合など)により結合/解離の平衡反応を生じる場合に、当該分子間の結合力を数値で表す指標である。低分子量化合物(生理活性物質や薬物など)の受容体タンパク質や血漿タンパク質等への結合の解析、およびタンパク質-タンパク質間相互作用の解析などで用いられる。 | |||
==定義== | ==定義== | ||
| 28行目: | 19行目: | ||
<math>K_D = \frac{1}{K_B} = \frac{[A][B]}{[AB]}</math> | <math>K_D = \frac{1}{K_B} = \frac{[A][B]}{[AB]}</math> | ||
受容体等のタンパク質に対するリガンドの結合の解析においては、一般に結合定数よりも解離定数のほうがよく用いられる。また解離定数は、酸/塩基の解離反応(イオン化反応:例えばCH<sub>3</sub>COOH ⇄ H<sup>+</sup> + CH<sub>3</sub>COO<sup>−</sup>)を記述する際にも用いられる。 | |||
==結合定数/解離定数の求め方== | ==結合定数/解離定数の求め方== | ||
| 55行目: | 46行目: | ||
Bを横軸、B/Fを縦軸にとると直線関係が得られ、その傾き(= −K<sub>B</sub>)よりK<sub>B</sub>が求められる(図1)。性質の異なる複数の結合が存在する場合には、プロットは複数の直線が合成された形の曲線となる。 | Bを横軸、B/Fを縦軸にとると直線関係が得られ、その傾き(= −K<sub>B</sub>)よりK<sub>B</sub>が求められる(図1)。性質の異なる複数の結合が存在する場合には、プロットは複数の直線が合成された形の曲線となる。 | ||
Scatchardプロットの作成に必要なBおよびFの値は、<sup>3</sup>Hや<sup>125</sup> | Scatchardプロットの作成に必要なBおよびFの値は、<sup>3</sup>Hや<sup>125</sup>Iなどの放射性同位元素で標識したリガンドを用いた結合実験により測定できる。結合型と遊離型のリガンドを分離する手法としては、低分子量化合物のみを通す透析膜を用いた平衡透析法や、一定以上の分子量のものを通さない限外ろ過膜を用いた限外ろ過法などがある。 | ||
===等温滴定熱量測定=== | ===等温滴定熱量測定=== | ||
[[Image:2-ITC.jpg|thumb|250px|'''図2.等温滴定熱量測定により得られる結合等温線の一例''']] | [[Image:2-ITC.jpg|thumb|250px|'''図2.等温滴定熱量測定により得られる結合等温線の一例''']] | ||
Isothermal titration calorimetry (ITC) <ref>'''織田昌幸'''<br>等温滴定熱測定.<br>'' | Isothermal titration calorimetry (ITC) <ref>'''織田昌幸'''<br>等温滴定熱測定.<br>''蛋白質科学会アーカイブ #30'':2008</ref> | ||
分子同士が結合する際に発生する(もしくは吸収される)微小な熱量を一定温度下で測定することにより、当該分子間相互作用の熱力学的プロファイル(結合定数を含む)を精度良く得る手法である。測定対象分子の化学修飾や固定化が不要であり、自然な状態に近い条件下での測定が可能である。実際の測定では、一方の分子の溶液に他方の分子の溶液を一定量ずつ滴下し、その際に生じた熱量変化を測定することで結合等温線(図2)が得られる。この曲線の回帰パラメータより結合定数が求められる。 | |||
===表面プラズモン共鳴=== | ===表面プラズモン共鳴=== | ||
| 69行目: | 60行目: | ||
Surface plasmon resonance (SPR)分析 <ref>'''津本浩平'''<br>タンパク質相互作用解析:等温滴定型熱量測定と表面プラズモン共鳴.<br>''生物工学会誌89(7);391-394'':2011</ref> | Surface plasmon resonance (SPR)分析 <ref>'''津本浩平'''<br>タンパク質相互作用解析:等温滴定型熱量測定と表面プラズモン共鳴.<br>''生物工学会誌89(7);391-394'':2011</ref> | ||
センサーチップ上で分子間相互作用をリアルタイムに測定し、分子間の結合/解離のパラメータを得る手法である。金(Au)の薄膜を蒸着させたセンサーチップ上に一方の分子B(リガンド)を固定化しておき、他方の分子A(アナライト)の溶液を一定時間灌流する。AとBの結合によって生じる微量の質量変化をSPRシグナルとして検出し(図3)、その測定値から結合反応(A + B → AB)の速度定数 k<sub>on</sub> | センサーチップ上で分子間相互作用をリアルタイムに測定し、分子間の結合/解離のパラメータを得る手法である。金(Au)の薄膜を蒸着させたセンサーチップ上に一方の分子B(リガンド)を固定化しておき、他方の分子A(アナライト)の溶液を一定時間灌流する。AとBの結合によって生じる微量の質量変化をSPRシグナルとして検出し(図3)、その測定値から結合反応(A + B → AB)の速度定数 k<sub>on</sub> を得る。その後、アナライトを含まない緩衝液を灌流するとSPRシグナルが減衰し、これにより解離反応(AB → A + B)の速度定数 k<sub>off</sub> が得られる。このとき、結合定数 K<sub>B</sub> = k<sub>on</sub>/k<sub>off</sub> である。 | ||
== 関連項目 == | == 関連項目 == | ||
| 79行目: | 66行目: | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
(執筆者:香月博志 担当編集委員:河西春郎) | |||
2013年2月9日 (土) 13:43時点における版
英語名:Binding constant
同義語:会合定数 Association constant、親和定数 Affinity constant
結合定数とは、ある分子Aと別の分子Bが非共有結合(水素結合、疎水結合、イオン結合など)により結合/解離の平衡反応を生じる場合に、当該分子間の結合力を数値で表す指標である。低分子量化合物(生理活性物質や薬物など)の受容体タンパク質や血漿タンパク質等への結合の解析、およびタンパク質-タンパク質間相互作用の解析などで用いられる。
定義
・・・・・(1)
分子Aと分子Bとの結合/解離について上記(1)の平衡反応が成立する場合、平衡状態における遊離型の分子A、遊離型の分子Bおよび結合型ABのモル濃度をそれぞれ[A]、[B]、[AB]とすると、結合定数KB(単位:M−1)は以下の式で表される。
・・・・・(2)
解離定数
平衡反応(1)を、結合型ABから遊離型のAおよびBへの解離反応(AB ⇄ A + B)として捉えた場合の平衡定数が解離定数KD(単位:M)である。すなわち、結合定数の逆数が解離定数となる。
受容体等のタンパク質に対するリガンドの結合の解析においては、一般に結合定数よりも解離定数のほうがよく用いられる。また解離定数は、酸/塩基の解離反応(イオン化反応:例えばCH3COOH ⇄ H+ + CH3COO−)を記述する際にも用いられる。
結合定数/解離定数の求め方
Scatchardプロット
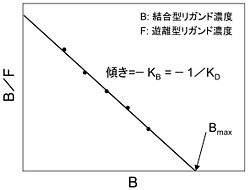
受容体等のタンパク質へのリガンドの結合を解析する際に用いられてきた古典的手法である[1]。受容体Bに対するリガンドAの結合を考えるとき、受容体総濃度Bmax = (非結合型のBの濃度) + (Aの結合したBの濃度) = [B] + [AB]であり、これを式(2)に代入すると
これを変形すると
・・・・・(3)
Scatchard解析では慣例的に以下の記号を用いる。
B(Boundの意):リガンドA-受容体Bの複合体の濃度(= [AB])
F (Freeの意):遊離型のリガンドAの濃度 (= [A])
これらの記号を用いると、式(3)は以下のように書き換えられる。
Bを横軸、B/Fを縦軸にとると直線関係が得られ、その傾き(= −KB)よりKBが求められる(図1)。性質の異なる複数の結合が存在する場合には、プロットは複数の直線が合成された形の曲線となる。
Scatchardプロットの作成に必要なBおよびFの値は、3Hや125Iなどの放射性同位元素で標識したリガンドを用いた結合実験により測定できる。結合型と遊離型のリガンドを分離する手法としては、低分子量化合物のみを通す透析膜を用いた平衡透析法や、一定以上の分子量のものを通さない限外ろ過膜を用いた限外ろ過法などがある。
等温滴定熱量測定
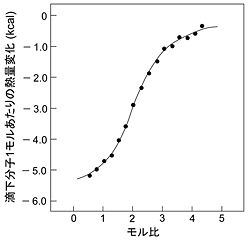
Isothermal titration calorimetry (ITC) [2]
分子同士が結合する際に発生する(もしくは吸収される)微小な熱量を一定温度下で測定することにより、当該分子間相互作用の熱力学的プロファイル(結合定数を含む)を精度良く得る手法である。測定対象分子の化学修飾や固定化が不要であり、自然な状態に近い条件下での測定が可能である。実際の測定では、一方の分子の溶液に他方の分子の溶液を一定量ずつ滴下し、その際に生じた熱量変化を測定することで結合等温線(図2)が得られる。この曲線の回帰パラメータより結合定数が求められる。
表面プラズモン共鳴
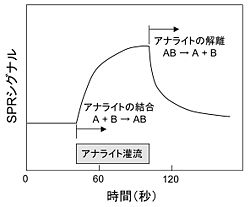
Surface plasmon resonance (SPR)分析 [3]
センサーチップ上で分子間相互作用をリアルタイムに測定し、分子間の結合/解離のパラメータを得る手法である。金(Au)の薄膜を蒸着させたセンサーチップ上に一方の分子B(リガンド)を固定化しておき、他方の分子A(アナライト)の溶液を一定時間灌流する。AとBの結合によって生じる微量の質量変化をSPRシグナルとして検出し(図3)、その測定値から結合反応(A + B → AB)の速度定数 kon を得る。その後、アナライトを含まない緩衝液を灌流するとSPRシグナルが減衰し、これにより解離反応(AB → A + B)の速度定数 koff が得られる。このとき、結合定数 KB = kon/koff である。
関連項目
- 解離定数 Dissociation constant
参考文献
(執筆者:香月博志 担当編集委員:河西春郎)

![{\displaystyle K_{B}={\frac {[AB]}{[A][B]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4505306b04d5948adad0797ad3d40607fc6af842)
![{\displaystyle K_{D}={\frac {1}{K_{B}}}={\frac {[A][B]}{[AB]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36cf098628752a068d662036bd883ebc696342f7)
![{\displaystyle K_{B}={\frac {[AB]}{[A](B_{max}-[AB])}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9e7345a97c2e8dab143833f0412137e46641000)
![{\displaystyle {\frac {[AB]}{[A]}}=K_{B}(B_{max}-[AB])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98702e0277198682f34ab5f2ba575aa68155b370)
