「光遺伝学」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の8版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/tsune 常松 友美]、[http://researchmap.jp/akihiroyamanaka 山中 章弘]</font><br> | <font size="+1">[http://researchmap.jp/tsune 常松 友美]、[http://researchmap.jp/akihiroyamanaka 山中 章弘]</font><br> | ||
''名古屋大学 環境医学研究所''<br> | ''名古屋大学 環境医学研究所''<br> | ||
DOI XXXX/XXXX 原稿受付日:2013年7月8日 原稿完成日:2013年xx月xx日<br> | |||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
英語名:optogenetics | 英語名:optogenetics | ||
{{box|text= | {{box|text= | ||
光遺伝学(オプトジェネティクス)とは、光によって活性化されるタンパク分子を遺伝学的手法を用いて特定の細胞に発現させ、その機能を光で操作する技術である。光(opto)と遺伝学(genetics)を組み合わせたことから光遺伝学と呼ばれる。光遺伝学の開発により、特定の神経の活動を高い時間精度で正確に操作することが初めて可能となった。このことにより神経活動と行動発現とを直接繋げることが可能となった。 | |||
これまでの神経活動の操作手法としては、電気刺激による神経活動の活性化が主に用いられてきた。電気刺激とそれに伴う行動の変化からその電極近傍の神経の担う生理的役割が解析されてきていた。しかし、電気刺激は特異性が低く電極の近傍に存在する軸索や細胞体を非特異的に活性化してしまう。また、電気刺激では神経活動の抑制は不可能であった(図1)。一方、作動薬や拮抗薬等の局所投与などの薬理学的手法は、神経の活性化と抑制の両方が可能であるが、時間的精度が低いという欠点があった。さらに、特定の遺伝子欠損動物の行動解析では、発生過程における影響や他の神経による機能補償などが起こっている可能性を払拭できなかった。 | |||
光遺伝学はこれらの欠点を全て補っており、マイクロ〜ミリ秒オーダーの神経活動の活性化あるいは抑制が可能であり、特定の神経活動のみを制御できる(図1)。これによって自由行動下の動物において特定の神経活動のみを制御することを可能にした。光遺伝学は脳神経科学分野の新手法として非常に大きなインパクトを与え、2010年にNature publishing groupによって全分野の中から、最も優れた研究手法としてMethod of the Yearに選定されていることからも、その影響力の大きさが窺える。 | 光遺伝学はこれらの欠点を全て補っており、マイクロ〜ミリ秒オーダーの神経活動の活性化あるいは抑制が可能であり、特定の神経活動のみを制御できる(図1)。これによって自由行動下の動物において特定の神経活動のみを制御することを可能にした。光遺伝学は脳神経科学分野の新手法として非常に大きなインパクトを与え、2010年にNature publishing groupによって全分野の中から、最も優れた研究手法としてMethod of the Yearに選定されていることからも、その影響力の大きさが窺える。 | ||
光遺伝学は、線虫、ショウジョウバエ、ゼブラフィッシュ、マウス、ラットおよび霊長類において適用例が報告されている。 | |||
}} | }} | ||
| 24行目: | 22行目: | ||
== 光遺伝学の始まり == | == 光遺伝学の始まり == | ||
微生物からヒトに至るまで、ほとんどの生物は光情報を受容することが出来る。そのため、多岐にわたる生物種において光受容を担う光活性化タンパク質が存在することが古くから知られていた。例えば、塩湖や塩田などの高塩環境に生息している古細菌の一種である高度好塩菌は微生物型ロドプシンであるハロロドプシンやバクテリオロドプシンを発現しており、これらによる光エネルギーを利用したポンプ作用によって浸透圧調節を行っている。これらの微生物型ロドプシンは1970年代前半には既に発見されており、光によって活性化されるイオンポンプであることが報告されている<ref name=ref1><pubmed></pubmed></ref>。また、緑藻類クラミドモナスは走光性や光驚動反応を示す。この応答は1980年代前半に光感覚器官である眼点に存在する微生物型ロドプシンを介した反応であると報告されている。その後、2002年から2003年にかけて、その微生物型ロドプシンであるチャネルロドプシン1(ChR1)およびチャネルロドプシン2(ChR2)が、それぞれプロトンイオンチャネルおよび非選択的陽イオンチャネルを形成するイオンチャネル型の光活性化タンパク質であることが同定された。現在までに、光活性化タンパク質の中でイオンチャネル型であると同定されているのは、チャネルロドプシンのみである。 | |||
このような光活性化タンパク質を応用して光遺伝学という新手法が最初に報告されたのは2005年のことである。スタンフォード大学のKarl Deisserothらの研究グループが、レンチウイルスベクターを用いてチャネルロドプシン2を海馬の培養神経細胞に発現させ、光によってその神経活動をミリ秒オーダーで活性化することに成功した<ref name=ref2><pubmed></pubmed></ref>。2006年には、東北大学のYawoらの研究グループが、シンドビスウイルスを用いて生きたマウスの海馬神経細胞にチャネルロドプシン2を発現させ、光強度依存的に活動電位を誘導することに成功した<ref name=ref3><pubmed></pubmed></ref>。 | |||
当初、微生物型ロドプシンは哺乳類の神経細胞では細胞膜に効率良く移行せず、細胞内で凝集体を作ったりして、十分量発現させることができなかった。しかし、使用コドンを哺乳類において翻訳効率の高いコドンに置換し、さらに膜移行シグナルを付加するといった改良により、光活性化タンパク質の膜へ移行が向上した<ref name=ref2 />。光遺伝学の脳神経科学分野への急速な広がりから、新たな光活性化タンパク質の探索、変異体の作製など、まさに日進月歩の先端技術となっている。 | |||
== 光活性化タンパク質の基本的構造 == | == 光活性化タンパク質の基本的構造 == | ||
| 35行目: | 33行目: | ||
[[image:光遺伝学図3.jpg|thumb|400px|'''図3.光活性化タンパク質の吸収スペクトル''']] | [[image:光遺伝学図3.jpg|thumb|400px|'''図3.光活性化タンパク質の吸収スペクトル''']] | ||
光受容体は、補因子としてレチナールを結合したロドプシンファミリータンパク質によって担われている。レチナールを結合したロドプシンファミリーは、一次構造の違いにより、2つのスーパーファミリーに分類される。 | |||
* | *タイプ1(微生物型ロドプシン):原核生物、藻類、菌類に存在する。 | ||
* | *タイプ2(動物型ロドプシン):真核生物以上に存在し、主に視覚情報受容やサーカディアンリズムの形成を担当する。 | ||
いずれのタイプも7回膜貫通型タンパク質であり、機能するためには補因子であるレチナールの結合が必須である。ロドプシンは発色団である11-シスレチナールと結合している。ロドプシンが光量子を吸収すると、レチナールは11—シス型から前トランス型に異性化する。それに伴い、ロドプシンの構造変化が起こり活性型に変化する。微生物型ロドプシンはそれ自身がイオンチャネルあるいはポンプを形成し、光受容と同時にイオンの流出入を制御する(図2)。これに対し、動物型ロドプシンは細胞内でGタンパク質と共役する。光遺伝学に用いられる光活性化タンパク質は、多くは緑藻植物や古細菌において発現する微生物型ロドプシンであるが、後述の通り、動物型ロドプシンが用いられることもある。 | |||
哺乳類の脳には十分量のレチナールが存在しているため、新たにレチナールを添加する必要はなく、光活性化タンパク質を発現させるだけで機能させることができる。しかし、無脊椎動物(ショウジョウバエや線虫)では、レチナールを加えないと十分な光応答が得られないと報告されている<ref name=ref4><pubmed></pubmed></ref> <ref name=ref5><pubmed></pubmed></ref>。 | |||
== 活性化に用いられる光活性化タンパク質 == | == 活性化に用いられる光活性化タンパク質 == | ||
=== | ===チャネルロドプシン2(Channelrhodopsin-2, ChR2)=== | ||
緑藻類クラミドモナスの眼点から同定された、唯一の光活性化非選択的陽イオンチャネルである。470 nmの青色光照射によって最も強く活性化される(図3)。青色光を受容すると非選択的陽イオンチャネルが開口し、その結果ChR2発現細胞は脱分極応答を示す(図2)。光照射からチャネルが開口するまでの反応時間(τon)は非常に早く、30マイクロ秒以内である。チャネルのコンダクタンスは40 fS程度と考えられており、他の電位依存性チャネルと比較しても非常に小さい。欠点としては、脱感作しやすく一度活性化されると光応答が完全に戻るまでに25秒程要する<ref name=ref6><pubmed></pubmed></ref>。より長波長である570 nmの光を照射することで、不活性状態からの回復を促すことができる。 | |||
また、他の欠点として非常に大量に細胞に発現させると細胞内で凝集体を形成して光応答が見られなくなる。長らくイオンが通過するポア領域が分かっていなかったが、2012年に結晶構造解析からChR2が二量体を形成していること、さらにイオンは形成した二量体の境界面では無く、単量体の中を通っていることが報告された<ref name=ref7><pubmed></pubmed></ref>。 | |||
===変異型ChR2=== | |||
野生型ChR2の光反応時間、光感受性、光応答電流などを改善し、より高精度かつ大きな電流を流す分子の作成を目指して様々な変異型ChR2が作成されている。 | 野生型ChR2の光反応時間、光感受性、光応答電流などを改善し、より高精度かつ大きな電流を流す分子の作成を目指して様々な変異型ChR2が作成されている。 | ||
====ChR2/H134R==== | |||
450 nmの青色光照射によって最も強く活性化される。野生型ChR2と比較して、僅かに脱感作しにくくなり、光感受性も若干向上している。ただし、光照射を止めてからチャネルが閉じるまでの反応時間(τoff)が少し延長しているために、時間的精度はChR2に劣る<ref name=ref8><pubmed> | 450 nmの青色光照射によって最も強く活性化される。野生型ChR2と比較して、僅かに脱感作しにくくなり、光感受性も若干向上している。ただし、光照射を止めてからチャネルが閉じるまでの反応時間(τoff)が少し延長しているために、時間的精度はChR2に劣る<ref name=ref8><pubmed></pubmed></ref>。 | ||
====ChR2/C128X(XはT, AまたはS)またはChR2/D156A==== | |||
ChR2と比較して、光感受性が格段に向上しているが(約100倍高感度)、光応答電流は若干小さくなっている。これらのチャネルは、光照射開始からチャネルが開くまでの反応時間(τon)が10ミリ秒前後と僅かに遅くなっているが、光照射を止めてからチャネルが閉じるまでの反応時間(τoff)が非常に遅くなっている(2秒から100秒)のが最大の特徴である。しかし、550 nm前後の緑色光、もしくは橙色光照射により、チャネルを瞬時に閉じることができる。つまり、青色パルス光を一度照射するだけで、脱分極状態を長時間持続させ、緑色(または橙色)パルス光を照射することで膜電位を元に戻すことが出来る。これらの特徴から、長時間の持続的な脱分極に適している<ref name=ref9><pubmed> | ChR2と比較して、光感受性が格段に向上しているが(約100倍高感度)、光応答電流は若干小さくなっている。これらのチャネルは、光照射開始からチャネルが開くまでの反応時間(τon)が10ミリ秒前後と僅かに遅くなっているが、光照射を止めてからチャネルが閉じるまでの反応時間(τoff)が非常に遅くなっている(2秒から100秒)のが最大の特徴である。しかし、550 nm前後の緑色光、もしくは橙色光照射により、チャネルを瞬時に閉じることができる。つまり、青色パルス光を一度照射するだけで、脱分極状態を長時間持続させ、緑色(または橙色)パルス光を照射することで膜電位を元に戻すことが出来る。これらの特徴から、長時間の持続的な脱分極に適している<ref name=ref9><pubmed></pubmed></ref>。 | ||
====ChR2/E123T(ChETA)==== | |||
490 | 490 nmの青色光照射によって最も強く活性化される。チャネルの光反応時間が非常に早くなり改善されている。その一方、光応答電流は減少している。光反応速度が上がった分、高頻度な光刺激に適しており、光刺激による活動電位の誘導が200Hz程度まで可能となっている<ref name=ref10><pubmed></pubmed></ref>。 | ||
===キメラ型ChR=== | |||
ChR2の膜貫通ドメインをChR1の膜貫通ドメインと置換し6種類のキメラタンパク質を作製し、それぞれの膜移行、光反応時間、光感受性、光応答電流等の解析を行った | ChR2の膜貫通ドメインをChR1の膜貫通ドメインと置換し6種類のキメラタンパク質を作製し、それぞれの膜移行、光反応時間、光感受性、光応答電流等の解析を行った[11]。その中でN末端から第5膜貫通ドメインまでがChR1で、それ以降C末端までがChR2で構成されるキメラチャネル(ChEF)、およびChEF/I170V(ChIEF)では、哺乳類細胞における発現と膜移行は野生型ChR2よりも向上していた。ChEFは470 nmの青色光照射によって、一方、ChIEFは450 nmの青色光照射によって最も強く活性化される。ChR2と比較して脱感作しにくくなっている。光感受性はChR2と比較して劣っているものの、光応答電流はほとんど変わらない。ChIEFはミリ秒オーダーの光反応時間を持ち、さらに脱感作しにくい性質を持つことから、高頻度、繰り返し、または持続的な光刺激に対しても適している[8]。 | ||
また、ChR1のうち第6膜貫通ドメインと第7膜貫通ドメインの後半部分のみがChR2の配列で構成されるキメラチャネルは、520nmの緑色光照射によって最も強く活性化されるため、チャネルロドプシングリーンレシーバー(ChRGR)と呼ばれている。ChRGRは、ChR2と比較して光反応時間、光感受性が上がり、脱感作もしにくくなっている。一度活性化されてから1.3秒で光応答が完全に戻る | また、ChR1のうち第6膜貫通ドメインと第7膜貫通ドメインの後半部分のみがChR2の配列で構成されるキメラチャネルは、520nmの緑色光照射によって最も強く活性化されるため、チャネルロドプシングリーンレシーバー(ChRGR)と呼ばれている。ChRGRは、ChR2と比較して光反応時間、光感受性が上がり、脱感作もしにくくなっている。一度活性化されてから1.3秒で光応答が完全に戻る[12]。そのため、高頻度な光刺激に適している。また、青色光よりも長波長である緑色光で最も活性されるため、個体において深い組織への照射効率が上がる利点がある。 | ||
===ボルボックスチャネルロドプシン1=== | ===ボルボックスチャネルロドプシン1=== | ||
(Volvox carteri channelrhodopsin-1, VChR1) | |||
群体を形成する藻類の一種であるボルボックスから同定された光活性型非選択的陽イオンチャネルである。ChR2と異なり、540 nmの緑色光照射によって最も活性化される。さらに長波長側の黄色光照射によっても十分に活性化される長波長シフト型ChRである。ただし、400 nmの短波長でも活性化される性質を持つ。欠点としては、光反応時間が遅いため、時間的精度が低い。また、現時点では発現レベルが不十分であり、さらに膜移行が難しいことが挙げられている[13]。 | |||
今後、期待されるChR2変異体の性質としては、以下の点が挙げられる。 | 今後、期待されるChR2変異体の性質としては、以下の点が挙げられる。 | ||
# | #チャネルのコンダクタンスを上げる。<br>それにより、発現レベルが低くても十分な電流を得られるようになる。 | ||
#イオン選択性を変える。<br> | #イオン選択性を変える。<br>クロライドイオンやカリウムイオンだけを通すチャネル特性に変異出来れば、神経細胞を過分極させることが可能となる。 | ||
#光反応時間の向上<br>これまでのところ、光反応時間を向上させると、往々にして光感受性が落ちるという欠点があったが、光感受性を保ったままでの向上が望まれる。 | #光反応時間の向上<br>これまでのところ、光反応時間を向上させると、往々にして光感受性が落ちるという欠点があったが、光感受性を保ったままでの向上が望まれる。 | ||
#600 nm以上の長波長光刺激で活性化する。<br> | #600 nm以上の長波長光刺激で活性化する。<br>長波長側にシフトすることによって、カルシウムイメージングとの併用や、深い組織への照射効率を上げることが出来る。 | ||
== 抑制に用いられる光活性化タンパク質 == | == 抑制に用いられる光活性化タンパク質 == | ||
===ハロロドプシン=== | ===ハロロドプシン=== | ||
(Halorhodopsin, eNpHR) | |||
古細菌高度好塩菌(Natronomas pharaonis)から同定された光活性化クロライドイオンポンプである。590 nmの黄色光照射によって最も活性化される(図3)。黄色光を受容すると内蔵ポンプが駆動し、細胞外から細胞内にクロライドイオンを流入させ、結果として過分極応答を示す(図2)。ハロロドプシンが神経活動抑制分子として最初に光遺伝学に導入されたのは2007年のことである[14]。 | |||
ハロロドプシンもChR2と同様に、哺乳類の神経細胞では細胞膜への移行効率が悪く、細胞内で凝集体を作ったりして、うまく発現させることができなかった。しかし、使用コドンを哺乳類において翻訳効率の高いコドンに置換し、さらに膜移行シグナルを付加することで、細胞膜への移行を促進し、哺乳類神経細胞を光によって抑制することに成功した | ハロロドプシンもChR2と同様に、哺乳類の神経細胞では細胞膜への移行効率が悪く、細胞内で凝集体を作ったりして、うまく発現させることができなかった。しかし、使用コドンを哺乳類において翻訳効率の高いコドンに置換し、さらに膜移行シグナルを付加することで、細胞膜への移行を促進し、哺乳類神経細胞を光によって抑制することに成功した[14]。しかしながら、ハロロドプシンも脱感作しやすい性質を持つため、長時間の刺激や繰り返し刺激には適さない。 | ||
===アーキロドプシン3=== | ===アーキロドプシン3=== | ||
(Archaerhodopsin-3) | |||
古細菌、真正細菌、植物、菌類のゲノムデータから、微生物型ロドプシンの相同性検索により同定された光活性化プロトンポンプである。古細菌高度好塩菌の一種であるHalorubrum sodomense由来であり、550 nmの緑色光照射によって最も強く活性化される(図3)。緑色光を受容するとポンプが駆動し、細胞内から細胞外へプロトンイオンが排出される。その結果、細胞膜電位は過分極する(図2)。ハロロドプシンと比較して、光感受性が高く、光応答電流が大きい。また脱感作しにくい性質を持つため、長時間刺激や繰り返し刺激に適している[15]。 | |||
===アーキロドプシンT=== | ===アーキロドプシンT=== | ||
(Archaerhodopsin-T) | |||
アーキロドプシン3の配列をもとに、Halorubrum属のゲノムデータから相同性検索によりHalorubrum TP009系統から同定された。アーキロドプシンTもプロトンポンプを形成しており、緑色光を受容するとポンプが駆動し、細胞膜電位は過分極を示す。アーキロドプシン3と比較して、20 mW/mm2以下の光強度での光応答電流が大きく、光感受性も3倍程度良い。570 nmの緑色光照射によって最も強く活性化される[16]。 | |||
===MAC === | ===MAC === | ||
アーキロドプシン3と同じ方法により見つかった、光活性化プロトンポンプである。子嚢菌の一種であるLeptosphaeria maculans 由来であり、550 nmの緑色光照射によって最も強く活性化される[15]。 | |||
== GPCRシグナル伝達系の制御 == | == GPCRシグナル伝達系の制御 == | ||
===OptoXRs=== | ===OptoXRs=== | ||
光照射によって細胞内シグナル伝達経路を制御するために作られた変異体である。ロドプシンの細胞内ループをGタンパク質共役型受容体であるアドレナリン受容体の細胞内ループに置き換えたキメラタンパク質を作製した。α1受容体はGq共役型受容体なので、ホスホリパーゼCを活性化し、細胞内カルシウム濃度を増加させる(opto-α1AR)。したがって、青色光を照射すると、opto-α1AR発現細胞のGqシグナル経路を介して、神経細胞を活性化することができる[17]。 | |||
また、別のグループにより、Gi共役型受容体である5HT1A受容体とロドプシンのキメラタンパク質を神経細胞に発現させ、光照射により、Giシグナル経路の下流に存在するGタンパク質共役型内向き整流性カリウムチャネル(G-protein-coupled inward rectifier potassium channel, GIRK)を介して細胞を抑制することに成功している[18]。 | |||
===光活性化アデニル酸シクラーゼ=== | ===光活性化アデニル酸シクラーゼ=== | ||
(Photosensitive adenylyl cyclase, PAC) | |||
鞭毛虫の一群であるユーグレナもクラミドモナスと同様に走行性や光驚動反応を示す。この応答は、感光点に存在する光活性化アデニル酸シクラーゼを介した反応であることが2002年に発見されている。光活性化アデニル酸シクラーゼは、青色光照射によって最も強く活性化され、細胞内cAMPの産生が促進される。産生されたcAMPによってサイクリックヌクレオチド感受性チャネルが開口し、細胞を活性化することができる[19]。 | |||
===メラノプシン=== | ===メラノプシン=== | ||
(Melanopsin) | |||
メラノプシンは網膜の神経節細胞で同定された7回膜貫通型Gタンパク質共役型受容体である。メラノプシンを発現する一部の網膜神経節細胞は体内時計の中枢である視交叉上核に直接投射しており、サーカディアンリズムや瞳孔反射を担っている。メラノプシンは480 nmの青色光照射によって最も強く活性化される。Gqカップリング受容体であるため、いったんメラノプシンが活性化すると、下流に存在するホスホリパーゼCの活性化を介して非選択的陽イオンチャネル(TRPCチャネル)を開口すると考えられている。培養細胞にメラノプシンとTRPC3チャネルを共発現させた系では、青色光照射により膜電位を脱分極させることに成功している[20]。特徴としては、光感受性が非常に高く、一度光刺激を行うと細胞内シグナル伝達系を介するために数分に渡り持続的に活性化できる。 | |||
== 光活性化タンパク質の導入方法 == | == 光活性化タンパク質の導入方法 == | ||
光活性化タンパク質を特定神経に導入するための主な方法として、以下の3種類が挙げられる。 | 光活性化タンパク質を特定神経に導入するための主な方法として、以下の3種類が挙げられる。 | ||
# | #ウイルスベクターを用いた方法<br>利点として、迅速かつ多用途な導入が可能であること、また高感染性かつ高コピー数であり発現レベルが高いことが挙げられる。さらに、遺伝子改変動物の系が確立していない生物に対しても発現させることができる。現在のところ、マウス、ラット、霊長類においてはレンチウイルスやアデノ随伴ウイルス(AAV)等で導入に成功している。 | ||
#Creマウス+ウイルスベクター<br> | #Creマウス+ウイルスベクター<br>光活性化タンパク質を特定細胞のみに発現させるために、Creリコンビナーゼ依存的に遺伝子を発現するウイルスベクターを用いて遺伝子導入する。このときdoublefloxed inverted open-reading-frame (DIO)と呼ばれる、光活性化タンパク質が2ペアのlox配列(例えばloxPとlox2272)に挟まれた状態で逆向きに挿入されている。Creリコンビナーゼ発現細胞のみで光活性化タンパク質が発現してくることになる。 | ||
# | #遺伝子改変動物を作製する<br>遺伝子改変動物またはノックイン動物を作製する。最初に成功した遺伝子改変マウスはThy1プロモーターが用いられた。遺伝子改変動物を作製するためには、強力なプロモーターを使用することが成功の鍵を握る。欠点としては、作製、管理、維持の過程において時間と労力と費用がかかることが挙げられるが、利点として光活性化タンパク質の発現量を一定に保つことができる。 | ||
{| class="wikitable" | {| class="wikitable" | ||
|+'''表.活性化に使われる光活性化タンパク質のチャネル特性'''<br>脱感作レベルは定常電流をピーク電流で割った値。 | |+'''表.活性化に使われる光活性化タンパク質のチャネル特性'''<br>脱感作レベルは定常電流をピーク電流で割った値。[21]より一部改変して引用。 | ||
|- | |- | ||
| style="background-color:#d3d3d3; text-align:center" | チャネル名 | | style="background-color:#d3d3d3; text-align:center" | チャネル名 | ||
| 142行目: | 136行目: | ||
| style="background-color:#d3d3d3; text-align:center" | τoff | | style="background-color:#d3d3d3; text-align:center" | τoff | ||
|- | |- | ||
| | | ChR2 | ||
| 〜470 nm | | 〜470 nm | ||
| 〜0.22 | | 〜0.22 | ||
| 149行目: | 143行目: | ||
| 〜13.5 ms | | 〜13.5 ms | ||
|- | |- | ||
| | | ChR2/H134R | ||
| 〜450 nm | | 〜450 nm | ||
| 〜0.39 | | 〜0.39 | ||
| 156行目: | 150行目: | ||
| 〜17.9 ms | | 〜17.9 ms | ||
|- | |- | ||
| | | ChR2/C128X | ||
| 〜480 nm | | 〜480 nm | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| 163行目: | 157行目: | ||
| 2-100 s | | 2-100 s | ||
|- | |- | ||
| | | ChETA | ||
| 〜490 nm | | 〜490 nm | ||
| 〜0.24 | | 〜0.24 | ||
| 170行目: | 164行目: | ||
| 〜7.9-8.5 ms | | 〜7.9-8.5 ms | ||
|- | |- | ||
| | | ChIEF | ||
| 〜450 nm | | 〜450 nm | ||
| 〜0.80 | | 〜0.80 | ||
| 177行目: | 171行目: | ||
| 〜12.0 ms | | 〜12.0 ms | ||
|- | |- | ||
| | | ChRGR | ||
| 〜520 nm | | 〜520 nm | ||
| 〜0.15 | | 〜0.15 | ||
| 184行目: | 178行目: | ||
| 〜4.0 ms | | 〜4.0 ms | ||
|- | |- | ||
| | | VChR1 | ||
| 〜570 nm | | 〜570 nm | ||
| 〜0.48 | | 〜0.48 | ||
2013年7月8日 (月) 11:58時点における版
常松 友美、山中 章弘
名古屋大学 環境医学研究所
DOI XXXX/XXXX 原稿受付日:2013年7月8日 原稿完成日:2013年xx月xx日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:optogenetics
光遺伝学(オプトジェネティクス)とは、光によって活性化されるタンパク分子を遺伝学的手法を用いて特定の細胞に発現させ、その機能を光で操作する技術である。光(opto)と遺伝学(genetics)を組み合わせたことから光遺伝学と呼ばれる。光遺伝学の開発により、特定の神経の活動を高い時間精度で正確に操作することが初めて可能となった。このことにより神経活動と行動発現とを直接繋げることが可能となった。
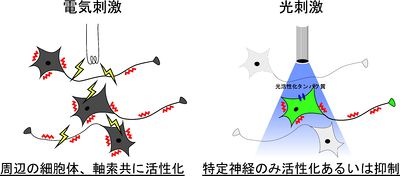
これまでの神経活動の操作手法としては、電気刺激による神経活動の活性化が主に用いられてきた。電気刺激とそれに伴う行動の変化からその電極近傍の神経の担う生理的役割が解析されてきていた。しかし、電気刺激は特異性が低く電極の近傍に存在する軸索や細胞体を非特異的に活性化してしまう。また、電気刺激では神経活動の抑制は不可能であった(図1)。一方、作動薬や拮抗薬等の局所投与などの薬理学的手法は、神経の活性化と抑制の両方が可能であるが、時間的精度が低いという欠点があった。さらに、特定の遺伝子欠損動物の行動解析では、発生過程における影響や他の神経による機能補償などが起こっている可能性を払拭できなかった。
光遺伝学はこれらの欠点を全て補っており、マイクロ〜ミリ秒オーダーの神経活動の活性化あるいは抑制が可能であり、特定の神経活動のみを制御できる(図1)。これによって自由行動下の動物において特定の神経活動のみを制御することを可能にした。光遺伝学は脳神経科学分野の新手法として非常に大きなインパクトを与え、2010年にNature publishing groupによって全分野の中から、最も優れた研究手法としてMethod of the Yearに選定されていることからも、その影響力の大きさが窺える。
光遺伝学は、線虫、ショウジョウバエ、ゼブラフィッシュ、マウス、ラットおよび霊長類において適用例が報告されている。
光遺伝学の始まり
微生物からヒトに至るまで、ほとんどの生物は光情報を受容することが出来る。そのため、多岐にわたる生物種において光受容を担う光活性化タンパク質が存在することが古くから知られていた。例えば、塩湖や塩田などの高塩環境に生息している古細菌の一種である高度好塩菌は微生物型ロドプシンであるハロロドプシンやバクテリオロドプシンを発現しており、これらによる光エネルギーを利用したポンプ作用によって浸透圧調節を行っている。これらの微生物型ロドプシンは1970年代前半には既に発見されており、光によって活性化されるイオンポンプであることが報告されている[1]。また、緑藻類クラミドモナスは走光性や光驚動反応を示す。この応答は1980年代前半に光感覚器官である眼点に存在する微生物型ロドプシンを介した反応であると報告されている。その後、2002年から2003年にかけて、その微生物型ロドプシンであるチャネルロドプシン1(ChR1)およびチャネルロドプシン2(ChR2)が、それぞれプロトンイオンチャネルおよび非選択的陽イオンチャネルを形成するイオンチャネル型の光活性化タンパク質であることが同定された。現在までに、光活性化タンパク質の中でイオンチャネル型であると同定されているのは、チャネルロドプシンのみである。
このような光活性化タンパク質を応用して光遺伝学という新手法が最初に報告されたのは2005年のことである。スタンフォード大学のKarl Deisserothらの研究グループが、レンチウイルスベクターを用いてチャネルロドプシン2を海馬の培養神経細胞に発現させ、光によってその神経活動をミリ秒オーダーで活性化することに成功した[2]。2006年には、東北大学のYawoらの研究グループが、シンドビスウイルスを用いて生きたマウスの海馬神経細胞にチャネルロドプシン2を発現させ、光強度依存的に活動電位を誘導することに成功した[3]。
当初、微生物型ロドプシンは哺乳類の神経細胞では細胞膜に効率良く移行せず、細胞内で凝集体を作ったりして、十分量発現させることができなかった。しかし、使用コドンを哺乳類において翻訳効率の高いコドンに置換し、さらに膜移行シグナルを付加するといった改良により、光活性化タンパク質の膜へ移行が向上した[2]。光遺伝学の脳神経科学分野への急速な広がりから、新たな光活性化タンパク質の探索、変異体の作製など、まさに日進月歩の先端技術となっている。
光活性化タンパク質の基本的構造
光受容体は、補因子としてレチナールを結合したロドプシンファミリータンパク質によって担われている。レチナールを結合したロドプシンファミリーは、一次構造の違いにより、2つのスーパーファミリーに分類される。
- タイプ1(微生物型ロドプシン):原核生物、藻類、菌類に存在する。
- タイプ2(動物型ロドプシン):真核生物以上に存在し、主に視覚情報受容やサーカディアンリズムの形成を担当する。
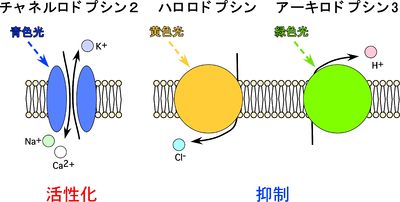
いずれのタイプも7回膜貫通型タンパク質であり、機能するためには補因子であるレチナールの結合が必須である。ロドプシンは発色団である11-シスレチナールと結合している。ロドプシンが光量子を吸収すると、レチナールは11—シス型から前トランス型に異性化する。それに伴い、ロドプシンの構造変化が起こり活性型に変化する。微生物型ロドプシンはそれ自身がイオンチャネルあるいはポンプを形成し、光受容と同時にイオンの流出入を制御する(図2)。これに対し、動物型ロドプシンは細胞内でGタンパク質と共役する。光遺伝学に用いられる光活性化タンパク質は、多くは緑藻植物や古細菌において発現する微生物型ロドプシンであるが、後述の通り、動物型ロドプシンが用いられることもある。
哺乳類の脳には十分量のレチナールが存在しているため、新たにレチナールを添加する必要はなく、光活性化タンパク質を発現させるだけで機能させることができる。しかし、無脊椎動物(ショウジョウバエや線虫)では、レチナールを加えないと十分な光応答が得られないと報告されている[4] [5]。
活性化に用いられる光活性化タンパク質
チャネルロドプシン2(Channelrhodopsin-2, ChR2)
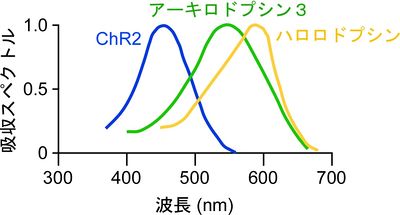
緑藻類クラミドモナスの眼点から同定された、唯一の光活性化非選択的陽イオンチャネルである。470 nmの青色光照射によって最も強く活性化される(図3)。青色光を受容すると非選択的陽イオンチャネルが開口し、その結果ChR2発現細胞は脱分極応答を示す(図2)。光照射からチャネルが開口するまでの反応時間(τon)は非常に早く、30マイクロ秒以内である。チャネルのコンダクタンスは40 fS程度と考えられており、他の電位依存性チャネルと比較しても非常に小さい。欠点としては、脱感作しやすく一度活性化されると光応答が完全に戻るまでに25秒程要する[6]。より長波長である570 nmの光を照射することで、不活性状態からの回復を促すことができる。
また、他の欠点として非常に大量に細胞に発現させると細胞内で凝集体を形成して光応答が見られなくなる。長らくイオンが通過するポア領域が分かっていなかったが、2012年に結晶構造解析からChR2が二量体を形成していること、さらにイオンは形成した二量体の境界面では無く、単量体の中を通っていることが報告された[7]。
変異型ChR2
野生型ChR2の光反応時間、光感受性、光応答電流などを改善し、より高精度かつ大きな電流を流す分子の作成を目指して様々な変異型ChR2が作成されている。
ChR2/H134R
450 nmの青色光照射によって最も強く活性化される。野生型ChR2と比較して、僅かに脱感作しにくくなり、光感受性も若干向上している。ただし、光照射を止めてからチャネルが閉じるまでの反応時間(τoff)が少し延長しているために、時間的精度はChR2に劣る[8]。
ChR2/C128X(XはT, AまたはS)またはChR2/D156A
ChR2と比較して、光感受性が格段に向上しているが(約100倍高感度)、光応答電流は若干小さくなっている。これらのチャネルは、光照射開始からチャネルが開くまでの反応時間(τon)が10ミリ秒前後と僅かに遅くなっているが、光照射を止めてからチャネルが閉じるまでの反応時間(τoff)が非常に遅くなっている(2秒から100秒)のが最大の特徴である。しかし、550 nm前後の緑色光、もしくは橙色光照射により、チャネルを瞬時に閉じることができる。つまり、青色パルス光を一度照射するだけで、脱分極状態を長時間持続させ、緑色(または橙色)パルス光を照射することで膜電位を元に戻すことが出来る。これらの特徴から、長時間の持続的な脱分極に適している[9]。
ChR2/E123T(ChETA)
490 nmの青色光照射によって最も強く活性化される。チャネルの光反応時間が非常に早くなり改善されている。その一方、光応答電流は減少している。光反応速度が上がった分、高頻度な光刺激に適しており、光刺激による活動電位の誘導が200Hz程度まで可能となっている[10]。
キメラ型ChR
ChR2の膜貫通ドメインをChR1の膜貫通ドメインと置換し6種類のキメラタンパク質を作製し、それぞれの膜移行、光反応時間、光感受性、光応答電流等の解析を行った[11]。その中でN末端から第5膜貫通ドメインまでがChR1で、それ以降C末端までがChR2で構成されるキメラチャネル(ChEF)、およびChEF/I170V(ChIEF)では、哺乳類細胞における発現と膜移行は野生型ChR2よりも向上していた。ChEFは470 nmの青色光照射によって、一方、ChIEFは450 nmの青色光照射によって最も強く活性化される。ChR2と比較して脱感作しにくくなっている。光感受性はChR2と比較して劣っているものの、光応答電流はほとんど変わらない。ChIEFはミリ秒オーダーの光反応時間を持ち、さらに脱感作しにくい性質を持つことから、高頻度、繰り返し、または持続的な光刺激に対しても適している[8]。
また、ChR1のうち第6膜貫通ドメインと第7膜貫通ドメインの後半部分のみがChR2の配列で構成されるキメラチャネルは、520nmの緑色光照射によって最も強く活性化されるため、チャネルロドプシングリーンレシーバー(ChRGR)と呼ばれている。ChRGRは、ChR2と比較して光反応時間、光感受性が上がり、脱感作もしにくくなっている。一度活性化されてから1.3秒で光応答が完全に戻る[12]。そのため、高頻度な光刺激に適している。また、青色光よりも長波長である緑色光で最も活性されるため、個体において深い組織への照射効率が上がる利点がある。
ボルボックスチャネルロドプシン1
(Volvox carteri channelrhodopsin-1, VChR1)
群体を形成する藻類の一種であるボルボックスから同定された光活性型非選択的陽イオンチャネルである。ChR2と異なり、540 nmの緑色光照射によって最も活性化される。さらに長波長側の黄色光照射によっても十分に活性化される長波長シフト型ChRである。ただし、400 nmの短波長でも活性化される性質を持つ。欠点としては、光反応時間が遅いため、時間的精度が低い。また、現時点では発現レベルが不十分であり、さらに膜移行が難しいことが挙げられている[13]。
今後、期待されるChR2変異体の性質としては、以下の点が挙げられる。
- チャネルのコンダクタンスを上げる。
それにより、発現レベルが低くても十分な電流を得られるようになる。 - イオン選択性を変える。
クロライドイオンやカリウムイオンだけを通すチャネル特性に変異出来れば、神経細胞を過分極させることが可能となる。 - 光反応時間の向上
これまでのところ、光反応時間を向上させると、往々にして光感受性が落ちるという欠点があったが、光感受性を保ったままでの向上が望まれる。 - 600 nm以上の長波長光刺激で活性化する。
長波長側にシフトすることによって、カルシウムイメージングとの併用や、深い組織への照射効率を上げることが出来る。
抑制に用いられる光活性化タンパク質
ハロロドプシン
(Halorhodopsin, eNpHR)
古細菌高度好塩菌(Natronomas pharaonis)から同定された光活性化クロライドイオンポンプである。590 nmの黄色光照射によって最も活性化される(図3)。黄色光を受容すると内蔵ポンプが駆動し、細胞外から細胞内にクロライドイオンを流入させ、結果として過分極応答を示す(図2)。ハロロドプシンが神経活動抑制分子として最初に光遺伝学に導入されたのは2007年のことである[14]。
ハロロドプシンもChR2と同様に、哺乳類の神経細胞では細胞膜への移行効率が悪く、細胞内で凝集体を作ったりして、うまく発現させることができなかった。しかし、使用コドンを哺乳類において翻訳効率の高いコドンに置換し、さらに膜移行シグナルを付加することで、細胞膜への移行を促進し、哺乳類神経細胞を光によって抑制することに成功した[14]。しかしながら、ハロロドプシンも脱感作しやすい性質を持つため、長時間の刺激や繰り返し刺激には適さない。
アーキロドプシン3
(Archaerhodopsin-3)
古細菌、真正細菌、植物、菌類のゲノムデータから、微生物型ロドプシンの相同性検索により同定された光活性化プロトンポンプである。古細菌高度好塩菌の一種であるHalorubrum sodomense由来であり、550 nmの緑色光照射によって最も強く活性化される(図3)。緑色光を受容するとポンプが駆動し、細胞内から細胞外へプロトンイオンが排出される。その結果、細胞膜電位は過分極する(図2)。ハロロドプシンと比較して、光感受性が高く、光応答電流が大きい。また脱感作しにくい性質を持つため、長時間刺激や繰り返し刺激に適している[15]。
アーキロドプシンT
(Archaerhodopsin-T)
アーキロドプシン3の配列をもとに、Halorubrum属のゲノムデータから相同性検索によりHalorubrum TP009系統から同定された。アーキロドプシンTもプロトンポンプを形成しており、緑色光を受容するとポンプが駆動し、細胞膜電位は過分極を示す。アーキロドプシン3と比較して、20 mW/mm2以下の光強度での光応答電流が大きく、光感受性も3倍程度良い。570 nmの緑色光照射によって最も強く活性化される[16]。
MAC
アーキロドプシン3と同じ方法により見つかった、光活性化プロトンポンプである。子嚢菌の一種であるLeptosphaeria maculans 由来であり、550 nmの緑色光照射によって最も強く活性化される[15]。
GPCRシグナル伝達系の制御
OptoXRs
光照射によって細胞内シグナル伝達経路を制御するために作られた変異体である。ロドプシンの細胞内ループをGタンパク質共役型受容体であるアドレナリン受容体の細胞内ループに置き換えたキメラタンパク質を作製した。α1受容体はGq共役型受容体なので、ホスホリパーゼCを活性化し、細胞内カルシウム濃度を増加させる(opto-α1AR)。したがって、青色光を照射すると、opto-α1AR発現細胞のGqシグナル経路を介して、神経細胞を活性化することができる[17]。
また、別のグループにより、Gi共役型受容体である5HT1A受容体とロドプシンのキメラタンパク質を神経細胞に発現させ、光照射により、Giシグナル経路の下流に存在するGタンパク質共役型内向き整流性カリウムチャネル(G-protein-coupled inward rectifier potassium channel, GIRK)を介して細胞を抑制することに成功している[18]。
光活性化アデニル酸シクラーゼ
(Photosensitive adenylyl cyclase, PAC)
鞭毛虫の一群であるユーグレナもクラミドモナスと同様に走行性や光驚動反応を示す。この応答は、感光点に存在する光活性化アデニル酸シクラーゼを介した反応であることが2002年に発見されている。光活性化アデニル酸シクラーゼは、青色光照射によって最も強く活性化され、細胞内cAMPの産生が促進される。産生されたcAMPによってサイクリックヌクレオチド感受性チャネルが開口し、細胞を活性化することができる[19]。
メラノプシン
(Melanopsin)
メラノプシンは網膜の神経節細胞で同定された7回膜貫通型Gタンパク質共役型受容体である。メラノプシンを発現する一部の網膜神経節細胞は体内時計の中枢である視交叉上核に直接投射しており、サーカディアンリズムや瞳孔反射を担っている。メラノプシンは480 nmの青色光照射によって最も強く活性化される。Gqカップリング受容体であるため、いったんメラノプシンが活性化すると、下流に存在するホスホリパーゼCの活性化を介して非選択的陽イオンチャネル(TRPCチャネル)を開口すると考えられている。培養細胞にメラノプシンとTRPC3チャネルを共発現させた系では、青色光照射により膜電位を脱分極させることに成功している[20]。特徴としては、光感受性が非常に高く、一度光刺激を行うと細胞内シグナル伝達系を介するために数分に渡り持続的に活性化できる。
光活性化タンパク質の導入方法
光活性化タンパク質を特定神経に導入するための主な方法として、以下の3種類が挙げられる。
- ウイルスベクターを用いた方法
利点として、迅速かつ多用途な導入が可能であること、また高感染性かつ高コピー数であり発現レベルが高いことが挙げられる。さらに、遺伝子改変動物の系が確立していない生物に対しても発現させることができる。現在のところ、マウス、ラット、霊長類においてはレンチウイルスやアデノ随伴ウイルス(AAV)等で導入に成功している。 - Creマウス+ウイルスベクター
光活性化タンパク質を特定細胞のみに発現させるために、Creリコンビナーゼ依存的に遺伝子を発現するウイルスベクターを用いて遺伝子導入する。このときdoublefloxed inverted open-reading-frame (DIO)と呼ばれる、光活性化タンパク質が2ペアのlox配列(例えばloxPとlox2272)に挟まれた状態で逆向きに挿入されている。Creリコンビナーゼ発現細胞のみで光活性化タンパク質が発現してくることになる。 - 遺伝子改変動物を作製する
遺伝子改変動物またはノックイン動物を作製する。最初に成功した遺伝子改変マウスはThy1プロモーターが用いられた。遺伝子改変動物を作製するためには、強力なプロモーターを使用することが成功の鍵を握る。欠点としては、作製、管理、維持の過程において時間と労力と費用がかかることが挙げられるが、利点として光活性化タンパク質の発現量を一定に保つことができる。
| チャネル名 | 活性化波長 | 脱感作レベル | 光感受性 | τon | τoff |
| ChR2 | 〜470 nm | 〜0.22 | 〜1.10 mW mm-2 | 〜1.21 ms | 〜13.5 ms |
| ChR2/H134R | 〜450 nm | 〜0.39 | 〜1.07 mW mm-2 | 〜1.92 ms | 〜17.9 ms |
| ChR2/C128X | 〜480 nm | - | 〜0.01 mW mm-2 | 7.2-20.0 ms | 2-100 s |
| ChETA | 〜490 nm | 〜0.24 | 〜5.02 mW mm-2 | 〜0.86 ms | 〜7.9-8.5 ms |
| ChIEF | 〜450 nm | 〜0.80 | 〜1.65 mW mm-2 | 〜1.62 ms | 〜12.0 ms |
| ChRGR | 〜520 nm | 〜0.15 | 〜0.10 mW mm-2 | 〜1.20 ms | 〜4.0 ms |
| VChR1 | 〜570 nm | 〜0.48 | - | 〜2.80 ms | >90 ms |
参考文献
- ↑ Resource not found in PubMed.
- ↑ 2.0 2.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.