「カリウムチャネル」の版間の差分
細編集の要約なし |
Kazuharufurutani (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の19版が非表示) | |||
| 1行目: | 1行目: | ||
英:potassium channel、英略語:K<sup>+</sup> channel 独:Kaliumkanal 仏:canal potassique | 英:potassium channel、英略語:K<sup>+</sup> channel 独:Kaliumkanal 仏:canal potassique | ||
カリウムチャネルは[[wikipedia:ja:カリウムイオン|カリウムイオン]]を選択的に透過させる[[イオンチャネル]]である。[[静止膜電位]]の形成や電気的な細胞応答、[[シナプス伝達]]やカリウム濃度の[[wikipedia:ja:恒常性|恒常性]]維持に関わっている。100種類以上の遺伝子群から構成されているが、六回膜貫通型の「[[カリウムチャネル#電位依存性カリウムチャネル|電位依存性カリウムチャネル]]」と「[[カリウムチャネル#カルシウム活性化カリウムチャネル|カルシウム活性化カリウムチャネル]]」、二回膜貫通型の「[[カリウムチャネル#内向き整流性カリウムチャネル|内向き整流性カリウムチャネル]]」、四回膜貫通型の「[[カリウムチャネル#Two-pore domainカリウムチャネル|Two-pore domainカリウムチャネル]]」に大別される。 | |||
カリウムチャネルは[[ | |||
==カリウムチャネルとは== | ==カリウムチャネルとは== | ||
カリウムチャネルは[[ | カリウムチャネルは[[wikipedia:ja:カリウムイオン|カリウムイオン]]を選択的に透過させる[[イオンチャネル]]である。[[静止膜電位]]の形成や電気的な細胞応答、[[シナプス伝達]]やカリウム濃度の[[wikipedia:ja:恒常性|恒常性]]維持に関わっている。ほとんどのカリウムチャネルはαサブユニットが四量体を形成し、中央部分にカリウムを通す小孔(ポア)が開くようになっている。[[電気生理学]]的特性やαサブユニットの[[wikipedia:ja:膜貫通領域|膜貫通領域]]の構造の違いにより、六回膜貫通型の「[[カリウムチャネル#電位依存性カリウムチャネル|電位依存性カリウムチャネル]]」と「[[カリウムチャネル#カルシウム活性化カリウムチャネル|カルシウム活性化カリウムチャネル]]」、二回膜貫通型の「[[カリウムチャネル#内向き整流性カリウムチャネル|内向き整流性カリウムチャネル]]」、四回膜貫通型の「[[カリウムチャネル#Two-pore domainカリウムチャネル|Two-pore domainカリウムチャネル]]」に大別される。イオン透過経路を構成するαサブユニットと電流特性や膜発現量を制御するβサブユニットあわせると100種類以上の遺伝子群から構成されており、これら豊富なサブユニット分子種、αサブユニットのヘテロ四量体形成、さらにβサブユニットとの複合体形成がカリウムチャネルの多様性の実体的理由である。イオンチャネルの中で、電気生理学的な解析、生化学・構造生物学的な解析が最も行われているのがカリウムチャネルであり、イオンチャネルの分子機構に関する極めて重要な研究成果がカリウムチャネルを用いた研究から得られている。 | ||
==基本的分子機能と構造 == | ==基本的分子機能と構造 == | ||
細胞は[[細胞膜|脂質二重膜]]に囲まれているため、荷電したイオンは自由に細胞に出入りすることは出来ない。そこで細胞はイオンを通すための小孔(ポア)を膜に持っている。[[電気化学ポテンシャル]]を駆動力として、カリウムイオン(K<sup>+</sup>)の選択的な膜透過をつかさどるタンパク質がカリウムチャネルである<ref>'''Y Kurachi, LY Jan, M Lazdunski'''<br>"Potassium Ion Channels: Molecular Structure, Function, and Diseases". Current Topics in Membranes, vol 46<br>''Academic Press, London'':1999 ISBN 0-12-153346-8.</ref><ref>'''B Hille'''<br>"Chapter 5: Potassium Channels and Chloride Channels". Ion channels of excitable membranes<br>''Sinauer Associate Inc, Sunderland, MA'':pp. 131–168:2002 ISBN 0-87893-321-2.</ref>。従来の電気生理学的解析により各組織、各細胞で異なる性質を持つカリウムチャネルの存在が明らかにされてきた。しかしそれらに共通する機能として、生体膜のエネルギー障壁([[ | 細胞は[[細胞膜|脂質二重膜]]に囲まれているため、荷電したイオンは自由に細胞に出入りすることは出来ない。そこで細胞はイオンを通すための小孔(ポア)を膜に持っている。[[電気化学ポテンシャル]]を駆動力として、カリウムイオン(K<sup>+</sup>)の選択的な膜透過をつかさどるタンパク質がカリウムチャネルである<ref>'''Y Kurachi, LY Jan, M Lazdunski'''<br>"Potassium Ion Channels: Molecular Structure, Function, and Diseases". Current Topics in Membranes, vol 46<br>''Academic Press, London'':1999 ISBN 0-12-153346-8.</ref><ref>'''B Hille'''<br>"Chapter 5: Potassium Channels and Chloride Channels". Ion channels of excitable membranes<br>''Sinauer Associate Inc, Sunderland, MA'':pp. 131–168:2002 ISBN 0-87893-321-2.</ref>。従来の電気生理学的解析により各組織、各細胞で異なる性質を持つカリウムチャネルの存在が明らかにされてきた。しかしそれらに共通する機能として、生体膜のエネルギー障壁([[wikipedia:Self-energy|ボルンエネルギー]])を克服しカリウムイオンを選択的に透過させる機能を持っている。また、多くは小孔の開閉を制御する特徴的なゲート機能を備えている。 | ||
=== 二次構造 === | === 二次構造 === | ||
| 23行目: | 14行目: | ||
[[Image:KCh fig1.png|thumb|right|300px|<b>図1.カリウムチャネルの二次構造、結晶構造、ドメイン配置</b><br />2TM型の内向き整流性カリウムチャネル、4TM型のtwo-pore domainカリウムチャネル、6TM型の電位依存性カリウムチャネル・カルシウム活性化カリウムチャネルαサブユニットの二次構造(上段)、結晶構造のTop view(中段)そしてドメイン配置(下段)。結晶構造は、PBD Data Bankに登録されたPDBID 3SPI (Kir2.2)、3UKM (TWIK-1)、2R9R (Kv1.2-Kv2.1 paddle chimera channel)をもとにPyMolで作成。]] | [[Image:KCh fig1.png|thumb|right|300px|<b>図1.カリウムチャネルの二次構造、結晶構造、ドメイン配置</b><br />2TM型の内向き整流性カリウムチャネル、4TM型のtwo-pore domainカリウムチャネル、6TM型の電位依存性カリウムチャネル・カルシウム活性化カリウムチャネルαサブユニットの二次構造(上段)、結晶構造のTop view(中段)そしてドメイン配置(下段)。結晶構造は、PBD Data Bankに登録されたPDBID 3SPI (Kir2.2)、3UKM (TWIK-1)、2R9R (Kv1.2-Kv2.1 paddle chimera channel)をもとにPyMolで作成。]] | ||
ほとんどのカリウムチャネルはポアドメイン形成に関わるタンパク質(αサブユニット)が4つ一組になって働く。カリウムチャネルのαサブユニットの二次構造を図1に示す。代表的な構造として、電位依存性カリウムチャネルが含まれる六回膜貫通(6TM)型の構造と、内向き整流性カリウムチャネルが含まれる二回膜貫通(2TM)型の構造がある。膜貫通領域(セグメント)のS5とS6(2TM型ではTM1とTM2)はカリウムイオンを透過させるためのポアドメインを構成する。またこの二つの膜貫通領域間の細胞外リンカー部分にはカリウムチャネルで広く保持されたシグネチャ配列(signature | ほとんどのカリウムチャネルはポアドメイン形成に関わるタンパク質(αサブユニット)が4つ一組になって働く。カリウムチャネルのαサブユニットの二次構造を図1に示す。代表的な構造として、電位依存性カリウムチャネルが含まれる六回膜貫通(6TM)型の構造と、内向き整流性カリウムチャネルが含まれる二回膜貫通(2TM)型の構造がある。膜貫通領域(セグメント)のS5とS6(2TM型ではTM1とTM2)はカリウムイオンを透過させるためのポアドメインを構成する。またこの二つの膜貫通領域間の細胞外リンカー部分にはカリウムチャネルで広く保持されたシグネチャ配列(signature sequence, 選択的特異配列とも; TXTTVGYG, 特にGYGまたはGFGはよく保存されている)を含むP領域が存在し、ここは[[イオン選択フィルター]]機能に関わる。一方、S1-S4で構成される領域は電位センサーとして機能し、S4には正に帯電したアミノ酸が周期的に並んでいる。6TM型だが、膜電位ではなく細胞内[[カルシウム|Ca<sup>2+</sup>]]によって活性化されるカリウムチャネルも存在する。2TMの内向き整流性カリウムチャネルは6TM型の電位依存性カリウムチャネルの電位センサードメイン(S1-S4)に対応する構造をもっておらず、代わりに大きな細胞内領域をもつ。また、2TM及びP領域がサブユニット分子内で2回タンデムにつながった構造の4TM型のカリウムチャネルも存在する。このαサブユニットは二量体を形成しイオンチャネルとして機能する。ポアドメインを構成する領域を分子内に2つ有するためtwo-pore domainカリウム(K2P)チャネル、あるいはタンデム(直列)ポアドメイン(tandem pore domain)チャネルと呼ばれる。 | ||
=== 結晶構造 === | === 結晶構造 === | ||
カリウムチャネルの結晶化とその構造解析が進んでいる。1998年の[[ | カリウムチャネルの結晶化とその構造解析が進んでいる。1998年の[[wikipedia:ja:原核生物|原核生物]]由来の2TM型カリウムチャネルKcsAの[[wikipedia:ja:X線構造解析|X線構造解析]]に始まり(図1,2)<ref name="ref3"><pubmed>9525859</pubmed></ref>、Ca依存的/活性化カリウムチャネル(MthK, hBK)、電位依存性カリウムチャネル(KvAP, Kv1.2-Kv2.1 paddle chimera channel)、Kirチャネル(KirBac、Kir2、Kir3)、K2Pチャネル(TRAAK、TWIK-1)と原核生物に留まらず近年では[[wikipedia:ja:真核生物|真核生物]]のカリウムチャネルの構造も相次いで報告されている。共通の性質として(図2)、①2つの膜貫通領域から水性のポアが形成される、②P領域がポアヘリックスとイオン選択フィルターを形成し、シグネチャ配列がイオン選択性フィルターの一部を形成し、それは細胞膜の中心から外側にかけて存在する、③イオン選択フィルターの細胞内側に中心腔(central cavity)とよばれる水性の空間が存在する、④ポアヘリックスが4対称軸の中心に向いておりC末側が中心腔に到達している、ことなどがあげられる。これらの水性ポアドメインの構造に関わる共通点から、カリウムチャネルの選択イオン透過機能に関わる立体構造はほぼ等価であるといえる。 | ||
=== 選択的イオン透過機能を支える構造基盤 === | === 選択的イオン透過機能を支える構造基盤 === | ||
| 34行目: | 25行目: | ||
[[Image:KCh fig3.png|thumb|right|300px|<b>図3.カリウムチャネルの選択的イオン透過機構の構造基盤</b><br />a.イオンは水分子と相互作用(水和)した状態で水に溶けている(上段)。イオンチャネルの細いフィルター内に入る際に、イオンは水分子との相互作用をフィルターを形成するアミノ酸の酸素原子を含むカルボニル基との相互作用に置き換える(下段)。b.カリウムチャネルのシグネチャ配列がイオン選択フィルターを形成する。カリウムは中心軸に沿ってフィルター内では4箇所の結合部位に存在する。c.4本のペプチド主鎖から提供された酸素原子が5つの回転対称な平面を構成する。カリウム(緑丸)と水(赤丸)は交互に一列配置しているイオン透過過程のモデル。カリウムの[1,3][2,4]配置では上下の平面由来の8つの酸素原子と配位しており、中間遷移状態では同一平面の4つの酸素原子および上下の2つの水分子と配位している。いづれの配位結合もエネルギー的にはほぼ等価であり、これがカリウムのスムーズな移動を保証する。<br />b.Morais-Cabralら Nature 2001<ref name="ref5"><pubmed>11689935</pubmed></ref>、c.Zhouら Nature 2001<ref name="ref6"><pubmed>11689936</pubmed></ref>より許可を得て転載]] | [[Image:KCh fig3.png|thumb|right|300px|<b>図3.カリウムチャネルの選択的イオン透過機構の構造基盤</b><br />a.イオンは水分子と相互作用(水和)した状態で水に溶けている(上段)。イオンチャネルの細いフィルター内に入る際に、イオンは水分子との相互作用をフィルターを形成するアミノ酸の酸素原子を含むカルボニル基との相互作用に置き換える(下段)。b.カリウムチャネルのシグネチャ配列がイオン選択フィルターを形成する。カリウムは中心軸に沿ってフィルター内では4箇所の結合部位に存在する。c.4本のペプチド主鎖から提供された酸素原子が5つの回転対称な平面を構成する。カリウム(緑丸)と水(赤丸)は交互に一列配置しているイオン透過過程のモデル。カリウムの[1,3][2,4]配置では上下の平面由来の8つの酸素原子と配位しており、中間遷移状態では同一平面の4つの酸素原子および上下の2つの水分子と配位している。いづれの配位結合もエネルギー的にはほぼ等価であり、これがカリウムのスムーズな移動を保証する。<br />b.Morais-Cabralら Nature 2001<ref name="ref5"><pubmed>11689935</pubmed></ref>、c.Zhouら Nature 2001<ref name="ref6"><pubmed>11689936</pubmed></ref>より許可を得て転載]] | ||
イオンチャネルの電気生理学的な解析によって、[[単一チャネル電流]]を定量的に記録することが可能である。この方法によって単一のイオンチャネルを透過するイオンの速度を見積もることが出来る。この実験から、カリウムチャネルではK<sup>+</sup>イオンがNa<sup>+</sup>イオンよりも1000倍ほど透過性が高いことが知られている(一価陽イオンの選択性序列は K<sup>+</sup>>Rb<sup>+</sup>>Cs<sup>+</sup>>Na<sup>+</sup>>Li<sup>+</sup>。これはEisenman IV型であり、イオン選択フィルターがやや弱い[[ | イオンチャネルの電気生理学的な解析によって、[[単一チャネル電流]]を定量的に記録することが可能である。この方法によって単一のイオンチャネルを透過するイオンの速度を見積もることが出来る。この実験から、カリウムチャネルではK<sup>+</sup>イオンがNa<sup>+</sup>イオンよりも1000倍ほど透過性が高いことが知られている(一価陽イオンの選択性序列は K<sup>+</sup>>Rb<sup>+</sup>>Cs<sup>+</sup>>Na<sup>+</sup>>Li<sup>+</sup>。これはEisenman IV型であり、イオン選択フィルターがやや弱い[[wikipedia:ja:静電場|静電場]]をもつことを示唆する)。しかも、開いた小孔を電気化学的な差に従って、イオンの水溶液中の拡散速度に匹敵する程の、1秒間に数百万個ものイオンが通過することが分かっている(単一イオンチャネルコンダクタンスが数百pSに達すものもある)。つまりカリウムチャネルは極めて高いイオン選択性と非常に早いイオン透過速度という一見相容れない特性を両立する。 | ||
特定のイオンを透過させる機構としては大きさによる分子フィルター機構がまず考えられる。しかしながら、[[ | 特定のイオンを透過させる機構としては大きさによる分子フィルター機構がまず考えられる。しかしながら、[[wikipedia:ja:イオン半径|イオン半径]]では、Na<sup>+</sup>(イオン半径r=0.95 Å)はK<sup>+</sup>(r=1.33 Å)はよりも小さく、なぜK<sup>+</sup>を透過してNa<sup>+</sup>を透過させないのか説明がつかない。カリウムチャネルのこのカリウム選択的透過機構はこのチャネルがもつ小孔の最も狭い領域、[[イオン選択フィルター]]の構造に関係がある<ref name="ref3" /><ref name="ref4" />。イオンは水分子と相互作用(水和)した状態で水に溶けている(図3a)。イオンチャネルの細いフィルター内に入る際に、イオンは水分子との相互作用をフィルターを形成するアミノ酸の[[wikipedia:ja:酸素|酸素]]原子を含む[[wikipedia:ja:カルボニル基|カルボニル基]]との相互作用に置き換える(図3a, b)。小孔の大きさがK<sup>+</sup>イオンに適切であり、K<sup>+</sup>イオンは4つサブユニットのカルボニル基から均等に作用を受け、安定な8[[wikipedia:ja:水和|水和]]様構造をとり安定する(図3a, c)<ref name="ref5" /><ref name="ref6" />。一方、Na<sup>+</sup>イオンはイオン半径が小さくK<sup>+</sup>イオンのようには相互作用が出来ず(図3a)、K<sup>+</sup>イオンに比べ不安定に存在する。このような違いがK<sup>+</sup>イオンの選択的な透過に寄与していると考えられている。この機構は[[最適合close-fit説]]とよばれる。 | ||
カリウムチャネルの選択フィルターは12 Åほどの長さがあり結晶構造では4つのK<sup>+</sup>イオン結合部位が認められる(図3b)。しかし近接した結合部位にK<sup>+</sup>イオンが同時に結合するとイオン間で電気的な反発がおこり不安定であると考えられる。そのため4つの部位を細胞外側から1-4サイトとすると、K<sup>+</sup>イオンとチャネルの結合には[1,3]サイトに結合した状態と[2,4]サイトに結合した状態があると考えられる(図3c)。また、フィルター内に複数のイオンが同時に入ることによってイオン間に静電気的反発力が発生し、玉突き状態になることが早いイオン透過に寄与していると考えられている<ref><pubmed>11689935</pubmed></ref>。 | カリウムチャネルの選択フィルターは12 Åほどの長さがあり結晶構造では4つのK<sup>+</sup>イオン結合部位が認められる(図3b)。しかし近接した結合部位にK<sup>+</sup>イオンが同時に結合するとイオン間で電気的な反発がおこり不安定であると考えられる。そのため4つの部位を細胞外側から1-4サイトとすると、K<sup>+</sup>イオンとチャネルの結合には[1,3]サイトに結合した状態と[2,4]サイトに結合した状態があると考えられる(図3c)。また、フィルター内に複数のイオンが同時に入ることによってイオン間に静電気的反発力が発生し、玉突き状態になることが早いイオン透過に寄与していると考えられている<ref><pubmed>11689935</pubmed></ref>。 | ||
イオンは膜を透過しようとするとボルンエネルギーというエネルギー障壁を超える必要がある。小孔はそのボルンエネルギーを低くする役目がある。もし小孔が均一な内径の形状であるとすると、ボルンエネルギーは均一に低下し、ボルンエネルギーの極大値は膜の中央部分にくる。結晶構造で存在が知られたイオンチャネルの内腔は大量の水分子で満たされている(図2)。またポアヘリックスがそのC末端側を中心腔の内部に向けていることで、[[ | イオンは膜を透過しようとするとボルンエネルギーというエネルギー障壁を超える必要がある。小孔はそのボルンエネルギーを低くする役目がある。もし小孔が均一な内径の形状であるとすると、ボルンエネルギーは均一に低下し、ボルンエネルギーの極大値は膜の中央部分にくる。結晶構造で存在が知られたイオンチャネルの内腔は大量の水分子で満たされている(図2)。またポアヘリックスがそのC末端側を中心腔の内部に向けていることで、[[wikipedia:ja:αヘリックス|αヘリックス]]の[[wikipedia:ja:双極子モーメント|双極子モーメント]]が空洞内に[[wikipedia:ja:陽イオン|陽イオン]]が留まりやすい環境を作り出す。こういった中心腔の存在により、本来ボルンエネルギーの高いはずの膜中央部でイオンは水和して安定に存在できる。一方で、イオン透過経路を形成するチャネル壁は[[wikipedia:ja:疎水性|疎水性]]の残基で裏打ちされている。これにより水和したイオンはイオン壁と強い相互作用をすることなく、言い換えればポテンシャルの谷間に落ち込んで出られなくなることなく、細胞質からイオン選択フィルターまでの早いイオン流を確保している。生理的な実験とこれまでに述べたようなイオン透過経路の構造から、膜にかけられた外部電位によるポア内電場のおよそ80%は選択フィルターで生じていると推測される(図2)。 | ||
カリウムチャネルの結晶構造解析に成功し、イオンチャネルの本質的特徴の一つである選択的イオン透過機構の謎を解明した[[ | カリウムチャネルの結晶構造解析に成功し、イオンチャネルの本質的特徴の一つである選択的イオン透過機構の謎を解明した[[wikipedia:ja:ロデリック・マキノン|ロデリック・マッキノン]]は2003年[[wikipedia:ja:ノーベル化学賞|ノーベル化学賞]]を受賞している。 | ||
== 分子機構と構造による分類 == | == 分子機構と構造による分類 == | ||
| 52行目: | 43行目: | ||
=== 電位依存性カリウムチャネル === | === 電位依存性カリウムチャネル === | ||
電位依存性カリウム(Kv)チャネルは静止膜電位付近ではポアが閉じているが、[[脱分極]]によって活性化([[開口確率]]が上昇)し小孔が開口するカリウムチャネルである(図4)。Kvチャネルファミリーのαサブユニットの遺伝子はKv1-12の12クラス、さらにサブファミリーも存在し40種類ほど単離されている<ref><pubmed>14657415</pubmed></ref><ref | 電位依存性カリウム(Kv)チャネルは静止膜電位付近ではポアが閉じているが、[[脱分極]]によって活性化([[開口確率]]が上昇)し小孔が開口するカリウムチャネルである(図4)。Kvチャネルファミリーのαサブユニットの遺伝子はKv1-12の12クラス、さらにサブファミリーも存在し40種類ほど単離されている<ref><pubmed>14657415</pubmed></ref><ref><pubmed>16382104</pubmed></ref>。先に述べたように、6TM型の二次構造をとり、N末端から5番目、6番目の膜貫通領域(S5, S6)がポアドメインの形成に関与し、1番目から4番目の膜貫通領域(S1-S4)が電位センサーとして機能する構造を形成する。結晶構造が報告され、電位センサードメインが隣接するサブユニット由来のポアドメインと近接しているという特徴的なドメイン配置が明らかにされている(図1)。 | ||
Kvチャネルは、活性化の電位依存性や[[不活性化]]の有無、薬物感受性などから様々なタイプに細分類される。脱分極刺激による活性化後直ぐに不活性化され、一過的な電流を流す[[早期不活性化カリウムチャネル]](A型Kチャネル)と不活性化が殆どおこらず活性化が持続する[[遅延整流性カリウムチャネル]]に分けることができる。また活性化のスピードから「早い成分」と「遅い成分」とに、あるいは活性化の閾値から「低閾値(low-voltage- | Kvチャネルは、活性化の電位依存性や[[不活性化]]の有無、薬物感受性などから様々なタイプに細分類される。脱分極刺激による活性化後直ぐに不活性化され、一過的な電流を流す[[早期不活性化カリウムチャネル]](A型Kチャネル)と不活性化が殆どおこらず活性化が持続する[[遅延整流性カリウムチャネル]]に分けることができる。また活性化のスピードから「早い成分」と「遅い成分」とに、あるいは活性化の閾値から「低閾値(low-voltage-activated, LVA)型」と「高閾値(high-voltage-activated, HVA)型」とに分類されることもある。 | ||
Kvチャネルの活性化の機構としては、膜電位変化に応じて電位センサードメインの構造変化が起こることが想定されている。この電位センサードメインの構造変化が、チャネルの開閉時に測定されるゲート電流と呼ばれる小さな電流を担っていると考えられている。電位センサードメインが脂質二重膜を横切る膜電位の変化をどのように感知し、そして小孔の開閉を制御する仕組みが精力的に研究されているが、その分子機構は明らかではない。近年は電位センサードメインの結晶構造が報告され、その構造変化とその結果起こる小孔の開口のメカニズムに関して議論が続いている。 | Kvチャネルの活性化の機構としては、膜電位変化に応じて電位センサードメインの構造変化が起こることが想定されている。この電位センサードメインの構造変化が、チャネルの開閉時に測定されるゲート電流と呼ばれる小さな電流を担っていると考えられている。電位センサードメインが脂質二重膜を横切る膜電位の変化をどのように感知し、そして小孔の開閉を制御する仕組みが精力的に研究されているが、その分子機構は明らかではない。近年は電位センサードメインの結晶構造が報告され、その構造変化とその結果起こる小孔の開口のメカニズムに関して議論が続いている。 | ||
| 62行目: | 53行目: | ||
チャネルのN型不活性化に関わる領域は、以前はボール状の構造をとりS4-S5のリンカー部分に結合し細胞のポア領域を塞ぐような機構(ball-and-chain機構)が提唱されていたが、最近の解析からはもう少し細い線状の構造がポア内に侵入してポアを塞ぐと考えられるようになってきた。 | チャネルのN型不活性化に関わる領域は、以前はボール状の構造をとりS4-S5のリンカー部分に結合し細胞のポア領域を塞ぐような機構(ball-and-chain機構)が提唱されていたが、最近の解析からはもう少し細い線状の構造がポア内に侵入してポアを塞ぐと考えられるようになってきた。 | ||
一方、C型の不活性化機構にはP領域とS6(あるいはM2)の一部が関与していると見られる。この領域はポアの細胞外の入り口付近にあたり、この部分の構造変化が基盤であると考えられている。 | 一方、C型の不活性化機構にはP領域とS6(あるいはM2)の一部が関与していると見られる。この領域はポアの細胞外の入り口付近にあたり、この部分の構造変化が基盤であると考えられている。 | ||
===カルシウム活性化カリウムチャネル === | ===カルシウム活性化カリウムチャネル === | ||
カルシウム活性化カリウムチャネル(KCaチャネル)は[[wikipedia:ja:細胞質|細胞質]]のCa<sup>2+</sup>濃度上昇によって活性が増加するカリウムチャネルである<ref><pubmed>12678784</pubmed></ref><ref><pubmed>15378036</pubmed></ref><ref name="ref13"><pubmed>21942705</pubmed></ref>。シングルチャネルコンダクタンスの違いから[[大(Big)コンダクタンスカルシウム活性化カリウム(BK)チャネル]]と[[小(Small)コンダクタンスカルシウム活性化カリウム(SK)チャネル]]、そしてBKチャネルとIKチャネルの中間のコンダクタンスを持つ[[中間(Intermediate)コンダクタンスカルシウム活性化カリウム(IK)チャネル]]に分類されている。BKチャネルは電位依存的な活性化がおこり、アミノ酸の相同性の面からも電位依存性カリウムチャネルに分類されることも多いが、本項ではKCaチャネルの項目で扱う。BKチャネルにCa<sup>2+</sup>が結合することで電位依存的な活性化の特性が影響をうける。一方、IK、SKチャネルは電位非依存的であるが、細胞内Ca<sup>2+</sup>濃度上昇(100-600 nM)によって開口する。この機構には細胞内[[カルモデュリン]](CaM)が必要である。 | |||
サブユニットの構造としてはKvチャネルと同様に六回膜貫通領域と一つのP領域を持つ6TM型である。SK、IKチャネルサブユニット(KCNN1- | サブユニットの構造としてはKvチャネルと同様に六回膜貫通領域と一つのP領域を持つ6TM型である。SK、IKチャネルサブユニット(KCNN1-3, or SK1-4)はS4に正電荷を帯びたアミノ酸が揃っておらず、機能的に電位非依存的であることに関連する。またS6のC末端側にCaMに結合する領域をもつ。一方、[[wikipedia:ja:哺乳類|哺乳類]]のBKチャネル[KCNMA1, MaxiK or Slo1([[ショウジョウバエ]]のslowpoke mutantから見つかったことに由来)]はS1-S6に加えN末端側にさらにS0膜貫通領域をもつ。S4が電位センサーの中心として機能し、C末端の二つのRCK(Regulators of the K conductance)領域はCa<sup>2+</sup>依存的な活性化機構に重要な役割を果す。これらはすべて四量体を形成しチャネルを構成する。BKチャネルのβサブユニットSlob(slowpoke channel binding protein)も同定されている。 | ||
BKチャネルと同じsloサブファミリーに属するSlo2(Slo2. | BKチャネルと同じsloサブファミリーに属するSlo2(Slo2.1, 2.2)チャネルはCa<sup>2+</sup>によってではなく、Na<sup>+</sup>によって活性化される。このチャネルは神経細胞などで観察されるNa活性化カリウムチャネルの分子実体であると考えられている。 | ||
=== 内向き整流性カリウムチャネル === | === 内向き整流性カリウムチャネル === | ||
[[内向き整流性カリウム(Kir)チャネル]]は、遅延整流性カリウムチャネルの外向き[[ | [[内向き整流性カリウム(Kir)チャネル]]は、遅延整流性カリウムチャネルの外向き[[wikipedia:ja:整流|整流]]性と明らかに異なる電位依存性を示し、カリウムの平衡電位E<sub>K</sub>よりも過分極した膜電位でコンダクタンスが増加し内向きカリウム電流を流すカリウムチャネルである(図4)<ref><pubmed>20086079</pubmed></ref>。遅延整流性カリウムチャネルの外向き整流特性はチャネルの電位依存的な活性化によるものだが、Kirチャネルの外向き整流特性は細胞内の[[wikipedia:ja:ポリアミン|ポリアミン]]や[[wikipedia:ja:マグネシウム|マグネシウム]]イオンによる外向き電流のブロックによっておこる。Kirチャネルファミリーのサブユニットの遺伝子がKir1-7サブファミリー、15種類ほど単離されている。Kirチャネルサブユニットによって内向き整流特性の強さは大きく異なる。整流性が強く古典的な内向き整流性カリウム電流を担う[[Kir2]]サブファミリーの他に、整流性が中程度、もしくは殆どなくカリウム輸送などに関わる[[Kir1]]、[[Kir4]]、[[Kir5]]、[[Kir7]]サブファミリー、細胞の[[wikipedia:ja:心臓|心臓]]の[[脳神経#第X脳神経|迷走神経]]依存的な[[wikipedia:ja:徐脈|徐脈]]や抑制性の[[シナプス伝達]]などに関わる[[Gタンパク質制御K]](K<sub>G</sub>)チャネルの分子実体である[[Kir3]]サブファミリーや、[[wikipedia:ja:グルコース|グルコース]]依存的な[[wikipedia:ja:膵臓β細胞|膵臓β細胞]]からの[[wikipedia:ja:インスリン|インスリン]]分泌に関わる[[ATP感受性カリウムチャネル]](K<sub>ATP</sub>)のポア領域も[[Kir6]]サブファミリーのKirチャネルに属する。 | ||
Kirチャネルのサブユニットは二回膜貫通領域と一つのP領域を有し、Kvカリウムチャネルの電位センサードメイン(S1-S4)に相当する部位はもっていない。代わりにN末端、C末端で形成される大きな細胞内領域が特徴である。Kirチャネルサブユニットはホモあるいはヘテロテトラマーを形成し機能する。 | Kirチャネルのサブユニットは二回膜貫通領域と一つのP領域を有し、Kvカリウムチャネルの電位センサードメイン(S1-S4)に相当する部位はもっていない。代わりにN末端、C末端で形成される大きな細胞内領域が特徴である。Kirチャネルサブユニットはホモあるいはヘテロテトラマーを形成し機能する。 | ||
| 85行目: | 76行目: | ||
{| class="wikitable" | {| class="wikitable" | ||
|+ | |+カリウムチャネルのクラス、機能、薬理学<ref name="pmid16382103"/><ref name="pmid16382104"/><ref name="pmid16382105"/><ref name="pmid16382106"/> | ||
|- | |- | ||
|'''Class''' | |'''Class''' | ||
! | ! IUPHAR Name | ||
! | !Human Gene Name | ||
! | !Other Name | ||
!補助サブユニット | !補助サブユニット | ||
!分子機能 | !分子機能 | ||
| 98行目: | 89行目: | ||
!活性化薬(EC<sub>50</sub>) | !活性化薬(EC<sub>50</sub>) | ||
|- | |- | ||
|rowspan= | |rowspan=5 | [[Calcium-activated potassium channel|Calcium-activated]] <br /> 6[[transmembrane helix|T]] & 1[[pore-forming loop|P]] | ||
| | | | ||
K<sub>Ca</sub>1.1 | |||
| | |||
KCNMA1 | |||
| | | | ||
Slo, Slo1, BK | |||
| | | | ||
| | | | ||
脱分極によって活性化、細胞内Ca<sup>2+</sup>濃度上昇による活性化 | |||
| | | | ||
書く | |||
| | | | ||
charybdotoxin(2.9 nM), iberiotoxin(1.7 nM), TEA(0.14 mM) | |||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>Ca</sub>2.1-2.3 | |||
| | | | ||
KCNN1-3 | |||
| | | | ||
SK<sub>Ca</sub>1-3 | |||
| | | | ||
calmodulin | |||
| | |||
細胞内Ca<sup>2+</sup>濃度上昇による活性化 | |||
| | | | ||
書く | |||
| | | | ||
UCL1684(1 nM for K<sub>Ca</sub>2.1; 250 pM for K<sub>Ca</sub>2.2), apamin(8 nM for K<sub>Ca</sub>2.1; 60-200 pM for K<sub>Ca</sub>2.2; 10 nM for K<sub>Ca</sub>2.3), tamapin(42 nM for K<sub>Ca</sub>2.1; 24 pM for K<sub>Ca</sub>2.2) | |||
| | | | ||
EBIO(630 µM), NS309(30 nM) | |||
|- | |- | ||
| | | | ||
K<sub>Ca</sub>3.1 | |||
| | |||
KCNT1 | |||
| | | | ||
IK<sub>Ca</sub>1 | |||
| | | | ||
calmodulin | |||
| | | | ||
細胞内Ca<sup>2+</sup>濃度上昇による活性化 | |||
| | | | ||
書く | |||
| | | | ||
charybdotoxin(5 nM), iberiotoxin(1.7 nM), TEA(24 mM), ketoconazol(30 µM), econazole(12 µM) | |||
| | | | ||
EBIO, NS309(10 nM) | |||
|- | |- | ||
| | | | ||
K<sub>Ca</sub>4.1, 4.2 | |||
| | |||
KCNT2 | |||
| | | | ||
Slack, Slo2.2; Slick, Slo2.1 | |||
| | | | ||
| | | | ||
細胞内Na<sup>+</sup>濃度上昇による活性化 | |||
| | | | ||
書く | |||
| | | | ||
TEA, quinidine | |||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>Ca</sub>5.1 | |||
| | |||
KCNU1 | |||
| | | | ||
Slo3 | |||
| | | | ||
| | | | ||
細胞内Ca<sup>2+</sup>濃度上昇による活性化 | |||
| | | | ||
書く | |||
| | | | ||
TEA | |||
| | | | ||
|- | |- | ||
|rowspan=8 | [[Inward-rectifier potassium ion channel|Inwardly rectifying]] <br /> 2[[transmembrane helix|T]] & 1[[pore-forming loop|P]] | |||
| | |||
K<sub>ir</sub>1.1 | |||
| | | | ||
KCNJ1 | |||
| | | | ||
ROMK | |||
| | | | ||
| | | | ||
常時活性 | |||
| | | | ||
ネフロンにおけるカリウムリサイクリンク、分泌 | |||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup> | |||
| | | | ||
|- | |- | ||
|K<sub>ir</sub>2.1-2.4 | |||
| | | | ||
KCNJ2,12,4,14 | |||
| | | | ||
IRK | |||
| | | | ||
| | | | ||
常時活性 | |||
| | | | ||
静止膜電位形成への関与、心臓におけるIK1電流(Kir2.1/Kir2.2) | |||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup>, 細胞内Mg<sup>2+</sup>, 細胞内polyamines | |||
| | | | ||
|- | |||
| | | | ||
K<sub>ir</sub>3.1-3.4 | |||
| | | | ||
KCNJ3,6,9,5 | |||
| | | | ||
GIRK | |||
| | | | ||
| | | | ||
Gbgによる活性化、代謝型受容体依存的な膜興奮性抑制 | |||
| | | | ||
神経細胞における遅延性の抑制性シナプス後電位の形成(Kir3.1/Kir3.2)、心臓における徐脈の分子機構(Kir3.1/Kir3.4) | |||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup>, terpiapin | |||
| | | | ||
Gbg、細胞内Na<sup>+</sup>、PIP<sub>2</sub>、GPCR活性化薬(三量体G蛋白質シグナルを介して) | |||
|- | |- | ||
| | | | ||
K<sub>ir</sub>4.1-4.2 | |||
| | | | ||
KCNJ10,15 | |||
| | | | ||
KAB-2, BIR(K)10 | |||
| | | | ||
| | | | ||
常時活性 | |||
| | | | ||
脳内におけるグリア細胞によるカリウムバッファリング機構、内耳や腎臓におけるカリウム恒常性 | |||
| | |||
Ba<sup>2+</sup>, Cs<sup>+</sup>, 細胞内Mg<sup>2+</sup>, 細胞内polyamines | |||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>ir</sub>5.1 | |||
| | | | ||
KCNJ16 | |||
| | | | ||
BIR9 | |||
| | | | ||
| | | | ||
常時活性 | |||
| | | | ||
pHセンシング機構 | |||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup>, 細胞内H<sup>+</sup> | |||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>ir</sub>6.1 | |||
| | | | ||
KCNJ8 | |||
| | | | ||
uKATP-1 | |||
| | | | ||
SUR2B(血管平滑筋) | |||
| | | | ||
細胞内ヌクレオチドによる活性化 | |||
| | | | ||
血管平滑筋の緊張度調節 | |||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup>, スルホニル尿素剤(SURに結合することによる) | |||
| | | | ||
カリウムチャネル開口薬(diazoxide, pinacidil, nicorandilなど、SURに結合することによる) | |||
|- | |- | ||
| | | | ||
K<sub>ir</sub>6.2 | |||
| | | | ||
KCNJ11 | |||
| | | | ||
BIR | |||
| | | | ||
SUR1(膵臓b細胞), SUR2A(心筋細胞), SUR2B(血管平滑筋) | |||
| | | | ||
細胞内ATPによる抑制 | |||
| | | | ||
膵臓b細胞からのインスリン分泌、脳内における酸素・グルコースセンサー機能、心臓、脳における虚血に対する細胞保護作用 | |||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup>, スルホニル尿素剤(SURに結合することによる) | |||
| | | | ||
カリウムチャネル開口薬(diazoxide, pinacidil, nicorandilなど、SURに結合することによる) | |||
|- | |- | ||
| | | | ||
K<sub>ir</sub>7.1 | |||
| | | | ||
KCNJ13 | |||
| | | | ||
| | | | ||
| | | | ||
常時活性 | |||
| | | | ||
| | | | ||
Ba<sup>2+</sup>, Cs<sup>+</sup>(他のKirファミリーに比べて感受性は低い) | |||
| | | | ||
|- | |- | ||
|rowspan=18 | [[Tandem pore domain potassium channel|Tandem pore domain]] <br /> 4[[transmembrane helix|T]] & 2[[pore-forming loop|P]] | |||
| | | | ||
K<sub>2P</sub>1.1 | |||
| | | | ||
KCNK1 | |||
| | | | ||
TWIK-1 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>2.1 | |||
| | | | ||
KCNK2 | |||
| | | | ||
TREK-1 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
アラキドン酸(10 mM)、揮発性吸入麻酔薬(halothane, isofluorane)など | |||
|- | |- | ||
| | | | ||
K<sub>2P</sub>3.1 | |||
| | | | ||
KCNK3 | |||
| | | | ||
TASK-1 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
細胞外酸性化(pH7.3) | |||
| | | | ||
揮発性吸入麻酔薬(halothane, isofluorane)など | |||
|- | |- | ||
| | | | ||
K<sub>2P</sub>4.1 | |||
| | | | ||
KCNK4 | |||
| | | | ||
TRAAK | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>5.1 | |||
| | | | ||
KCNK5 | |||
| | | | ||
TASK-2 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
細胞外酸性化(pH6.5) | |||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>6.1 | |||
| | | | ||
KCNK6 | |||
| | | | ||
TWIK-2 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>7.1 | |||
| | | | ||
KCNK7 | |||
| | | | ||
(KCNK8) | |||
| | | | ||
| | | | ||
常時活性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>8.1 | |||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>9.1 | |||
| | | | ||
KCNK9 | |||
| | | | ||
TASK-3 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
細胞外酸性化(pH6.5)、ruthenium red (700 nM) | |||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>10.1 | |||
| | | | ||
KCNK10 | |||
| | | | ||
TREK-2 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>11.1 | |||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>12.1 | |||
| | | | ||
KCNK12 | |||
| | | | ||
THIK-2 | |||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>13.1 | |||
| | | | ||
KCNK13 | |||
| | | | ||
THIK-1 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
アラキドン酸(0.98 mM) | |||
|- | |- | ||
| | | | ||
K<sub>2P</sub>14.1 | |||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>15.1 | |||
| | | | ||
KCNK15 | |||
| | | | ||
TASK-5 | |||
| | | | ||
| | | | ||
機能的なチャネル発現の報告なし | |||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>16.1 | |||
| | | | ||
KCNK16 | |||
| | | | ||
TALK-1 | |||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>17.1 | |||
| | | | ||
KCNK17 | |||
| | | | ||
TASK-4 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
K<sub>2P</sub>18.1 | |||
| | | | ||
KCNK18 | |||
| | | | ||
TRESK-1/TRESK-2 | |||
| | | | ||
| | | | ||
常時活性、GHK整流性 | |||
| | | | ||
静止膜電位形成への関与 | |||
| | | | ||
| | | | ||
|- | |- | ||
|rowspan=19 | [[Voltage-gated potassium channel|Voltage-gated]] <br /> 6[[transmembrane helix|T]] & 1[[pore-forming loop|P]] | |||
| | | | ||
Kv1.1-1.3 | |||
| | | | ||
KCNA1-3 | |||
| | | | ||
|rowspan=6 |Shaker-related | |||
| | | | ||
Kvb | |||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
神経細胞、骨格筋細胞における興奮性の制御(遅延性整流性カリウム電流 Kv1.2) | |||
| | | | ||
4-Aminopyridine(< mM), TEA(0.3 mM)(Kv1.1) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv1.4 | |||
| | | | ||
KCNA4 | |||
| | | | ||
Kvb | |||
| | | | ||
脱分極によって活性化、早い不活性化(A-type) | |||
| | | | ||
A-type電流、神経細胞における脱分極後過分極AHP | |||
| | | | ||
4-Aminopyridine(13 µM), TEA(>100 mM) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv1.5 | |||
| | | | ||
KCNA5 | |||
| | | | ||
Kvb | |||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
心臓におけるIKur | |||
| | | | ||
quinidine(0.6 µM), propafenone(4.4 µM), 4-Aminopyridine(270 µM), TEA(330 mM) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv1.6 | |||
| | | | ||
KCNA6 | |||
| | | | ||
Kvb | |||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
神経細胞における膜電位の制御 | |||
| | | | ||
a-dendrotoxin(20 nM), 4-Aminopyridine(1.5 mM), TEA(7 mM) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv1.7 | |||
| | | | ||
KCNA7 | |||
| | | | ||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
心臓におけるIKur | |||
| | | | ||
flecainide(8 µM), quinidine(15 µM), verapamil(16 µM), amiodarone(35 µM), 4-Aminopyridine(150 µM), TEA(150 mM) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv1.8 | |||
| | | | ||
KCNA10 | |||
| | | | ||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
腎近位尿細管における膜電位の制御 | |||
| | | | ||
Ba<sup>2+</sup>(5 mM), charybdotoxin(100 nM), 4-Aminopyridine(1.5 mM), TEA(50 mM) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv2.1, 2.2 | |||
| | | | ||
KCNB1,2 | |||
| | | | ||
Shab-related | |||
| | | | ||
Kv5,6,8,9, KChaP | |||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
神経細胞、骨格筋細胞における興奮性の制御 | |||
| | | | ||
Hanatoxin(42 nM)(Kv2.1), 細胞内TEA, 細胞外TEA(2.6 mM)(Kv2.2), 4-Aminopyridine(18 mM for Kv2.1; 1.5 mM for Kv2.2) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv3.1, 3.2 | |||
| | | | ||
KCNC1,2 | |||
| | | | ||
|rowspan=2 |Shaw-related | |||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
神経細胞の高頻度発火、fast spiking | |||
| | | | ||
4-Aminopyridine(29 µM for Kv3.1; 0.1 mM for Kv3.2), TEA(0.2 mM for Kv3.1; 0.1 mM for Kv3.2) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv3.3, 3.4 | |||
| | | | ||
KCNC3,4 | |||
| | | | ||
| | | | ||
脱分極によって活性化、早い不活性化(A-type) | |||
| | | | ||
書く | |||
| | | | ||
4-Aminopyridine(1.2 mM for Kv3.3), TEA(0.14 mM for Kv3.3; 0.3 mM for Kv3.4) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv4.1-4.3 | |||
| | | | ||
KCND1-3 | |||
| | | | ||
Shal-related | |||
| | | | ||
KChiP1, KChiPs, DPPX, DPP10(Kv4.2) | |||
| | | | ||
脱分極によって活性化、早い不活性化(A-type) | |||
| | | | ||
心臓におけるIto(Kv4.2/Kv4.3/KChiP2)、神経細胞の細胞体におけるISA | |||
| | | | ||
4-Aminopyridine(9 mM for Kv4.1; 5 mM for Kv4.2), TEA(>10 mM for Kv4.1) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv5.1 | |||
| | | | ||
KCNF1 | |||
| | | | ||
modifier | |||
| | | | ||
| | | | ||
Kv2 familyのmodifier | |||
| | | | ||
| | | | ||
| | | | ||
|- | |- | ||
| | | | ||
Kv6.1-6.4 | |||
| | | | ||
KCNG1-4 | |||
| | | | ||
modifiers | |||
| | | | ||
| | | | ||
Kv2 familyのmodifiers | |||
| | | | ||
| | | | ||
| 720行目: | 705行目: | ||
|- | |- | ||
| | | | ||
Kv7.1 | |||
| | | | ||
KCNQ1 | |||
| | | | ||
KVLQT, KQT | |||
| | | | ||
KCNE1-3 | |||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
活動電位の再分極、心臓におけるIKs電流(Kv7.1(KCNQ1)/KCNE1)、LQT1の原因遺伝子 | |||
| | | | ||
Chlomanol 298B(1 µM)(Kv7.1) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv7.2-7.5 | |||
| | | | ||
KCNQ2-5 | |||
| | | | ||
| | | | ||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
神経細胞におけるM電流(Kv7.2/7.3, Kv7.5)、内耳機能(Kv7.4) | |||
| | | | ||
| | | | ||
Retigabine(10 µM for Kv7.2; 0.6 µM for Kv7.3; 1 µM for Kv7.4; 1.4 µM for Kv7.3/Kv7.5) | |||
|- | |- | ||
| | | | ||
Kv8.1-8.2 | |||
| | | | ||
KCNV1-2 | |||
| | | | ||
modifiers | |||
| | | | ||
| | | | ||
Kv2 familyのmodifiers | |||
| | | | ||
| | | | ||
| 757行目: | 748行目: | ||
|- | |- | ||
| | | | ||
Kv9.1-9.3 | |||
| | | | ||
KCNS1-3 | |||
| | | | ||
modifiers | |||
| | | | ||
| | | | ||
Kv2 familyのmodifiers | |||
| | | | ||
| | | | ||
| 770行目: | 761行目: | ||
|- | |- | ||
| | | | ||
Kv10.1, 10.2 | |||
| | | | ||
KCNH1, 5 | |||
| | | | ||
eag | |||
| | | | ||
| | | | ||
脱分極によって活性化、遅延性整流性 | |||
| | | | ||
| | | | ||
quinidine(1.4 µM for Kv10.4) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv11.1-11.3 | |||
| | | | ||
KCNH2,6,7 | |||
| | | | ||
erg | |||
| | | | ||
minK, KCNE2(Kv11.1) | |||
| | | | ||
脱分極によって活性化、早い不活性化機構(C-type)による内向き整流性 | |||
| | | | ||
活動電位の再分極、心臓におけるIKr電流、LQT2の原因遺伝子、薬物誘発性不整脈の分子機構(Kv11.1) | |||
| | | | ||
astemizol(1 nM for Kv11.1), dofetilide(15-35 nM for Kv11.1), sertindole(3 nM for Kv11.1; 43 nM for Kv11.3) | |||
| | | | ||
|- | |- | ||
| | | | ||
Kv12.1-12.3 | |||
| | | | ||
KCNH8,3,4 | |||
| | | | ||
elk | |||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| | | | ||
| 815行目: | 808行目: | ||
[[Image:KCh fig5.png|thumb|right|300px|<b>図5.電位依存性カリウムチャネルの神経細胞における分布と機能</b><br />Johnstonら J Physiol 2010<ref name="ref18"><pubmed>20519310</pubmed></ref>の図をもとに執筆者が本項に合わせ改変]] | [[Image:KCh fig5.png|thumb|right|300px|<b>図5.電位依存性カリウムチャネルの神経細胞における分布と機能</b><br />Johnstonら J Physiol 2010<ref name="ref18"><pubmed>20519310</pubmed></ref>の図をもとに執筆者が本項に合わせ改変]] | ||
[[神経細胞]]や[[ | [[神経細胞]]や[[wikipedia:ja:心筋|心筋]]細胞の静止膜電位や興奮性の多様性は、多くの場合、それぞれの細胞に発現するカリウムチャネルの種類と量によって説明することが出来る。また細胞内においても均一に発現しているわけではなく、[[樹状突起]]や[[軸索]]に局在して発現していることも多い(図5)。 | ||
=== 電位依存性カリウムチャネル === | === 電位依存性カリウムチャネル === | ||
| 821行目: | 814行目: | ||
神経系において、Kvチャネルは電位依存性ナトリウムチャネルと膜電位を介して機能的に共役し、活動電位の再分極、シナプス後細胞の興奮性の制御、振動性の興奮の制御、スパイク間隔の制御など重要な役割を果たしている。Kvチャネルの多様性が様々な生理機能のそれぞれに対応できるように、多種類の遅延整流性カリウムチャネルを形成している<ref name="ref18" /><ref><pubmed>16791144</pubmed></ref>。 | 神経系において、Kvチャネルは電位依存性ナトリウムチャネルと膜電位を介して機能的に共役し、活動電位の再分極、シナプス後細胞の興奮性の制御、振動性の興奮の制御、スパイク間隔の制御など重要な役割を果たしている。Kvチャネルの多様性が様々な生理機能のそれぞれに対応できるように、多種類の遅延整流性カリウムチャネルを形成している<ref name="ref18" /><ref><pubmed>16791144</pubmed></ref>。 | ||
神経細胞には[[Kv1]] | 神経細胞には[[Kv1]], [[Kv2]], [[Kv3]], [[Kv4]], [[Kv7]], [[Kv11]]といったカリウムチャネルサブユニットの発現が認められている。各Kvチャネルクラスはサブファミリーをもち、それらのヘテロテトラマーとしてカリウムチャネルが構成されるので、その可能な組み合わせはサブユニットの数以上に膨大な数となる。 | ||
==== A電流 ==== | ==== A電流 ==== | ||
| 829行目: | 822行目: | ||
また、A電流が不活性化を受ける膜電位の範囲に静止膜電位が入っており、この電流は静止膜電位において一部不活性化を受けている。このことにより、静止膜電位付近の僅かな膜電位変化でもこの不活性化が制御され、A電流量に影響を及ぼす。例えば、過分極により不活性化が軽減され細胞膜の興奮性が下がる。さらに、[[PKA]]、[[PKC]]、[[MAPK]]、[[ERK]]などによる[[リン酸化]]など[[シグナル伝達]]による制御もよく知られている。このようなことから、神経細胞において小さな、局所的な膜電位変化である[[シナプス]]入力や[[GPCR]]を介した代謝性シグナル伝達がこのA電流を介して、膜の興奮性を制御することが可能である。 | また、A電流が不活性化を受ける膜電位の範囲に静止膜電位が入っており、この電流は静止膜電位において一部不活性化を受けている。このことにより、静止膜電位付近の僅かな膜電位変化でもこの不活性化が制御され、A電流量に影響を及ぼす。例えば、過分極により不活性化が軽減され細胞膜の興奮性が下がる。さらに、[[PKA]]、[[PKC]]、[[MAPK]]、[[ERK]]などによる[[リン酸化]]など[[シグナル伝達]]による制御もよく知られている。このようなことから、神経細胞において小さな、局所的な膜電位変化である[[シナプス]]入力や[[GPCR]]を介した代謝性シグナル伝達がこのA電流を介して、膜の興奮性を制御することが可能である。 | ||
[[Kv1.4]] | [[Kv1.4]], [[Kv3.4]], および[[Kv4]]サブユニットファミリー(Kv4.1-4.3)を細胞に発現させるとカリウムチャネルはA電流を流す(図5、Kv4電流)。その為、これらのサブユニットが生理的に計測されるA電流を担っていると考えられている。 | ||
神経細胞においては、[[細胞体]]や樹状突起からA電流が計測され、特に遠位樹状突起で大きなA電流が認められる。樹状突起におけるA電流はシナプス入力に対するシナプス後細胞の応答を制御しており、また細胞体から樹状突起への[[活動電位の逆伝搬現象]](backpropagating action | 神経細胞においては、[[細胞体]]や樹状突起からA電流が計測され、特に遠位樹状突起で大きなA電流が認められる。樹状突起におけるA電流はシナプス入力に対するシナプス後細胞の応答を制御しており、また細胞体から樹状突起への[[活動電位の逆伝搬現象]](backpropagating action potential, bAP)も制御している。Kv4サブファミリーは神経系におけるA電流のαサブユニットの主要な構成要素であり、例えば、[[CA1]][[錐体神経細胞]]では、[[Kv4.2]]サブユニットが細胞体樹状突起に豊富に発現している(図5)。しかし培養細胞にKv4ファミリーのαサブユニットのみを発現させただけでは、神経細胞で計測されるA電流の電気生理学的な特性を十分再現できない。 [[神経特異的カルシウムセンサータンパク質]](Neuronal Calcium sensor protein, NCS)のファミリーに属する[[K channel-interacting proteins]] (KChiPs)や [[dipeptidyl peptidase-like proteins]](DPPX、とくにDPP6やDPP10)というβサブユニットがKv4チャネルと複合体を形成し、その電流が神経細胞のA電流に類似していることから、その複合体が生理的に機能していると考えられる。 | ||
A電流の様に、非常に早く活性化され、その後速やかに不活性化される、一過性のカリウム電流であるが不活性化の膜電位がA電流と異なり、さらにカリウムチャネルに作用する薬物に対する感受性も明らかに異なる成分が認められることから、A電流とは分子実体の異なる[[D電流]]の存在が報告されている。[[Dendrotoxin]]感受性のD電流は、Kv4ではなく、Kv1サブファミリーが分子実体であると考えられる。 | A電流の様に、非常に早く活性化され、その後速やかに不活性化される、一過性のカリウム電流であるが不活性化の膜電位がA電流と異なり、さらにカリウムチャネルに作用する薬物に対する感受性も明らかに異なる成分が認められることから、A電流とは分子実体の異なる[[D電流]]の存在が報告されている。[[Dendrotoxin]]感受性のD電流は、Kv4ではなく、Kv1サブファミリーが分子実体であると考えられる。 | ||
| 849行目: | 842行目: | ||
[[アセチルコリン]]AChなどの神経活動制御因子は遅延整流性カリウム電流を抑制することで、閾膜電位付近の興奮性を高め、発火頻度やシナプス入力に対する応答性を制御する。[[ムスカリン性ACh受容体]]の活性化に共役したカリウム電流がよく研究されており、この電流はムスカリン muscarinから[[M電流]]と呼ばれている。神経系においては、主にKv7.2(KCNQ2)/Kv7.3(KCNQ3)から構成されているイオンチャネルがこの電流を担っていると考えられている。 | [[アセチルコリン]]AChなどの神経活動制御因子は遅延整流性カリウム電流を抑制することで、閾膜電位付近の興奮性を高め、発火頻度やシナプス入力に対する応答性を制御する。[[ムスカリン性ACh受容体]]の活性化に共役したカリウム電流がよく研究されており、この電流はムスカリン muscarinから[[M電流]]と呼ばれている。神経系においては、主にKv7.2(KCNQ2)/Kv7.3(KCNQ3)から構成されているイオンチャネルがこの電流を担っていると考えられている。 | ||
このイオンチャネルの活性には[[細胞膜]]の内側に存在しているリン脂質PIP<sub>2</sub> | このイオンチャネルの活性には[[細胞膜]]の内側に存在しているリン脂質PIP<sub>2</sub>との結合が必要であり、Gq共役型のGPCR、例えば[[M<sub>3</sub> ACh]]受容体の刺激はホスホリパーゼCを活性化し、膜のPIP<sub>2</sub>を減少させることでチャネルの活性を抑制すると考えられている。 | ||
CA1錐体細胞の樹状突起から計測される持続性のカリウム電流は電気生理学的な特性や薬理学的な特性(4-アミノピリジン(4-AP)よりもTEA感受性が高い)からHVA型のKv2サブファミリーであると考えられている(図5)。この電流は活動電位の中の膜電位で活性化される。神経細胞の高頻度発火の際にはこの電流が活性化し活動電位間の膜電位を過分極させる。 | CA1錐体細胞の樹状突起から計測される持続性のカリウム電流は電気生理学的な特性や薬理学的な特性(4-アミノピリジン(4-AP)よりもTEA感受性が高い)からHVA型のKv2サブファミリーであると考えられている(図5)。この電流は活動電位の中の膜電位で活性化される。神経細胞の高頻度発火の際にはこの電流が活性化し活動電位間の膜電位を過分極させる。 | ||
| 855行目: | 848行目: | ||
=== カルシウム活性化カリウムチャネル === | === カルシウム活性化カリウムチャネル === | ||
神経細胞において活動電位後過分極(after | 神経細胞において活動電位後過分極(after hyperpolarization, AHP)が観察される。活動電位中に細胞内に流入したCa<sup>2+</sup>イオンによってKCaチャネルが活性化しAHPの形成に一部関与する<ref name="ref13" />。また、ある種類の神経細胞では電流を注入した時、始めは高頻度で発火するが次第に頻度が下がる順応反応[[spike frequency adaptation]]を呈する。KCaチャネルはこの順応反応にも関与する。KCaチャネルの活性化に必要なカルシウムシグナルは電位依存性Caチャネルと[[リアノジン受容体]]の働きにより形成されるが、結合膜構造が必要であるとの結果も出ている。また、[[初代培養|培養海馬細胞]]においてSKチャネルが[[スパイン]]に局在していることが報告され、シナプスにおけるカルシウムシグナルによって活性化されてシナプス後電位の形成にも関与することが示されている<ref name="ref13" />。 | ||
=== 内向き整流性カリウムチャネル === | === 内向き整流性カリウムチャネル === | ||
| 861行目: | 854行目: | ||
====古典的内向き整流カリウム(IRK)電流==== | ====古典的内向き整流カリウム(IRK)電流==== | ||
Kir2が形成するKirチャネルは内向き整流性がとても強く[[ | Kir2が形成するKirチャネルは内向き整流性がとても強く[[wikipedia:ja:古典的内向き整流カリウム(IRK)電流|古典的内向き整流カリウム(IRK)電流]]を担う。細胞の静止膜電位、興奮性の制御に関わる。[[ROMK]](Kir1)、[[Kir4.1]]、[[Kir5.1]]チャネルは整流性が弱くもしくは殆ど無く、常時活性化型であり、イオンの輸送に関わっている。Kir4.1は[[アストログリア]]細胞に発現が多く、なかでも[[wikipedia:ja:血管|血管]]周囲やシナプス周囲に局在している<ref><pubmed>11502569</pubmed></ref>。 | ||
====Gタンパク質活性化カリウム(GIRK)チャネル==== | ====Gタンパク質活性化カリウム(GIRK)チャネル==== | ||
Gタンパク質活性化カリウム(GIRK)チャネルは三量体Gタンパク質のGβγサブユニットとの結合によって活性化されるカリウムチャネルである。このチャネルは心臓の徐脈に関与するイオンチャネルとしてよく知られている。中枢神経系においては[[GABAB受容体|GABA<sub>B</sub>受容体]]などと機能的に共役し、抑制性シナプスにおいて観察される遅延性の抑制性シナプス後電流(slow inhibitory postsynaptic | Gタンパク質活性化カリウム(GIRK)チャネルは三量体Gタンパク質のGβγサブユニットとの結合によって活性化されるカリウムチャネルである。このチャネルは心臓の徐脈に関与するイオンチャネルとしてよく知られている。中枢神経系においては[[GABAB受容体|GABA<sub>B</sub>受容体]]などと機能的に共役し、抑制性シナプスにおいて観察される遅延性の抑制性シナプス後電流(slow inhibitory postsynaptic current, sIPSC)を担う。GIRKチャネルはKir3サブファミリーで構成されるKirチャネルであり、神経細胞においてはKir3.1とKir3.2とで構成されるGIRKチャネルが主要な構成要素であると考えられている。しかし生化学的にはKir3.3や心臓型のKir3.4サブユニットの発現も認められる。 | ||
====ATP感受性カリウムチャネル==== | ====ATP感受性カリウムチャネル==== | ||
[[ | [[wikipedia:ja:ATP感受性K|ATP感受性K]](K<sub>ATP</sub>)はチャネルのポアを形成するイオンチャネルもKirチャネルファミリーに属する(Kir6サブファミリー)。Kir6.2にATPが結合することでチャネルが閉口する。ABCタンパク質ファミリーに属し、[[wikipedia:ja:スルホニルウレア|スルホニルウレア]]剤の標的として知られる[[wikipedia:ja:スルホニルウレア受容体|スルホニルウレア受容体]](sulfonylurea receptor, SUR)はK<sub>ATP</sub>チャネルに必須のβサブユニットであり、Kir6とSURは4:4のヘテロオクタマーを形成し機能する。 | ||
K<sub>ATP</sub>チャネルの細胞内ATPによる閉口は、[[ | K<sub>ATP</sub>チャネルの細胞内ATPによる閉口は、[[wikipedia:ja:グルコース|グルコース]]依存的な[[wikipedia:ja:膵臓β細胞|膵臓β細胞]]からの[[wikipedia:ja:インスリン|インスリン]]分泌の分子機構として役割が最もよく知られている。加えて、[[視床下部]]などで認められるいくつかの神経細胞で観察される、膜の電気的な興奮性のグルコース感受性の機構の一つとして知られている。グルコース濃度上昇によって、細胞へのグルコース取り込み増し、細胞内ATP産生増によるK<sub>ATP</sub>チャネル阻害がおこり、結果として膜の脱分極、細胞興奮性の亢進がおこる。他にも心筋細胞、[[wikipedia:ja:平滑筋|平滑筋]]細胞などにも発現しており、やはり細胞の代謝レベルと膜の興奮性の共役を担っている。 | ||
=== Two-pore domainカリウムチャネル === | === Two-pore domainカリウムチャネル === | ||
| 879行目: | 872行目: | ||
== 病気との関連 -カリウムチャネルのチャネル病 == | == 病気との関連 -カリウムチャネルのチャネル病 == | ||
心臓病、筋肉病、脳疾患、腎疾患、代謝性疾患など様々な疾患で、イオンチャネルをコードする遺伝子の異常を原因とするものが知られるようになってきた。いわゆる、[[チャネル病]](Channelopathy)という概念が定着してきている<ref><pubmed>16554803</pubmed></ref><ref><pubmed>22290238</pubmed></ref>。代表的なものとして、先天性[[ | 心臓病、筋肉病、脳疾患、腎疾患、代謝性疾患など様々な疾患で、イオンチャネルをコードする遺伝子の異常を原因とするものが知られるようになってきた。いわゆる、[[チャネル病]](Channelopathy)という概念が定着してきている<ref><pubmed>16554803</pubmed></ref><ref><pubmed>22290238</pubmed></ref>。代表的なものとして、先天性[[wikipedia:ja:QT延長症候群|QT延長症候群]](Long QT syndrome, LQTs)を引き起こす電位依存的カリウムチャネルのαサブユニットKv7.1(KCNQ1)の遺伝子異常が多数見つかっている(タイプ1, LQT1)。また、このチャネルのβサブユニットであるminK(KCNE1)の異常がLQT5の患者から見つかっている。LQT2の場合は、Kv11.1(HERG)遺伝子に異常が見つかっている。これらの遺伝子異常により、心筋の遅延整流性カリウム電流の遅い成分(''I''<sub>Ks</sub>)や早い成分(''I''<sub>Kr</sub>)を担うカリウムチャネルは機能欠損(loss-of-function)になり、それによって心筋細胞を再分極させる外向き電流が減少することが、活動電位の延長やQT時間の延長の原因である。また、[[wikipedia:ja:不整脈|不整脈]](QT 延長)に両側性[[wikipedia:ja:感音性難聴|感音性難聴]]を伴う[[wikipedia:ja:Jervell & Lange-Nielson症候群|Jervell & Lange-Nielson症候群]] (JLN) の機能欠損変異もKv7.1(KCNQ1) 、minK(KCNE1)で見つかっている。不整脈、突発性の筋脱力、形態異常など全身性の症状を呈する[[wikipedia:ja:Andersen-Tawil症候群|Andersen-Tawil症候群]](LQT7)の患者からはKir2.1の機能欠損変異が見つかっている。逆に、KCNQ1、hERG、Kir2.1の遺伝子の機能獲得(gain-of-function)変異が[[wikipedia:ja:QT短縮症候群|QT短縮症候群]](Short QT syndrome, SQTs) 患者から見つかっている。 | ||
脳疾患では、神経性のM電流を欠損するKv7.2(KCNQ2)やKv7.3(KCNQ3)の機能欠損変異が[[家族性良性新生児痙攣]](Benign familial neonatal | 脳疾患では、神経性のM電流を欠損するKv7.2(KCNQ2)やKv7.3(KCNQ3)の機能欠損変異が[[家族性良性新生児痙攣]](Benign familial neonatal epilepsy, BFNE)の原因として報告されている <ref><pubmed>9430594</pubmed></ref><ref><pubmed>9872318</pubmed></ref><ref><pubmed>9425900</pubmed></ref><ref><pubmed>9425895</pubmed></ref>。また、Kv1.1の機能欠損変異が[[発作性運動失調症]](episodic ataxia, EA)を引き起こすこと知られている<ref><pubmed>7842011</pubmed></ref>。さらに、Kv7.4(KCNQ4)やKir4.1の変異が難聴に繋がることも分かっている。(KCNQ4遺伝子は[[wikipedia:ja:常染色体優性遺伝|常染色体優性遺伝]]形式を取るDFNA2の原因遺伝子として報告された) | ||
[[腎]]疾患、代謝性疾患で代表的なものは、[[ | [[wikipedia:ja:腎|腎]]疾患、代謝性疾患で代表的なものは、[[wikipedia:ja:腎尿細管|腎尿細管]]上皮細胞頂上膜に局在するKir1.1(ROMK1)の異常が[[wikipedia:ja:代謝性アルカローシス|代謝性アルカローシス]]や[[wikipedia:ja:低K<sup>+</sup>血症|低K<sup>+</sup>血症]]を伴う[[wikipedia:ja:Bartter症候群|Bartter症候群]](II型)を引き起こすことが分かっている。さらにKir6.2、SUR1の変異による膵臓β細胞K<sub>ATP</sub>チャネルの機能獲得変異によって[[wikipedia:ja:新生児糖尿病|新生児糖尿病]](permenent neonatal diabetes)で、逆に機能欠損変異で[[wikipedia:ja:新生児持続性高インスリン性低血糖症|新生児持続性高インスリン性低血糖症]](Persistent hyperinsulinemic hypoglycemia of infancy, PHHI)などで見つかっている。 | ||
チャネル病の遺伝性を解析してみると、表現型が常染色体優性遺伝で遺伝されることが多い。カリウムチャネルはα、βサブユニットの複合体であるため、異常なサブユニットが一つでも入ることで複合体の機能が欠失するドミナントネガティブ効果でイオンチャネル機能が阻害されることがある。一方、[[ | チャネル病の遺伝性を解析してみると、表現型が常染色体優性遺伝で遺伝されることが多い。カリウムチャネルはα、βサブユニットの複合体であるため、異常なサブユニットが一つでも入ることで複合体の機能が欠失するドミナントネガティブ効果でイオンチャネル機能が阻害されることがある。一方、[[wikipedia:ja:ハプロ不全|ハプロ不全]](haplo-insufficiency)で発病する場合も多く報告されている。しかもその場合、機能欠損変異のみならず機能獲得変異によるチャネル病も報告されている。このことはイオンチャネルの機能が欠損していても過剰になっていても生体にとっては不適で、言い換えると適切な発現レベルや活性の範囲が存在することを示している。 | ||
遺伝子異常を原因としないものとしては、様々な[[ストレス]]下でおこるイオンチャネルのリモデリングが心臓不整脈などの疾患の原因となることが知られている。 | 遺伝子異常を原因としないものとしては、様々な[[ストレス]]下でおこるイオンチャネルのリモデリングが心臓不整脈などの疾患の原因となることが知られている。 | ||
| 893行目: | 886行目: | ||
カリウムチャネルは様々な生理的役割を果たしており、カリウムチャネルに作用する毒物や薬物は生体にとって深刻な作用を与えうる。これら毒素や薬物はチャネル研究を行なう上で重要なツールとなっている。また、カリウムチャネルは薬物治療の標的となり、いくつかの阻害薬および活性化薬が臨床の現場で使用されている。 | カリウムチャネルは様々な生理的役割を果たしており、カリウムチャネルに作用する毒物や薬物は生体にとって深刻な作用を与えうる。これら毒素や薬物はチャネル研究を行なう上で重要なツールとなっている。また、カリウムチャネルは薬物治療の標的となり、いくつかの阻害薬および活性化薬が臨床の現場で使用されている。 | ||
実験室レベルで用いられるKvチャネルの阻害薬としてtetraethylammonium(TEA)、4-aminopyridine(4-AP)[[ | 実験室レベルで用いられるKvチャネルの阻害薬としてtetraethylammonium(TEA)、4-aminopyridine(4-AP)[[wikipedia:ja:ヘビ|ヘビ]]毒のdendrotoxin、[[wikipedia:ja:サソリ|サソリ]]毒の[[agitoxin]]、[[wikipedia:ja:蜘蛛|蜘蛛]]毒の[[hanatoxin]]などがある。イオンチャネルごとに異なる薬物選択性が知られており、イオン電流成分の分離や分子種の推定に薬理学的解析が行われている。阻害の機序としては、TEA、4-AP、dendrotoxin、agitoxinなどは小孔、もしくは小孔の近傍に結合し、イオン透過機能を阻害する。一方、hanatoxinなどは電位センサー部位に結合し、電位依存性を変える。 | ||
[[ | [[wikipedia:amiodarone|amiodarone]]や[[wikipedia:nifekalant|nifekalant]]は心筋細胞の''I''<sub>Kr</sub>電流を阻害し活動電位持続時間を延長し、相対的不応期を延長することから[[wikipedia:ja:抗不整脈薬|抗不整脈薬]](第三群)として臨床使用されている。 | ||
近年、Kvチャネル電流を増加させる薬物も報告されており、それらは不活性化機構や脱感作機構に影響を及ぼしていると報告されている。 | 近年、Kvチャネル電流を増加させる薬物も報告されており、それらは不活性化機構や脱感作機構に影響を及ぼしていると報告されている。 | ||
KCaチャネルのBKチャネルはサソリ毒の[[charybdotoxin]]、[[iberiotoxin]]、そして比較的低濃度のTEA(<1 mM)によって阻害される。またSKチャネルはハチ毒[[apamin]]によって強力に阻害される。この薬物感受性の違いはCa活性化Kチャネルの分子種の特定に利用される。また、1- | KCaチャネルのBKチャネルはサソリ毒の[[charybdotoxin]]、[[iberiotoxin]]、そして比較的低濃度のTEA(<1 mM)によって阻害される。またSKチャネルはハチ毒[[apamin]]によって強力に阻害される。この薬物感受性の違いはCa活性化Kチャネルの分子種の特定に利用される。また、1-EBIOなどKCaチャネル(IK, SKチャネル)の開口薬が存在し、これらはCa<sup>2+</sup>感受性を高めることが報告されているが詳細なメカニズムは不明である。 | ||
K<sub>ATP</sub>チャネルの[[阻害薬]]と[[活性化薬]]が薬物治療に用いられている。スルホニルウレア剤(tolbutamide、glibenclamideなど)は膵臓β細胞のK<sub>ATP</sub> | K<sub>ATP</sub>チャネルの[[阻害薬]]と[[活性化薬]]が薬物治療に用いられている。スルホニルウレア剤(tolbutamide、glibenclamideなど)は膵臓β細胞のK<sub>ATP</sub>チャネルを阻害し細胞を脱分極させ、インスリン分泌を促す作用があり糖尿病の治療に用いられる。スルホニルウレア(sulfonylurea, SU)剤の受容サイトがあることから、K<sub>ATP </sub>チャネルのβサブユニットはスルホニルウレア受容体(sulfonylurea receptor, SUR)と呼ばれる。また、[[wikipedia:diazoxide|diazoxide]]や[[wikipedia:pinacidil|pinacidil]]などカリウムチャネル開口薬(K channel opener, KCO)とはK<sub>ATP</sub>チャネルの開口薬である。これらは血管の緊張を緩和し、血管拡張剤として用いられている。KCOもK<sub>ATP</sub>チャネルのβサブユニットSURに作用する。 | ||
[[ | [[wikipedia:ja:吸引性麻酔薬|吸引性麻酔薬]]である[[wikipedia:halothane|halothane]]がK2Pチャネルを活性化することが知られており、この作用は局所麻酔薬の分子作用機序として考えられている<ref><pubmed>10321245</pubmed></ref>。 | ||
臨床で用いられているものを含む多くの化合物の作用を詳細に調べると、主作用とは別にカリウムチャネルに対する作用を併せ持つ薬物が非常に多くあることが分かってきた。例えば[[ | 臨床で用いられているものを含む多くの化合物の作用を詳細に調べると、主作用とは別にカリウムチャネルに対する作用を併せ持つ薬物が非常に多くあることが分かってきた。例えば[[wikipedia:ja:抗ヒスタミン薬|抗ヒスタミン薬]]の[[wikipedia:terfenadine|terfenadine]]はカリウムチャネルを阻害する副作用を持ち、その為に致死的な不整脈を誘発する危険性が有り、臨床で使われなくなった。他には中枢神経系作動薬([[haloperidol]]などの[[抗精神病薬]]や[[fluoxetine]]などの[[抗うつ薬]]など)にも副作用としてカリウムチャネルに対する作用が認められる。例えば''I''<sub>K</sub>電流の阻害が知られており、hERGチャネルの阻害が報告されている。またKirチャネルに対する作用なども報告されているが、治療効果への関与は未解明である。 | ||
==関連項目== | ==関連項目== | ||
| 914行目: | 907行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
(執筆者:古谷和春、倉智嘉久 担当編集委員:尾藤晴彦) | |||
2013年8月20日 (火) 11:21時点における版
英:potassium channel、英略語:K+ channel 独:Kaliumkanal 仏:canal potassique
カリウムチャネルはカリウムイオンを選択的に透過させるイオンチャネルである。静止膜電位の形成や電気的な細胞応答、シナプス伝達やカリウム濃度の恒常性維持に関わっている。100種類以上の遺伝子群から構成されているが、六回膜貫通型の「電位依存性カリウムチャネル」と「カルシウム活性化カリウムチャネル」、二回膜貫通型の「内向き整流性カリウムチャネル」、四回膜貫通型の「Two-pore domainカリウムチャネル」に大別される。
カリウムチャネルとは
カリウムチャネルはカリウムイオンを選択的に透過させるイオンチャネルである。静止膜電位の形成や電気的な細胞応答、シナプス伝達やカリウム濃度の恒常性維持に関わっている。ほとんどのカリウムチャネルはαサブユニットが四量体を形成し、中央部分にカリウムを通す小孔(ポア)が開くようになっている。電気生理学的特性やαサブユニットの膜貫通領域の構造の違いにより、六回膜貫通型の「電位依存性カリウムチャネル」と「カルシウム活性化カリウムチャネル」、二回膜貫通型の「内向き整流性カリウムチャネル」、四回膜貫通型の「Two-pore domainカリウムチャネル」に大別される。イオン透過経路を構成するαサブユニットと電流特性や膜発現量を制御するβサブユニットあわせると100種類以上の遺伝子群から構成されており、これら豊富なサブユニット分子種、αサブユニットのヘテロ四量体形成、さらにβサブユニットとの複合体形成がカリウムチャネルの多様性の実体的理由である。イオンチャネルの中で、電気生理学的な解析、生化学・構造生物学的な解析が最も行われているのがカリウムチャネルであり、イオンチャネルの分子機構に関する極めて重要な研究成果がカリウムチャネルを用いた研究から得られている。
基本的分子機能と構造
細胞は脂質二重膜に囲まれているため、荷電したイオンは自由に細胞に出入りすることは出来ない。そこで細胞はイオンを通すための小孔(ポア)を膜に持っている。電気化学ポテンシャルを駆動力として、カリウムイオン(K+)の選択的な膜透過をつかさどるタンパク質がカリウムチャネルである[1][2]。従来の電気生理学的解析により各組織、各細胞で異なる性質を持つカリウムチャネルの存在が明らかにされてきた。しかしそれらに共通する機能として、生体膜のエネルギー障壁(ボルンエネルギー)を克服しカリウムイオンを選択的に透過させる機能を持っている。また、多くは小孔の開閉を制御する特徴的なゲート機能を備えている。
二次構造
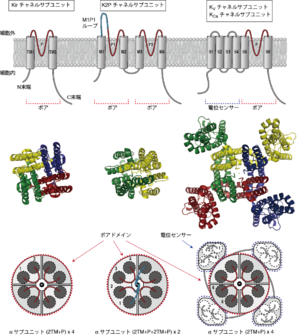
2TM型の内向き整流性カリウムチャネル、4TM型のtwo-pore domainカリウムチャネル、6TM型の電位依存性カリウムチャネル・カルシウム活性化カリウムチャネルαサブユニットの二次構造(上段)、結晶構造のTop view(中段)そしてドメイン配置(下段)。結晶構造は、PBD Data Bankに登録されたPDBID 3SPI (Kir2.2)、3UKM (TWIK-1)、2R9R (Kv1.2-Kv2.1 paddle chimera channel)をもとにPyMolで作成。
ほとんどのカリウムチャネルはポアドメイン形成に関わるタンパク質(αサブユニット)が4つ一組になって働く。カリウムチャネルのαサブユニットの二次構造を図1に示す。代表的な構造として、電位依存性カリウムチャネルが含まれる六回膜貫通(6TM)型の構造と、内向き整流性カリウムチャネルが含まれる二回膜貫通(2TM)型の構造がある。膜貫通領域(セグメント)のS5とS6(2TM型ではTM1とTM2)はカリウムイオンを透過させるためのポアドメインを構成する。またこの二つの膜貫通領域間の細胞外リンカー部分にはカリウムチャネルで広く保持されたシグネチャ配列(signature sequence, 選択的特異配列とも; TXTTVGYG, 特にGYGまたはGFGはよく保存されている)を含むP領域が存在し、ここはイオン選択フィルター機能に関わる。一方、S1-S4で構成される領域は電位センサーとして機能し、S4には正に帯電したアミノ酸が周期的に並んでいる。6TM型だが、膜電位ではなく細胞内Ca2+によって活性化されるカリウムチャネルも存在する。2TMの内向き整流性カリウムチャネルは6TM型の電位依存性カリウムチャネルの電位センサードメイン(S1-S4)に対応する構造をもっておらず、代わりに大きな細胞内領域をもつ。また、2TM及びP領域がサブユニット分子内で2回タンデムにつながった構造の4TM型のカリウムチャネルも存在する。このαサブユニットは二量体を形成しイオンチャネルとして機能する。ポアドメインを構成する領域を分子内に2つ有するためtwo-pore domainカリウム(K2P)チャネル、あるいはタンデム(直列)ポアドメイン(tandem pore domain)チャネルと呼ばれる。
結晶構造
カリウムチャネルの結晶化とその構造解析が進んでいる。1998年の原核生物由来の2TM型カリウムチャネルKcsAのX線構造解析に始まり(図1,2)[3]、Ca依存的/活性化カリウムチャネル(MthK, hBK)、電位依存性カリウムチャネル(KvAP, Kv1.2-Kv2.1 paddle chimera channel)、Kirチャネル(KirBac、Kir2、Kir3)、K2Pチャネル(TRAAK、TWIK-1)と原核生物に留まらず近年では真核生物のカリウムチャネルの構造も相次いで報告されている。共通の性質として(図2)、①2つの膜貫通領域から水性のポアが形成される、②P領域がポアヘリックスとイオン選択フィルターを形成し、シグネチャ配列がイオン選択性フィルターの一部を形成し、それは細胞膜の中心から外側にかけて存在する、③イオン選択フィルターの細胞内側に中心腔(central cavity)とよばれる水性の空間が存在する、④ポアヘリックスが4対称軸の中心に向いておりC末側が中心腔に到達している、ことなどがあげられる。これらの水性ポアドメインの構造に関わる共通点から、カリウムチャネルの選択イオン透過機能に関わる立体構造はほぼ等価であるといえる。
選択的イオン透過機能を支える構造基盤
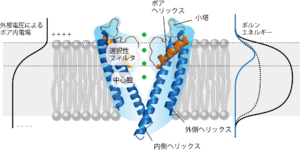
老木成稔 蛋白核酸酵素 1999 [4]で用いられている図をもとに執筆者が改変

a.イオンは水分子と相互作用(水和)した状態で水に溶けている(上段)。イオンチャネルの細いフィルター内に入る際に、イオンは水分子との相互作用をフィルターを形成するアミノ酸の酸素原子を含むカルボニル基との相互作用に置き換える(下段)。b.カリウムチャネルのシグネチャ配列がイオン選択フィルターを形成する。カリウムは中心軸に沿ってフィルター内では4箇所の結合部位に存在する。c.4本のペプチド主鎖から提供された酸素原子が5つの回転対称な平面を構成する。カリウム(緑丸)と水(赤丸)は交互に一列配置しているイオン透過過程のモデル。カリウムの[1,3][2,4]配置では上下の平面由来の8つの酸素原子と配位しており、中間遷移状態では同一平面の4つの酸素原子および上下の2つの水分子と配位している。いづれの配位結合もエネルギー的にはほぼ等価であり、これがカリウムのスムーズな移動を保証する。
b.Morais-Cabralら Nature 2001[5]、c.Zhouら Nature 2001[6]より許可を得て転載
イオンチャネルの電気生理学的な解析によって、単一チャネル電流を定量的に記録することが可能である。この方法によって単一のイオンチャネルを透過するイオンの速度を見積もることが出来る。この実験から、カリウムチャネルではK+イオンがNa+イオンよりも1000倍ほど透過性が高いことが知られている(一価陽イオンの選択性序列は K+>Rb+>Cs+>Na+>Li+。これはEisenman IV型であり、イオン選択フィルターがやや弱い静電場をもつことを示唆する)。しかも、開いた小孔を電気化学的な差に従って、イオンの水溶液中の拡散速度に匹敵する程の、1秒間に数百万個ものイオンが通過することが分かっている(単一イオンチャネルコンダクタンスが数百pSに達すものもある)。つまりカリウムチャネルは極めて高いイオン選択性と非常に早いイオン透過速度という一見相容れない特性を両立する。
特定のイオンを透過させる機構としては大きさによる分子フィルター機構がまず考えられる。しかしながら、イオン半径では、Na+(イオン半径r=0.95 Å)はK+(r=1.33 Å)はよりも小さく、なぜK+を透過してNa+を透過させないのか説明がつかない。カリウムチャネルのこのカリウム選択的透過機構はこのチャネルがもつ小孔の最も狭い領域、イオン選択フィルターの構造に関係がある[3][4]。イオンは水分子と相互作用(水和)した状態で水に溶けている(図3a)。イオンチャネルの細いフィルター内に入る際に、イオンは水分子との相互作用をフィルターを形成するアミノ酸の酸素原子を含むカルボニル基との相互作用に置き換える(図3a, b)。小孔の大きさがK+イオンに適切であり、K+イオンは4つサブユニットのカルボニル基から均等に作用を受け、安定な8水和様構造をとり安定する(図3a, c)[5][6]。一方、Na+イオンはイオン半径が小さくK+イオンのようには相互作用が出来ず(図3a)、K+イオンに比べ不安定に存在する。このような違いがK+イオンの選択的な透過に寄与していると考えられている。この機構は最適合close-fit説とよばれる。
カリウムチャネルの選択フィルターは12 Åほどの長さがあり結晶構造では4つのK+イオン結合部位が認められる(図3b)。しかし近接した結合部位にK+イオンが同時に結合するとイオン間で電気的な反発がおこり不安定であると考えられる。そのため4つの部位を細胞外側から1-4サイトとすると、K+イオンとチャネルの結合には[1,3]サイトに結合した状態と[2,4]サイトに結合した状態があると考えられる(図3c)。また、フィルター内に複数のイオンが同時に入ることによってイオン間に静電気的反発力が発生し、玉突き状態になることが早いイオン透過に寄与していると考えられている[7]。
イオンは膜を透過しようとするとボルンエネルギーというエネルギー障壁を超える必要がある。小孔はそのボルンエネルギーを低くする役目がある。もし小孔が均一な内径の形状であるとすると、ボルンエネルギーは均一に低下し、ボルンエネルギーの極大値は膜の中央部分にくる。結晶構造で存在が知られたイオンチャネルの内腔は大量の水分子で満たされている(図2)。またポアヘリックスがそのC末端側を中心腔の内部に向けていることで、αヘリックスの双極子モーメントが空洞内に陽イオンが留まりやすい環境を作り出す。こういった中心腔の存在により、本来ボルンエネルギーの高いはずの膜中央部でイオンは水和して安定に存在できる。一方で、イオン透過経路を形成するチャネル壁は疎水性の残基で裏打ちされている。これにより水和したイオンはイオン壁と強い相互作用をすることなく、言い換えればポテンシャルの谷間に落ち込んで出られなくなることなく、細胞質からイオン選択フィルターまでの早いイオン流を確保している。生理的な実験とこれまでに述べたようなイオン透過経路の構造から、膜にかけられた外部電位によるポア内電場のおよそ80%は選択フィルターで生じていると推測される(図2)。
カリウムチャネルの結晶構造解析に成功し、イオンチャネルの本質的特徴の一つである選択的イオン透過機構の謎を解明したロデリック・マッキノンは2003年ノーベル化学賞を受賞している。
分子機構と構造による分類
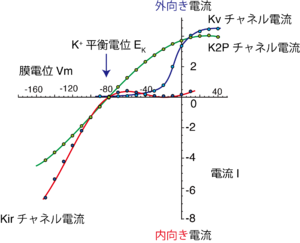
各カリウムチャネルのゲート機構は、カリウムチャネルの構造的、機能的多様性の根源である。以下では各カリウムチャネルの生理的ゲート機構を概説する。
電位依存性カリウムチャネル
電位依存性カリウム(Kv)チャネルは静止膜電位付近ではポアが閉じているが、脱分極によって活性化(開口確率が上昇)し小孔が開口するカリウムチャネルである(図4)。Kvチャネルファミリーのαサブユニットの遺伝子はKv1-12の12クラス、さらにサブファミリーも存在し40種類ほど単離されている[8][9]。先に述べたように、6TM型の二次構造をとり、N末端から5番目、6番目の膜貫通領域(S5, S6)がポアドメインの形成に関与し、1番目から4番目の膜貫通領域(S1-S4)が電位センサーとして機能する構造を形成する。結晶構造が報告され、電位センサードメインが隣接するサブユニット由来のポアドメインと近接しているという特徴的なドメイン配置が明らかにされている(図1)。
Kvチャネルは、活性化の電位依存性や不活性化の有無、薬物感受性などから様々なタイプに細分類される。脱分極刺激による活性化後直ぐに不活性化され、一過的な電流を流す早期不活性化カリウムチャネル(A型Kチャネル)と不活性化が殆どおこらず活性化が持続する遅延整流性カリウムチャネルに分けることができる。また活性化のスピードから「早い成分」と「遅い成分」とに、あるいは活性化の閾値から「低閾値(low-voltage-activated, LVA)型」と「高閾値(high-voltage-activated, HVA)型」とに分類されることもある。
Kvチャネルの活性化の機構としては、膜電位変化に応じて電位センサードメインの構造変化が起こることが想定されている。この電位センサードメインの構造変化が、チャネルの開閉時に測定されるゲート電流と呼ばれる小さな電流を担っていると考えられている。電位センサードメインが脂質二重膜を横切る膜電位の変化をどのように感知し、そして小孔の開閉を制御する仕組みが精力的に研究されているが、その分子機構は明らかではない。近年は電位センサードメインの結晶構造が報告され、その構造変化とその結果起こる小孔の開口のメカニズムに関して議論が続いている。
Kvチャネルの不活性化の機構としては、活性化された後急速におこる不活性化機構としては、活性化後早い不活性化を担うN型の不活性化と、N型と比べて遅い不活性化機構であるC型の不活性化機構という異なる機構が報告されている。N型の不活性化機構にはKvチャネルのN末端のアミノ酸が関与している。また、βサブユニットがN型の不活性化機構に大きく影響を与えることも知られている[10]。
チャネルのN型不活性化に関わる領域は、以前はボール状の構造をとりS4-S5のリンカー部分に結合し細胞のポア領域を塞ぐような機構(ball-and-chain機構)が提唱されていたが、最近の解析からはもう少し細い線状の構造がポア内に侵入してポアを塞ぐと考えられるようになってきた。
一方、C型の不活性化機構にはP領域とS6(あるいはM2)の一部が関与していると見られる。この領域はポアの細胞外の入り口付近にあたり、この部分の構造変化が基盤であると考えられている。
カルシウム活性化カリウムチャネル
カルシウム活性化カリウムチャネル(KCaチャネル)は細胞質のCa2+濃度上昇によって活性が増加するカリウムチャネルである[11][12][13]。シングルチャネルコンダクタンスの違いから大(Big)コンダクタンスカルシウム活性化カリウム(BK)チャネルと小(Small)コンダクタンスカルシウム活性化カリウム(SK)チャネル、そしてBKチャネルとIKチャネルの中間のコンダクタンスを持つ中間(Intermediate)コンダクタンスカルシウム活性化カリウム(IK)チャネルに分類されている。BKチャネルは電位依存的な活性化がおこり、アミノ酸の相同性の面からも電位依存性カリウムチャネルに分類されることも多いが、本項ではKCaチャネルの項目で扱う。BKチャネルにCa2+が結合することで電位依存的な活性化の特性が影響をうける。一方、IK、SKチャネルは電位非依存的であるが、細胞内Ca2+濃度上昇(100-600 nM)によって開口する。この機構には細胞内カルモデュリン(CaM)が必要である。
サブユニットの構造としてはKvチャネルと同様に六回膜貫通領域と一つのP領域を持つ6TM型である。SK、IKチャネルサブユニット(KCNN1-3, or SK1-4)はS4に正電荷を帯びたアミノ酸が揃っておらず、機能的に電位非依存的であることに関連する。またS6のC末端側にCaMに結合する領域をもつ。一方、哺乳類のBKチャネル[KCNMA1, MaxiK or Slo1(ショウジョウバエのslowpoke mutantから見つかったことに由来)]はS1-S6に加えN末端側にさらにS0膜貫通領域をもつ。S4が電位センサーの中心として機能し、C末端の二つのRCK(Regulators of the K conductance)領域はCa2+依存的な活性化機構に重要な役割を果す。これらはすべて四量体を形成しチャネルを構成する。BKチャネルのβサブユニットSlob(slowpoke channel binding protein)も同定されている。
BKチャネルと同じsloサブファミリーに属するSlo2(Slo2.1, 2.2)チャネルはCa2+によってではなく、Na+によって活性化される。このチャネルは神経細胞などで観察されるNa活性化カリウムチャネルの分子実体であると考えられている。
内向き整流性カリウムチャネル
内向き整流性カリウム(Kir)チャネルは、遅延整流性カリウムチャネルの外向き整流性と明らかに異なる電位依存性を示し、カリウムの平衡電位EKよりも過分極した膜電位でコンダクタンスが増加し内向きカリウム電流を流すカリウムチャネルである(図4)[14]。遅延整流性カリウムチャネルの外向き整流特性はチャネルの電位依存的な活性化によるものだが、Kirチャネルの外向き整流特性は細胞内のポリアミンやマグネシウムイオンによる外向き電流のブロックによっておこる。Kirチャネルファミリーのサブユニットの遺伝子がKir1-7サブファミリー、15種類ほど単離されている。Kirチャネルサブユニットによって内向き整流特性の強さは大きく異なる。整流性が強く古典的な内向き整流性カリウム電流を担うKir2サブファミリーの他に、整流性が中程度、もしくは殆どなくカリウム輸送などに関わるKir1、Kir4、Kir5、Kir7サブファミリー、細胞の心臓の迷走神経依存的な徐脈や抑制性のシナプス伝達などに関わるGタンパク質制御K(KG)チャネルの分子実体であるKir3サブファミリーや、グルコース依存的な膵臓β細胞からのインスリン分泌に関わるATP感受性カリウムチャネル(KATP)のポア領域もKir6サブファミリーのKirチャネルに属する。
Kirチャネルのサブユニットは二回膜貫通領域と一つのP領域を有し、Kvカリウムチャネルの電位センサードメイン(S1-S4)に相当する部位はもっていない。代わりにN末端、C末端で形成される大きな細胞内領域が特徴である。Kirチャネルサブユニットはホモあるいはヘテロテトラマーを形成し機能する。
Two-pore domainカリウムチャネル
2TM型(二回膜貫通領域と一つのP領域)が二個直列につながったサブユニット構造をしているのがtwo-pore domainカリウム(K2P)チャネルである[15][16]。タンデム(直列)ポアドメインtandem pore domain K チャネルとも呼ばれる。すなわち、ポアの形成に関わるドメインが一つのサブユニット上に二つ存在し、二量体を形成することで一つのイオン透過経路をもったイオンチャネルとなる。これまでに15種のK2Pチャネルサブユニットが同定されており、電気生理学的特性や薬理学的な特性から6つのサブファミリー(TWIK、TREK、TASK、TALK、THINK、TRAAK)に分類されている。
比較的最近遺伝子が単離されたカリウムチャネルであり、他のカリウムチャネルに比べると生理的な機能や構造活性相関の解析は進んでいない。電気生理学的特性から背景(漏洩)カリウム電流を担っていると考えられ静止膜電位の形成や膜抵抗の決定に関与していると考えられている。TREK1で形成されるイオンチャネルは最もよく研究されているK2Pチャネルであり、膜電位や細胞膜のホスファチジルイノシトール-4,5-二リン酸との相互作用、リン酸化、pH、膜の伸展、熱などによる制御が示され、多様式polymodalな制御を受けるイオンチャネルであると知られてきている[17]。
| Class | IUPHAR Name | Human Gene Name | Other Name | 補助サブユニット | 分子機能 | 生理的意義 | 阻害薬(IC50) | 活性化薬(EC50) | |
|---|---|---|---|---|---|---|---|---|---|
| Calcium-activated 6T & 1P |
KCa1.1 |
KCNMA1 |
Slo, Slo1, BK |
脱分極によって活性化、細胞内Ca2+濃度上昇による活性化 |
書く |
charybdotoxin(2.9 nM), iberiotoxin(1.7 nM), TEA(0.14 mM) |
|||
|
KCa2.1-2.3 |
KCNN1-3 |
SKCa1-3 |
calmodulin |
細胞内Ca2+濃度上昇による活性化 |
書く |
UCL1684(1 nM for KCa2.1; 250 pM for KCa2.2), apamin(8 nM for KCa2.1; 60-200 pM for KCa2.2; 10 nM for KCa2.3), tamapin(42 nM for KCa2.1; 24 pM for KCa2.2) |
EBIO(630 µM), NS309(30 nM) | ||
|
KCa3.1 |
KCNT1 |
IKCa1 |
calmodulin |
細胞内Ca2+濃度上昇による活性化 |
書く |
charybdotoxin(5 nM), iberiotoxin(1.7 nM), TEA(24 mM), ketoconazol(30 µM), econazole(12 µM) |
EBIO, NS309(10 nM) | ||
|
KCa4.1, 4.2 |
KCNT2 |
Slack, Slo2.2; Slick, Slo2.1 |
細胞内Na+濃度上昇による活性化 |
書く |
TEA, quinidine |
||||
|
KCa5.1 |
KCNU1 |
Slo3 |
細胞内Ca2+濃度上昇による活性化 |
書く |
TEA |
||||
| Inwardly rectifying 2T & 1P |
Kir1.1 |
KCNJ1 |
ROMK |
常時活性 |
ネフロンにおけるカリウムリサイクリンク、分泌 |
Ba2+, Cs+ |
|||
| Kir2.1-2.4 |
KCNJ2,12,4,14 |
IRK |
常時活性 |
静止膜電位形成への関与、心臓におけるIK1電流(Kir2.1/Kir2.2) |
Ba2+, Cs+, 細胞内Mg2+, 細胞内polyamines |
||||
|
Kir3.1-3.4 |
KCNJ3,6,9,5 |
GIRK |
Gbgによる活性化、代謝型受容体依存的な膜興奮性抑制 |
神経細胞における遅延性の抑制性シナプス後電位の形成(Kir3.1/Kir3.2)、心臓における徐脈の分子機構(Kir3.1/Kir3.4) |
Ba2+, Cs+, terpiapin |
Gbg、細胞内Na+、PIP2、GPCR活性化薬(三量体G蛋白質シグナルを介して) | |||
|
Kir4.1-4.2 |
KCNJ10,15 |
KAB-2, BIR(K)10 |
常時活性 |
脳内におけるグリア細胞によるカリウムバッファリング機構、内耳や腎臓におけるカリウム恒常性 |
Ba2+, Cs+, 細胞内Mg2+, 細胞内polyamines |
||||
|
Kir5.1 |
KCNJ16 |
BIR9 |
常時活性 |
pHセンシング機構 |
Ba2+, Cs+, 細胞内H+ |
||||
|
Kir6.1 |
KCNJ8 |
uKATP-1 |
SUR2B(血管平滑筋) |
細胞内ヌクレオチドによる活性化 |
血管平滑筋の緊張度調節 |
Ba2+, Cs+, スルホニル尿素剤(SURに結合することによる) |
カリウムチャネル開口薬(diazoxide, pinacidil, nicorandilなど、SURに結合することによる) | ||
|
Kir6.2 |
KCNJ11 |
BIR |
SUR1(膵臓b細胞), SUR2A(心筋細胞), SUR2B(血管平滑筋) |
細胞内ATPによる抑制 |
膵臓b細胞からのインスリン分泌、脳内における酸素・グルコースセンサー機能、心臓、脳における虚血に対する細胞保護作用 |
Ba2+, Cs+, スルホニル尿素剤(SURに結合することによる) |
カリウムチャネル開口薬(diazoxide, pinacidil, nicorandilなど、SURに結合することによる) | ||
|
Kir7.1 |
KCNJ13 |
常時活性 |
Ba2+, Cs+(他のKirファミリーに比べて感受性は低い) |
||||||
| Tandem pore domain 4T & 2P |
K2P1.1 |
KCNK1 |
TWIK-1 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
||||
|
K2P2.1 |
KCNK2 |
TREK-1 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
アラキドン酸(10 mM)、揮発性吸入麻酔薬(halothane, isofluorane)など | ||||
|
K2P3.1 |
KCNK3 |
TASK-1 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
細胞外酸性化(pH7.3) |
揮発性吸入麻酔薬(halothane, isofluorane)など | |||
|
K2P4.1 |
KCNK4 |
TRAAK |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
|||||
|
K2P5.1 |
KCNK5 |
TASK-2 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
細胞外酸性化(pH6.5) |
||||
|
K2P6.1 |
KCNK6 |
TWIK-2 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
|||||
|
K2P7.1 |
KCNK7 |
(KCNK8) |
常時活性 |
静止膜電位形成への関与 |
|||||
|
K2P8.1 |
|||||||||
|
K2P9.1 |
KCNK9 |
TASK-3 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
細胞外酸性化(pH6.5)、ruthenium red (700 nM) |
||||
|
K2P10.1 |
KCNK10 |
TREK-2 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
|||||
|
K2P11.1 |
|||||||||
|
K2P12.1 |
KCNK12 |
THIK-2 |
|||||||
|
K2P13.1 |
KCNK13 |
THIK-1 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
アラキドン酸(0.98 mM) | ||||
|
K2P14.1 |
|||||||||
|
K2P15.1 |
KCNK15 |
TASK-5 |
機能的なチャネル発現の報告なし |
||||||
|
K2P16.1 |
KCNK16 |
TALK-1 |
|||||||
|
K2P17.1 |
KCNK17 |
TASK-4 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
|||||
|
K2P18.1 |
KCNK18 |
TRESK-1/TRESK-2 |
常時活性、GHK整流性 |
静止膜電位形成への関与 |
|||||
| Voltage-gated 6T & 1P |
Kv1.1-1.3 |
KCNA1-3 |
Shaker-related |
Kvb |
脱分極によって活性化、遅延性整流性 |
神経細胞、骨格筋細胞における興奮性の制御(遅延性整流性カリウム電流 Kv1.2) |
4-Aminopyridine(< mM), TEA(0.3 mM)(Kv1.1) |
||
|
Kv1.4 |
KCNA4 |
Kvb |
脱分極によって活性化、早い不活性化(A-type) |
A-type電流、神経細胞における脱分極後過分極AHP |
4-Aminopyridine(13 µM), TEA(>100 mM) |
||||
|
Kv1.5 |
KCNA5 |
Kvb |
脱分極によって活性化、遅延性整流性 |
心臓におけるIKur |
quinidine(0.6 µM), propafenone(4.4 µM), 4-Aminopyridine(270 µM), TEA(330 mM) |
||||
|
Kv1.6 |
KCNA6 |
Kvb |
脱分極によって活性化、遅延性整流性 |
神経細胞における膜電位の制御 |
a-dendrotoxin(20 nM), 4-Aminopyridine(1.5 mM), TEA(7 mM) |
||||
|
Kv1.7 |
KCNA7 |
脱分極によって活性化、遅延性整流性 |
心臓におけるIKur |
flecainide(8 µM), quinidine(15 µM), verapamil(16 µM), amiodarone(35 µM), 4-Aminopyridine(150 µM), TEA(150 mM) |
|||||
|
Kv1.8 |
KCNA10 |
脱分極によって活性化、遅延性整流性 |
腎近位尿細管における膜電位の制御 |
Ba2+(5 mM), charybdotoxin(100 nM), 4-Aminopyridine(1.5 mM), TEA(50 mM) |
|||||
|
Kv2.1, 2.2 |
KCNB1,2 |
Shab-related |
Kv5,6,8,9, KChaP |
脱分極によって活性化、遅延性整流性 |
神経細胞、骨格筋細胞における興奮性の制御 |
Hanatoxin(42 nM)(Kv2.1), 細胞内TEA, 細胞外TEA(2.6 mM)(Kv2.2), 4-Aminopyridine(18 mM for Kv2.1; 1.5 mM for Kv2.2) |
|||
|
Kv3.1, 3.2 |
KCNC1,2 |
Shaw-related |
脱分極によって活性化、遅延性整流性 |
神経細胞の高頻度発火、fast spiking |
4-Aminopyridine(29 µM for Kv3.1; 0.1 mM for Kv3.2), TEA(0.2 mM for Kv3.1; 0.1 mM for Kv3.2) |
||||
|
Kv3.3, 3.4 |
KCNC3,4 |
脱分極によって活性化、早い不活性化(A-type) |
書く |
4-Aminopyridine(1.2 mM for Kv3.3), TEA(0.14 mM for Kv3.3; 0.3 mM for Kv3.4) |
|||||
|
Kv4.1-4.3 |
KCND1-3 |
Shal-related |
KChiP1, KChiPs, DPPX, DPP10(Kv4.2) |
脱分極によって活性化、早い不活性化(A-type) |
心臓におけるIto(Kv4.2/Kv4.3/KChiP2)、神経細胞の細胞体におけるISA |
4-Aminopyridine(9 mM for Kv4.1; 5 mM for Kv4.2), TEA(>10 mM for Kv4.1) |
|||
|
Kv5.1 |
KCNF1 |
modifier |
Kv2 familyのmodifier |
||||||
|
Kv6.1-6.4 |
KCNG1-4 |
modifiers |
Kv2 familyのmodifiers |
||||||
|
Kv7.1 |
KCNQ1 |
KVLQT, KQT |
KCNE1-3 |
脱分極によって活性化、遅延性整流性 |
活動電位の再分極、心臓におけるIKs電流(Kv7.1(KCNQ1)/KCNE1)、LQT1の原因遺伝子 |
Chlomanol 298B(1 µM)(Kv7.1) |
|||
|
Kv7.2-7.5 |
KCNQ2-5 |
脱分極によって活性化、遅延性整流性 |
神経細胞におけるM電流(Kv7.2/7.3, Kv7.5)、内耳機能(Kv7.4) |
Retigabine(10 µM for Kv7.2; 0.6 µM for Kv7.3; 1 µM for Kv7.4; 1.4 µM for Kv7.3/Kv7.5) | |||||
|
Kv8.1-8.2 |
KCNV1-2 |
modifiers |
Kv2 familyのmodifiers |
||||||
|
Kv9.1-9.3 |
KCNS1-3 |
modifiers |
Kv2 familyのmodifiers |
||||||
|
Kv10.1, 10.2 |
KCNH1, 5 |
eag |
脱分極によって活性化、遅延性整流性 |
quinidine(1.4 µM for Kv10.4) |
|||||
|
Kv11.1-11.3 |
KCNH2,6,7 |
erg |
minK, KCNE2(Kv11.1) |
脱分極によって活性化、早い不活性化機構(C-type)による内向き整流性 |
活動電位の再分極、心臓におけるIKr電流、LQT2の原因遺伝子、薬物誘発性不整脈の分子機構(Kv11.1) |
astemizol(1 nM for Kv11.1), dofetilide(15-35 nM for Kv11.1), sertindole(3 nM for Kv11.1; 43 nM for Kv11.3) |
|||
|
Kv12.1-12.3 |
KCNH8,3,4 |
elk |
神経細胞におけるカリウムチャネルの役割
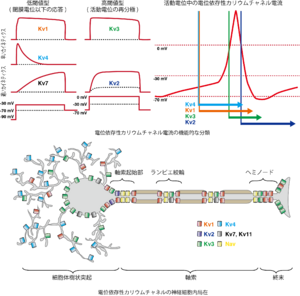
Johnstonら J Physiol 2010[22]の図をもとに執筆者が本項に合わせ改変
神経細胞や心筋細胞の静止膜電位や興奮性の多様性は、多くの場合、それぞれの細胞に発現するカリウムチャネルの種類と量によって説明することが出来る。また細胞内においても均一に発現しているわけではなく、樹状突起や軸索に局在して発現していることも多い(図5)。
電位依存性カリウムチャネル
神経系において、Kvチャネルは電位依存性ナトリウムチャネルと膜電位を介して機能的に共役し、活動電位の再分極、シナプス後細胞の興奮性の制御、振動性の興奮の制御、スパイク間隔の制御など重要な役割を果たしている。Kvチャネルの多様性が様々な生理機能のそれぞれに対応できるように、多種類の遅延整流性カリウムチャネルを形成している[22][23]。
神経細胞にはKv1, Kv2, Kv3, Kv4, Kv7, Kv11といったカリウムチャネルサブユニットの発現が認められている。各Kvチャネルクラスはサブファミリーをもち、それらのヘテロテトラマーとしてカリウムチャネルが構成されるので、その可能な組み合わせはサブユニットの数以上に膨大な数となる。
A電流
幅広い周波数で発火することが出来る神経細胞の電気的特性は、脳内の情報処理・情報伝達に極めて役割を果たしている。高周波発火神経細胞は100 Hz程度で発火することができ、成熟した聴神経細胞に至っては1000 Hzで発火することができる。そういった高周波数で神経細胞が発火するためには活動電位持続時間が十分短く、且つイオンチャネルの不応期からの素早い回復が必要である。A電流やItoとよばれるカリウムチャネル電流は活動電位中に素早く活性化されその後不活性化され、一過性の外向き電流を流し、活動電位を短く保つ役割をもつ。活動電位後 A電流は一過的に不活性化されているが、他のカリウムチャネルの活性による過分極によって不活性化から回復し、次の活動電位中に再び活性化する。
また、A電流が不活性化を受ける膜電位の範囲に静止膜電位が入っており、この電流は静止膜電位において一部不活性化を受けている。このことにより、静止膜電位付近の僅かな膜電位変化でもこの不活性化が制御され、A電流量に影響を及ぼす。例えば、過分極により不活性化が軽減され細胞膜の興奮性が下がる。さらに、PKA、PKC、MAPK、ERKなどによるリン酸化などシグナル伝達による制御もよく知られている。このようなことから、神経細胞において小さな、局所的な膜電位変化であるシナプス入力やGPCRを介した代謝性シグナル伝達がこのA電流を介して、膜の興奮性を制御することが可能である。
Kv1.4, Kv3.4, およびKv4サブユニットファミリー(Kv4.1-4.3)を細胞に発現させるとカリウムチャネルはA電流を流す(図5、Kv4電流)。その為、これらのサブユニットが生理的に計測されるA電流を担っていると考えられている。
神経細胞においては、細胞体や樹状突起からA電流が計測され、特に遠位樹状突起で大きなA電流が認められる。樹状突起におけるA電流はシナプス入力に対するシナプス後細胞の応答を制御しており、また細胞体から樹状突起への活動電位の逆伝搬現象(backpropagating action potential, bAP)も制御している。Kv4サブファミリーは神経系におけるA電流のαサブユニットの主要な構成要素であり、例えば、CA1錐体神経細胞では、Kv4.2サブユニットが細胞体樹状突起に豊富に発現している(図5)。しかし培養細胞にKv4ファミリーのαサブユニットのみを発現させただけでは、神経細胞で計測されるA電流の電気生理学的な特性を十分再現できない。 神経特異的カルシウムセンサータンパク質(Neuronal Calcium sensor protein, NCS)のファミリーに属するK channel-interacting proteins (KChiPs)や dipeptidyl peptidase-like proteins(DPPX、とくにDPP6やDPP10)というβサブユニットがKv4チャネルと複合体を形成し、その電流が神経細胞のA電流に類似していることから、その複合体が生理的に機能していると考えられる。
A電流の様に、非常に早く活性化され、その後速やかに不活性化される、一過性のカリウム電流であるが不活性化の膜電位がA電流と異なり、さらにカリウムチャネルに作用する薬物に対する感受性も明らかに異なる成分が認められることから、A電流とは分子実体の異なるD電流の存在が報告されている。Dendrotoxin感受性のD電流は、Kv4ではなく、Kv1サブファミリーが分子実体であると考えられる。
遅延整流性カリウム電流
不活性化をあまり受けない電位依存性カリウム電流は、一過性のA 電流に対して持続性カリウム電流と呼ばれることがある。活性化の速度が早いものと遅いものがあり、また活性化の電位依存性も様々異なるものが記録される。
Kv1、Kv3サブファミリーは脱分極による活性化のカイネティクスが比較的早いタイプの遅延性整流性カリウムチャネルである(図5)。
Kv1.1-1.3は低閾値型(LVA型)で脱分極により持続した外向き電流を流す。脱分極が続くと遅い不活性化を受ける。神経細胞においては、有髄神経のランビエ絞輪(node of Ranvier)周辺にKv1.1やKv1.2が集積しており、一方ミエリン化されていない軸索にはKv1.4が均一に分布している。活動電位発生の閾値となる膜電位(閾膜電位)以下で活性化されるこのチャネルの活性は活動電位の閾値を上げる役割を果す。特に神経細胞の発火帯、軸索といった部位におけるこれらのチャネルの活性は(図5)、神経細胞の自発的な発火を抑え、神経活動依存的に発火するようになり、神経伝達の忠実性fidelityを上げるという意義がある。
また、Kv3サブファミリーは高閾値型(HVA型)で早く活性化されるカリウムチャネルであり、活動電位の発生後に活性化され、活動電位の振幅や活動電位活動電位持続時間 の制御を行なっている(図5)。神経細胞に広く発現するが、シナプス前終末に到達する活動電位の波形はシナプス小胞の放出に大きな影響を与えることから、Kv3は神経伝達機構を制御していると言える。Kv3は他よりもTEA感受性が高く、実際テトラエチルアンモニウム(TEA)によって神経細胞のKv3チャネルを阻害すると活動電位の振幅を大きくし、活動電位活動電位持続時間 を延長し、Ca2+電流を増強してシナプス伝達が亢進する。
Kv7(KCNQ)、Kv11 (KCNH、eag/ergとも)、Kv2サブファミリーは脱分極による活性化のカイネティクスが遅いタイプのKvチャネルである。 活動電位持続時間の長い心筋細胞においては、Kv7.1(KCNQ1)はMinK(KCNE1)と、Kv11.1 (KCNH、hERGとも)はMinK related protein1(MiRP)(KCNE2)と複合体を形成し、それぞれIKs、IKrという遅延整流性カリウム電流の早い成分と遅い成分を担い、活動電位第三相で細胞を再分極させるために働いている。しかしながら心筋細胞に比べて活動電位持続時間が短い神経細胞においては、個々の活動電位中に活性化されるわけではない。LVA型のKv7(KCNQ)は深い膜電位でも活性化される一方で不活性化はあまり受けず、閾膜電位以下の膜電位でも持続的な外向き電流を流しており、細胞の興奮性の制御に関わっている(図5)。
アセチルコリンAChなどの神経活動制御因子は遅延整流性カリウム電流を抑制することで、閾膜電位付近の興奮性を高め、発火頻度やシナプス入力に対する応答性を制御する。ムスカリン性ACh受容体の活性化に共役したカリウム電流がよく研究されており、この電流はムスカリン muscarinからM電流と呼ばれている。神経系においては、主にKv7.2(KCNQ2)/Kv7.3(KCNQ3)から構成されているイオンチャネルがこの電流を担っていると考えられている。
このイオンチャネルの活性には細胞膜の内側に存在しているリン脂質PIP2との結合が必要であり、Gq共役型のGPCR、例えば[[M3 ACh]]受容体の刺激はホスホリパーゼCを活性化し、膜のPIP2を減少させることでチャネルの活性を抑制すると考えられている。
CA1錐体細胞の樹状突起から計測される持続性のカリウム電流は電気生理学的な特性や薬理学的な特性(4-アミノピリジン(4-AP)よりもTEA感受性が高い)からHVA型のKv2サブファミリーであると考えられている(図5)。この電流は活動電位の中の膜電位で活性化される。神経細胞の高頻度発火の際にはこの電流が活性化し活動電位間の膜電位を過分極させる。
カルシウム活性化カリウムチャネル
神経細胞において活動電位後過分極(after hyperpolarization, AHP)が観察される。活動電位中に細胞内に流入したCa2+イオンによってKCaチャネルが活性化しAHPの形成に一部関与する[13]。また、ある種類の神経細胞では電流を注入した時、始めは高頻度で発火するが次第に頻度が下がる順応反応spike frequency adaptationを呈する。KCaチャネルはこの順応反応にも関与する。KCaチャネルの活性化に必要なカルシウムシグナルは電位依存性Caチャネルとリアノジン受容体の働きにより形成されるが、結合膜構造が必要であるとの結果も出ている。また、培養海馬細胞においてSKチャネルがスパインに局在していることが報告され、シナプスにおけるカルシウムシグナルによって活性化されてシナプス後電位の形成にも関与することが示されている[13]。
内向き整流性カリウムチャネル
古典的内向き整流カリウム(IRK)電流
Kir2が形成するKirチャネルは内向き整流性がとても強く古典的内向き整流カリウム(IRK)電流を担う。細胞の静止膜電位、興奮性の制御に関わる。ROMK(Kir1)、Kir4.1、Kir5.1チャネルは整流性が弱くもしくは殆ど無く、常時活性化型であり、イオンの輸送に関わっている。Kir4.1はアストログリア細胞に発現が多く、なかでも血管周囲やシナプス周囲に局在している[24]。
Gタンパク質活性化カリウム(GIRK)チャネル
Gタンパク質活性化カリウム(GIRK)チャネルは三量体Gタンパク質のGβγサブユニットとの結合によって活性化されるカリウムチャネルである。このチャネルは心臓の徐脈に関与するイオンチャネルとしてよく知られている。中枢神経系においてはGABAB受容体などと機能的に共役し、抑制性シナプスにおいて観察される遅延性の抑制性シナプス後電流(slow inhibitory postsynaptic current, sIPSC)を担う。GIRKチャネルはKir3サブファミリーで構成されるKirチャネルであり、神経細胞においてはKir3.1とKir3.2とで構成されるGIRKチャネルが主要な構成要素であると考えられている。しかし生化学的にはKir3.3や心臓型のKir3.4サブユニットの発現も認められる。
ATP感受性カリウムチャネル
ATP感受性K(KATP)はチャネルのポアを形成するイオンチャネルもKirチャネルファミリーに属する(Kir6サブファミリー)。Kir6.2にATPが結合することでチャネルが閉口する。ABCタンパク質ファミリーに属し、スルホニルウレア剤の標的として知られるスルホニルウレア受容体(sulfonylurea receptor, SUR)はKATPチャネルに必須のβサブユニットであり、Kir6とSURは4:4のヘテロオクタマーを形成し機能する。
KATPチャネルの細胞内ATPによる閉口は、グルコース依存的な膵臓β細胞からのインスリン分泌の分子機構として役割が最もよく知られている。加えて、視床下部などで認められるいくつかの神経細胞で観察される、膜の電気的な興奮性のグルコース感受性の機構の一つとして知られている。グルコース濃度上昇によって、細胞へのグルコース取り込み増し、細胞内ATP産生増によるKATPチャネル阻害がおこり、結果として膜の脱分極、細胞興奮性の亢進がおこる。他にも心筋細胞、平滑筋細胞などにも発現しており、やはり細胞の代謝レベルと膜の興奮性の共役を担っている。
Two-pore domainカリウムチャネル
K2Pチャネルは背景漏洩(リーク)カリウム電流を担い、静止膜電位の形成や膜抵抗の制御に関わると見られる。
病気との関連 -カリウムチャネルのチャネル病
心臓病、筋肉病、脳疾患、腎疾患、代謝性疾患など様々な疾患で、イオンチャネルをコードする遺伝子の異常を原因とするものが知られるようになってきた。いわゆる、チャネル病(Channelopathy)という概念が定着してきている[25][26]。代表的なものとして、先天性QT延長症候群(Long QT syndrome, LQTs)を引き起こす電位依存的カリウムチャネルのαサブユニットKv7.1(KCNQ1)の遺伝子異常が多数見つかっている(タイプ1, LQT1)。また、このチャネルのβサブユニットであるminK(KCNE1)の異常がLQT5の患者から見つかっている。LQT2の場合は、Kv11.1(HERG)遺伝子に異常が見つかっている。これらの遺伝子異常により、心筋の遅延整流性カリウム電流の遅い成分(IKs)や早い成分(IKr)を担うカリウムチャネルは機能欠損(loss-of-function)になり、それによって心筋細胞を再分極させる外向き電流が減少することが、活動電位の延長やQT時間の延長の原因である。また、不整脈(QT 延長)に両側性感音性難聴を伴うJervell & Lange-Nielson症候群 (JLN) の機能欠損変異もKv7.1(KCNQ1) 、minK(KCNE1)で見つかっている。不整脈、突発性の筋脱力、形態異常など全身性の症状を呈するAndersen-Tawil症候群(LQT7)の患者からはKir2.1の機能欠損変異が見つかっている。逆に、KCNQ1、hERG、Kir2.1の遺伝子の機能獲得(gain-of-function)変異がQT短縮症候群(Short QT syndrome, SQTs) 患者から見つかっている。
脳疾患では、神経性のM電流を欠損するKv7.2(KCNQ2)やKv7.3(KCNQ3)の機能欠損変異が家族性良性新生児痙攣(Benign familial neonatal epilepsy, BFNE)の原因として報告されている [27][28][29][30]。また、Kv1.1の機能欠損変異が発作性運動失調症(episodic ataxia, EA)を引き起こすこと知られている[31]。さらに、Kv7.4(KCNQ4)やKir4.1の変異が難聴に繋がることも分かっている。(KCNQ4遺伝子は常染色体優性遺伝形式を取るDFNA2の原因遺伝子として報告された)
腎疾患、代謝性疾患で代表的なものは、腎尿細管上皮細胞頂上膜に局在するKir1.1(ROMK1)の異常が代謝性アルカローシスや[[wikipedia:ja:低K+血症|低K+血症]]を伴うBartter症候群(II型)を引き起こすことが分かっている。さらにKir6.2、SUR1の変異による膵臓β細胞KATPチャネルの機能獲得変異によって新生児糖尿病(permenent neonatal diabetes)で、逆に機能欠損変異で新生児持続性高インスリン性低血糖症(Persistent hyperinsulinemic hypoglycemia of infancy, PHHI)などで見つかっている。
チャネル病の遺伝性を解析してみると、表現型が常染色体優性遺伝で遺伝されることが多い。カリウムチャネルはα、βサブユニットの複合体であるため、異常なサブユニットが一つでも入ることで複合体の機能が欠失するドミナントネガティブ効果でイオンチャネル機能が阻害されることがある。一方、ハプロ不全(haplo-insufficiency)で発病する場合も多く報告されている。しかもその場合、機能欠損変異のみならず機能獲得変異によるチャネル病も報告されている。このことはイオンチャネルの機能が欠損していても過剰になっていても生体にとっては不適で、言い換えると適切な発現レベルや活性の範囲が存在することを示している。
遺伝子異常を原因としないものとしては、様々なストレス下でおこるイオンチャネルのリモデリングが心臓不整脈などの疾患の原因となることが知られている。
薬理学
カリウムチャネルは様々な生理的役割を果たしており、カリウムチャネルに作用する毒物や薬物は生体にとって深刻な作用を与えうる。これら毒素や薬物はチャネル研究を行なう上で重要なツールとなっている。また、カリウムチャネルは薬物治療の標的となり、いくつかの阻害薬および活性化薬が臨床の現場で使用されている。
実験室レベルで用いられるKvチャネルの阻害薬としてtetraethylammonium(TEA)、4-aminopyridine(4-AP)ヘビ毒のdendrotoxin、サソリ毒のagitoxin、蜘蛛毒のhanatoxinなどがある。イオンチャネルごとに異なる薬物選択性が知られており、イオン電流成分の分離や分子種の推定に薬理学的解析が行われている。阻害の機序としては、TEA、4-AP、dendrotoxin、agitoxinなどは小孔、もしくは小孔の近傍に結合し、イオン透過機能を阻害する。一方、hanatoxinなどは電位センサー部位に結合し、電位依存性を変える。
amiodaroneやnifekalantは心筋細胞のIKr電流を阻害し活動電位持続時間を延長し、相対的不応期を延長することから抗不整脈薬(第三群)として臨床使用されている。
近年、Kvチャネル電流を増加させる薬物も報告されており、それらは不活性化機構や脱感作機構に影響を及ぼしていると報告されている。
KCaチャネルのBKチャネルはサソリ毒のcharybdotoxin、iberiotoxin、そして比較的低濃度のTEA(<1 mM)によって阻害される。またSKチャネルはハチ毒apaminによって強力に阻害される。この薬物感受性の違いはCa活性化Kチャネルの分子種の特定に利用される。また、1-EBIOなどKCaチャネル(IK, SKチャネル)の開口薬が存在し、これらはCa2+感受性を高めることが報告されているが詳細なメカニズムは不明である。
KATPチャネルの阻害薬と活性化薬が薬物治療に用いられている。スルホニルウレア剤(tolbutamide、glibenclamideなど)は膵臓β細胞のKATPチャネルを阻害し細胞を脱分極させ、インスリン分泌を促す作用があり糖尿病の治療に用いられる。スルホニルウレア(sulfonylurea, SU)剤の受容サイトがあることから、KATP チャネルのβサブユニットはスルホニルウレア受容体(sulfonylurea receptor, SUR)と呼ばれる。また、diazoxideやpinacidilなどカリウムチャネル開口薬(K channel opener, KCO)とはKATPチャネルの開口薬である。これらは血管の緊張を緩和し、血管拡張剤として用いられている。KCOもKATPチャネルのβサブユニットSURに作用する。
吸引性麻酔薬であるhalothaneがK2Pチャネルを活性化することが知られており、この作用は局所麻酔薬の分子作用機序として考えられている[32]。
臨床で用いられているものを含む多くの化合物の作用を詳細に調べると、主作用とは別にカリウムチャネルに対する作用を併せ持つ薬物が非常に多くあることが分かってきた。例えば抗ヒスタミン薬のterfenadineはカリウムチャネルを阻害する副作用を持ち、その為に致死的な不整脈を誘発する危険性が有り、臨床で使われなくなった。他には中枢神経系作動薬(haloperidolなどの抗精神病薬やfluoxetineなどの抗うつ薬など)にも副作用としてカリウムチャネルに対する作用が認められる。例えばIK電流の阻害が知られており、hERGチャネルの阻害が報告されている。またKirチャネルに対する作用なども報告されているが、治療効果への関与は未解明である。
関連項目
参考文献
- ↑ Y Kurachi, LY Jan, M Lazdunski
"Potassium Ion Channels: Molecular Structure, Function, and Diseases". Current Topics in Membranes, vol 46
Academic Press, London:1999 ISBN 0-12-153346-8. - ↑ B Hille
"Chapter 5: Potassium Channels and Chloride Channels". Ion channels of excitable membranes
Sinauer Associate Inc, Sunderland, MA:pp. 131–168:2002 ISBN 0-87893-321-2. - ↑ 3.0 3.1
Doyle, D.A., Morais Cabral, J., Pfuetzner, R.A., Kuo, A., Gulbis, J.M., Cohen, S.L., ..., & MacKinnon, R. (1998).
The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science (New York, N.Y.), 280(5360), 69-77. [PubMed:9525859] [WorldCat] [DOI] - ↑ 4.0 4.1 老木成稔
Kチャネルの結晶構造に至る道ーK選択性透過を担うポア構造ー
蛋白拡散酵素:43, 1990-1997, 1998 - ↑ 5.0 5.1
Morais-Cabral, J.H., Zhou, Y., & MacKinnon, R. (2001).
Energetic optimization of ion conduction rate by the K+ selectivity filter. Nature, 414(6859), 37-42. [PubMed:11689935] [WorldCat] [DOI] - ↑ 6.0 6.1
Zhou, Y., Morais-Cabral, J.H., Kaufman, A., & MacKinnon, R. (2001).
Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution. Nature, 414(6859), 43-8. [PubMed:11689936] [WorldCat] [DOI] - ↑
Morais-Cabral, J.H., Zhou, Y., & MacKinnon, R. (2001).
Energetic optimization of ion conduction rate by the K+ selectivity filter. Nature, 414(6859), 37-42. [PubMed:11689935] [WorldCat] [DOI] - ↑
Gutman, G.A., Chandy, K.G., Adelman, J.P., Aiyar, J., Bayliss, D.A., Clapham, D.E., ..., & International Union of Pharmacology (2003).
International Union of Pharmacology. XLI. Compendium of voltage-gated ion channels: potassium channels. Pharmacological reviews, 55(4), 583-6. [PubMed:14657415] [WorldCat] [DOI] - ↑
Gutman, G.A., Chandy, K.G., Grissmer, S., Lazdunski, M., McKinnon, D., Pardo, L.A., ..., & Wang, X. (2005).
International Union of Pharmacology. LIII. Nomenclature and molecular relationships of voltage-gated potassium channels. Pharmacological reviews, 57(4), 473-508. [PubMed:16382104] [WorldCat] [DOI] - ↑
Heinemann, S.H., Rettig, J., Graack, H.R., & Pongs, O. (1996).
Functional characterization of Kv channel beta-subunits from rat brain. The Journal of physiology, 493 ( Pt 3), 625-33. [PubMed:8799886] [PMC] [WorldCat] [DOI] - ↑
Wu, S.N. (2003).
Large-conductance Ca2+- activated K+ channels:physiological role and pharmacology. Current medicinal chemistry, 10(8), 649-61. [PubMed:12678784] [WorldCat] [DOI] - ↑
Stocker, M. (2004).
Ca(2+)-activated K+ channels: molecular determinants and function of the SK family. Nature reviews. Neuroscience, 5(10), 758-70. [PubMed:15378036] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Adelman, J.P., Maylie, J., & Sah, P. (2012).
Small-conductance Ca2+-activated K+ channels: form and function. Annual review of physiology, 74, 245-69. [PubMed:21942705] [WorldCat] [DOI] - ↑
Hibino, H., Inanobe, A., Furutani, K., Murakami, S., Findlay, I., & Kurachi, Y. (2010).
Inwardly rectifying potassium channels: their structure, function, and physiological roles. Physiological reviews, 90(1), 291-366. [PubMed:20086079] [WorldCat] [DOI] - ↑
Lesage, F., & Lazdunski, M. (2000).
Molecular and functional properties of two-pore-domain potassium channels. American journal of physiology. Renal physiology, 279(5), F793-801. [PubMed:11053038] [WorldCat] [DOI] - ↑
Buckingham, S.D., Kidd, J.F., Law, R.J., Franks, C.J., & Sattelle, D.B. (2005).
Structure and function of two-pore-domain K+ channels: contributions from genetic model organisms. Trends in pharmacological sciences, 26(7), 361-7. [PubMed:15939489] [WorldCat] [DOI] - ↑
Honoré, E. (2007).
The neuronal background K2P channels: focus on TREK1. Nature reviews. Neuroscience, 8(4), 251-61. [PubMed:17375039] [WorldCat] [DOI] - ↑ 引用エラー: 無効な
<ref>タグです。「pmid16382103」という名前の注釈に対するテキストが指定されていません - ↑ 引用エラー: 無効な
<ref>タグです。「pmid16382104」という名前の注釈に対するテキストが指定されていません - ↑ 引用エラー: 無効な
<ref>タグです。「pmid16382105」という名前の注釈に対するテキストが指定されていません - ↑ 引用エラー: 無効な
<ref>タグです。「pmid16382106」という名前の注釈に対するテキストが指定されていません - ↑ 22.0 22.1
Johnston, J., Forsythe, I.D., & Kopp-Scheinpflug, C. (2010).
Going native: voltage-gated potassium channels controlling neuronal excitability. The Journal of physiology, 588(Pt 17), 3187-200. [PubMed:20519310] [PMC] [WorldCat] [DOI] - ↑
Lai, H.C., & Jan, L.Y. (2006).
The distribution and targeting of neuronal voltage-gated ion channels. Nature reviews. Neuroscience, 7(7), 548-62. [PubMed:16791144] [WorldCat] [DOI] - ↑
Higashi, K., Fujita, A., Inanobe, A., Tanemoto, M., Doi, K., Kubo, T., & Kurachi, Y. (2001).
An inwardly rectifying K(+) channel, Kir4.1, expressed in astrocytes surrounds synapses and blood vessels in brain. American journal of physiology. Cell physiology, 281(3), C922-31. [PubMed:11502569] [WorldCat] [DOI] - ↑
Ashcroft, F.M. (2006).
From molecule to malady. Nature, 440(7083), 440-7. [PubMed:16554803] [WorldCat] [DOI] - ↑
Giudicessi, J.R., & Ackerman, M.J. (2012).
Potassium-channel mutations and cardiac arrhythmias--diagnosis and therapy. Nature reviews. Cardiology, 9(6), 319-32. [PubMed:22290238] [PMC] [WorldCat] [DOI] - ↑
Biervert, C., Schroeder, B.C., Kubisch, C., Berkovic, S.F., Propping, P., Jentsch, T.J., & Steinlein, O.K. (1998).
A potassium channel mutation in neonatal human epilepsy. Science (New York, N.Y.), 279(5349), 403-6. [PubMed:9430594] [WorldCat] [DOI] - ↑
Schroeder, B.C., Kubisch, C., Stein, V., & Jentsch, T.J. (1998).
Moderate loss of function of cyclic-AMP-modulated KCNQ2/KCNQ3 K+ channels causes epilepsy. Nature, 396(6712), 687-90. [PubMed:9872318] [WorldCat] [DOI] - ↑
Charlier, C., Singh, N.A., Ryan, S.G., Lewis, T.B., Reus, B.E., Leach, R.J., & Leppert, M. (1998).
A pore mutation in a novel KQT-like potassium channel gene in an idiopathic epilepsy family. Nature genetics, 18(1), 53-5. [PubMed:9425900] [WorldCat] [DOI] - ↑
Singh, N.A., Charlier, C., Stauffer, D., DuPont, B.R., Leach, R.J., Melis, R., ..., & Leppert, M. (1998).
A novel potassium channel gene, KCNQ2, is mutated in an inherited epilepsy of newborns. Nature genetics, 18(1), 25-9. [PubMed:9425895] [WorldCat] [DOI] - ↑
Browne, D.L., Gancher, S.T., Nutt, J.G., Brunt, E.R., Smith, E.A., Kramer, P., & Litt, M. (1994).
Episodic ataxia/myokymia syndrome is associated with point mutations in the human potassium channel gene, KCNA1. Nature genetics, 8(2), 136-40. [PubMed:7842011] [WorldCat] [DOI] - ↑
Patel, A.J., Honoré, E., Lesage, F., Fink, M., Romey, G., & Lazdunski, M. (1999).
Inhalational anesthetics activate two-pore-domain background K+ channels. Nature neuroscience, 2(5), 422-6. [PubMed:10321245] [WorldCat] [DOI]
(執筆者:古谷和春、倉智嘉久 担当編集委員:尾藤晴彦)