(3人の利用者による、間の34版が非表示) 1行目:
1行目: 英:green fluorescent protein、英略語:GFP、独:Grün fluoreszierendes Protein、仏:Protéine fluorescente verte <br>
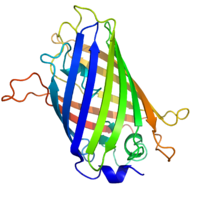
[[Image:GFP structure.png|frame|GFPの結晶構造(Tsienらによる)]]
同義語:GFP、緑色蛍光蛋白質、緑色蛍光蛋白、緑色蛍光タンパク(よく使われる他の良い方などを書いて下さい.編集部でリンクを作ります)
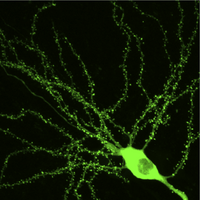
[[Image:GFP-actin.png|200px|thumb|GFP-actin融合蛋白質を発現した海馬ニューロン(岡本賢一・林康紀による)]]
(冒頭に全体の要約を作成して下さい)
緑色蛍光タンパク質とは、[[wikipedia:jp:%E3%82%AA%E3%83%AF%E3%83%B3%E3%82%AF%E3%83%A9%E3%82%B2|オワンクラゲ]]''Aequorea victoria''由来の緑色[[wikipedia:jp:%E8%9B%8D%E5%85%89|蛍光]]を発する[[wikipedia:jp:%E8%9B%8B%E7%99%BD%E8%B3%AA|タンパク質]]である。[[wikipedia:jp:%E4%B8%8B%E6%9D%91%E8%84%A9|下村脩]]により発光タンパク質である[[wikipedia:jp:%E3%82%A8%E3%82%AF%E3%82%AA%E3%83%AA%E3%83%B3|エクオリン]]の精製の過程で同定された<ref><pubmed> 13911999 </pubmed></ref>。GFPは異種の細胞でも容易に発現し、ほぼ毒性も無いのでGFPを発現するさまざまな[[wikipedia:jp:%E3%83%88%E3%83%A9%E3%83%B3%E3%82%B9%E3%82%B8%E3%82%A7%E3%83%8B%E3%83%83%E3%82%AF%E5%8B%95%E7%89%A9|トランスジェニック動物]]([[wikipedia:jp:%E5%93%BA%E4%B9%B3%E9%A1%9E|哺乳類]]から[[wikipedia:jp:%E9%AD%9A%E9%A1%9E|魚類]]、[[wikipedia:jp:%E7%84%A1%E8%84%8A%E6%A4%8E%E5%8B%95%E7%89%A9|無脊椎動物]])が開発されている。[[wikipedia:jp:%E9%81%BA%E4%BC%9D%E5%AD%90|遺伝子]]発現のレポーターや、その他のタンパク質と[[wikipedia:jp:%E8%9E%8D%E5%90%88%E8%9B%8B%E7%99%BD%E8%B3%AA|融合タンパク質]]を作成する事で、分子の局在を観察する事も可能である。また、[[Förster共鳴エネルギー移動]](FRET)などを応用し[[wikipedia:ja:センサー|センサー]]としての応用も可能で細胞内Ca<sup>2+</sup>、[[wikipedia:jp:%E3%82%B7%E3%82%B0%E3%83%8A%E3%83%AB%E4%BC%9D%E9%81%94|シグナル伝達]]、[[wikipedia:ja:%E9%85%B5%E7%B4%A0|酵素]]反応などの生体イメージングへの応用も試みられている<ref><pubmed> 16242400 </pubmed></ref>。
GFP、緑色蛍光タンパク質、緑色蛍光タンパク、緑色蛍光蛋白質 (他の有り得そうな呼び方を書いて下さい。リダイレクトを作るのに使います。後で除きます。)
(以下の目次は見出しが有る場合、自動的に作成されます)
== GFPとは==
英:green fluorescent protein、独:Grün fluoreszierendes Protein、英略語:GFP (ドイツ語は無理していれる必要は有りません。)
(見出しは==で囲んで下さい.)
==GFPとは==
(はじめに解説用語について定義をしてください。)
緑色蛍光蛋白質とは、[[wikipedia:jp:%E3%82%AA%E3%83%AF%E3%83%B3%E3%82%AF%E3%83%A9%E3%82%B2|オワンクラゲ]]''Aequorea victoria''由来の分子量約27,000の緑色の[[wikipedia:jp:%E8%9B%8D%E5%85%89|蛍光]]を発する[[wikipedia:jp:%E8%9B%8B%E7%99%BD%E8%B3%AA|蛋白質]]である。1960年代に[[wikipedia:jp:%E4%B8%8B%E6%9D%91%E8%84%A9|下村脩]]により発光蛋白質である[[wikipedia:jp:%E3%82%A8%E3%82%AF%E3%82%AA%E3%83%AA%E3%83%B3|エクオリン]]の精製の過程で同定された。エクオリンは生体内で緑色発光を示すが、精製標品は青色発光を示す。そのため、生体内ではエクオリンとGFPが複合体を作りエクオリンのエネルギーがGFPに移行する事により緑色の発光をすると考えられている。
緑色蛍光タンパク質とは、オワンクラゲAequorea victoria由来の分子量約27,000の緑色の蛍光を発するタンパク質である。1960年代に下村脩により発光タンパク質であるエクオリンの精製の過程で同定された。エクオリンは生体内で緑色発光を示すが、精製標品は青色発光を示す。そのため、生体内ではエクオリンとGFPが複合体を作りエクオリンのエネルギーがGFPに移行する事により緑色の発光をすると考えられている。
蛋白質が翻訳されると[[wikipedia:jp:%E8%A3%9C%E9%85%B5%E7%B4%A0|補酵素]]等の非存在下でSer65–Tyr66–Gly67の[[wikipedia:jp:%E3%82%A2%E3%83%9F%E3%83%8E%E9%85%B8|アミノ酸]]残基の自己脱水縮合により[[wikipedia:jp:%E7%99%BA%E8%89%B2%E5%9B%A3|発色団]]が形成される。[[wikipedia:jp:X%E7%B7%9A%E6%A7%8B%E9%80%A0%E8%A7%A3%E6%9E%90|X線構造解析]]の結果からはこの発光団を囲むようにして[[wikipedia:jp:%CE%B2%E3%82%B7%E3%83%BC%E3%83%88|βシート]]が存在し(β-canあるいはβ-barrel構造とも呼ばれる)、周囲の環境から発色団を分離している。そのため、GFPの蛍光は比較的外的環境の影響を受けにくいが、酸性域では蛍光強度が低下することが有る。基本的には単量体であるが、高濃度の場合は2量体を形成する傾向もある。
(図は以下の様に入力します。)
アミノ酸配列上、様々な変異が加えられ、蛍光強度が向上した他、青色、シアン、黄色の変異体も作られた。またこれに触発され様々な [[wikipedia :jp:%E8%85%94%E8%85%B8%E5%8B%95%E7%89%A9 |腔腸動物 ]]が調べられ、同じ基本構造を持つ蛋白質が多数見つかってきている。それらを元にさらに長波長側の蛍光をしめす蛋白質(例えば赤色蛍光を示すDsRedやそれを元に作成されたmOrange, mCherry, mStrawberryなど)も報告されている <ref >Giepmans BN, Adams SR, Ellisman MH, Tsien RY. The fluorescent toolbox for assessing protein location and function. Science. 2006 Apr 14;312(5771) :217-24 </ref >。
[[Image:GFP structure.png|thumb|200px|'''図1.GFPの結晶構造'''<br>Tsienらによる。]]
<nowiki>[[Image:GFP structure.png|thumb|'''図1.GFPの結晶構造'''<br>Tsienらによる。]]</nowiki>
(図の説明にも内部リンクを挿入することが出来ます。)
GFPは異種の細胞でも容易に発現し、ほぼ毒性も無いのでGFPを発現するさまざまな [[wikipedia :jp:%E3%83%88%E3%83%A9%E3%83%B3%E3%82%B9%E3%82%B8%E3%82%A7%E3%83%8B%E3%83%83%E3%82%AF%E5%8B%95%E7%89%A9 |トランスジェニック動物]]( [[wikipedia:jp:%E5%93%BA%E4%B9%B3%E9%A1%9E|哺乳類 ]]から [[wikipedia:jp:%E9%AD%9A%E9%A1%9E|魚類 ]]、 [[wikipedia:jp:%E7%84%A1%E8%84%8A%E6%A4%8E%E5%8B%95%E7%89%A9|無脊椎動物 ]])が開発されている。 [[wikipedia:jp:%E9%81%BA%E4%BC%9D%E5%AD%90|遺伝子 ]]発現のレポーターや、その他の蛋白質と[[wikipedia:jp:%E8%9E%8D%E5%90%88%E8%9B%8B%E7%99%BD%E8%B3%AA|融合蛋白質 ]]を作成する事で、分子の局在を観察する事も可能である。また、 [[wikipedia :jp:FRET |Förster共鳴エネルギー移動 ]](FRET)などを応用し [[wikipedia:jp:%E3%82%BB%E3%83%B3%E3%82%B5%E3%83%BC|センサー ]]としての応用も可能で細胞内Ca<sup>2+</sup>、 [[wikipedia:jp:%E3%82%B7%E3%82%B0%E3%83%8A%E3%83%AB%E4%BC%9D%E9%81%94|シグナル伝達 ]]、 [[wikipedia:jp:%E9%85%B5%E7%B4%A0|酵素 ]]反応などの生体イメージングへの応用も試みられている <ref >Miyawaki A. Innovations in the imaging of brain functions using fluorescent proteins. Neuron. 2005 Oct 20;48(2):189-99. </ref >。
[[Image:GFP-actin.png|thumb|200px|'''図2.GFP−[[アクチン]]融合タンパク質を発現した[[海馬]][[錐体細胞]]の[[二光子顕微鏡像]]'''<br>岡本らによる未発表データー。]]
<nowiki>[[Image:GFP-actin.png|thumb|200px|'''図2.GFP−[[アクチン]]融合タンパク質を発現した[[海馬]][[錐体細胞]]の[[二光子顕微鏡像]]'''<br>岡本らによる未発表データー。]] </nowiki>
(内部リンク(脳科学関係の用語)、Wikipediaへのリンク(それ以外の用語)は初出時のみ、以下の様に入れて下さい。リンク先がない場合は、赤字になりますが、後で編集部で調整致します。)
<nowiki>また、[[Förster共鳴エネルギー移動]](FRET)などを応用し[[wikipedia:jp:センサー|センサー]]としての応用も可能で</nowiki>
== 参考文献 ==
(文献は次の様にPubmed IDで入力して下さい。)
<references/>
<nowiki><ref><pubmed> 16242400 </pubmed></ref></nowiki>
==発色団形成のメカニズム==
タンパク質が翻訳されると[[wikipedia:jp:%E8%A3%9C%E9%85%B5%E7%B4%A0|補酵素]]等の非存在下でSer65–Tyr66–Gly67の[[wikipedia:jp:%E3%82%A2%E3%83%9F%E3%83%8E%E9%85%B8|アミノ酸]]残基の自己脱水縮合により[[wikipedia:jp:%E7%99%BA%E8%89%B2%E5%9B%A3|発色団]]が形成される。[[wikipedia:jp:X%E7%B7%9A%E6%A7%8B%E9%80%A0%E8%A7%A3%E6%9E%90|X線構造解析]]の結果からはこの発光団を囲むようにして[[wikipedia:jp:%CE%B2%E3%82%B7%E3%83%BC%E3%83%88|βシート]]が存在し(β-canあるいはβ-barrel構造とも呼ばれる)、周囲の環境から発色団を分離している。そのため、GFPの蛍光は比較的外的環境の影響を受けにくいが、酸性域では蛍光強度が低下することが有る。基本的には単量体であるが、高濃度の場合は2量体を形成する傾向もある。
== GFP関連分子 ==
=== GFP色変異体 ===
(小見出しは===で囲んで下さい.以下更に細目を作りたいときには、=を増やして下さい.)
===GFP色変異体===
セリン65をスレオニンに置き換えることでGFPの蛍光強度が向上するという発見を嚆矢とし、GFPに様々な変異を入れ、緑色ばかりではなく、青色から黄色までの変異体を作られている。
=== GFPを利用したセンサータンパク質 ===
GFPを用い、様々な細胞内現象を蛍光を使って読み出すためのセンサーが開発されている。
一番始めに報告されたのは、細胞内カルシウム濃度を測定することができるCameleonであった。これは、カルシウム結合タンパク質の立体構造変化をシアン蛍光タンパク質と黄色蛍光タンパク質間のFRETを用い読み出すのものであった。
これをきっかけに、様々なセンサータンパク質がこれまで開発されている。
=== 他種動物由来GFP様タンパク質 ===
GFPの変異体でもっとも長波長の傾向を示す変異体でも黄色(ピーク波長525 nm付近)までであった。GFPとの二重染色のためには、赤色蛍光タンパク質が望ましかったが、GFPを変異体させることからは赤色蛍光タンパク質の作成は成功しなかった。
Lukyanovらのグループは様々な[[wikipedia:jp:%E8%85%94%E8%85%B8%E5%8B%95%E7%89%A9|腔腸動物]]を調べ、''Discoma sp.''由来のDsRedが、赤色蛍光を示す蛍光タンパク質である事を初めて報告した。元々は蛍光を示さないタンパク質であったが、変異を導入することにより赤色蛍光を持つようになった。当初報告されたDsRedは四量体であったが、変異をいれ単量体にしたmRFPやその波長の変異体が現在までに開発されている。mOrange, mCherry, mStrawberryなど、果物の名前が付けられた物が多く、mFruitsシリーズとしても知られる<ref><pubmed> 16614209 </pubmed></ref>。
==関連項目==
(関連する項目を記入して下さい。現在のところ、脳科学辞典の項目として存在しなくても構いません。)
*[[赤色蛍光タンパク質]]
<nowiki>*[[赤色蛍光タンパク質]]</nowiki>
*[[青色蛍光タンパク質]]
*[[シアン蛍光タンパク質]]
*[[黄色蛍光タンパク質]]
*[[Cameleon]]
*[[G-CaMP]]
== 参考文献 ==
(次のように入力すると自動的に参考文献リストが出来ます)
<nowiki><references /></nowiki>
<references />
(執筆者:林 康紀、担当編集委員:林 康紀) (執筆者と査読をした担当編集委員お名前を入れて下さい.共著可)。
GFPの結晶構造(Tsienらによる) GFP-actin融合蛋白質を発現した海馬ニューロン(岡本賢一・林康紀による)
英:green fluorescent protein、独:Grün fluoreszierendes Protein、英略語:GFP (ドイツ語は無理していれる必要は有りません。)
緑色蛍光蛋白質とは、オワンクラゲ Aequorea victoria 由来の分子量約27,000の緑色の蛍光 を発する蛋白質 である。1960年代に下村脩 により発光蛋白質であるエクオリン の精製の過程で同定された。エクオリンは生体内で緑色発光を示すが、精製標品は青色発光を示す。そのため、生体内ではエクオリンとGFPが複合体を作りエクオリンのエネルギーがGFPに移行する事により緑色の発光をすると考えられている。
蛋白質が翻訳されると補酵素 等の非存在下でSer65–Tyr66–Gly67のアミノ酸 残基の自己脱水縮合により発色団 が形成される。X線構造解析 の結果からはこの発光団を囲むようにしてβシート が存在し(β-canあるいはβ-barrel構造とも呼ばれる)、周囲の環境から発色団を分離している。そのため、GFPの蛍光は比較的外的環境の影響を受けにくいが、酸性域では蛍光強度が低下することが有る。基本的には単量体であるが、高濃度の場合は2量体を形成する傾向もある。
アミノ酸配列上、様々な変異が加えられ、蛍光強度が向上した他、青色、シアン、黄色の変異体も作られた。またこれに触発され様々な腔腸動物 が調べられ、同じ基本構造を持つ蛋白質が多数見つかってきている。それらを元にさらに長波長側の蛍光をしめす蛋白質(例えば赤色蛍光を示すDsRedやそれを元に作成されたmOrange, mCherry, mStrawberryなど)も報告されている[ 1]
GFPは異種の細胞でも容易に発現し、ほぼ毒性も無いのでGFPを発現するさまざまなトランスジェニック動物 (哺乳類 から魚類 、無脊椎動物 )が開発されている。遺伝子 発現のレポーターや、その他の蛋白質と融合蛋白質 を作成する事で、分子の局在を観察する事も可能である。また、Förster共鳴エネルギー移動 (FRET)などを応用しセンサー としての応用も可能で細胞内Ca2+ 、シグナル伝達 、酵素 反応などの生体イメージングへの応用も試みられている[ 2]
参考文献
↑ Giepmans BN, Adams SR, Ellisman MH, Tsien RY. The fluorescent toolbox for assessing protein location and function. Science. 2006 Apr 14;312(5771):217-24
↑ Miyawaki A. Innovations in the imaging of brain functions using fluorescent proteins. Neuron. 2005 Oct 20;48(2):189-99.