「ボツリヌス毒素」の版間の差分
細編集の要約なし |
|||
| (3人の利用者による、間の34版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0077838 幸田 知子]、[http://researchmap.jp/read0077839 小崎 俊司]</font><br> | <font size="+1">[http://researchmap.jp/read0077838 幸田 知子]、[http://researchmap.jp/read0077839 小崎 俊司]</font><br> | ||
''大阪府立大学 大学院生命環境科学研究科 獣医学専攻''<br> | ''大阪府立大学 大学院生命環境科学研究科 獣医学専攻''<br> | ||
DOI XXXX/XXXX 原稿受付日:2014年4月15日 原稿完成日:2014年月日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 9行目: | 9行目: | ||
{{box|text= ボツリヌス神経毒素は[[wj:偏性嫌気性|偏性嫌気性]][[wj:有芽胞菌|有芽胞菌]]である[[wj:ボツリヌス菌|ボツリヌス菌]][[wj:ボツリヌス菌|''Clostridium botulinum'']]によって産生される致死性の高いタンパク質毒素である。[[wj:金属プロテアーゼ|亜鉛依存性プロテアーゼ]]活性を持ち、[[神経筋結合部]]や[[自律神経]]終末において[[SNAREタンパク質]]を分解することで[[神経伝達物質]]である[[アセチルコリン]]の放出を阻害し、弛緩性の[[麻痺]]を引き起こす。菌は産生する毒素の抗原性の違いにより、A〜Gの毒素型に分類され、異なった基質特異性を持つ。近年、欧米を中心に毒素の高い麻痺活性を利用し、[[ジストニア]]や[[痙縮]]などの筋緊張の亢進症に対し、治療薬として臨床応用されている。}} | {{box|text= ボツリヌス神経毒素は[[wj:偏性嫌気性|偏性嫌気性]][[wj:有芽胞菌|有芽胞菌]]である[[wj:ボツリヌス菌|ボツリヌス菌]][[wj:ボツリヌス菌|''Clostridium botulinum'']]によって産生される致死性の高いタンパク質毒素である。[[wj:金属プロテアーゼ|亜鉛依存性プロテアーゼ]]活性を持ち、[[神経筋結合部]]や[[自律神経]]終末において[[SNAREタンパク質]]を分解することで[[神経伝達物質]]である[[アセチルコリン]]の放出を阻害し、弛緩性の[[麻痺]]を引き起こす。菌は産生する毒素の抗原性の違いにより、A〜Gの毒素型に分類され、異なった基質特異性を持つ。近年、欧米を中心に毒素の高い麻痺活性を利用し、[[ジストニア]]や[[痙縮]]などの筋緊張の亢進症に対し、治療薬として臨床応用されている。}} | ||
(編集コメント:脳科学辞典の想定される読者の興味は神経系ですので、それに併せて内容を書き換えました) | |||
{{Infobox protein family | {{Infobox protein family | ||
| Symbol = | | Symbol = | ||
| Name = Peptidase_M27 | | Name = Peptidase_M27 | ||
| image = | | image = 3c88.pdb | ||
| width = | | width = | ||
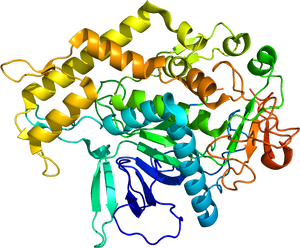
| caption = | | caption = A型毒素活性フラグメントの結晶構造 | ||
| Pfam = PF01742 | | Pfam = PF01742 | ||
| Pfam_clan = CL0126 | | Pfam_clan = CL0126 | ||
| 29行目: | 29行目: | ||
| CDD = | | CDD = | ||
}} | }} | ||
==背景== | ==背景== | ||
ボツリヌス菌は、[[wj:芽胞|芽胞]]の形で自然界に広く分布し、産生する毒素により[[ヒト]]を含む種々の[[哺乳動物]]や[[鳥類]]が特異な神経症状を呈するボツリヌス症を起こす。古くから本菌は食品内で増殖し、その際産生する毒素をヒトが摂取することにより典型的な毒素型食中毒を起こすことが知られていた。ボツリヌス症(botulism)の語源は、原因食品である「ソーセージ」のラテン語である「botulus」に由来する。 | ボツリヌス菌は、[[wj:芽胞|芽胞]]の形で自然界に広く分布し、産生する毒素により[[ヒト]]を含む種々の[[哺乳動物]]や[[鳥類]]が特異な神経症状を呈するボツリヌス症を起こす。古くから本菌は食品内で増殖し、その際産生する毒素をヒトが摂取することにより典型的な毒素型食中毒を起こすことが知られていた。ボツリヌス症(botulism)の語源は、原因食品である「ソーセージ」のラテン語である「botulus」に由来する。 | ||
菌は産生する毒素の血清型により分類されA〜G型の7型がある(編集コメント:最近はH型が報告されていると思います。また、CにはC1とC2があると思いますので、全部で9種類になるのではないでしょうか)。ヒトのボツリヌス症は、主としてA、BおよびE型により起こり、稀にF型による事例が報告されている。わが国では1951年「[[wj:飯寿司|いずし]]」を原因食品とするE型菌による[[wj:食中毒|食中毒]]が初めて報告され、その後北海道、東北地方を中心に中毒の発生が多い。アメリカ、カリフォルニア州で1歳未満、特に生後2週から3ヶ月の乳児に麻痺症状を呈する患者が多数発生したことを契機として、1976年には、乳児の消化管内で菌の増殖にともなう毒素産生によって起こる[[wj:ボツリヌス菌#ボツリヌス症|乳児ボツリヌス症]]が確認された<ref name=ref1><pubmed>62164</pubmed></ref>。本症は北アメリカ以外に、南アメリカ、ヨーロッパ、日本、オーストラリアの各地で発生が報告されている。 | |||
A-G型とは別に、C3毒素が知られている。これは全く異なった特性を持つ毒素であり、[[Rhoファミリー低分子量Gタンパク質]]を[[ADPリボシル化]]する事により不活化する活性を持つ<ref name=ref3805032><pubmed>3805032</pubmed></ref>。 | |||
==臨床症状== | ==臨床症状== | ||
現在、ボツリヌス中毒は発病機序により[[wj:ボツリヌス菌#ボツリヌス症|食餌性ボツリヌス症]](foodborne botulism)、乳児ボツリヌス症(infant botulism)、[[wj:ボツリヌス菌#ボツリヌス症|創傷ボツリヌス症]](wound botulism)、および[[wj:ボツリヌス菌#ボツリヌス症|成人腸管定着性ボツリヌス症]](adult colonization botulism)の4型に分類されている。 | |||
(編集コメント:各病型の病態生理と症状にについて御記述下さい。) | |||
==構造== | ==構造== | ||
(編集コメント:図があればと思います。特に複合体毒素からどのように神経毒素ができるのかがよくわかりません。) | |||
===複合体毒素=== | ===複合体毒素=== | ||
すべての型の毒素は菌体内で分子量約15万の神経毒素と無毒成分の複合体毒素として、菌融解時に放出される。 | すべての型の毒素は菌体内で分子量約15万の神経毒素と無毒成分の複合体毒素として、菌融解時に放出される。 | ||
複合体毒素は分子量の違いにより、LL毒素(分子量90万)、L毒素(分子量50万)、M毒素(分子量30万)に分けられる。LL毒素、L毒素の無毒成分は[[wj:血球凝集|血球凝集]]活性を持っている。A型菌は3種類(LL、L、M)の毒素、B、C、D型菌は2種類(L、M)の毒素、EおよびF型菌はM毒素、G型菌はL毒素のそれぞれ1種類のみを産生する<ref name=ref2><pubmed>6763707</pubmed></ref>。 | |||
弱アルカリ(pH 7. | 弱アルカリ(pH 7.2以上)条件下で神経毒素と無毒成分に速やかに解離する。このため食品内で産生された毒素は複合体の形で経口的に摂取され、[[wj:小腸|小腸]]上部で吸収された後、[[wj:リンパ管|リンパ管]]内あるいは血中で神経毒素と無毒成分に解離する。 | ||
===神経毒素=== | ===神経毒素=== | ||
神経毒素は菌体内で1本鎖ポリペプチドの形(intact form)で産生され、培養液中あるいは[[wj:消化管|消化管]]内で[[wj:トリプシン|トリプシン]]などの[[タンパク質分解酵素]]により、分子内に解裂(nicking)が生じ分子量5万の軽鎖(light chain)と分子量10万の重鎖(heavy chain)がジスルフィド(SS)結合で結ばれた2本鎖フラグメント構造(nicked | [[ファイル:Botulinus toxin 1.png|right|thumb|250px|'''図1. ボツリヌス神経毒素の構造''']] | ||
神経毒素は菌体内で1本鎖ポリペプチドの形(intact form)で産生され、培養液中あるいは[[wj:消化管|消化管]]内で[[wj:トリプシン|トリプシン]]などの[[タンパク質分解酵素]]により、分子内に解裂(nicking)が生じ分子量5万の軽鎖(light chain)と分子量10万の重鎖(heavy chain)がジスルフィド(SS)結合で結ばれた2本鎖フラグメント構造(nicked form)へ変化する。第Ⅰ群菌(これはA-Gの分類とどのような関係にあるのでしょうか)では自己の産生するトリプシン様酵素が神経毒素のnicked formへの変化に関与している。神経毒素はこの分子内解裂による変化により数倍から数百倍に毒力が上昇するが、この活性化現象はタンパク質非分解性B、E型菌に著明に認められる。軽鎖と重鎖はnicked formの神経毒素から還元処理により分離することができる。重鎖はさらに分子量のほぼ等しいN末端領域(H<small>N</small>)とC末端流域(H<small>C</small>)の機能の異なる2つのドメインに分けられる<ref name=ref3><pubmed>2824382</pubmed></ref>。 | |||
===無毒成分=== | ===無毒成分=== | ||
神経毒素を[[wj:胃酸|胃酸]]、あるいは[[wj:ペプシン|ペプシン]]などの[[wj:消化酵素|消化酵素]]による分解から保護し、[[wj:腸管上皮|腸管上皮]]細胞への吸収を促進する働きがあることから、ボツリヌス毒素が食餌性ボツリヌス症を起こす経口毒の活性を持つために重要な役割を果たしていると考えられている。 | 神経毒素を[[wj:胃酸|胃酸]]、あるいは[[wj:ペプシン|ペプシン]]などの[[wj:消化酵素|消化酵素]]による分解から保護し、[[wj:腸管上皮|腸管上皮]]細胞への吸収を促進する働きがあることから、ボツリヌス毒素が食餌性ボツリヌス症を起こす経口毒の活性を持つために重要な役割を果たしていると考えられている。 | ||
==作用機能== | ==作用機能== | ||
[[Image:Botulinus toxin 2.png|thumb|350px|'''図2.ボツリヌス毒素の作用機構'''<br>図の説明をお願いいたします。]] | |||
===シナプス終末への侵入=== | ===シナプス終末への侵入=== | ||
神経毒素は生体内では[[コリン]]作動性[[末梢神経]]に作用し、[[アセチルコリン]]の遊離を阻害することにより麻痺を引き起こすと考えられている。神経毒素は温度非依存的に重鎖、特にH<small>C</small>を介して神経細胞膜表面にある受容体に結合する。A型およびB型神経毒素の受容体はそれぞれ[[シナプス小胞]]膜に存在するタンパク質 [[SV2]]([[synaptic vesicle protein 2]])<ref name=ref5><pubmed>16543415</pubmed></ref>と[[シナプトタグミン]]<ref name=ref6><pubmed>8144634</pubmed></ref>であることがわかった。これらの受容体タンパク質は、神経[[細胞膜]]に豊富に存在する糖脂質である[[wj:ガングリオシド|ガングリオシド]]存在下で、より高い毒素結合活性を持つ<ref name=ref7>'''居原 秀、小崎俊司'''<br>細菌性神経毒素とガングリオシド<br>''生体の科学'' 60:228-233, 2009.</ref>。[[シナプス]]小胞は神経伝達物質を放出後、再び細胞内に取り込まれるが受容体に結合した毒素は、この小胞のリサイクリングを巧みに利用することで細胞内に侵入する<ref name=ref8>'''小崎俊司、居原 秀'''<br>クロストリジウム神経毒素の受容体認識<br>''実験医学'' 27:1598-1605,2009.</ref>。重鎖H<small>N</small>には毒素の型に共通した構造が存在し、この部分が膜にチャネルを形成することで軽鎖の細胞質内への移行が起こると考えられている。 | 神経毒素は生体内では[[コリン]]作動性[[末梢神経]]に作用し、[[アセチルコリン]]の遊離を阻害することにより麻痺を引き起こすと考えられている。神経毒素は温度非依存的に重鎖、特にH<small>C</small>を介して神経細胞膜表面にある受容体に結合する。A型およびB型神経毒素の受容体はそれぞれ[[シナプス小胞]]膜に存在するタンパク質 [[SV2]]([[synaptic vesicle protein 2]])<ref name=ref5><pubmed>16543415</pubmed></ref>と[[シナプトタグミン]]<ref name=ref6><pubmed>8144634</pubmed></ref>であることがわかった。これらの受容体タンパク質は、神経[[細胞膜]]に豊富に存在する糖脂質である[[wj:ガングリオシド|ガングリオシド]]存在下で、より高い毒素結合活性を持つ<ref name=ref7>'''居原 秀、小崎俊司'''<br>細菌性神経毒素とガングリオシド<br>''生体の科学'' 60:228-233, 2009.</ref>。[[シナプス]]小胞は神経伝達物質を放出後、再び細胞内に取り込まれるが受容体に結合した毒素は、この小胞のリサイクリングを巧みに利用することで細胞内に侵入する<ref name=ref8>'''小崎俊司、居原 秀'''<br>クロストリジウム神経毒素の受容体認識<br>''実験医学'' 27:1598-1605,2009.</ref>。重鎖H<small>N</small>には毒素の型に共通した構造が存在し、この部分が膜にチャネルを形成することで軽鎖の細胞質内への移行が起こると考えられている。 | ||
===SNARE分解活性=== | ===SNARE分解活性=== | ||
シナプス小胞内の神経伝達物質を放出するには[[シナプス前]]膜との融合が必要であり、その一連の過程で[[SNARE|SNAP(soluble NSF attachment protein)受容体]](SNARE)と呼ばれタンパク質群([[VAMP]]/[[シナプトブレビン]]、[[SNAP-25]]、[[シンタキシン]])が関与している。軽鎖は亜鉛依存性プロテアーゼ活性を持ち、これらSNAREタンパク質のいずれかを分解する<ref name=ref9><pubmed>22289120</pubmed></ref> | シナプス小胞内の神経伝達物質を放出するには[[シナプス前]]膜との融合が必要であり、その一連の過程で[[SNARE|SNAP(soluble NSF attachment protein)受容体]](SNARE)と呼ばれタンパク質群([[VAMP]]/[[シナプトブレビン]]、[[SNAP-25]]、[[シンタキシン]])が関与している。軽鎖は亜鉛依存性プロテアーゼ活性を持ち、これらSNAREタンパク質のいずれかを分解する<ref name=ref9><pubmed>22289120</pubmed></ref>。B,D,F,G型毒素はVAMP/シナプトブレビンを、A,E型毒素はSNAP-25を、C型毒素はSNAP-25とシンタキシンを、それぞれ切断する<ref name=ref10936621><pubmed>10936621</pubmed></ref>。その結果、シナプス小胞と前膜の融合が起こらず神経伝達物質の放出が阻止される。軽鎖の持つプロテアーゼ活性は基質特異性が高く、これがボツリヌス毒素の持つ神経に対する高い毒性を反映している(図1)。 | ||
一方、脳[[シナプトソーム]]や[[初代神経培養細胞]]に対する毒作用解析から、神経毒素は[[シナプス前膜]]に存在する特異的な受容体に結合後、神経細胞内に侵入し、アセチルコリン以外の種々の神経伝達物質の放出も阻害することが明らかになっている<ref name=ref4><pubmed>19264088</pubmed></ref> | 一方、脳[[シナプトソーム]]や[[初代神経培養細胞]]に対する毒作用解析から、神経毒素は[[シナプス前膜]]に存在する特異的な受容体に結合後、神経細胞内に侵入し、アセチルコリン以外の種々の神経伝達物質の放出も阻害することが明らかになっている<ref name=ref4><pubmed>19264088</pubmed></ref>。臨床的に中枢神経作用があまり問題にならないのは、テタヌス毒素とは異なり、ボツリヌス毒素は脳血液関門を通らないためと考えられている。 | ||
==治療== | ==治療== | ||
==神経毒素の臨床応用== | ==神経毒素の臨床応用== | ||
| 197行目: | 77行目: | ||
*[[テタヌス毒素]] | *[[テタヌス毒素]] | ||
*[[神経筋接合部]] | *[[神経筋接合部]] | ||
(編集コメント:C3毒素についても御記述頂ければと思いますが、もしかしたら別項目の方がよいかもしれません) | |||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2014年4月19日 (土) 09:42時点における版
幸田 知子、小崎 俊司
大阪府立大学 大学院生命環境科学研究科 獣医学専攻
DOI XXXX/XXXX 原稿受付日:2014年4月15日 原稿完成日:2014年月日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:botulinum toxin 独:Botulinumtoxin 仏:toxine botulique
ボツリヌス神経毒素は偏性嫌気性有芽胞菌であるボツリヌス菌Clostridium botulinumによって産生される致死性の高いタンパク質毒素である。亜鉛依存性プロテアーゼ活性を持ち、神経筋結合部や自律神経終末においてSNAREタンパク質を分解することで神経伝達物質であるアセチルコリンの放出を阻害し、弛緩性の麻痺を引き起こす。菌は産生する毒素の抗原性の違いにより、A〜Gの毒素型に分類され、異なった基質特異性を持つ。近年、欧米を中心に毒素の高い麻痺活性を利用し、ジストニアや痙縮などの筋緊張の亢進症に対し、治療薬として臨床応用されている。
(編集コメント:脳科学辞典の想定される読者の興味は神経系ですので、それに併せて内容を書き換えました)
| Peptidase_M27 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
A型毒素活性フラグメントの結晶構造 | |||||||||
| Identifiers | |||||||||
| Symbol | ? | ||||||||
| Pfam | PF01742 | ||||||||
| Pfam clan | CL0126 | ||||||||
| PROSITE | PDOC00129 | ||||||||
| MEROPS | M27 | ||||||||
| SCOP | 3bta | ||||||||
| SUPERFAMILY | 3bta | ||||||||
| |||||||||
背景
ボツリヌス菌は、芽胞の形で自然界に広く分布し、産生する毒素によりヒトを含む種々の哺乳動物や鳥類が特異な神経症状を呈するボツリヌス症を起こす。古くから本菌は食品内で増殖し、その際産生する毒素をヒトが摂取することにより典型的な毒素型食中毒を起こすことが知られていた。ボツリヌス症(botulism)の語源は、原因食品である「ソーセージ」のラテン語である「botulus」に由来する。
菌は産生する毒素の血清型により分類されA〜G型の7型がある(編集コメント:最近はH型が報告されていると思います。また、CにはC1とC2があると思いますので、全部で9種類になるのではないでしょうか)。ヒトのボツリヌス症は、主としてA、BおよびE型により起こり、稀にF型による事例が報告されている。わが国では1951年「いずし」を原因食品とするE型菌による食中毒が初めて報告され、その後北海道、東北地方を中心に中毒の発生が多い。アメリカ、カリフォルニア州で1歳未満、特に生後2週から3ヶ月の乳児に麻痺症状を呈する患者が多数発生したことを契機として、1976年には、乳児の消化管内で菌の増殖にともなう毒素産生によって起こる乳児ボツリヌス症が確認された[1]。本症は北アメリカ以外に、南アメリカ、ヨーロッパ、日本、オーストラリアの各地で発生が報告されている。
A-G型とは別に、C3毒素が知られている。これは全く異なった特性を持つ毒素であり、Rhoファミリー低分子量Gタンパク質をADPリボシル化する事により不活化する活性を持つ[2]。
臨床症状
現在、ボツリヌス中毒は発病機序により食餌性ボツリヌス症(foodborne botulism)、乳児ボツリヌス症(infant botulism)、創傷ボツリヌス症(wound botulism)、および成人腸管定着性ボツリヌス症(adult colonization botulism)の4型に分類されている。
(編集コメント:各病型の病態生理と症状にについて御記述下さい。)
構造
(編集コメント:図があればと思います。特に複合体毒素からどのように神経毒素ができるのかがよくわかりません。)
複合体毒素
すべての型の毒素は菌体内で分子量約15万の神経毒素と無毒成分の複合体毒素として、菌融解時に放出される。
複合体毒素は分子量の違いにより、LL毒素(分子量90万)、L毒素(分子量50万)、M毒素(分子量30万)に分けられる。LL毒素、L毒素の無毒成分は血球凝集活性を持っている。A型菌は3種類(LL、L、M)の毒素、B、C、D型菌は2種類(L、M)の毒素、EおよびF型菌はM毒素、G型菌はL毒素のそれぞれ1種類のみを産生する[3]。
弱アルカリ(pH 7.2以上)条件下で神経毒素と無毒成分に速やかに解離する。このため食品内で産生された毒素は複合体の形で経口的に摂取され、小腸上部で吸収された後、リンパ管内あるいは血中で神経毒素と無毒成分に解離する。
神経毒素
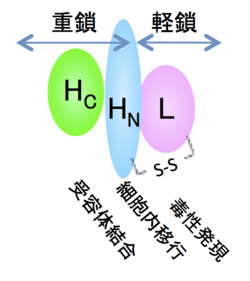
神経毒素は菌体内で1本鎖ポリペプチドの形(intact form)で産生され、培養液中あるいは消化管内でトリプシンなどのタンパク質分解酵素により、分子内に解裂(nicking)が生じ分子量5万の軽鎖(light chain)と分子量10万の重鎖(heavy chain)がジスルフィド(SS)結合で結ばれた2本鎖フラグメント構造(nicked form)へ変化する。第Ⅰ群菌(これはA-Gの分類とどのような関係にあるのでしょうか)では自己の産生するトリプシン様酵素が神経毒素のnicked formへの変化に関与している。神経毒素はこの分子内解裂による変化により数倍から数百倍に毒力が上昇するが、この活性化現象はタンパク質非分解性B、E型菌に著明に認められる。軽鎖と重鎖はnicked formの神経毒素から還元処理により分離することができる。重鎖はさらに分子量のほぼ等しいN末端領域(HN)とC末端流域(HC)の機能の異なる2つのドメインに分けられる[4]。
無毒成分
神経毒素を胃酸、あるいはペプシンなどの消化酵素による分解から保護し、腸管上皮細胞への吸収を促進する働きがあることから、ボツリヌス毒素が食餌性ボツリヌス症を起こす経口毒の活性を持つために重要な役割を果たしていると考えられている。
作用機能
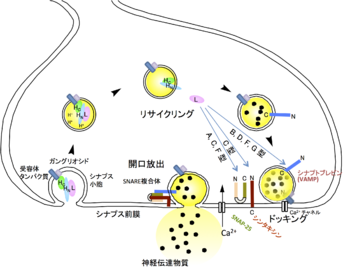
図の説明をお願いいたします。
シナプス終末への侵入
神経毒素は生体内ではコリン作動性末梢神経に作用し、アセチルコリンの遊離を阻害することにより麻痺を引き起こすと考えられている。神経毒素は温度非依存的に重鎖、特にHCを介して神経細胞膜表面にある受容体に結合する。A型およびB型神経毒素の受容体はそれぞれシナプス小胞膜に存在するタンパク質 SV2(synaptic vesicle protein 2)[5]とシナプトタグミン[6]であることがわかった。これらの受容体タンパク質は、神経細胞膜に豊富に存在する糖脂質であるガングリオシド存在下で、より高い毒素結合活性を持つ[7]。シナプス小胞は神経伝達物質を放出後、再び細胞内に取り込まれるが受容体に結合した毒素は、この小胞のリサイクリングを巧みに利用することで細胞内に侵入する[8]。重鎖HNには毒素の型に共通した構造が存在し、この部分が膜にチャネルを形成することで軽鎖の細胞質内への移行が起こると考えられている。
SNARE分解活性
シナプス小胞内の神経伝達物質を放出するにはシナプス前膜との融合が必要であり、その一連の過程でSNAP(soluble NSF attachment protein)受容体(SNARE)と呼ばれタンパク質群(VAMP/シナプトブレビン、SNAP-25、シンタキシン)が関与している。軽鎖は亜鉛依存性プロテアーゼ活性を持ち、これらSNAREタンパク質のいずれかを分解する[9]。B,D,F,G型毒素はVAMP/シナプトブレビンを、A,E型毒素はSNAP-25を、C型毒素はSNAP-25とシンタキシンを、それぞれ切断する[10]。その結果、シナプス小胞と前膜の融合が起こらず神経伝達物質の放出が阻止される。軽鎖の持つプロテアーゼ活性は基質特異性が高く、これがボツリヌス毒素の持つ神経に対する高い毒性を反映している(図1)。
一方、脳シナプトソームや初代神経培養細胞に対する毒作用解析から、神経毒素はシナプス前膜に存在する特異的な受容体に結合後、神経細胞内に侵入し、アセチルコリン以外の種々の神経伝達物質の放出も阻害することが明らかになっている[11]。臨床的に中枢神経作用があまり問題にならないのは、テタヌス毒素とは異なり、ボツリヌス毒素は脳血液関門を通らないためと考えられている。
治療
神経毒素の臨床応用
筋弛緩作用を有するボツリヌス毒素の医薬品としての応用は、まず斜視の治療に用いられて以来、眼瞼痙攣、痙性斜頚、ジストニア、痛みならびに泌尿器疾患など多岐にわたる治療に利用されている[12] [13] [14]。微量の使用で治療効果が高いボツリヌス毒素製剤は、現在では神経疾患の治療薬として不可欠なものとなりつつある。
関連項目
(編集コメント:C3毒素についても御記述頂ければと思いますが、もしかしたら別項目の方がよいかもしれません)
参考文献
- ↑
Midura, T.F., & Arnon, S.S. (1976).
Infant botulism. Identification of Clostridium botulinum and its toxins in faeces. Lancet (London, England), 2(7992), 934-6. [PubMed:62164] [WorldCat] [DOI] - ↑
Ohashi, Y., & Narumiya, S. (1987).
ADP-ribosylation of a Mr 21,000 membrane protein by type D botulinum toxin. The Journal of biological chemistry, 262(4), 1430-3. [PubMed:3805032] [WorldCat] - ↑
Sakaguchi, G. (1982).
Clostridium botulinum toxins. Pharmacology & therapeutics, 19(2), 165-94. [PubMed:6763707] [WorldCat] [DOI] - ↑
Kozaki, S., Ogasawara, J., Shimote, Y., Kamata, Y., & Sakaguchi, G. (1987).
Antigenic structure of Clostridium botulinum type B neurotoxin and its interaction with gangliosides, cerebroside, and free fatty acids. Infection and immunity, 55(12), 3051-6. [PubMed:2824382] [PMC] [WorldCat] - ↑
Dong, M., Yeh, F., Tepp, W.H., Dean, C., Johnson, E.A., Janz, R., & Chapman, E.R. (2006).
SV2 is the protein receptor for botulinum neurotoxin A. Science (New York, N.Y.), 312(5773), 592-6. [PubMed:16543415] [WorldCat] [DOI] - ↑
Nishiki, T., Kamata, Y., Nemoto, Y., Omori, A., Ito, T., Takahashi, M., & Kozaki, S. (1994).
Identification of protein receptor for Clostridium botulinum type B neurotoxin in rat brain synaptosomes. The Journal of biological chemistry, 269(14), 10498-503. [PubMed:8144634] [WorldCat] - ↑ 居原 秀、小崎俊司
細菌性神経毒素とガングリオシド
生体の科学 60:228-233, 2009. - ↑ 小崎俊司、居原 秀
クロストリジウム神経毒素の受容体認識
実験医学 27:1598-1605,2009. - ↑
Yamamoto, H., Ida, T., Tsutsuki, H., Mori, M., Matsumoto, T., Kohda, T., ..., & Ihara, H. (2012).
Specificity of botulinum protease for human VAMP family proteins. Microbiology and immunology, 56(4), 245-53. [PubMed:22289120] [WorldCat] [DOI] - ↑
Rossetto, O., Seveso, M., Caccin, P., Schiavo, G., & Montecucco, C. (2001).
Tetanus and botulinum neurotoxins: turning bad guys into good by research. Toxicon : official journal of the International Society on Toxinology, 39(1), 27-41. [PubMed:10936621] [WorldCat] [DOI] - ↑
Caleo, M., & Schiavo, G. (2009).
Central effects of tetanus and botulinum neurotoxins. Toxicon : official journal of the International Society on Toxinology, 54(5), 593-9. [PubMed:19264088] [WorldCat] [DOI] - ↑
Casale, R., & Tugnoli, V. (2008).
Botulinum toxin for pain. Drugs in R&D, 9(1), 11-27. [PubMed:18095750] [WorldCat] [DOI] - ↑
Lucioni, A., Reynolds, W.S., Rapp, D.E., Katz, M., & Bales, G.T. (2008).
The use of botulinum toxin for treatment of lower urinary tract symptoms. Minerva urologica e nefrologica = The Italian journal of urology and nephrology, 60(2), 93-103. [PubMed:18500224] [WorldCat] - ↑
Truong, D.D., & Jost, W.H. (2006).
Botulinum toxin: clinical use. Parkinsonism & related disorders, 12(6), 331-55. [PubMed:16870487] [WorldCat] [DOI]