「Nogo」の版間の差分
細編集の要約なし |
Masashifujitani (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の72版が非表示) | |||
| 1行目: | 1行目: | ||
(読み方)ノゴ (英)Nogo 同じ | |||
= 概要 = | |||
Nogoは脊椎動物の中枢神経細胞に対して軸索伸長の阻害効果をもち、髄鞘(ミエリン)に含まれる軸索損傷後の再生を阻害する分子であると考えられている。Nogo-A蛋白内には2つの軸索伸張阻害作用を有する蛋白ドメインがあり(Δ20とNogo-66)、軸索伸長阻害のみならず、軸索の先端の成長円錐を虚脱させる作用を持っている。動物実験によりNogo-Aあるいはその下流のシグナルを阻害することにより、神経損傷時における神経軸索の再生を促すことが示されてきた。このことから軸索が損傷を受け、その再生ができないことにより、重度の後遺障害が残る脊髄損傷や多発性硬化症のような脱髄疾患における軸索再生治療への期待がかけられている。また、病態時のみならず、脳内の学習と記憶のプロセスを強化する課程において重要な役割を果たすことが分かっている。 <br> | |||
[[Image:Nogo 一次構造.jpg|frame|right|250px|(図1)Nogo蛋白の一次構造]] | |||
[[Image:Nogo 一次構造.jpg| | |||
= 蛋白の一次構造とドメイン = | |||
Nogo-A蛋白は、1163アミノ酸で構成される蛋白である。<br> 図1に示されるとおり、Nogo蛋白の一次構造は、''RTN4''遺伝子によりコードされる二回膜貫通型の蛋白である。 ''RTN4''遺伝子からは、3つのアイソフォームNogo-A,Nogo-B,Nogo-Cが作られる。軸索伸展阻害作用を持つNogo-66はNogo-A,-B,-Cに共通のドメインである。一方、もう一つの軸索伸展阻害作用を持つΔ20ドメインは、Nogo-Aのみが持つことが分かっている。Δ20ドメインが重要と考えているグループと膜貫通領域に挟まれる66個のアミノ酸からなるペプチド部分(Nogo-66)が重要と考えているグループに分かれているが、一般的に、Nogoの作用を指すのは、Nogo-66の作用である場合が多い。<br> | |||
Nogo- | Nogo-Aは二回膜貫通型で、図2で示されるように、アミノ末端部は細胞外に露出していると考えられている。また、アミノ末端側の膜貫通ドメインは二回膜貫通できるのに十分長いと考えられている。 | ||
= | = <br>蛋白の発現様式<br> = | ||
細胞内では、他のreticulonファミリー蛋白と同様に、小胞体もしくは図2に示されるように細胞表面に発現していると考えられている。 | |||
神経系においては、発生時期には、神経芽細胞や移動中の幼弱な神経細胞に発現が報告されている。一方、生後および成獣においては主として希突起膠細胞そして、一部の神経細胞に発現が認められると報告されている。 | |||
[[Image:Nogo signal | [[Image:Nogo signal.jpg|frame|right|500px]] | ||
= | = 蛋白の機能 <br> = | ||
==== | === <span style="font-weight: bold;">成体神経細胞に対する軸索伸展阻害作用</span> === | ||
==== ミエリン由来軸索伸展阻害分子の作用とは ==== | |||
今からおよそ80年前のスペインの神経学者Ramon y Cajal、その後のAguayoらの実験により、神経細胞自体には再生する力があり、神経細胞を取り巻く環境が再生に適していないのではないかと考えられるようになる。その候補分子の一つとして、ミエリンが神経突起の伸展を抑制することが報告されたことから、ミエリンの中に再生を阻害し | |||
ている分子が存在していると考えられた。そして、Schwabらにより、ミエリンの各フラクションに対する抗体が作成され、IN-1抗体が発見される。IN-1はミエリンの作用を打ち消し、また、IN-1抗体を脊髄損傷させたラットに投与すると、軸索再生と運動機能の回復が認められることが報告された。その後、3つのグループによりIN-1抗体の認識するペプチド配列をもとに、目的の蛋白がクローニングされ、Nogoと名付けられた。 | |||
==== 受容体と細胞内シグナル ==== | |||
StrittmatterらはNogo-66の受容体Nogo受容体NgRを同定した。NgRは細胞内ドメインをもたないGPIアンカー型蛋白であり、Nogo-66に対し高親和性を示す。更に、そのシグナル伝達の受容体が、神経栄養因子の受容体であるp75受容体であることが証明された<ref><pubmed> 12422217</pubmed></ref>。また、その細胞内へのシグナルはRho/ROCK経路を介した、細胞骨格制御であると報告されている。<br> しかしながらp75/Nogo受容体のみでは、ある種の細胞ではリガンドで刺激してもRhoが活性化しない。そこでLingo-1がp75/Nogo受容体コンポーネントとして重要と報告され、p75/Nogo受容体/Lingo-1という受容体複合によりRhoが活性化されて、軸索伸展が阻止されるという基本モデルが完成した(図2左側)<ref><pubmed> 14966521</pubmed></ref>。<br> さらに最近になって、Tessier-Lavigneのグループは、Nogo-66に対する受容体をスクリーニングし、NgRと共に、paired immunoglobulin-like receptor B(PirB)を報告した。PirBとNgRの両方を阻害することにより、ミエリンや、Nogo-66の軸索伸展阻害作用のほぼ完全な消失が証明された。<ref><pubmed> 18988857 </pubmed></ref><br> | |||
==== ミエリン由来軸索伸展阻害因子のin vivoにおける作用 ==== | ==== ミエリン由来軸索伸展阻害因子のin vivoにおける作用 ==== | ||
Nogoは当初、IN-1抗体や、NEP1-40という阻害ペプチドを用いて、脊髄損傷モデルを治療できると報告され、in vivoで再生阻害蛋白として働くと考えられていた。しかし、Nogoのノックアウトマウスを3つのグループが独自に作成し、脊髄損傷後の軸索再生を評価したが、グループ間でけっかがこ明らかな、軸索再生は認められなかったものから一部再生が認められるというものまで結果が食い違って報告された。また、最近になり、主要な再生阻害因子(MAG,Nogo,OMgp)のトリプルノックアウトマウスにおいても、脊髄損傷モデルが作成されたが、再生の促進が認められないと報告された。 | |||
このことから、<br><br> | |||
=== その他の機能 === | === その他の機能 === | ||
正常における機能も解析されている。その中では、 | |||
*Critical periodの形成に関わり、成体の軸索の再編成を制御し、神経ネットワークの可塑性を制御すること | |||
*胎生期神経前駆細胞の放射状移動を制御すること | |||
*βセクレターゼ活性の制御によるAPPの切断を制御すること | |||
が報告されている。明確な証明はないが、正常において、ミエリンや、ミエリン由来の軸索伸展阻害因子は、軸索の余計な芽生えや分枝が起こることを防ぐことにより、正常な軸索の状態を維持するのに役立っているのではないかという考えが、昔から提唱されてきたが、今のところそれを明確に証明する研究は報告されていないようである。参考文献<ref><pubmed> 21045861 </pubmed></ref><br> | |||
<br> | |||
<br> | |||
<references /><br> | |||
<br> | |||
< | <br> | ||
2012年2月16日 (木) 11:19時点における版
(読み方)ノゴ (英)Nogo 同じ
概要
Nogoは脊椎動物の中枢神経細胞に対して軸索伸長の阻害効果をもち、髄鞘(ミエリン)に含まれる軸索損傷後の再生を阻害する分子であると考えられている。Nogo-A蛋白内には2つの軸索伸張阻害作用を有する蛋白ドメインがあり(Δ20とNogo-66)、軸索伸長阻害のみならず、軸索の先端の成長円錐を虚脱させる作用を持っている。動物実験によりNogo-Aあるいはその下流のシグナルを阻害することにより、神経損傷時における神経軸索の再生を促すことが示されてきた。このことから軸索が損傷を受け、その再生ができないことにより、重度の後遺障害が残る脊髄損傷や多発性硬化症のような脱髄疾患における軸索再生治療への期待がかけられている。また、病態時のみならず、脳内の学習と記憶のプロセスを強化する課程において重要な役割を果たすことが分かっている。
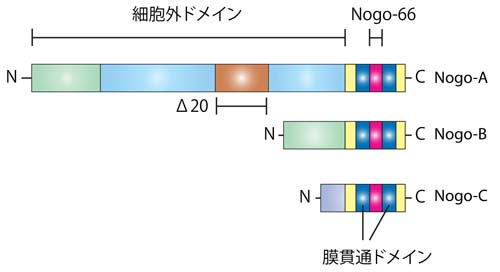
蛋白の一次構造とドメイン
Nogo-A蛋白は、1163アミノ酸で構成される蛋白である。
図1に示されるとおり、Nogo蛋白の一次構造は、RTN4遺伝子によりコードされる二回膜貫通型の蛋白である。 RTN4遺伝子からは、3つのアイソフォームNogo-A,Nogo-B,Nogo-Cが作られる。軸索伸展阻害作用を持つNogo-66はNogo-A,-B,-Cに共通のドメインである。一方、もう一つの軸索伸展阻害作用を持つΔ20ドメインは、Nogo-Aのみが持つことが分かっている。Δ20ドメインが重要と考えているグループと膜貫通領域に挟まれる66個のアミノ酸からなるペプチド部分(Nogo-66)が重要と考えているグループに分かれているが、一般的に、Nogoの作用を指すのは、Nogo-66の作用である場合が多い。
Nogo-Aは二回膜貫通型で、図2で示されるように、アミノ末端部は細胞外に露出していると考えられている。また、アミノ末端側の膜貫通ドメインは二回膜貫通できるのに十分長いと考えられている。
蛋白の発現様式
細胞内では、他のreticulonファミリー蛋白と同様に、小胞体もしくは図2に示されるように細胞表面に発現していると考えられている。
神経系においては、発生時期には、神経芽細胞や移動中の幼弱な神経細胞に発現が報告されている。一方、生後および成獣においては主として希突起膠細胞そして、一部の神経細胞に発現が認められると報告されている。
蛋白の機能
成体神経細胞に対する軸索伸展阻害作用
ミエリン由来軸索伸展阻害分子の作用とは
今からおよそ80年前のスペインの神経学者Ramon y Cajal、その後のAguayoらの実験により、神経細胞自体には再生する力があり、神経細胞を取り巻く環境が再生に適していないのではないかと考えられるようになる。その候補分子の一つとして、ミエリンが神経突起の伸展を抑制することが報告されたことから、ミエリンの中に再生を阻害し
ている分子が存在していると考えられた。そして、Schwabらにより、ミエリンの各フラクションに対する抗体が作成され、IN-1抗体が発見される。IN-1はミエリンの作用を打ち消し、また、IN-1抗体を脊髄損傷させたラットに投与すると、軸索再生と運動機能の回復が認められることが報告された。その後、3つのグループによりIN-1抗体の認識するペプチド配列をもとに、目的の蛋白がクローニングされ、Nogoと名付けられた。
受容体と細胞内シグナル
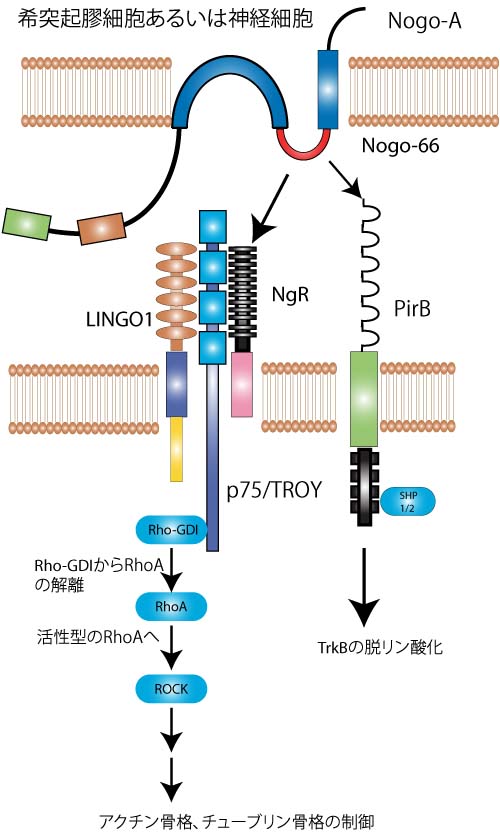
StrittmatterらはNogo-66の受容体Nogo受容体NgRを同定した。NgRは細胞内ドメインをもたないGPIアンカー型蛋白であり、Nogo-66に対し高親和性を示す。更に、そのシグナル伝達の受容体が、神経栄養因子の受容体であるp75受容体であることが証明された[1]。また、その細胞内へのシグナルはRho/ROCK経路を介した、細胞骨格制御であると報告されている。
しかしながらp75/Nogo受容体のみでは、ある種の細胞ではリガンドで刺激してもRhoが活性化しない。そこでLingo-1がp75/Nogo受容体コンポーネントとして重要と報告され、p75/Nogo受容体/Lingo-1という受容体複合によりRhoが活性化されて、軸索伸展が阻止されるという基本モデルが完成した(図2左側)[2]。
さらに最近になって、Tessier-Lavigneのグループは、Nogo-66に対する受容体をスクリーニングし、NgRと共に、paired immunoglobulin-like receptor B(PirB)を報告した。PirBとNgRの両方を阻害することにより、ミエリンや、Nogo-66の軸索伸展阻害作用のほぼ完全な消失が証明された。[3]
ミエリン由来軸索伸展阻害因子のin vivoにおける作用
Nogoは当初、IN-1抗体や、NEP1-40という阻害ペプチドを用いて、脊髄損傷モデルを治療できると報告され、in vivoで再生阻害蛋白として働くと考えられていた。しかし、Nogoのノックアウトマウスを3つのグループが独自に作成し、脊髄損傷後の軸索再生を評価したが、グループ間でけっかがこ明らかな、軸索再生は認められなかったものから一部再生が認められるというものまで結果が食い違って報告された。また、最近になり、主要な再生阻害因子(MAG,Nogo,OMgp)のトリプルノックアウトマウスにおいても、脊髄損傷モデルが作成されたが、再生の促進が認められないと報告された。
このことから、
その他の機能
正常における機能も解析されている。その中では、
- Critical periodの形成に関わり、成体の軸索の再編成を制御し、神経ネットワークの可塑性を制御すること
- 胎生期神経前駆細胞の放射状移動を制御すること
- βセクレターゼ活性の制御によるAPPの切断を制御すること
が報告されている。明確な証明はないが、正常において、ミエリンや、ミエリン由来の軸索伸展阻害因子は、軸索の余計な芽生えや分枝が起こることを防ぐことにより、正常な軸索の状態を維持するのに役立っているのではないかという考えが、昔から提唱されてきたが、今のところそれを明確に証明する研究は報告されていないようである。参考文献[4]
- ↑
Wang, K.C., Kim, J.A., Sivasankaran, R., Segal, R., & He, Z. (2002).
P75 interacts with the Nogo receptor as a co-receptor for Nogo, MAG and OMgp. Nature, 420(6911), 74-8. [PubMed:12422217] [WorldCat] [DOI] - ↑
Mi, S., Lee, X., Shao, Z., Thill, G., Ji, B., Relton, J., ..., & Pepinsky, R.B. (2004).
LINGO-1 is a component of the Nogo-66 receptor/p75 signaling complex. Nature neuroscience, 7(3), 221-8. [PubMed:14966521] [WorldCat] [DOI] - ↑
Atwal, J.K., Pinkston-Gosse, J., Syken, J., Stawicki, S., Wu, Y., Shatz, C., & Tessier-Lavigne, M. (2008).
PirB is a functional receptor for myelin inhibitors of axonal regeneration. Science (New York, N.Y.), 322(5903), 967-70. [PubMed:18988857] [WorldCat] [DOI] - ↑
Schwab, M.E. (2010).
Functions of Nogo proteins and their receptors in the nervous system. Nature reviews. Neuroscience, 11(12), 799-811. [PubMed:21045861] [WorldCat] [DOI]