「軸索再生」の版間の差分
細 →参考文献 |
|||
| (2人の利用者による、間の26版が非表示) | |||
| 1行目: | 1行目: | ||
英語名: Axon regeneration | |||
軸索再生とは、外傷などにより切断された神経細胞の軸索が標的細胞へ向かって伸展し、神経回路を再構築することである。末梢神経軸索が損傷領域を超えて再生するポテンシャルを有するのに対し、中枢神経系は神経細胞の複雑なネットワークで構成されており、一度損傷を受けてこのネットワークが破壊されると回復は難しい。切断された中枢神経軸索が再び伸展し、標的細胞とシナプスを形成することが出来れば機能的な回復が望めるはずであるが、実際にこのような現象はほとんど起こらない。損傷を受けた神経細胞が再び神経ネットワークに組み込まれて機能するためには、軸索の伸展、標的部位への誘導、標的細胞とのシナプス形成、ミエリン化という段階をふんだ再生が必要である。すなわち、損傷した中枢神経軸索から標的細胞への新たな軸索再生が不可欠である。 | |||
== 中枢神経系における軸索再生 == | == 中枢神経系における軸索再生 == | ||
ヒトを含む成体哺乳類の神経軸索が、外傷などにより切断された場合、末梢神経では損傷部を超えた軸索の再生が認められるのに対し、中枢神経では軸索の再生は難しいと考えられてきた。この原因として、中枢神経系の損傷部の環境が再生に適していないという外的要因と、中枢神経細胞自体の軸索伸長能が弱いという内的要因の二点があげられる。 | |||
=== 再生を困難にする外的要因 === | === 再生を困難にする外的要因 === | ||
哺乳類の中枢神経系には、軸索再生を抑止する機構が神経細胞を取り巻く周囲の細胞に存在すると考えられている。1920年代にRamon y Cajalは、末梢神経である後根神経の軸索を切断し、その後の軸索再生を観察した。再生しかけた後根神経の軸索は、脊髄の中には侵入することがなかった。1980年代には、DavidとAguayoが、脊髄損傷後の欠損部に末梢神経の周囲組織を移植し、この移植片内に軸索が再生することを観察した。以上の研究から、中枢神経の周囲の環境が、軸索の再生に適していないと考えられている。中枢神経細胞の再生を困難にさせる外的要因として、1) 軸索再生阻害因子、2) グリア瘢痕の形成、3) 炎症反応などが存在する。 | |||
==== 1) 軸索再生阻害因子 ==== | |||
[[Image:1. ミエリン由来軸索再生阻害因子の構造.png|RTENOTITLE|right|300px]] | |||
[[Image:2. 軸索再生阻害のシグナル伝達機構.png|RTENOTITLE|right|300px]] | |||
中枢神経軸索は、オリゴデンドロサイトの細胞膜表面のリン脂質からなるミエリンにより覆われている。軸索が損傷された後にも、ミエリンはdebrisとして残存し、この中には、複数の軸索再生阻害因子が含まれることが報告されている。中でも、myelin associated glycoprotein (MAG), Nogo, oligodendrocyte myelin glycoprotein (OMgp)についての研究が進んでいる。MAGは、1回膜貫通型の糖タンパク質であり、免疫グロブリン様ドメインを有する。Nogoは、2回膜貫通構造を持ち、スプライシングにより長さの異なる3種のタンパク質として発現する。このうち、最も長いNogo-Aには再生阻害作用を有する2つのドメインがある。N末端側のamino-Nogoと、疎水性領域に挟まれる66個のアミノ酸配列からなるペプチド配列Nogo-66である。OMgpは、GPIアンカー型のタンパク質で、セリンスレオニンリッチドメインとロイシンリッチリピートを有する (図1)。このように、これらの因子は全て構造が異なるにもかかわらず、Nogo受容体 (NgR)、PIR-Bといった共通の受容体を介して軸索再生阻害シグナルを伝える。NgRは細胞内ドメインを持たないGPIアンカー型タンパク質である。従って、NgR単独では細胞内にシグナルを伝えることは不可能で、神経栄養因子の受容体として知られるp75と共受容体を形成し、ミエリン由来軸索再生阻害因子のシグナルを細胞内に伝達することが報告されている。p75はこれらの軸索再生阻害因子の存在下で、低分子量Gタンパク質であるRhoAを活性化することで軸索伸展を阻害する。低分子量Gタンパク質の一種であるRhoAは、アクチン骨格系を制御する因子で、細胞内ではRho guanine nucleotide dissociation inhibitor (Rho-GDI)と結合した不活性化の状態で安定となっている。p75はRhoとRho-GDIの結合を解離することでRhoの活性化を誘導し、軸索伸長を阻害する <ref><pubmed> 12692556 </pubmed></ref>。しかし、ある種の細胞においては、p75/NgRのみではリガンドで刺激してもRhoが活性化されない。そこで、新たにLingo-1が受容体複合体の構成要素として同定された <ref><pubmed> 14966521 </pubmed></ref>。こうして、NgR/p75/Lingo-1の受容体複合体形成により、Rhoが活性化されて軸索伸展が阻害されるという基本モデルが確立された(図2)。Rhoの活性化は、そのエフェクターであるRhoキナーゼの活性化を誘導し、軸索再生阻害作用を示す。これは、Rhoキナーゼの阻害剤がミエリン由来軸索再生阻害因子の作用を抑制することによって証明されている。さらに、この下流のシグナルとして、Rhoキナーゼの基質であるCRMP-2の不活性化が示されている。CRMP-2は、微小管構成タンパク質であるチュブリン二量体と結合し、微小管重合を促進することが知られている。MAG刺激で、CRMP-2はRhoキナーゼによるリン酸化を受けて不活性化し、微小管重合を抑制することから、ミエリン由来軸索再生阻害因子は、Rho/Rhoキナーゼの活性化を介して微小管重合を抑制し、軸索伸長阻害作用を示すことが示唆される。 | |||
近年、MAG、Nogo、OMgpの三者を欠損したマウスが作成された。中枢神経軸索再生の研究には、脊髄損傷モデルがよく使われるが、MAG、Nogo、OMgp全てを欠損したマウスにおいても、脊髄損傷後の有為な軸索再生は認められなかった。このことから、これら以外の軸索再生阻害因子による寄与も大きいことが考えられる <ref><pubmed> 20547125 </pubmed></ref>。MAG、Nogo、OMgp以外に軸索再生を阻害する因子として、軸索反発因子がある <ref><pubmed> 16858390 </pubmed></ref>。軸索反発因子は、発生期における神経回路の形成を担うことが知られている。脊髄損傷モデル動物では、損傷領域周辺で、Semaphorin、Ephrin、Wnt、Repulsive guidance molecule (RGM)などの軸索反発因子の発現が増強する。これらの因子の作用を減弱させることで、損傷後の神経軸索の再生や機能回復に繋がることが報告されている。脊髄損傷モデルにおいて、Sema3Aの発現上昇が確認されており、Sema3A阻害剤の投与により縫線核脊髄路の再生、運動機能の回復が示された。Ephrin-B3は、発生期に脊髄正中線に発現し、軸索反発因子として働くが、ミエリン存在下、神経突起の伸長を抑制することが示された。Ephrin-B3は成体マウス脊髄白質のオリゴデンドロサイトに発現することが確認されている。in vitroの神経突起伸展アッセイにおいて、Ephrin-B3が小脳顆粒細胞や大脳皮質神経細胞の突起伸展を抑制することが確認されている。in vivoの実験においても、Ephrin-B3の受容体であるEphA4欠損マウスでは、脊髄損傷後の皮質脊髄路と赤核脊髄路の再生と機能回復が示されたことから、Ephrin-B3は軸索再生阻害タンパク質の一種であると考えられている。Wnt1, Wnt5aの発現は、脊髄損傷後1日で損傷部周辺での発現が上昇する。これらの受容体であるRykの中和抗体の投与により、脊髄損傷後の再生軸索の増加が認められている。RGMは、GPIアンカー型のタンパク質であり、脊髄損傷後、損傷部周辺での発現上昇が確認されている。in vivoの神経突起伸展アッセイにおいて、RGMがRhoAの活性化を介して小脳顆粒細胞の突起伸展を抑制することが示されている。in vivoにおいても、脊髄損傷後2週間にわたり、RGM中和抗体を局所投与し、その機能を抑制すると、皮質脊髄路の再生及び運動機能の回復が認められている。RGMはオリゴデンドロサイト由来のミエリンに発現しているが、脊髄損傷後の損傷部位に集積するミクログリアにも強く発現している。これは、免疫系細胞の軸索再生への関与を示唆している。 | |||
==== 2) グリア瘢痕 ==== | |||
損傷を受けた中枢神経系では、損傷周囲部に反応性アストロサイトが集積し、グリア瘢痕と呼ばれる高密度の瘢痕組織を形成する。これは、軸索再生を妨げる物理的な障害となり得る。また、グリア瘢痕に集まる細胞から産生される因子は、化学的に軸索の再生を妨げる。損傷部位に集積する反応性アストロサイトは、軸索伸長を阻害するコンドロイチン硫酸プロテオグリカン (chondroitin sulphate proteoglycans: CSPGs)を産生する。CSPGsは長大な糖鎖である硫酸グリコサミノグリカンとコアタンパク質からなる分子で、aggrecan、brevican、neurocan、versican、phosphacan、NG2などが知られており、軸索伸長阻害作用を示す。脊髄損傷後、CSPGsのコアタンパク質からグリコサミノグリカンを除去するコンドロイチナーゼABCを投与すると、CSPGsが分解され、感覚神経線維と運動神経繊維の再生および、運動機能、固有感覚の回復が認められた。CSPGsはepidermal growth factor (EGF)受容体を介して軸索伸長阻害作用を示すことが示唆されている。脊髄損傷モデル動物に対して、EGF受容体の阻害剤を投与すると、縫線核脊髄路のセロトニン作動性神経繊維の再生、及び運動機能、膀胱機能の回復が認められた。他にも、瘢痕組織の線維芽細胞からは、再生反応を阻害するSemaphorin3Aが産生されることが知られている (上記1)参照)。 | |||
一方、グリア瘢痕には、損傷治癒や機能回復を促す方向に作用するという面もある。グリア瘢痕の形成により、炎症細胞の遊走や細胞の変性を局所にとどめ、損傷領域を最小限に抑えられると考えられている。また、一部のアストロサイトは、軸索再生を促すことが示唆されている。glial fibrillary acid protein (GFAP)陽性の反応性アストロサイトを除去することにより、脊髄損傷後の脱髄の悪化、神経やオリゴデンドロサイトの細胞死の増加、運動機能の悪化することが示されている。脊髄損傷後のアストロサイトの反応性を制御する因子として、STAT3が報告されている。アストロサイトのSTAT3を欠損させたマウスでは、脊髄損傷後、アストロサイトの損傷部への遊走や蓄積が抑制される。また、STAT3を負に制御するSocs3をアストロサイトで欠損させたマウスでは、脊髄損傷後の運動機能の回復が認められている <ref><pubmed> 16783372 </pubmed></ref>。 | |||
==== 3) 炎症反応 ==== | |||
通常状態では、血液脳関門の存在のため、免疫細胞を含む血液系の細胞の中枢神経系への侵入は限定されている。しかし、損傷時には血液脳関門は破壊され、免疫系細胞が中枢神経系に侵入し、炎症反応を誘導する。免疫細胞は多くの因子を産生し、神経変性を惹起する方向に働くと考えられてきた。一方で、免疫反応が中枢神経の修復に寄与するという報告もあり、中枢神経の軸索再生に対して、促進と阻害の二面性をもつ。 | |||
脊髄損傷後の自然免疫の役割: 脊髄損傷後には、好中球、マクロファージなどが、損傷部修復のために集積するが、これらの細胞は、組織への障害性も併せ持つ。脊髄損傷後、好中球は活性化し、myeloperoxidaseやelastaseなどの傷害性因子を産生する。脊髄損傷モデル動物に、これらの因子の阻害剤を投与すると、機能的な回復が認められている。マクロファージも神経細胞やグリア細胞に対する傷害性因子を産生する。一方で、これらの細胞の活性化は損傷部位の修復にも貢献する。脊髄損傷後、LPSを投与しマクロファージからのサイトカイン産生を誘導すると、損傷部の空洞化が抑制され、神経線維の側枝形成が促されることが報告されている。 | |||
脊髄損傷後の獲得免疫の役割: 獲得免疫系においては、リンパ球が主要な役割を担う。脊髄損傷後には、T細胞が中枢神経系のタンパク質に反応性を示し、活性化することが報告されている。これらのT細胞は脊髄損傷後、早期における組織障害を悪化させたり、神経変性を進行させる。一方で、myelin basic protein (MBP)に反応性を示すT細胞が、脊髄損傷後の組織修復や機能回復を促すという報告もある <ref><pubmed> 18490917 </pubmed></ref>。 | |||
=== 再生を困難にする内的要因 === | === 再生を困難にする内的要因 === | ||
中枢神経軸索の再生能が低下する内的要因として、細胞内cAMP濃度の減少が考えられている。胎生期の神経細胞では、細胞内cAMP濃度が高いが、生後まもなく、神経細胞内のcAMP濃度が劇的に減少する。ミエリン存在下で培養した神経細胞に、細胞膜透過性のcAMPアナログであるdibutyryl cyclic AMP (db-cAMP)を処置すると、神経軸索の伸長が促される。cAMPの分解酵素phosphodiesteraseの阻害剤であるrolipramの投与により、cAMPの濃度上昇を誘導すると、脊髄損傷後のセロトニン作動性神経線維の再生が促され、運動機能が回復する <ref><pubmed> 15173585 </pubmed></ref>。この分子機構として、cAMP濃度上昇に伴う、転写因子cAMP response element binding protein (CREB)のリン酸化の亢進と、これに続くポリアミン合成酵素Arginase I (Arg I)の発現上昇が重要であると考えられている。 | |||
神経栄養因子の投与によっても、細胞内cAMPの濃度が上昇する。神経栄養因子はcAMPの合成は誘導せず、分解を抑制する。神経栄養因子がTrk受容体に結合すると、細胞内でextracellular signal-regulated kinase (Erk)の活性化が起こり、phosphodiesteraseが阻害される。この結果、cAMPの分解が抑制されて、細胞内cAMP濃度が上昇する。Erk活性化によるPDE活性阻害とdb-cAMPは相乗的にcAMPの濃度を上昇させる。 | |||
=== 軸索再生の再評価 === | === 軸索再生の再評価 === | ||
O. Stewardらによると中枢神経の軸索再生は以下の様に定義されている <ref><pubmed> 12629662 </pubmed></ref>。 | |||
#中枢神経系から、中枢神経系ではない環境 (特に損傷などにより生じた瘢痕組織)へ、再生した軸索が伸長する | # 中枢神経系から、中枢神経系ではない環境 (特に損傷などにより生じた瘢痕組織)へ、再生した軸索が伸長する | ||
#宿主以外に由来する移植組織へ、再生した軸索が伸長する | # 宿主以外に由来する移植組織へ、再生した軸索が伸長する | ||
#切断部またはその周囲から再生した軸索が生じている | # 切断部またはその周囲から再生した軸索が生じている | ||
#もとの中枢神経系とは異なる経路で再生した軸索が走行している | # もとの中枢神経系とは異なる経路で再生した軸索が走行している | ||
#再生した軸索が妥当な再生距離を示す <br>損傷後5 ~ 7日: 損傷からの回復と、伸長反応の開始 <br>損傷後7 ~ 10日: 再生軸索が損傷部位に達する <br>損傷後10 ~ 14日: 再生軸索が損傷部周囲を伸長 <br>損傷後14 ~ 21日: 再生軸索が遠位の非損傷部位へ侵入 <br>損傷後21日以降: 再生軸索が最大で約1mm /日の速度で遠位部の中を伸長 | # 再生した軸索が妥当な再生距離を示す <br>損傷後5 ~ 7日: 損傷からの回復と、伸長反応の開始 <br>損傷後7 ~ 10日: 再生軸索が損傷部位に達する <br>損傷後10 ~ 14日: 再生軸索が損傷部周囲を伸長 <br>損傷後14 ~ 21日: 再生軸索が遠位の非損傷部位へ侵入 <br>損傷後21日以降: 再生軸索が最大で約1mm /日の速度で遠位部の中を伸長 | ||
#再生中には、軸索が伸長時に観察されるような形態 ( | # 再生中には、軸索が伸長時に観察されるような形態 (成長円錐のような先端)を示す | ||
#再生した軸索は、通常の軸索のような走行を示さず、蛇行性に伸長する | # 再生した軸索は、通常の軸索のような走行を示さず、蛇行性に伸長する | ||
中枢神経の軸索再生の研究には、脊髄損傷モデルがよく使われる。完全損傷モデルの場合、全ての軸索が切断されるため、切断された脊髄の段端がはなれて、脳脊髄液で満たされた間隙ができる。また、損傷部周辺では二次的な変性がおこり、切断面をさらに遠ざけてしまう。そこで、組織へのダメージを最小限にするため、不完全損傷モデルが使用されることが多い。不完全損傷モデルには、腹側皮質脊髄路のみを残し、他の皮質脊髄路の繊維は全て切断するdorsal hemisectionモデルや、一側を完全切断して反対側を残すlateral hemisetionモデルがある。最近の研究から、成体哺乳類の中枢神経系においても、薬剤投与や遺伝子操作により、脊髄損傷モデル動物における軸索再生が誘導されることが報告されている。しかし一方で、これらの結果の再現性に疑問を投げかける研究結果も報告されている。2003年に、National Institute of Neurological Disorders and Stroke (NINDS)により、Facilities of Research Excellence – Spinal Cord Injury (FORE – SCI)というプログラムが開始され、それまでに報告されていた脊髄損傷モデル動物を用いた軸索再生研究の再評価がなされた。その結果、再現性が確認されたのは、12件中2件 (うち1件は報告されていたものよりも、弱い回復)のみであった <ref><pubmed> 22078756 </pubmed></ref>。これらの研究結果からも、中枢神経の軸索再生を実現することの難しさが伺える。 | |||
== 末梢神経系における軸索再生 == | == 末梢神経系における軸索再生 == | ||
末梢神経は中枢神経に比べ、著明な軸索の再生が認められる。末梢神経では、細胞体が無傷であれば、軸索が切断されても再生が可能である。末梢神経系に存在するグリア細胞であるシュワン細胞は、損傷の刺激で増殖・活性化し、神経再生を促す。 | |||
末梢神経の軸索が切断されると、損傷部位より遠位の軸索は、ワーラー変性と呼ばれる過程により断片化し、ミクログリアなどの貪食細胞により除去される。この際、シュワン細胞は柱状に配列し、Büngner’s bandと呼ばれる構造を形成する。Büngner’s bandは、再生軸索の足場を確保するとともに、神経栄養因子を供給して、再生軸索の伸長を助ける。細胞体側の残存した軸索は (やや退縮するが)、成長円錐を形成し、Büngner’s bandの中を伸長する。 | |||
末梢神経の再生に関しても、cAMPの細胞内濃度の上昇が重要である。上記の通り、神経栄養因子はcAMPの分解を抑制し、細胞内cAMP濃度を上昇させる。神経栄養因子とdb-cAMPの両方の投与により、脊髄損傷後の感覚神経軸索の再生が促される。損傷前に感覚神経の細胞体が存在する脊髄後根神経節にdb-cAMPを投与しておき、損傷後に神経栄養因子neurotrophin-3 (NT-3)の投与を行うと、損傷1-3ヶ月後に損傷領域を超えて感覚神経の再生が認められる。損傷領域を超えての軸索再生はdb-cAMP、NT-3それぞれ単独投与では認められないことから、脊髄損傷後の軸索再生に必要な細胞内cAMP濃度上昇を促すためには、cAMPの投与と分解の抑制の両方が必要である <ref><pubmed> 12086637 </pubmed></ref>, <ref><pubmed> 12086638 </pubmed></ref>。 | |||
== 参考文献 == | |||
<references /> | |||
脳科学辞典の[[p75]]の項目 | |||
脳科学辞典の[[シュワン細胞]]の項目 | |||
(執筆担当者: 藤田幸、山下俊英、担当編集委員: 村上富士夫) | |||
2012年2月22日 (水) 13:59時点における版
英語名: Axon regeneration
軸索再生とは、外傷などにより切断された神経細胞の軸索が標的細胞へ向かって伸展し、神経回路を再構築することである。末梢神経軸索が損傷領域を超えて再生するポテンシャルを有するのに対し、中枢神経系は神経細胞の複雑なネットワークで構成されており、一度損傷を受けてこのネットワークが破壊されると回復は難しい。切断された中枢神経軸索が再び伸展し、標的細胞とシナプスを形成することが出来れば機能的な回復が望めるはずであるが、実際にこのような現象はほとんど起こらない。損傷を受けた神経細胞が再び神経ネットワークに組み込まれて機能するためには、軸索の伸展、標的部位への誘導、標的細胞とのシナプス形成、ミエリン化という段階をふんだ再生が必要である。すなわち、損傷した中枢神経軸索から標的細胞への新たな軸索再生が不可欠である。
中枢神経系における軸索再生
ヒトを含む成体哺乳類の神経軸索が、外傷などにより切断された場合、末梢神経では損傷部を超えた軸索の再生が認められるのに対し、中枢神経では軸索の再生は難しいと考えられてきた。この原因として、中枢神経系の損傷部の環境が再生に適していないという外的要因と、中枢神経細胞自体の軸索伸長能が弱いという内的要因の二点があげられる。
再生を困難にする外的要因
哺乳類の中枢神経系には、軸索再生を抑止する機構が神経細胞を取り巻く周囲の細胞に存在すると考えられている。1920年代にRamon y Cajalは、末梢神経である後根神経の軸索を切断し、その後の軸索再生を観察した。再生しかけた後根神経の軸索は、脊髄の中には侵入することがなかった。1980年代には、DavidとAguayoが、脊髄損傷後の欠損部に末梢神経の周囲組織を移植し、この移植片内に軸索が再生することを観察した。以上の研究から、中枢神経の周囲の環境が、軸索の再生に適していないと考えられている。中枢神経細胞の再生を困難にさせる外的要因として、1) 軸索再生阻害因子、2) グリア瘢痕の形成、3) 炎症反応などが存在する。
1) 軸索再生阻害因子
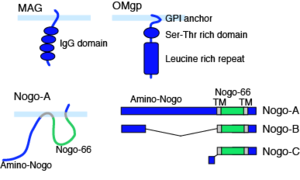
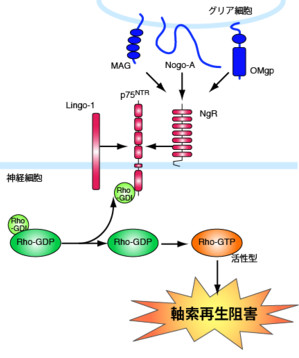
中枢神経軸索は、オリゴデンドロサイトの細胞膜表面のリン脂質からなるミエリンにより覆われている。軸索が損傷された後にも、ミエリンはdebrisとして残存し、この中には、複数の軸索再生阻害因子が含まれることが報告されている。中でも、myelin associated glycoprotein (MAG), Nogo, oligodendrocyte myelin glycoprotein (OMgp)についての研究が進んでいる。MAGは、1回膜貫通型の糖タンパク質であり、免疫グロブリン様ドメインを有する。Nogoは、2回膜貫通構造を持ち、スプライシングにより長さの異なる3種のタンパク質として発現する。このうち、最も長いNogo-Aには再生阻害作用を有する2つのドメインがある。N末端側のamino-Nogoと、疎水性領域に挟まれる66個のアミノ酸配列からなるペプチド配列Nogo-66である。OMgpは、GPIアンカー型のタンパク質で、セリンスレオニンリッチドメインとロイシンリッチリピートを有する (図1)。このように、これらの因子は全て構造が異なるにもかかわらず、Nogo受容体 (NgR)、PIR-Bといった共通の受容体を介して軸索再生阻害シグナルを伝える。NgRは細胞内ドメインを持たないGPIアンカー型タンパク質である。従って、NgR単独では細胞内にシグナルを伝えることは不可能で、神経栄養因子の受容体として知られるp75と共受容体を形成し、ミエリン由来軸索再生阻害因子のシグナルを細胞内に伝達することが報告されている。p75はこれらの軸索再生阻害因子の存在下で、低分子量Gタンパク質であるRhoAを活性化することで軸索伸展を阻害する。低分子量Gタンパク質の一種であるRhoAは、アクチン骨格系を制御する因子で、細胞内ではRho guanine nucleotide dissociation inhibitor (Rho-GDI)と結合した不活性化の状態で安定となっている。p75はRhoとRho-GDIの結合を解離することでRhoの活性化を誘導し、軸索伸長を阻害する [1]。しかし、ある種の細胞においては、p75/NgRのみではリガンドで刺激してもRhoが活性化されない。そこで、新たにLingo-1が受容体複合体の構成要素として同定された [2]。こうして、NgR/p75/Lingo-1の受容体複合体形成により、Rhoが活性化されて軸索伸展が阻害されるという基本モデルが確立された(図2)。Rhoの活性化は、そのエフェクターであるRhoキナーゼの活性化を誘導し、軸索再生阻害作用を示す。これは、Rhoキナーゼの阻害剤がミエリン由来軸索再生阻害因子の作用を抑制することによって証明されている。さらに、この下流のシグナルとして、Rhoキナーゼの基質であるCRMP-2の不活性化が示されている。CRMP-2は、微小管構成タンパク質であるチュブリン二量体と結合し、微小管重合を促進することが知られている。MAG刺激で、CRMP-2はRhoキナーゼによるリン酸化を受けて不活性化し、微小管重合を抑制することから、ミエリン由来軸索再生阻害因子は、Rho/Rhoキナーゼの活性化を介して微小管重合を抑制し、軸索伸長阻害作用を示すことが示唆される。
近年、MAG、Nogo、OMgpの三者を欠損したマウスが作成された。中枢神経軸索再生の研究には、脊髄損傷モデルがよく使われるが、MAG、Nogo、OMgp全てを欠損したマウスにおいても、脊髄損傷後の有為な軸索再生は認められなかった。このことから、これら以外の軸索再生阻害因子による寄与も大きいことが考えられる [3]。MAG、Nogo、OMgp以外に軸索再生を阻害する因子として、軸索反発因子がある [4]。軸索反発因子は、発生期における神経回路の形成を担うことが知られている。脊髄損傷モデル動物では、損傷領域周辺で、Semaphorin、Ephrin、Wnt、Repulsive guidance molecule (RGM)などの軸索反発因子の発現が増強する。これらの因子の作用を減弱させることで、損傷後の神経軸索の再生や機能回復に繋がることが報告されている。脊髄損傷モデルにおいて、Sema3Aの発現上昇が確認されており、Sema3A阻害剤の投与により縫線核脊髄路の再生、運動機能の回復が示された。Ephrin-B3は、発生期に脊髄正中線に発現し、軸索反発因子として働くが、ミエリン存在下、神経突起の伸長を抑制することが示された。Ephrin-B3は成体マウス脊髄白質のオリゴデンドロサイトに発現することが確認されている。in vitroの神経突起伸展アッセイにおいて、Ephrin-B3が小脳顆粒細胞や大脳皮質神経細胞の突起伸展を抑制することが確認されている。in vivoの実験においても、Ephrin-B3の受容体であるEphA4欠損マウスでは、脊髄損傷後の皮質脊髄路と赤核脊髄路の再生と機能回復が示されたことから、Ephrin-B3は軸索再生阻害タンパク質の一種であると考えられている。Wnt1, Wnt5aの発現は、脊髄損傷後1日で損傷部周辺での発現が上昇する。これらの受容体であるRykの中和抗体の投与により、脊髄損傷後の再生軸索の増加が認められている。RGMは、GPIアンカー型のタンパク質であり、脊髄損傷後、損傷部周辺での発現上昇が確認されている。in vivoの神経突起伸展アッセイにおいて、RGMがRhoAの活性化を介して小脳顆粒細胞の突起伸展を抑制することが示されている。in vivoにおいても、脊髄損傷後2週間にわたり、RGM中和抗体を局所投与し、その機能を抑制すると、皮質脊髄路の再生及び運動機能の回復が認められている。RGMはオリゴデンドロサイト由来のミエリンに発現しているが、脊髄損傷後の損傷部位に集積するミクログリアにも強く発現している。これは、免疫系細胞の軸索再生への関与を示唆している。
2) グリア瘢痕
損傷を受けた中枢神経系では、損傷周囲部に反応性アストロサイトが集積し、グリア瘢痕と呼ばれる高密度の瘢痕組織を形成する。これは、軸索再生を妨げる物理的な障害となり得る。また、グリア瘢痕に集まる細胞から産生される因子は、化学的に軸索の再生を妨げる。損傷部位に集積する反応性アストロサイトは、軸索伸長を阻害するコンドロイチン硫酸プロテオグリカン (chondroitin sulphate proteoglycans: CSPGs)を産生する。CSPGsは長大な糖鎖である硫酸グリコサミノグリカンとコアタンパク質からなる分子で、aggrecan、brevican、neurocan、versican、phosphacan、NG2などが知られており、軸索伸長阻害作用を示す。脊髄損傷後、CSPGsのコアタンパク質からグリコサミノグリカンを除去するコンドロイチナーゼABCを投与すると、CSPGsが分解され、感覚神経線維と運動神経繊維の再生および、運動機能、固有感覚の回復が認められた。CSPGsはepidermal growth factor (EGF)受容体を介して軸索伸長阻害作用を示すことが示唆されている。脊髄損傷モデル動物に対して、EGF受容体の阻害剤を投与すると、縫線核脊髄路のセロトニン作動性神経繊維の再生、及び運動機能、膀胱機能の回復が認められた。他にも、瘢痕組織の線維芽細胞からは、再生反応を阻害するSemaphorin3Aが産生されることが知られている (上記1)参照)。
一方、グリア瘢痕には、損傷治癒や機能回復を促す方向に作用するという面もある。グリア瘢痕の形成により、炎症細胞の遊走や細胞の変性を局所にとどめ、損傷領域を最小限に抑えられると考えられている。また、一部のアストロサイトは、軸索再生を促すことが示唆されている。glial fibrillary acid protein (GFAP)陽性の反応性アストロサイトを除去することにより、脊髄損傷後の脱髄の悪化、神経やオリゴデンドロサイトの細胞死の増加、運動機能の悪化することが示されている。脊髄損傷後のアストロサイトの反応性を制御する因子として、STAT3が報告されている。アストロサイトのSTAT3を欠損させたマウスでは、脊髄損傷後、アストロサイトの損傷部への遊走や蓄積が抑制される。また、STAT3を負に制御するSocs3をアストロサイトで欠損させたマウスでは、脊髄損傷後の運動機能の回復が認められている [5]。
3) 炎症反応
通常状態では、血液脳関門の存在のため、免疫細胞を含む血液系の細胞の中枢神経系への侵入は限定されている。しかし、損傷時には血液脳関門は破壊され、免疫系細胞が中枢神経系に侵入し、炎症反応を誘導する。免疫細胞は多くの因子を産生し、神経変性を惹起する方向に働くと考えられてきた。一方で、免疫反応が中枢神経の修復に寄与するという報告もあり、中枢神経の軸索再生に対して、促進と阻害の二面性をもつ。
脊髄損傷後の自然免疫の役割: 脊髄損傷後には、好中球、マクロファージなどが、損傷部修復のために集積するが、これらの細胞は、組織への障害性も併せ持つ。脊髄損傷後、好中球は活性化し、myeloperoxidaseやelastaseなどの傷害性因子を産生する。脊髄損傷モデル動物に、これらの因子の阻害剤を投与すると、機能的な回復が認められている。マクロファージも神経細胞やグリア細胞に対する傷害性因子を産生する。一方で、これらの細胞の活性化は損傷部位の修復にも貢献する。脊髄損傷後、LPSを投与しマクロファージからのサイトカイン産生を誘導すると、損傷部の空洞化が抑制され、神経線維の側枝形成が促されることが報告されている。
脊髄損傷後の獲得免疫の役割: 獲得免疫系においては、リンパ球が主要な役割を担う。脊髄損傷後には、T細胞が中枢神経系のタンパク質に反応性を示し、活性化することが報告されている。これらのT細胞は脊髄損傷後、早期における組織障害を悪化させたり、神経変性を進行させる。一方で、myelin basic protein (MBP)に反応性を示すT細胞が、脊髄損傷後の組織修復や機能回復を促すという報告もある [6]。
再生を困難にする内的要因
中枢神経軸索の再生能が低下する内的要因として、細胞内cAMP濃度の減少が考えられている。胎生期の神経細胞では、細胞内cAMP濃度が高いが、生後まもなく、神経細胞内のcAMP濃度が劇的に減少する。ミエリン存在下で培養した神経細胞に、細胞膜透過性のcAMPアナログであるdibutyryl cyclic AMP (db-cAMP)を処置すると、神経軸索の伸長が促される。cAMPの分解酵素phosphodiesteraseの阻害剤であるrolipramの投与により、cAMPの濃度上昇を誘導すると、脊髄損傷後のセロトニン作動性神経線維の再生が促され、運動機能が回復する [7]。この分子機構として、cAMP濃度上昇に伴う、転写因子cAMP response element binding protein (CREB)のリン酸化の亢進と、これに続くポリアミン合成酵素Arginase I (Arg I)の発現上昇が重要であると考えられている。
神経栄養因子の投与によっても、細胞内cAMPの濃度が上昇する。神経栄養因子はcAMPの合成は誘導せず、分解を抑制する。神経栄養因子がTrk受容体に結合すると、細胞内でextracellular signal-regulated kinase (Erk)の活性化が起こり、phosphodiesteraseが阻害される。この結果、cAMPの分解が抑制されて、細胞内cAMP濃度が上昇する。Erk活性化によるPDE活性阻害とdb-cAMPは相乗的にcAMPの濃度を上昇させる。
軸索再生の再評価
O. Stewardらによると中枢神経の軸索再生は以下の様に定義されている [8]。
- 中枢神経系から、中枢神経系ではない環境 (特に損傷などにより生じた瘢痕組織)へ、再生した軸索が伸長する
- 宿主以外に由来する移植組織へ、再生した軸索が伸長する
- 切断部またはその周囲から再生した軸索が生じている
- もとの中枢神経系とは異なる経路で再生した軸索が走行している
- 再生した軸索が妥当な再生距離を示す
損傷後5 ~ 7日: 損傷からの回復と、伸長反応の開始
損傷後7 ~ 10日: 再生軸索が損傷部位に達する
損傷後10 ~ 14日: 再生軸索が損傷部周囲を伸長
損傷後14 ~ 21日: 再生軸索が遠位の非損傷部位へ侵入
損傷後21日以降: 再生軸索が最大で約1mm /日の速度で遠位部の中を伸長 - 再生中には、軸索が伸長時に観察されるような形態 (成長円錐のような先端)を示す
- 再生した軸索は、通常の軸索のような走行を示さず、蛇行性に伸長する
中枢神経の軸索再生の研究には、脊髄損傷モデルがよく使われる。完全損傷モデルの場合、全ての軸索が切断されるため、切断された脊髄の段端がはなれて、脳脊髄液で満たされた間隙ができる。また、損傷部周辺では二次的な変性がおこり、切断面をさらに遠ざけてしまう。そこで、組織へのダメージを最小限にするため、不完全損傷モデルが使用されることが多い。不完全損傷モデルには、腹側皮質脊髄路のみを残し、他の皮質脊髄路の繊維は全て切断するdorsal hemisectionモデルや、一側を完全切断して反対側を残すlateral hemisetionモデルがある。最近の研究から、成体哺乳類の中枢神経系においても、薬剤投与や遺伝子操作により、脊髄損傷モデル動物における軸索再生が誘導されることが報告されている。しかし一方で、これらの結果の再現性に疑問を投げかける研究結果も報告されている。2003年に、National Institute of Neurological Disorders and Stroke (NINDS)により、Facilities of Research Excellence – Spinal Cord Injury (FORE – SCI)というプログラムが開始され、それまでに報告されていた脊髄損傷モデル動物を用いた軸索再生研究の再評価がなされた。その結果、再現性が確認されたのは、12件中2件 (うち1件は報告されていたものよりも、弱い回復)のみであった [9]。これらの研究結果からも、中枢神経の軸索再生を実現することの難しさが伺える。
末梢神経系における軸索再生
末梢神経は中枢神経に比べ、著明な軸索の再生が認められる。末梢神経では、細胞体が無傷であれば、軸索が切断されても再生が可能である。末梢神経系に存在するグリア細胞であるシュワン細胞は、損傷の刺激で増殖・活性化し、神経再生を促す。
末梢神経の軸索が切断されると、損傷部位より遠位の軸索は、ワーラー変性と呼ばれる過程により断片化し、ミクログリアなどの貪食細胞により除去される。この際、シュワン細胞は柱状に配列し、Büngner’s bandと呼ばれる構造を形成する。Büngner’s bandは、再生軸索の足場を確保するとともに、神経栄養因子を供給して、再生軸索の伸長を助ける。細胞体側の残存した軸索は (やや退縮するが)、成長円錐を形成し、Büngner’s bandの中を伸長する。
末梢神経の再生に関しても、cAMPの細胞内濃度の上昇が重要である。上記の通り、神経栄養因子はcAMPの分解を抑制し、細胞内cAMP濃度を上昇させる。神経栄養因子とdb-cAMPの両方の投与により、脊髄損傷後の感覚神経軸索の再生が促される。損傷前に感覚神経の細胞体が存在する脊髄後根神経節にdb-cAMPを投与しておき、損傷後に神経栄養因子neurotrophin-3 (NT-3)の投与を行うと、損傷1-3ヶ月後に損傷領域を超えて感覚神経の再生が認められる。損傷領域を超えての軸索再生はdb-cAMP、NT-3それぞれ単独投与では認められないことから、脊髄損傷後の軸索再生に必要な細胞内cAMP濃度上昇を促すためには、cAMPの投与と分解の抑制の両方が必要である [10], [11]。
参考文献
- ↑
Yamashita, T., & Tohyama, M. (2003).
The p75 receptor acts as a displacement factor that releases Rho from Rho-GDI. Nature neuroscience, 6(5), 461-7. [PubMed:12692556] [WorldCat] [DOI] - ↑
Mi, S., Lee, X., Shao, Z., Thill, G., Ji, B., Relton, J., ..., & Pepinsky, R.B. (2004).
LINGO-1 is a component of the Nogo-66 receptor/p75 signaling complex. Nature neuroscience, 7(3), 221-8. [PubMed:14966521] [WorldCat] [DOI] - ↑
Lee, J.K., Geoffroy, C.G., Chan, A.F., Tolentino, K.E., Crawford, M.J., Leal, M.A., ..., & Zheng, B. (2010).
Assessing spinal axon regeneration and sprouting in Nogo-, MAG-, and OMgp-deficient mice. Neuron, 66(5), 663-70. [PubMed:20547125] [PMC] [WorldCat] [DOI] - ↑
Yiu, G., & He, Z. (2006).
Glial inhibition of CNS axon regeneration. Nature reviews. Neuroscience, 7(8), 617-27. [PubMed:16858390] [PMC] [WorldCat] [DOI] - ↑
Okada, S., Nakamura, M., Katoh, H., Miyao, T., Shimazaki, T., Ishii, K., ..., & Okano, H. (2006).
Conditional ablation of Stat3 or Socs3 discloses a dual role for reactive astrocytes after spinal cord injury. Nature medicine, 12(7), 829-34. [PubMed:16783372] [WorldCat] [DOI] - ↑
Popovich, P.G., & Longbrake, E.E. (2008).
Can the immune system be harnessed to repair the CNS? Nature reviews. Neuroscience, 9(6), 481-93. [PubMed:18490917] [WorldCat] [DOI] - ↑
Nikulina, E., Tidwell, J.L., Dai, H.N., Bregman, B.S., & Filbin, M.T. (2004).
The phosphodiesterase inhibitor rolipram delivered after a spinal cord lesion promotes axonal regeneration and functional recovery. Proceedings of the National Academy of Sciences of the United States of America, 101(23), 8786-90. [PubMed:15173585] [PMC] [WorldCat] [DOI] - ↑
Steward, O., Zheng, B., & Tessier-Lavigne, M. (2003).
False resurrections: distinguishing regenerated from spared axons in the injured central nervous system. The Journal of comparative neurology, 459(1), 1-8. [PubMed:12629662] [WorldCat] [DOI] - ↑
Steward, O., Popovich, P.G., Dietrich, W.D., & Kleitman, N. (2012).
Replication and reproducibility in spinal cord injury research. Experimental neurology, 233(2), 597-605. [PubMed:22078756] [WorldCat] [DOI] - ↑
Neumann, S., Bradke, F., Tessier-Lavigne, M., & Basbaum, A.I. (2002).
Regeneration of sensory axons within the injured spinal cord induced by intraganglionic cAMP elevation. Neuron, 34(6), 885-93. [PubMed:12086637] [WorldCat] [DOI] - ↑
Qiu, J., Cai, D., Dai, H., McAtee, M., Hoffman, P.N., Bregman, B.S., & Filbin, M.T. (2002).
Spinal axon regeneration induced by elevation of cyclic AMP. Neuron, 34(6), 895-903. [PubMed:12086638] [WorldCat] [DOI]
脳科学辞典のp75の項目
脳科学辞典のシュワン細胞の項目
(執筆担当者: 藤田幸、山下俊英、担当編集委員: 村上富士夫)