「脳磁法」の版間の差分
Hidehikookamoto (トーク | 投稿記録) 細編集の要約なし |
|||
| (3人の利用者による、間の29版が非表示) | |||
| 1行目: | 1行目: | ||
英:magnetoencephalography 独: Magnetoenzephalographie 仏:Magnétoencéphalographie | |||
同義語・類義語:脳磁図、脳磁計 | |||
'''脳磁法とは''' | |||
脳磁法(magnetoencephalography, MEG)とは、脳の神経活動に伴って発生する磁場(磁界)を頭皮上から完全非侵襲的に計測する技術である。通常脳の神経活動に伴う磁界変化は非常に微弱であるため、SQUIDs(超伝導量子干渉計)を利用した高感度磁気センサーを用いる。記録の対象であるヒト脳磁場信号の大きさが10-14 T(テスラ)から10-12 T程度であるのに対して、例えば地磁気は10-5 Tの大きさを有しているため外部環境磁場ノイズを軽減することが重要である(図1)[[ファイル:環境磁場および生体磁場の強度.jpg|環境磁場と生体磁場の強度]]。そのため、脳磁計は透磁率の大きい合金(パーマロイ)等で出来た磁気シールドルーム内に設置される。1972年に超伝導量子干渉計を用いてヒトの脳から生じる磁場信号の検出に成功[1]した当時は単チャンネルであったが、その後多チャンネル化が急速に進み現在では100チャンネル以上のセンサーを有する多チャンネル全頭型装置(図2)[[ファイル:全頭型脳磁計.jpg|多チャンネル全頭型脳磁計の一例]]が一般的になり、基礎研究及び臨床研究に用いられている。超伝導量子干渉計は常に液体ヘリウムで冷却する必要があるため、高性能の断熱容器(デュワー)内に格納されている。脳磁場を検出コイルにはその形状から大きく分けてマグネトメーターとグラジオメーターがある(図3)[[ファイル:検出コイル.jpg|脳磁場を検出する各種コイルの形状]]。マグネトメーターは1個のコイルで磁束を補足する。形状が単純であり遠方の信号源からの磁場も比較的良く計測できるという長所があるが、その反面外部からの環境磁場の影響を受けやすい。グラジオメーターに関しては軸方向型と平面方向型に大別できる。軸方向型グラジオメーターは脳表に近い検出コイルと遠い補償コイルを逆向きに接続することで、両者の差分信号を計測する。近傍から発生する磁場は空間勾配が大きいため、脳から発生する磁場に関しては検出コイルのほうが補償コイルより大きい入力を受ける。それに対して遠隔に信号源を有する環境磁場に関しては、検出コイルと補償コイルにほぼ同様の影響を与える。その結果、軸方向型グラジオメーターは環境磁場の影響を軽減しながら脳からの磁場信号を計測することが出来る。それに対し、平面方向型グラジオメーターは頭皮の接線方向の磁場差分を計測しているため、環境磁場の影響を打ち消しながら近傍の信号源からの磁場に対しては高い感度を持つという特徴を持つ。反面、平面方向型グラジオメーターの計測磁場振幅は信号源から遠いと大きく減衰するため、脳深部からの磁場計測には適さない。またマグネトメーターと軸方向型グラジオメーターの計測磁場分布は似たようなパターンを示すのに対して、平面方向型グラジオメーターの計測磁場分布は大きく異なることにも注意が必要である。例えば、信号源の直上における計測磁場密度はマグネトメーターや軸方向型グラジオメーターでは0に近い値を示すのに対して、平面方向型グラジオメーターでは極大または極小となる。 | |||
'''磁場の起源''' | |||
神経細胞の興奮に伴う磁場変化は非常に微弱であるため、検出可能な信号を生み出すためには隣接する数万の細胞が同期して、なおかつ同じ向きの電流を発生させる必要がある[2]。この条件を満たす信号源として、脳表面(もしくは皮質6層構造)に対して垂直に配列する錐体細胞樹状突起における細胞内シナプス後電流(excitatory postsynaptic current)がある。また錐体細胞の配列も重要である。脳磁計で計測できる信号は主に頭蓋表面に平行に流れる電流により生じる磁場であって、頭蓋表面に対して垂直方向の電流に関してはうまく記録できない。また、脳活動より生じた磁界の強さは距離の2乗に反比例して減衰するため脳深部の神経活動の記録は困難である。 | |||
'''脳波との比較''' | |||
ヒトの脳機能を非侵襲的に計測する他の方法として、頭皮上に装着された頭皮上電極から記録される「脳波(electroencephalography: EEG)」がある。脳波は脳磁法と同じように非常に高い時間分解能で脳活動を計測することができるが、神経活動を導電率の異なる脳・脊髄液・骨・皮膚などを通して観察することになる。この信号源と記録電極の間にある[http://www.scholarpedia.org/article/Volume_conduction 容積導体](volume conduction)は不均一であり、脳波の空間分解能には限界がある。しかしながら、脳磁場信号は神経細胞内電流を直接的に反映し、容積導体の影響をほとんど受けないため、脳波に比べて高い空間分解能を有しておりmm単位の正確度で信号源を推測することも可能である[3]。すなわち頭蓋骨や表皮、脳脊髄液など電気伝導率が大きく異なる組成の影響を脳波のように受けないことが脳磁法の大きなメリットである[4]。また脳波では、何らかの基準点(耳朶電位基準や平均電位基準など)が必要となるが、脳磁法では基準点が必要ないこともメリットとなる。また脳波では記録電極と頭皮との接触が良くないと信号にノイズが混入してしまう。 | |||
脳磁法の短所としては、経済的な観点から見ると、計測装置が大型で高価であること、またSQUIDsを絶えず液体ヘリウムで冷却する必要が有るため維持費が高額になる点が挙げられる。神経活動計測に関しては、磁気センサーに対して垂直方向の電流を計測することが困難なこと、脳深部の神経活動計測が難しい点が挙げられる。また、計測中は頭の位値を固定しておく必要があるため、歩行中の脳活動や覚醒下の乳児を計測することは困難である。 | |||
'''脳磁法を用いた研究''' | |||
脳磁法は高い時間分解能で完全に非侵襲的に神経活動を計測することが出来るため、ヒトの基礎研究・臨床研究に利用されている。特に、一次聴覚野、一次体性感覚野、一次運動野など刺激に同期して活動し限局している信号源に対しては、刺激を繰り返し与え得られた波形を加算平均し、等価電流双極子モデル等を使うことによってかなり正確に特定することが可能である。しかしながら、複雑な認知行動課題などの場合は惹起された神経活動が分散しており刺激に正確に同期していない事が多いため信号源推定には注意を要する。 | |||
現在、脳磁図の臨床利用として主となるのは、てんかん患者におけるてんかん原性焦点や言語中枢等の重要な機能を担っている脳部位の同定である。脳磁法は脳波よりも空間分解能に優れており、脳磁法を使用することで脳波では捉えられなかったてんかん性脳活動を測定できることも報告されている[5]。できるだけ重要な機能を担う脳部位を温存して術後の後遺症を減らし、正確にてんかん源性脳部位を切除するために手術前に脳磁法により脳機能計測を行うことは有効だと考えられている[6]。 | |||
神経科学分野における脳磁法の利用としては、その高い時間・空間分解能を活かして視覚・聴覚・体性感覚・痛覚などにより惹起された誘発脳磁場反応による脳機能マッピング[7-10]や、顔認知や言語処理といったヒト脳における認知機能の解明[11-13]、安静時における脳部位間の機能的結合に関する研究[14]などが行われている。 | |||
'''その他のNeuroimaging法との比較''' | |||
脳磁法の長所としては、positron emission tomography (PET), Single Photon Emission Computed Tomography (SPECT), functional Magnetic Resonance Imaging (fMRI), Near Infra-Red Spectroscopy (NIRS)が血流や代謝などを指標に脳神経活動を間接的に計測しているのに対して、神経電気活動を非常に高い時間分解能で直接計測している点があげられる。また、脳磁法は生体への干渉を行わず観察するのみなので、他のNeuroimaging法とくらべても全くの非侵襲的計測法であるといえる。 | |||
短所としては脳磁法で神経活動の信号源を知るためには逆問題を解く必要があるが解が唯一ではない非適切な問題であるため、脳活動に関する前提的な知識を含んだモデルを用いて制限することで解を導き出す必要がある。PET、SPECT、fMRI,NIRSでは逆問題を解く必要はない。また脳磁法、NIRSは脳の深部の活動をうまく計測できないがPET, SPECT, fMRI では可能である。 | |||
'''参考文献''' | |||
1. Cohen, D., Magnetoencephalography - Detection of brains electrical-activity with a superconducting magnetometer. Science, 1972. 175(4022): p. 664-666. | |||
: | 2. Murakami, S. and Y. Okada, Contributions of principal neocortical neurons to magnetoencephalography and electroencephalography signals. Journal of Physiology-London, 2006. 575(3): p. 925-936. | ||
: | 3. Cohen, D. and B.N. Cuffin, Demonstration of useful differences between magnetoencephalogram and electroencephalogram. Electroencephalography and clinical neurophysiology, 1983. 56(1): p. 38-51. | ||
: | 4. Van Den Broek, S.P., et al., Volume conduction effects in EEG and MEG. Electroencephalography and clinical neurophysiology, 1998. 106(6): p. 522-534. | ||
5. Iwasaki, M., et al., Detection of epileptiform activity by human interpreters: Blinded comparison between electroencephalography and magnetoencephalography. Epilepsia, 2005. 46(1): p. 59-68. | |||
6. Ito, T., et al., Advantageous information provided by magnetoencephalography for patients with neocortical epilepsy. Brain and Development, 2015. 37(2): p. 237-242. | |||
7. Nakamura, A., et al., Somatosensory homunculus as drawn by MEG. Neuroimage, 1998. 7(4): p. 377-386. | |||
8. Pantev, C., et al., Tonotopic organization of the auditory cortex: pitch versus frequency representation. Science, 1989. 246(4929): p. 486-8. | |||
9. Ahlfors, S.P., R.J. Ilmoniemi, and M.S. Hämäläinen, Estimates of visually evoked cortical currents. Electroencephalography and clinical neurophysiology, 1992. 82(3): p. 225-236. | |||
10. Kakigi, R., H. Shibasaki, and A. Ikeda, Pain-related somatosensory evoked potentials following CO2 laser stimulation in man. Electroencephalography and Clinical Neurophysiology/ Evoked Potentials, 1989. 74(2): p. 139-146. | |||
11. Liu, J., A. Harris, and N. Kanwisher, Stages of processing in face perception: An MEG study. Nature neuroscience, 2002. 5(9): p. 910-916. | |||
12. Watanabe, S., R. Kakigi, and A. Puce, The spatiotemporal dynamics of the face inversion effect: A magneto- and electro-encephalographic study. Neuroscience, 2003. 116(3): p. 879-895. | |||
13. Luo, H. and D. Poeppel, Phase Patterns of Neuronal Responses Reliably Discriminate Speech in Human Auditory Cortex. Neuron, 2007. 54(6): p. 1001-1010. | |||
14. Brookes, M.J., et al., Investigating the electrophysiological basis of resting state networks using magnetoencephalography. Proceedings of the National Academy of Sciences of the United States of America, 2011. 108(40): p. 16783-16788. | |||
2015年9月2日 (水) 15:34時点における版
英:magnetoencephalography 独: Magnetoenzephalographie 仏:Magnétoencéphalographie
同義語・類義語:脳磁図、脳磁計
脳磁法とは
脳磁法(magnetoencephalography, MEG)とは、脳の神経活動に伴って発生する磁場(磁界)を頭皮上から完全非侵襲的に計測する技術である。通常脳の神経活動に伴う磁界変化は非常に微弱であるため、SQUIDs(超伝導量子干渉計)を利用した高感度磁気センサーを用いる。記録の対象であるヒト脳磁場信号の大きさが10-14 T(テスラ)から10-12 T程度であるのに対して、例えば地磁気は10-5 Tの大きさを有しているため外部環境磁場ノイズを軽減することが重要である(図1)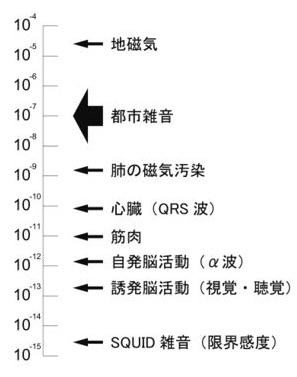 。そのため、脳磁計は透磁率の大きい合金(パーマロイ)等で出来た磁気シールドルーム内に設置される。1972年に超伝導量子干渉計を用いてヒトの脳から生じる磁場信号の検出に成功[1]した当時は単チャンネルであったが、その後多チャンネル化が急速に進み現在では100チャンネル以上のセンサーを有する多チャンネル全頭型装置(図2)
。そのため、脳磁計は透磁率の大きい合金(パーマロイ)等で出来た磁気シールドルーム内に設置される。1972年に超伝導量子干渉計を用いてヒトの脳から生じる磁場信号の検出に成功[1]した当時は単チャンネルであったが、その後多チャンネル化が急速に進み現在では100チャンネル以上のセンサーを有する多チャンネル全頭型装置(図2)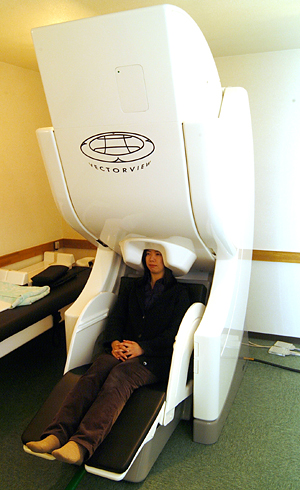 が一般的になり、基礎研究及び臨床研究に用いられている。超伝導量子干渉計は常に液体ヘリウムで冷却する必要があるため、高性能の断熱容器(デュワー)内に格納されている。脳磁場を検出コイルにはその形状から大きく分けてマグネトメーターとグラジオメーターがある(図3)
が一般的になり、基礎研究及び臨床研究に用いられている。超伝導量子干渉計は常に液体ヘリウムで冷却する必要があるため、高性能の断熱容器(デュワー)内に格納されている。脳磁場を検出コイルにはその形状から大きく分けてマグネトメーターとグラジオメーターがある(図3)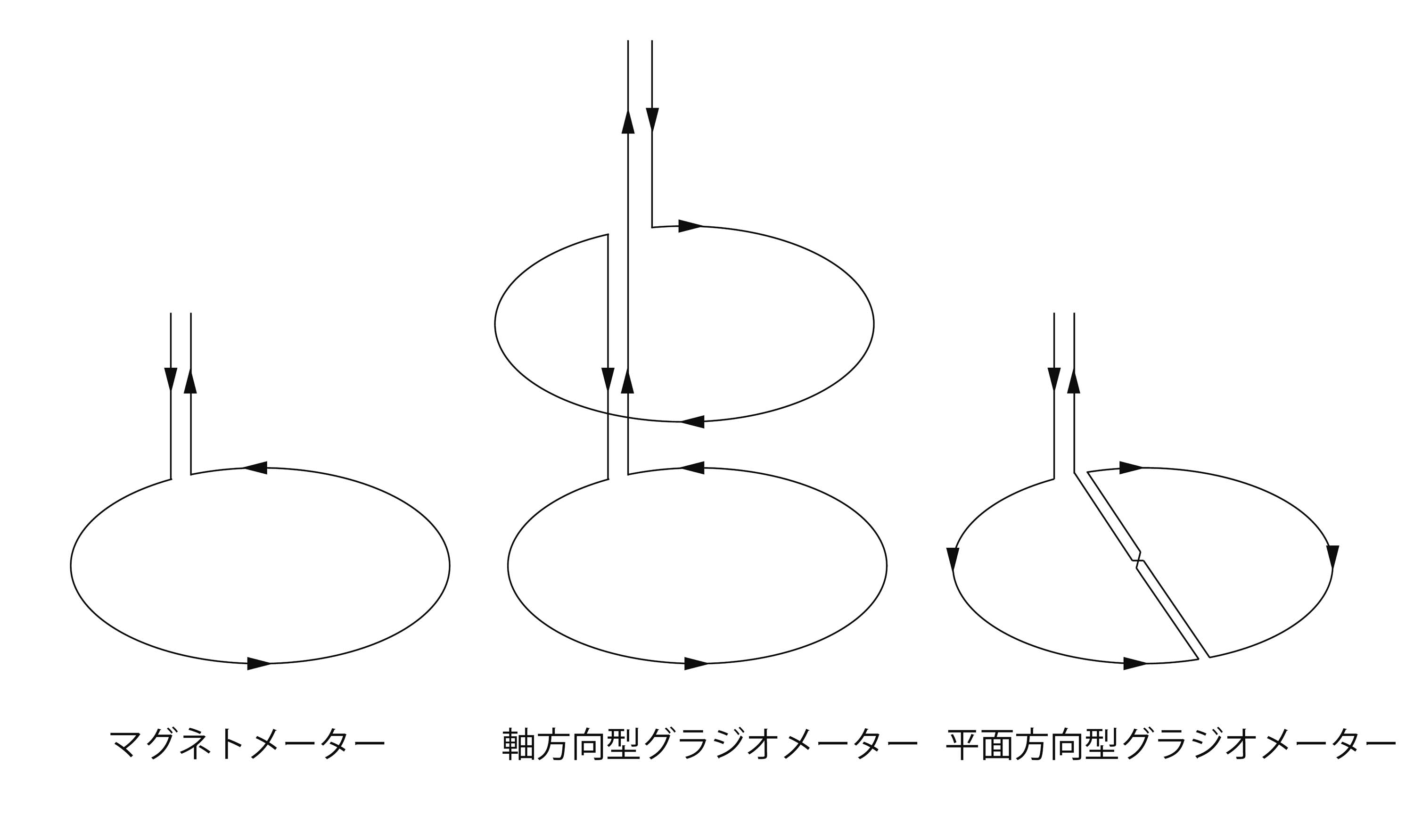 。マグネトメーターは1個のコイルで磁束を補足する。形状が単純であり遠方の信号源からの磁場も比較的良く計測できるという長所があるが、その反面外部からの環境磁場の影響を受けやすい。グラジオメーターに関しては軸方向型と平面方向型に大別できる。軸方向型グラジオメーターは脳表に近い検出コイルと遠い補償コイルを逆向きに接続することで、両者の差分信号を計測する。近傍から発生する磁場は空間勾配が大きいため、脳から発生する磁場に関しては検出コイルのほうが補償コイルより大きい入力を受ける。それに対して遠隔に信号源を有する環境磁場に関しては、検出コイルと補償コイルにほぼ同様の影響を与える。その結果、軸方向型グラジオメーターは環境磁場の影響を軽減しながら脳からの磁場信号を計測することが出来る。それに対し、平面方向型グラジオメーターは頭皮の接線方向の磁場差分を計測しているため、環境磁場の影響を打ち消しながら近傍の信号源からの磁場に対しては高い感度を持つという特徴を持つ。反面、平面方向型グラジオメーターの計測磁場振幅は信号源から遠いと大きく減衰するため、脳深部からの磁場計測には適さない。またマグネトメーターと軸方向型グラジオメーターの計測磁場分布は似たようなパターンを示すのに対して、平面方向型グラジオメーターの計測磁場分布は大きく異なることにも注意が必要である。例えば、信号源の直上における計測磁場密度はマグネトメーターや軸方向型グラジオメーターでは0に近い値を示すのに対して、平面方向型グラジオメーターでは極大または極小となる。
。マグネトメーターは1個のコイルで磁束を補足する。形状が単純であり遠方の信号源からの磁場も比較的良く計測できるという長所があるが、その反面外部からの環境磁場の影響を受けやすい。グラジオメーターに関しては軸方向型と平面方向型に大別できる。軸方向型グラジオメーターは脳表に近い検出コイルと遠い補償コイルを逆向きに接続することで、両者の差分信号を計測する。近傍から発生する磁場は空間勾配が大きいため、脳から発生する磁場に関しては検出コイルのほうが補償コイルより大きい入力を受ける。それに対して遠隔に信号源を有する環境磁場に関しては、検出コイルと補償コイルにほぼ同様の影響を与える。その結果、軸方向型グラジオメーターは環境磁場の影響を軽減しながら脳からの磁場信号を計測することが出来る。それに対し、平面方向型グラジオメーターは頭皮の接線方向の磁場差分を計測しているため、環境磁場の影響を打ち消しながら近傍の信号源からの磁場に対しては高い感度を持つという特徴を持つ。反面、平面方向型グラジオメーターの計測磁場振幅は信号源から遠いと大きく減衰するため、脳深部からの磁場計測には適さない。またマグネトメーターと軸方向型グラジオメーターの計測磁場分布は似たようなパターンを示すのに対して、平面方向型グラジオメーターの計測磁場分布は大きく異なることにも注意が必要である。例えば、信号源の直上における計測磁場密度はマグネトメーターや軸方向型グラジオメーターでは0に近い値を示すのに対して、平面方向型グラジオメーターでは極大または極小となる。
磁場の起源
神経細胞の興奮に伴う磁場変化は非常に微弱であるため、検出可能な信号を生み出すためには隣接する数万の細胞が同期して、なおかつ同じ向きの電流を発生させる必要がある[2]。この条件を満たす信号源として、脳表面(もしくは皮質6層構造)に対して垂直に配列する錐体細胞樹状突起における細胞内シナプス後電流(excitatory postsynaptic current)がある。また錐体細胞の配列も重要である。脳磁計で計測できる信号は主に頭蓋表面に平行に流れる電流により生じる磁場であって、頭蓋表面に対して垂直方向の電流に関してはうまく記録できない。また、脳活動より生じた磁界の強さは距離の2乗に反比例して減衰するため脳深部の神経活動の記録は困難である。
脳波との比較
ヒトの脳機能を非侵襲的に計測する他の方法として、頭皮上に装着された頭皮上電極から記録される「脳波(electroencephalography: EEG)」がある。脳波は脳磁法と同じように非常に高い時間分解能で脳活動を計測することができるが、神経活動を導電率の異なる脳・脊髄液・骨・皮膚などを通して観察することになる。この信号源と記録電極の間にある容積導体(volume conduction)は不均一であり、脳波の空間分解能には限界がある。しかしながら、脳磁場信号は神経細胞内電流を直接的に反映し、容積導体の影響をほとんど受けないため、脳波に比べて高い空間分解能を有しておりmm単位の正確度で信号源を推測することも可能である[3]。すなわち頭蓋骨や表皮、脳脊髄液など電気伝導率が大きく異なる組成の影響を脳波のように受けないことが脳磁法の大きなメリットである[4]。また脳波では、何らかの基準点(耳朶電位基準や平均電位基準など)が必要となるが、脳磁法では基準点が必要ないこともメリットとなる。また脳波では記録電極と頭皮との接触が良くないと信号にノイズが混入してしまう。 脳磁法の短所としては、経済的な観点から見ると、計測装置が大型で高価であること、またSQUIDsを絶えず液体ヘリウムで冷却する必要が有るため維持費が高額になる点が挙げられる。神経活動計測に関しては、磁気センサーに対して垂直方向の電流を計測することが困難なこと、脳深部の神経活動計測が難しい点が挙げられる。また、計測中は頭の位値を固定しておく必要があるため、歩行中の脳活動や覚醒下の乳児を計測することは困難である。
脳磁法を用いた研究
脳磁法は高い時間分解能で完全に非侵襲的に神経活動を計測することが出来るため、ヒトの基礎研究・臨床研究に利用されている。特に、一次聴覚野、一次体性感覚野、一次運動野など刺激に同期して活動し限局している信号源に対しては、刺激を繰り返し与え得られた波形を加算平均し、等価電流双極子モデル等を使うことによってかなり正確に特定することが可能である。しかしながら、複雑な認知行動課題などの場合は惹起された神経活動が分散しており刺激に正確に同期していない事が多いため信号源推定には注意を要する。 現在、脳磁図の臨床利用として主となるのは、てんかん患者におけるてんかん原性焦点や言語中枢等の重要な機能を担っている脳部位の同定である。脳磁法は脳波よりも空間分解能に優れており、脳磁法を使用することで脳波では捉えられなかったてんかん性脳活動を測定できることも報告されている[5]。できるだけ重要な機能を担う脳部位を温存して術後の後遺症を減らし、正確にてんかん源性脳部位を切除するために手術前に脳磁法により脳機能計測を行うことは有効だと考えられている[6]。 神経科学分野における脳磁法の利用としては、その高い時間・空間分解能を活かして視覚・聴覚・体性感覚・痛覚などにより惹起された誘発脳磁場反応による脳機能マッピング[7-10]や、顔認知や言語処理といったヒト脳における認知機能の解明[11-13]、安静時における脳部位間の機能的結合に関する研究[14]などが行われている。
その他のNeuroimaging法との比較
脳磁法の長所としては、positron emission tomography (PET), Single Photon Emission Computed Tomography (SPECT), functional Magnetic Resonance Imaging (fMRI), Near Infra-Red Spectroscopy (NIRS)が血流や代謝などを指標に脳神経活動を間接的に計測しているのに対して、神経電気活動を非常に高い時間分解能で直接計測している点があげられる。また、脳磁法は生体への干渉を行わず観察するのみなので、他のNeuroimaging法とくらべても全くの非侵襲的計測法であるといえる。 短所としては脳磁法で神経活動の信号源を知るためには逆問題を解く必要があるが解が唯一ではない非適切な問題であるため、脳活動に関する前提的な知識を含んだモデルを用いて制限することで解を導き出す必要がある。PET、SPECT、fMRI,NIRSでは逆問題を解く必要はない。また脳磁法、NIRSは脳の深部の活動をうまく計測できないがPET, SPECT, fMRI では可能である。
参考文献
1. Cohen, D., Magnetoencephalography - Detection of brains electrical-activity with a superconducting magnetometer. Science, 1972. 175(4022): p. 664-666.
2. Murakami, S. and Y. Okada, Contributions of principal neocortical neurons to magnetoencephalography and electroencephalography signals. Journal of Physiology-London, 2006. 575(3): p. 925-936.
3. Cohen, D. and B.N. Cuffin, Demonstration of useful differences between magnetoencephalogram and electroencephalogram. Electroencephalography and clinical neurophysiology, 1983. 56(1): p. 38-51.
4. Van Den Broek, S.P., et al., Volume conduction effects in EEG and MEG. Electroencephalography and clinical neurophysiology, 1998. 106(6): p. 522-534.
5. Iwasaki, M., et al., Detection of epileptiform activity by human interpreters: Blinded comparison between electroencephalography and magnetoencephalography. Epilepsia, 2005. 46(1): p. 59-68.
6. Ito, T., et al., Advantageous information provided by magnetoencephalography for patients with neocortical epilepsy. Brain and Development, 2015. 37(2): p. 237-242.
7. Nakamura, A., et al., Somatosensory homunculus as drawn by MEG. Neuroimage, 1998. 7(4): p. 377-386.
8. Pantev, C., et al., Tonotopic organization of the auditory cortex: pitch versus frequency representation. Science, 1989. 246(4929): p. 486-8.
9. Ahlfors, S.P., R.J. Ilmoniemi, and M.S. Hämäläinen, Estimates of visually evoked cortical currents. Electroencephalography and clinical neurophysiology, 1992. 82(3): p. 225-236.
10. Kakigi, R., H. Shibasaki, and A. Ikeda, Pain-related somatosensory evoked potentials following CO2 laser stimulation in man. Electroencephalography and Clinical Neurophysiology/ Evoked Potentials, 1989. 74(2): p. 139-146.
11. Liu, J., A. Harris, and N. Kanwisher, Stages of processing in face perception: An MEG study. Nature neuroscience, 2002. 5(9): p. 910-916.
12. Watanabe, S., R. Kakigi, and A. Puce, The spatiotemporal dynamics of the face inversion effect: A magneto- and electro-encephalographic study. Neuroscience, 2003. 116(3): p. 879-895.
13. Luo, H. and D. Poeppel, Phase Patterns of Neuronal Responses Reliably Discriminate Speech in Human Auditory Cortex. Neuron, 2007. 54(6): p. 1001-1010.
14. Brookes, M.J., et al., Investigating the electrophysiological basis of resting state networks using magnetoencephalography. Proceedings of the National Academy of Sciences of the United States of America, 2011. 108(40): p. 16783-16788.