「Αアクチニン」の版間の差分
細編集の要約なし |
細 →αアクチニン |
||
| 17行目: | 17行目: | ||
<br> | <br> | ||
{| cellspacing="1" cellpadding="1" border="1 | {| cellspacing="1" cellpadding="1" border="1" | ||
|- | |- | ||
| 分子量 | | 分子量 | ||
| 67行目: | 67行目: | ||
| (ー) | | (ー) | ||
| ヒト心筋症で変異が見出されている。ゼブラフィッシュのノックアウトでは骨格筋と心筋の形成不全が生じた。 | | ヒト心筋症で変異が見出されている。ゼブラフィッシュのノックアウトでは骨格筋と心筋の形成不全が生じた。 <ref><pubmed>22253474<pubmed><ref><br> | ||
|- | |- | ||
| ACTN3 | | ACTN3 | ||
| 76行目: | 76行目: | ||
| (ー) | | (ー) | ||
| 欧州人では18%程度が停止コドン挿入により欠落しているが、正常型とほとんど速筋に違いは見られない。マウスでは速筋の退社が遅筋的に変化することが示された。 | | 欧州人では18%程度が停止コドン挿入により欠落しているが、正常型とほとんど速筋に違いは見られない。マウスでは速筋の退社が遅筋的に変化することが示された。<ref><pubmed>21933355<pubmed><ref><br> | ||
|- | |- | ||
| ACTN4 | | ACTN4 | ||
| 89行目: | 89行目: | ||
カルシウムが結合するとアクチン結合能が低下する<br> | カルシウムが結合するとアクチン結合能が低下する<br> | ||
| 一部の優性遺伝の巣状文節性糸球体硬化症 (focal and segmental glomerulosclerosis)で変異が見出されている。ノックアウトマウスでも糸球体病変が出現する。 | | 一部の優性遺伝の巣状文節性糸球体硬化症 (focal and segmental glomerulosclerosis)で変異が見出されている。ノックアウトマウスでも糸球体病変が出現する。<ref><pubmed>12782671<pubmed><ref><br> | ||
|} | |} | ||
2012年3月5日 (月) 23:25時点における版
歴史
アクチニンは1965年に江橋節郎、文子夫妻と丸山工作により骨格筋の粗精製アクチンより分離された最初のアクチン結合タンパク質である。当時のアミノ酸組成分析(今では古典的な各アミノ酸の含有量をスター図で示す比較法)ではアクチンと類似しているデータが得られたために、アクチニンと命名された [1]。
αアクチニン
江橋夫妻らのα-アクチニンactininはカルシウム制御因子(トロポニン)の生成過程で超沈殿(アクチンとミオシンがATP付加により形成する凝集体を吸光度として測定する)を促進する活性因子として分離された[2]。
ヒトのαアクチニンにはACTN1、2、3、4の4個が見出されている。ACTN1と4のC末端カルモジュリン様ドメインのEFハンドは機能しており、Caを結合するCa制御性因子である。骨格筋型のACTN2と3のEFハンドはカルシウム結合能を失っている。細胞骨格の形成を含めて腫瘍細胞の浸潤との関連など多彩な機能が報告されている。
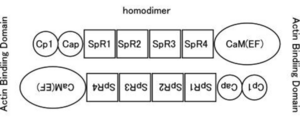
| 分子量 |
〜100kDa アンチパラレルに結合したホモダイマーとして存在 |
| 機能 |
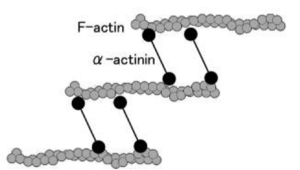
アクチン結合タンパク質 F-actin(繊維状アクチン)を架橋 |
| 分布 | Ca結合能 | 遺伝子異常 | |
| ACTN1 |
骨格筋以外の細胞(平滑筋を含む)比較的細胞膜直下に局在 いわゆる"non-muscle" α-actinin |
(+) カルシウムが結合するとアクチン結合能が低下する |
ノックアウトマウスは PubMed、MGI検索(2012年2月)で見いだされず。 |
| ACTN2 |
骨格筋(全て)、心筋、脳 いわゆる"muscle" α-actinin |
(ー) | ヒト心筋症で変異が見出されている。ゼブラフィッシュのノックアウトでは骨格筋と心筋の形成不全が生じた。 [3]。
<*注2> 丸山工作は反論の論文をProc Natl Acad Sci誌が掲載を認めないことに不満を唱えた。結局、反論論文はJ. Biochem[4]に掲載された。
Euアクチニンとγアクチニン丸山工作の一派により、ウサギ骨格筋からγアクチニン[5]とニワトリ骨格筋からEuアクチニン[6]が報告されている。それぞれ1報告のみであり、クローニングもされておらず、詳細は不明である。
参考文献
|