「キネシン」の版間の差分
細 →KIF13A |
細編集の要約なし |
||
| (2人の利用者による、間の41版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:kinesin | |||
'' | キネシンは、モータータンパク質の一つで、主にATPを加水分解しながら微小管に沿って運動する性質を持ち、細胞分裂や細胞内物質輸送に重要な働きをしている。キネシンは遺伝子ファミリーを形成しており、キネシンスーパーファミリータンパク質(kinesin superfamily proteins, KIFs)と呼ばれる。KIFsは哺乳類(マウス、ヒト)で45種類の遺伝子が同定されており、細胞内で膜小器官、タンパク質複合体やmRNAなどのカーゴ(荷物)を輸送することで、細胞の生存、形態形成および機能発現に重要な役割を果たしている(ref1)。最近、このKIFsが、記憶・学習などの脳の高次機能、神経回路網形成、体の左右軸の決定、腫瘍形成の抑制など重要な生命現象に関与していることが明らかとなった(ref2)。本項目ではKIFsによる細胞内物質輸送について述べる。細胞分裂に関わるKIFsについては総説(ref3)(ref4)を参考にされたい。 | ||
== 細胞内物質輸送 == | |||
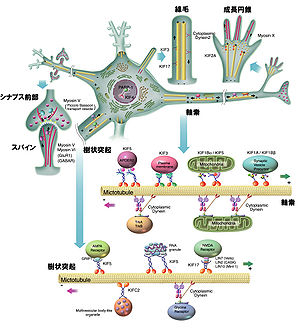
[[Image:kinesin1.jpg|thumb|300px|'''図1 神経細胞における細胞内物質輸送'''<br>(Hirokawa et al.(ref2)より改変)]] | |||
細胞はその形態形成、及び機能発現に必要なタンパク質を合成した後、多種類の膜小器官あるいはタンパク質複合体として必要とされる部位に適切に送り分けており、この細胞内物質輸送の機構は神経細胞や極性のある上皮細胞のみでなく、あらゆる細胞で細胞機能の重要な基盤となっている。 細胞内物質輸送を担うモータータンパク質には大きく分けて、キネシン、ダイニン、ミオシンの3つがある(図1)(ref2)。 | |||
== キネシンスーパーファミリータンパク質(KIFs)の分類 == | |||
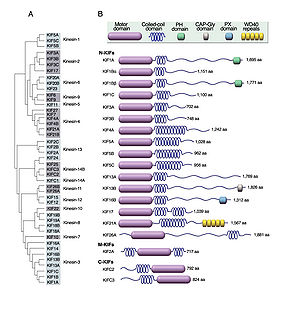
[[Image:kinesin2.jpg|thumb|300px|'''図2 (A)KIFsの分類 (B)KIFsの構造'''<br>(Hirokawa et al.(ref2)より改変)]] | |||
[[Image:kinesin3.jpg|thumb|300px|'''図3KIFsのカーゴ認識機構の例'''<br>(A、B、C)KIFsは、多くはアダプター蛋白や足場蛋白を介して間接的に、まれには直接的にカーゴと結合し、輸送する。(Hirokawa et al.(ref2)より改変)]] | |||
[[Image:kinesin4.jpg|thumb|300px|'''図4 (A)KIFsの分類 (B)KIFsの構造'''<br>(Hirokawa et al.(ref2)より改変)]] | |||
キネシンは、ATPを加水分解しながら、微小管に沿ってカーゴ(荷物)を輸送する。キネシンは遺伝子ファミリーを形成しており、キネシンスーパーファミリータンパク質(kinesin superfamily proteins, KIFs)と呼ばれ、哺乳類(マウス、ヒト)で45種類の遺伝子が同定されているが、mRNAスプライシングなどによる複数のアイソフォームの存在により、タンパク質としてはもっと多くの種類が存在する。KIFsは15個のファミリーから成り、分子内のモーター領域の存在部位によりN-KIFs(N末)、M-KIFs(中央)、C-KIFs(C末)に分けられる(図2)(ref2)。一般に、N-KIFsは微小管+(プラス)端へ、C-KIFsは微小管-(マイナス)端方向への輸送を行っており、M-KIFsは微小管の脱重合に関与している(ref1)。N-KIFsとC-KIFsはモーター領域(motor domain)、ストーク領域(stalk domain)、テイル領域(tail domain)より成り、モーター領域のアミノ酸配列の相同性は30~60%であるが、その他の部位のアミノ酸配列は各KIFsに特徴的で、多様性に富んでいる。モーター領域には微小管結合部位とATP結合部位があり、一般に、テイル領域(まれにストーク領域)が特異的なカーゴの認識や結合に関与している。各々KIFsは、多くはアダプター蛋白や足場蛋白を介して間接的に、まれには直接的にカーゴと結合し、これを輸送する(図3)(表1)(ref1)。カーゴとの結合・解離の制御には、リン酸化、Rab GTPase活性、Ca2+シグナリングによる制御が知られている(図4)(ref1)。 | |||
== 代表的なKIFsとその機能 == | |||
==== KIF1AとKIF1B ==== | |||
KIF1AとKIF1BはKinesin-3ファミリーに属し、KIF1BにはmRNAスプライシングにより、KIF1BαとKIF1Bβというアイソフォームがある。KIF1AとKIF1Bβは、synaptophysin、synaptotagmin、Rab3Aといったシナプス小胞蛋白を含むシナプス小胞前駆体を輸送する(ref5)。最近、Rab3との特異的な結合には、アダプター蛋白としてDENN/MADDがGTP依存的に働いていることが示された(ref6)。Kif1a及びKif1bホモ欠損マウスは共に、重篤な神経障害により生後すぐに死亡し、また、神経細胞死が認められる(ref7)(ref8)。一方、Kif1a及びKif1bヘテロ欠損マウスはどちらも生存するが、Kif1aヘテロ欠損マウスでは刺激の豊かな生育環境による脳の形態的、機能的変化が障害されており(ref9)、一方、Kif1bヘテロ欠損マウスでは、生後1年頃より進行性の筋力低下と運動失調を認め、Charcot-Marie-Tooth病2A型(CMT type2A)の原因遺伝子の一つと考えられている(ref8)。また、KIF1Bαはミトコンドリアの輸送に関与している(ref10)。 | |||
==== KIF2 ==== | |||
KIF2(KIF2A、KIF2B、KIF2C)はM-KIFsに分類され、Kinesin-13ファミリーに属する。KIF2はATP依存的に微小管を脱重合するユニークな性質を持つ。KIF2Aは幼若な脳に多く発現し、神経成長円錐の微小管を脱重合することによって軸索側枝の過剰な伸長を抑制し、神経回路網形成に重要な役割を担っている(ref11)。 | |||
==== KIF3 ==== | |||
KIF3はKinesin-2ファミリーに属し、細胞質内だけでなく、線毛や鞭毛内の物質輸送(intraflagellar transport)も行っている(ref12)。KIF3AとKIF3Bは異なった遺伝子から由来し、KAP3(KIF-associated protein 3)と結合してヘテロ三量体(KIF3複合体)を形成し、膜小器官やタンパク質複合体を輸送する(ref13)。神経細胞では軸索伸長に必要な膜小胞を、フォドリンを介して認識し、輸送する(ref14)。また、KIF3複合体は、線毛の構成成分をタンパク質複合体として線毛の基部から先端部へ輸送し、線毛の形成と維持に重要な役割を果たしている(ref15)。さらに、Kif3a及びKif3bホモ欠損マウスの解析により、KIF3が胎児初期のNodeの線毛を形成し、この線毛が回転運動をすることによってNode領域で胎児外液の左方向への流れ(Node流)を作り、これが体の左右軸を決定することが示された(ref16)(ref17)(ref18)。近年、KIF3複合体がN-cadherin/β-catenin複合体を形質膜に輸送することで細胞増殖を制御し、腫瘍形成の抑制に働いていることが明らかとなった(ref19)。 | |||
==== KIF4A ==== | |||
KIF4AはKinesin-4ファミリーに属し、主に幼若な神経細胞で発現し、細胞質と核内の両方に存在する(ref20)。KIF4Aは、脳の発達期において、核内ではPARP-1との結合・解離によりPARP-1の活性を制御することで活動依存的な神経細胞の生存及び細胞死を制御し、一方で細胞質内ではカーゴの輸送を行う(ref21)。 | |||
==== KIF5 ==== | |||
KIF5はKinesin-1ファミリーに属し、kinesin light chains(KLCs)と複合体を形成する。KIF5にはKIF5A、KIF5B、KIF5Cの3つのアイソフォームがあるが、発現場所、発現量はそれぞれ異なる。KIF5Bは全身に発現しているのに対し、KIF5A、KIF5Cは神経特異的に発現している(ref22)。これらは各々、異なるアダプター蛋白や足場蛋白を介して様々な膜小胞、ライソソーム、ミトコンドリアなどのカーゴを輸送する(ref23)(ref24)が、互いに類似の機能も持ち、一部の機能は相補的である。KIF5による輸送の例として、神経軸索では、アルツハイマー病に関与するAPPの輸送や(ref25)、syntabulinをアダプター蛋白としたsyntaxin 1の輸送などがある(ref26)。また、近年、KIF5によるミトコンドリアの輸送にCa2+濃度依存的な制御が働いていることが示された(ref27)。一方、樹状突起では、GRIP1を介したAMPA受容体サブユニットGluR2の輸送や(ref28)、HAP1(huntingtin-associated protein 1)を介したGABA受容体の輸送(ref29)、さらにはmRNA・タンパク質複合体(mRNP complex)の輸送(ref30)を担っている。また、KIF5Aの遺伝子変異は遺伝性痙性対麻痺を引き起こすことが知られている(ref31)。 | |||
==== KIF13A ==== | |||
KIF13AはKinesin-3ファミリーに属し、AP-1複合体を介してマンノース-6-リン酸受容体に結合し、これを含む小胞をゴルジ装置から形質膜へ輸送する(ref32)。 | |||
==== KIF16B ==== | |||
KIF16BはKinesin-3ファミリーに属し、Rab14を介してFGF受容体をゴルジ装置からエンドソームへ輸送することによって、胎児の発生期における初期胚形成に重要な働きを持つ(ref33)。 | |||
==== KIF17 ==== | |||
KIF17はKinesin-2ファミリーに属し、樹状突起でMint1(LIN10)を含む足場蛋白複合体を介してNMDA受容体サブユニットのNR2Bに結合し、これを輸送する(ref34)。また、カーゴの解離には、CaMKⅡαによるKIF17のリン酸化が重要である(ref35)。近年、遺伝子改変マウスの解析により、KIF17は単にNMDA受容体を輸送するだけでなく、転写因子CREBのリン酸化を介してKIF17及びNR2B mRNAsの転写を促進し、記憶・学習を制御していることが明らかとなった。KIF17を過剰発現させたマウスでは、空間及び作業記憶の向上が見られ(ref36)、一方で、Kif17ホモ欠損マウスでは、海馬依存的記憶の障害が認められた(ref37)。また、KIF17はNR2AとNR2Bの発現量を異なる機序で制御し、シナプスの機能や可塑性に重要な働きをしていることが示された(ref37)。 | |||
==== KIF26A ==== | |||
KIF26AはKIF26BとともにKinesin-11ファミリーに属し、ATPase活性や運動能を持たないユニークなKIFsである(ref38)。KIF26Aは、GDNF/Retシグナル伝達系の抑制因子として働くことによって腸管神経細胞の増殖を制御し、腸管の発達・形成に必須の働きを持つ(ref38)。 | |||
==== C-KIFs(KIFC1、KIFC2、KIFC3)==== | |||
C-KIFsにはKIFC1、KIFC2、KIFC3の3つがあり、Kinesin-14A及び14Bファミリーに属する。これらC-KIFsは、微小管の-端方向へ動く性質を持つ。KIFC1は多様な組織で発現し、細胞分裂に関与している。KIFC2は主に樹状突起に局在し、多胞体様の膜小器官を輸送している(ref39)。KIFC3は腎上皮細胞(MDCK細胞)で頂上部形質膜へ向けAnnexinⅩⅢbを含む膜小胞を輸送している(ref40)。 | |||
== 将来の展望 == | |||
これまで、KIFsには、単なる細胞内物質輸送からでは想像できない、より多岐にわたる、生命活動に必須の生理学的意義を持つことが明らかになってきた。しかし、依然としてまだ多くのKIFsはそのカーゴや機能が明らかにされていない。さらに、KIFsによるカーゴの認識、結合、解離の詳細な機序もまだ不明の点が多い。言い換えれば、細胞にとって必須であるイオンチャネルや受容体などのタンパク質には、その細胞内動態及び輸送が未知であるものが多い。これらの解明は、細胞機能を理解する上で非常に重要である。さらに、いかにして同一のKIFが異なるカーゴの輸送を行っているか、また、いかにして同一のカーゴが異なる複数のKIFsに振り分けられているのか、これらの制御機構の解明も待たれる。近年、KIFsは、脳神経疾患をはじめとする様々な疾患との関連が示唆されており、病態解明や治療法の開発も含め、今後のさらなる研究が期待される。 | |||
図3 | |||
KIFsのカーゴ認識機構の例 | |||
(A、B、C)KIFsは、多くはアダプター蛋白や足場蛋白を介して間接的に、まれには直接的にカーゴと結合し、輸送する。 | |||
(Hirokawa et al.(ref2)より改変) | |||
図4 | |||
カーゴとの結合・解離の制御機構 | |||
(A)リン酸化による制御 | |||
(B)Rab GTPase活性による制御 | |||
(C)Ca2+シグナリングによる制御 | |||
(Hirokawa et al.(ref2)より改変) | |||
表1 | |||
神経細胞におけるKIFsとカーゴ | |||
(Hirokawa et al.(ref2)より改変) | |||
== 参考文献 == | |||
ref1 PMID:19773780 | |||
Hirokawa, N., Y. Noda, Y. Tanaka, and S. Niwa. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10: 682-696, 2009. | |||
ref2 PMID:21092854 | |||
Hirokawa, N., S. Niwa and Y. Tanaka. Molecular motors in neurons: Transport mechanisms and roles in brain function, development, and disease. Neuron 68: 610-638, 2010. | |||
ref3 PMID:12142285 | |||
McIntosh JR. Grishchuk EL and West RR. Chromosome-microtubule interactions during mitosis. Annual Review of Cell and Developmental Biology 18: 193-219, 2002 | |||
ref4 PMID:15450976 | |||
Moore A. Wordeman L. The mechanism, function and regulation of depolymerizing kinesins during mitosis. Trends in Cell Biology 14 (10): 537-546, 2004 | |||
ref5 PMID:7539720 | |||
Okada, Y., H. Yamazaki, Y. Sekine-Aizawa, and N. Hirokawa. The neuron-specific kinesin superfamily protein KIF1A is a unique monomeric motor for anterograde axonal transport of synaptic vesicle precursors. Cell 81(5): 769-780. 1995. | |||
ref6 PMID:18849981 | |||
Niwa, S., Y. Tanaka and N. Hirokawa. KIF1Bbeta- and KIF1A-mediated axonal transport of presynaptic regulator Rab3 occurs in a GTP-dependent manner through DENN/MADD. Nature Cell Biology 11: 1269-1276, 2008. | |||
ref7 PMID:9548721 | |||
Yonekawa, Y., A. Harada, Y. Okada, T. Funakoshi, Y. Kanai, Y. Takei, S. Terada, T. Noda, and N. Hirokawa. Defect in synaptic vesicle precursor transport and neuronal cell death in KIF1A motor protein-deficient mice. Journal of Cell Biology 141(2): 431-441. 1998. | |||
ref8 PMID:11389829 | |||
Zhao, C., J. Takita, Y. Tanaka, M. Setou, T. Nakagawa, S. Takeda, H. W. Yang, S. Terada, T. Nakata, Y. Takei, M. Saito, S. Tsuji, Y. Hayashi, and N. Hirokawa. Charcot-Marie-Tooth disease type 2A caused by mutation in a microtubule motor KIF1Bbeta. Cell 105(5): 587-597. 2001. | |||
ref9 PMID:22365548 | |||
Kondo, M., Y. Takei, and N. Hirokawa. Motor protein KIF1A is essential for hippocampal synaptogenesis and learning enhancement in an enriched environment. Neuron.23:743-757, 2012. | |||
ref10 PMID:7528108 | |||
Nangaku, M., R. Sato-Yoshitake, Y. Okada, Y. Noda, R. Takemura, H. Yamazaki, and N. Hirokawa. KIF1B, a novel microtubule plus end-directed monomeric motor protein for transport of mitochondria. Cell 79(7): 1209-1220. 1994. | |||
ref11 PMID:12887924 | |||
Homma, N., Y. Takei, Y. Tanaka, T. Nakata, S. Terada, M. Kikkawa, Y. Noda, and N. Hirokawa. Kinesin superfamily protein 2A (KIF2A) functions in suppression of collateral branch extension. Cell 114: 229-239, 2003. | |||
ref12 PMID:12415299 | |||
Rosenbaum JL, Witman GB. Intraflagellar transport. Nature Reviews Molecular Cell Biology 3: 813-825, 2002 | |||
ref13 PMID:8710890 | |||
Yamazaki, H., T. Nakata, Y. Okada, and N. Hirokawa. Cloning and characterization of KAP3: a novel kinesin superfamily-associated protein of KIF3A/3B. Proceedings of the National Academy of Sciences of the United States of America 93(16): 8443-8448. 1996. | |||
ref14 PMID:10725338 | |||
Takeda, S., H. Yamazaki, D. H. Seog, Y. Kanai, S. Terada, and N. Hirokawa. Kinesin superfamily protein 3 (KIF3) motor transports fodrin-associating vesicles important for neurite building. Journal of Cell Biology 148(6): 1255-1265. 2000. | |||
ref15 PMID:22285930 | |||
Hirokawa N., Y. Tanaka, and Y. Okada. Cilia, KIF3 Molecular Motor and Nodal Flow. Current Opinion in Cell Biology 24:1-9, 2012. | |||
ref16 PMID:9865700 | |||
Nonaka, S., Y. Tanaka, Y. Okada, S. Takeda, A. Harada, Y. Kanai, M. Kido, and N. Hirokawa. Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein. Cell 95(6): 829-837. 1998. | |||
ref17 PMID:10330409 | |||
Takeda, S., Y. Yonekawa, Y. Tanaka, Y. Okada, S. Nonaka, and N. Hirokawa. Left-right asymmetry and kinesin superfamily protein KIF3A: new insights in determination of laterality and mesoderm induction by kif3A-/- mice analysis. Journal of Cell Biology 145(4): 825-836. 1999. | |||
ref18 PMID:15907475 | |||
Okada, Y., S. Takeda, Y. Tanaka, J.-C. I. Belmonte and N. Hirokawa. Mechanism of nodal flow: a conserved symmetry breaking event in left-right axis determination. Cell 121:633-644, 2005. | |||
ref19 PMID:15834408 | |||
Teng J., T. Rai, Y. Tanaka, Y. Takei, T. Nakata, M. Hirasawa, A. B. Kulkarni, and N. Hirokawa. The KIF3 motor transports N-cadherin and organizes the developing neuroepithelium. Nature Cell Biology. 7:474-482, 2005. | |||
ref20 PMID:7929562 | |||
Sekine, Y., Y. Okada, Y. Noda, S. Kondo, H. Aizawa, R. Takemura, and N. Hirokawa. A novel microtubule-based motor protein (KIF4) for organelle transports, whose expression is regulated developmentally. Journal of Cell Biology 127(1): 187-201. 1994. | |||
ref21 PMID:16630823 | |||
Midorikawa R., Y. Takei, and N. Hirokawa. KIF4 motor regulates activity-dependent neuronal survival by suppressing PARP-1 enzymatic activity. Cell 125(2): 371-383, 2006. | |||
ref22 PMID:10964943 | |||
Kanai, Y., Y. Okada, Y. Tanaka, A. Harada, S. Terada, and N. Hirokawa. KIF5C, a novel neuronal kinesin enriched in motor neurons. Journal of Neuroscience 20(17): 6374-6384. 2000. | |||
ref23 PMID:9456325 | |||
Nakata, T., S. Terada, and N. Hirokawa. Visualization of the dynamics of synaptic vesicle and plasma membrane proteins in living axons. Journal of Cell Biology 140(3): 659-74. 1998. | |||
ref24 PMID:9657148 | |||
Tanaka, Y., Y. Kanai, Y. Okada, S. Nonaka, S. Takeda, A. Harada, and N. Hirokawa. Targeted disruption of mouse conventional kinesin heavy chain, kif5B, results in abnormal perinuclear clustering of mitochondria. Cell 93(7): 1147-1158. 1998. | |||
ref25 PMID:11740561 | |||
Kamal A., Almenar-Queralt A, LeBlanc JF, Roberts EA and Goldstein LS. Kinesin-mediated axonal transport of a membrane compartment containing beta-secretase and presenilin-1 requires APP. Nature 414: 643-648, 2001. | |||
ref26 PMID:17611281 | |||
Cai Q., Pan PY and Sheng ZH. Syntabulin-kinesin-1 family member 5B-mediated axonal transport contributes to activity-dependent presynaptic assembly. Journal of Neuroscience 27 (27), 7284-7296, 2007. | |||
ref27 PMID:19135897 | |||
Wang X and Schwarz TL. The mechanism of Ca2+-dependent regulation of kinesin-mediated mitochondorial motility. Cell 136, 163-174, 2009. | |||
ref28 PMID:11986669 | |||
Setou, M., D.-H. Seog, Y. Tanaka, Y. Kanai, Y. Takei, M. Kawagishi, and N. Hirokawa. Glutamate-receptor-interacting protein GRIP1 directly steers kinesin to dendrites. Nature 417(6884): 83-87. 2002. | |||
ref29 PMID:20152113 | |||
Twelvetrees AE, Yuen EY, Arancibia-Carcamo IL, MacAskill AF, Rostaing P, Lumb MJ, Humbert S, Triller A, Saudou F, Yan Z and Kittler JT. Delivery of GABAARs to synapses is mediated by HAP1-KIF5 and disrupted by mutant huntingtin. Neuron 65, 53-65, 2010. | |||
ref30 PMID:15312650 | |||
Kanai, Y., N. Dohmae, and N. Hirokawa. Kinesin transports RNA: isolation and characterization of an RNA-transporting granule. Neuron 43: 513-525, 2004. | |||
ref31 PMID:12355402 | |||
Reid E, Kloos M, Ashley-Koch A, Hughes L, Bevan S, Svenson IK, Graham FL, Gaskell PC, Dearlove A, Pericak-Vance MA, Rubinsztein DC and Marchuk DA. A kinesin heavy chain (KIF5A) mutation in hereditary spastic paraplegia(SPG10). American Journal of Human Genetics 71 (5):1189-1194, 2002. | |||
ref32 PMID:11106728 | |||
Nakagawa, T., M. Setou, D. Seog, K. Ogasawara, N. Dohmae, K. Takio, and N. Hirokawa. A novel motor, KIF13A, transports mannose-6-phosphate receptor to plasma membrane through direct interaction with AP-1 complex. Cell 103(4): 569-581. 2000. | |||
ref33 PMID:21238925 | |||
Ueno, H., X. Huang, Y. Tanaka, and N. Hirokawa. KIF16B/Rab14 molecular motor complex is critical for early embryonic development by transporting FGF receptor. Developmental Cell 20: 60-71, 2011. | |||
ref34 PMID:10846156 | |||
Setou, M., T. Nakagawa, D. H. Seog, and N. Hirokawa. Kinesin superfamily motor protein KIF17 and mLin-10 in NMDA receptor-containing vesicle transport. Science 288(5472): 1796-1802. 2000. | |||
ref35 PMID:18066053 | |||
Guilaud, L., R. Wong and N. Hirokawa. Disruption of KIF17-Mint1 interation by CamKII-dependent phosphorylation: a molecular model of kinesin-cargo release. Nature Cell Biology 10 (1): 19-29, 2008. | |||
ref36 PMID:12391294 | |||
Wong, R. W.-C., M. Setou, J. Teng, Y. Takei, and N. Hirokawa. Overexpression of motor protein KIF17 enhances spatial and working memory in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America 99(22): 14500-14505. 2002. | |||
ref37 PMID:21521616 | |||
Yin, X., Y. Takei, M. A. Kido and N. Hirokawa. Molecular motor KIF17 is fundamental for memory and learning via differential support of synaptic NR2A/2B levels. Neuron 70: 310-325, 2011. | |||
ref38 PMID:19914172 | |||
Zhou R., S. Niwa, N. Homma, Y. Takei, and N. Hirokawa. KIF26A is an unconventional kinesin and regulates GDNF-Ret signaling in enteric neuronal development. Cell 139 (4): 802-813, 2009. | |||
ref39 PMID:9115736 | |||
Saito, N., Y. Okada, Y. Noda, Y. Kinoshita, S. Kondo, and N. Hirokawa. KIFC2 is a novel neuron-specific C-terminal type kinesin superfamily motor for dendritic transport of multivesicular body-like organelles. Neuron 18(3): 425-438. 1997. | |||
ref40 PMID:11581287 | |||
Noda, Y., Y. Okada, N. Saito, M. Setou, Y. Xu, Z. Zhang, and N. Hirokawa. KIFC3, a microtubule minus end-directed motor for the apical transport of annexin XIIIb-associated Triton-insoluble membranes. Journal of Cell Biology 155(1): 77-88. 2001. | |||
(執筆者:近藤誠、廣川信隆 担当編集委員:村上富士夫) | |||
2012年3月14日 (水) 18:39時点における版
英語名:kinesin
キネシンは、モータータンパク質の一つで、主にATPを加水分解しながら微小管に沿って運動する性質を持ち、細胞分裂や細胞内物質輸送に重要な働きをしている。キネシンは遺伝子ファミリーを形成しており、キネシンスーパーファミリータンパク質(kinesin superfamily proteins, KIFs)と呼ばれる。KIFsは哺乳類(マウス、ヒト)で45種類の遺伝子が同定されており、細胞内で膜小器官、タンパク質複合体やmRNAなどのカーゴ(荷物)を輸送することで、細胞の生存、形態形成および機能発現に重要な役割を果たしている(ref1)。最近、このKIFsが、記憶・学習などの脳の高次機能、神経回路網形成、体の左右軸の決定、腫瘍形成の抑制など重要な生命現象に関与していることが明らかとなった(ref2)。本項目ではKIFsによる細胞内物質輸送について述べる。細胞分裂に関わるKIFsについては総説(ref3)(ref4)を参考にされたい。
細胞内物質輸送
(Hirokawa et al.(ref2)より改変)
細胞はその形態形成、及び機能発現に必要なタンパク質を合成した後、多種類の膜小器官あるいはタンパク質複合体として必要とされる部位に適切に送り分けており、この細胞内物質輸送の機構は神経細胞や極性のある上皮細胞のみでなく、あらゆる細胞で細胞機能の重要な基盤となっている。 細胞内物質輸送を担うモータータンパク質には大きく分けて、キネシン、ダイニン、ミオシンの3つがある(図1)(ref2)。
キネシンスーパーファミリータンパク質(KIFs)の分類
(Hirokawa et al.(ref2)より改変)
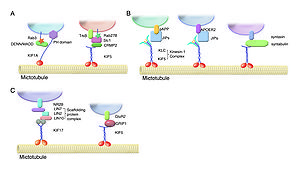
(A、B、C)KIFsは、多くはアダプター蛋白や足場蛋白を介して間接的に、まれには直接的にカーゴと結合し、輸送する。(Hirokawa et al.(ref2)より改変)
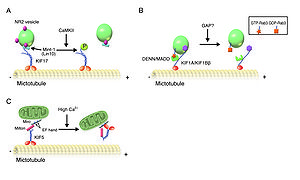
(Hirokawa et al.(ref2)より改変)
キネシンは、ATPを加水分解しながら、微小管に沿ってカーゴ(荷物)を輸送する。キネシンは遺伝子ファミリーを形成しており、キネシンスーパーファミリータンパク質(kinesin superfamily proteins, KIFs)と呼ばれ、哺乳類(マウス、ヒト)で45種類の遺伝子が同定されているが、mRNAスプライシングなどによる複数のアイソフォームの存在により、タンパク質としてはもっと多くの種類が存在する。KIFsは15個のファミリーから成り、分子内のモーター領域の存在部位によりN-KIFs(N末)、M-KIFs(中央)、C-KIFs(C末)に分けられる(図2)(ref2)。一般に、N-KIFsは微小管+(プラス)端へ、C-KIFsは微小管-(マイナス)端方向への輸送を行っており、M-KIFsは微小管の脱重合に関与している(ref1)。N-KIFsとC-KIFsはモーター領域(motor domain)、ストーク領域(stalk domain)、テイル領域(tail domain)より成り、モーター領域のアミノ酸配列の相同性は30~60%であるが、その他の部位のアミノ酸配列は各KIFsに特徴的で、多様性に富んでいる。モーター領域には微小管結合部位とATP結合部位があり、一般に、テイル領域(まれにストーク領域)が特異的なカーゴの認識や結合に関与している。各々KIFsは、多くはアダプター蛋白や足場蛋白を介して間接的に、まれには直接的にカーゴと結合し、これを輸送する(図3)(表1)(ref1)。カーゴとの結合・解離の制御には、リン酸化、Rab GTPase活性、Ca2+シグナリングによる制御が知られている(図4)(ref1)。
代表的なKIFsとその機能
KIF1AとKIF1B
KIF1AとKIF1BはKinesin-3ファミリーに属し、KIF1BにはmRNAスプライシングにより、KIF1BαとKIF1Bβというアイソフォームがある。KIF1AとKIF1Bβは、synaptophysin、synaptotagmin、Rab3Aといったシナプス小胞蛋白を含むシナプス小胞前駆体を輸送する(ref5)。最近、Rab3との特異的な結合には、アダプター蛋白としてDENN/MADDがGTP依存的に働いていることが示された(ref6)。Kif1a及びKif1bホモ欠損マウスは共に、重篤な神経障害により生後すぐに死亡し、また、神経細胞死が認められる(ref7)(ref8)。一方、Kif1a及びKif1bヘテロ欠損マウスはどちらも生存するが、Kif1aヘテロ欠損マウスでは刺激の豊かな生育環境による脳の形態的、機能的変化が障害されており(ref9)、一方、Kif1bヘテロ欠損マウスでは、生後1年頃より進行性の筋力低下と運動失調を認め、Charcot-Marie-Tooth病2A型(CMT type2A)の原因遺伝子の一つと考えられている(ref8)。また、KIF1Bαはミトコンドリアの輸送に関与している(ref10)。
KIF2
KIF2(KIF2A、KIF2B、KIF2C)はM-KIFsに分類され、Kinesin-13ファミリーに属する。KIF2はATP依存的に微小管を脱重合するユニークな性質を持つ。KIF2Aは幼若な脳に多く発現し、神経成長円錐の微小管を脱重合することによって軸索側枝の過剰な伸長を抑制し、神経回路網形成に重要な役割を担っている(ref11)。
KIF3
KIF3はKinesin-2ファミリーに属し、細胞質内だけでなく、線毛や鞭毛内の物質輸送(intraflagellar transport)も行っている(ref12)。KIF3AとKIF3Bは異なった遺伝子から由来し、KAP3(KIF-associated protein 3)と結合してヘテロ三量体(KIF3複合体)を形成し、膜小器官やタンパク質複合体を輸送する(ref13)。神経細胞では軸索伸長に必要な膜小胞を、フォドリンを介して認識し、輸送する(ref14)。また、KIF3複合体は、線毛の構成成分をタンパク質複合体として線毛の基部から先端部へ輸送し、線毛の形成と維持に重要な役割を果たしている(ref15)。さらに、Kif3a及びKif3bホモ欠損マウスの解析により、KIF3が胎児初期のNodeの線毛を形成し、この線毛が回転運動をすることによってNode領域で胎児外液の左方向への流れ(Node流)を作り、これが体の左右軸を決定することが示された(ref16)(ref17)(ref18)。近年、KIF3複合体がN-cadherin/β-catenin複合体を形質膜に輸送することで細胞増殖を制御し、腫瘍形成の抑制に働いていることが明らかとなった(ref19)。
KIF4A
KIF4AはKinesin-4ファミリーに属し、主に幼若な神経細胞で発現し、細胞質と核内の両方に存在する(ref20)。KIF4Aは、脳の発達期において、核内ではPARP-1との結合・解離によりPARP-1の活性を制御することで活動依存的な神経細胞の生存及び細胞死を制御し、一方で細胞質内ではカーゴの輸送を行う(ref21)。
KIF5
KIF5はKinesin-1ファミリーに属し、kinesin light chains(KLCs)と複合体を形成する。KIF5にはKIF5A、KIF5B、KIF5Cの3つのアイソフォームがあるが、発現場所、発現量はそれぞれ異なる。KIF5Bは全身に発現しているのに対し、KIF5A、KIF5Cは神経特異的に発現している(ref22)。これらは各々、異なるアダプター蛋白や足場蛋白を介して様々な膜小胞、ライソソーム、ミトコンドリアなどのカーゴを輸送する(ref23)(ref24)が、互いに類似の機能も持ち、一部の機能は相補的である。KIF5による輸送の例として、神経軸索では、アルツハイマー病に関与するAPPの輸送や(ref25)、syntabulinをアダプター蛋白としたsyntaxin 1の輸送などがある(ref26)。また、近年、KIF5によるミトコンドリアの輸送にCa2+濃度依存的な制御が働いていることが示された(ref27)。一方、樹状突起では、GRIP1を介したAMPA受容体サブユニットGluR2の輸送や(ref28)、HAP1(huntingtin-associated protein 1)を介したGABA受容体の輸送(ref29)、さらにはmRNA・タンパク質複合体(mRNP complex)の輸送(ref30)を担っている。また、KIF5Aの遺伝子変異は遺伝性痙性対麻痺を引き起こすことが知られている(ref31)。
KIF13A
KIF13AはKinesin-3ファミリーに属し、AP-1複合体を介してマンノース-6-リン酸受容体に結合し、これを含む小胞をゴルジ装置から形質膜へ輸送する(ref32)。
KIF16B
KIF16BはKinesin-3ファミリーに属し、Rab14を介してFGF受容体をゴルジ装置からエンドソームへ輸送することによって、胎児の発生期における初期胚形成に重要な働きを持つ(ref33)。
KIF17
KIF17はKinesin-2ファミリーに属し、樹状突起でMint1(LIN10)を含む足場蛋白複合体を介してNMDA受容体サブユニットのNR2Bに結合し、これを輸送する(ref34)。また、カーゴの解離には、CaMKⅡαによるKIF17のリン酸化が重要である(ref35)。近年、遺伝子改変マウスの解析により、KIF17は単にNMDA受容体を輸送するだけでなく、転写因子CREBのリン酸化を介してKIF17及びNR2B mRNAsの転写を促進し、記憶・学習を制御していることが明らかとなった。KIF17を過剰発現させたマウスでは、空間及び作業記憶の向上が見られ(ref36)、一方で、Kif17ホモ欠損マウスでは、海馬依存的記憶の障害が認められた(ref37)。また、KIF17はNR2AとNR2Bの発現量を異なる機序で制御し、シナプスの機能や可塑性に重要な働きをしていることが示された(ref37)。
KIF26A
KIF26AはKIF26BとともにKinesin-11ファミリーに属し、ATPase活性や運動能を持たないユニークなKIFsである(ref38)。KIF26Aは、GDNF/Retシグナル伝達系の抑制因子として働くことによって腸管神経細胞の増殖を制御し、腸管の発達・形成に必須の働きを持つ(ref38)。
C-KIFs(KIFC1、KIFC2、KIFC3)
C-KIFsにはKIFC1、KIFC2、KIFC3の3つがあり、Kinesin-14A及び14Bファミリーに属する。これらC-KIFsは、微小管の-端方向へ動く性質を持つ。KIFC1は多様な組織で発現し、細胞分裂に関与している。KIFC2は主に樹状突起に局在し、多胞体様の膜小器官を輸送している(ref39)。KIFC3は腎上皮細胞(MDCK細胞)で頂上部形質膜へ向けAnnexinⅩⅢbを含む膜小胞を輸送している(ref40)。
将来の展望
これまで、KIFsには、単なる細胞内物質輸送からでは想像できない、より多岐にわたる、生命活動に必須の生理学的意義を持つことが明らかになってきた。しかし、依然としてまだ多くのKIFsはそのカーゴや機能が明らかにされていない。さらに、KIFsによるカーゴの認識、結合、解離の詳細な機序もまだ不明の点が多い。言い換えれば、細胞にとって必須であるイオンチャネルや受容体などのタンパク質には、その細胞内動態及び輸送が未知であるものが多い。これらの解明は、細胞機能を理解する上で非常に重要である。さらに、いかにして同一のKIFが異なるカーゴの輸送を行っているか、また、いかにして同一のカーゴが異なる複数のKIFsに振り分けられているのか、これらの制御機構の解明も待たれる。近年、KIFsは、脳神経疾患をはじめとする様々な疾患との関連が示唆されており、病態解明や治療法の開発も含め、今後のさらなる研究が期待される。
図3 KIFsのカーゴ認識機構の例 (A、B、C)KIFsは、多くはアダプター蛋白や足場蛋白を介して間接的に、まれには直接的にカーゴと結合し、輸送する。 (Hirokawa et al.(ref2)より改変)
図4 カーゴとの結合・解離の制御機構 (A)リン酸化による制御 (B)Rab GTPase活性による制御 (C)Ca2+シグナリングによる制御 (Hirokawa et al.(ref2)より改変)
表1 神経細胞におけるKIFsとカーゴ (Hirokawa et al.(ref2)より改変)
参考文献
ref1 PMID:19773780 Hirokawa, N., Y. Noda, Y. Tanaka, and S. Niwa. Kinesin superfamily motor proteins and intracellular transport. Nature Reviews Molecular Cell Biology. 10: 682-696, 2009.
ref2 PMID:21092854 Hirokawa, N., S. Niwa and Y. Tanaka. Molecular motors in neurons: Transport mechanisms and roles in brain function, development, and disease. Neuron 68: 610-638, 2010.
ref3 PMID:12142285 McIntosh JR. Grishchuk EL and West RR. Chromosome-microtubule interactions during mitosis. Annual Review of Cell and Developmental Biology 18: 193-219, 2002
ref4 PMID:15450976 Moore A. Wordeman L. The mechanism, function and regulation of depolymerizing kinesins during mitosis. Trends in Cell Biology 14 (10): 537-546, 2004
ref5 PMID:7539720 Okada, Y., H. Yamazaki, Y. Sekine-Aizawa, and N. Hirokawa. The neuron-specific kinesin superfamily protein KIF1A is a unique monomeric motor for anterograde axonal transport of synaptic vesicle precursors. Cell 81(5): 769-780. 1995.
ref6 PMID:18849981 Niwa, S., Y. Tanaka and N. Hirokawa. KIF1Bbeta- and KIF1A-mediated axonal transport of presynaptic regulator Rab3 occurs in a GTP-dependent manner through DENN/MADD. Nature Cell Biology 11: 1269-1276, 2008.
ref7 PMID:9548721 Yonekawa, Y., A. Harada, Y. Okada, T. Funakoshi, Y. Kanai, Y. Takei, S. Terada, T. Noda, and N. Hirokawa. Defect in synaptic vesicle precursor transport and neuronal cell death in KIF1A motor protein-deficient mice. Journal of Cell Biology 141(2): 431-441. 1998.
ref8 PMID:11389829 Zhao, C., J. Takita, Y. Tanaka, M. Setou, T. Nakagawa, S. Takeda, H. W. Yang, S. Terada, T. Nakata, Y. Takei, M. Saito, S. Tsuji, Y. Hayashi, and N. Hirokawa. Charcot-Marie-Tooth disease type 2A caused by mutation in a microtubule motor KIF1Bbeta. Cell 105(5): 587-597. 2001.
ref9 PMID:22365548 Kondo, M., Y. Takei, and N. Hirokawa. Motor protein KIF1A is essential for hippocampal synaptogenesis and learning enhancement in an enriched environment. Neuron.23:743-757, 2012.
ref10 PMID:7528108 Nangaku, M., R. Sato-Yoshitake, Y. Okada, Y. Noda, R. Takemura, H. Yamazaki, and N. Hirokawa. KIF1B, a novel microtubule plus end-directed monomeric motor protein for transport of mitochondria. Cell 79(7): 1209-1220. 1994.
ref11 PMID:12887924 Homma, N., Y. Takei, Y. Tanaka, T. Nakata, S. Terada, M. Kikkawa, Y. Noda, and N. Hirokawa. Kinesin superfamily protein 2A (KIF2A) functions in suppression of collateral branch extension. Cell 114: 229-239, 2003.
ref12 PMID:12415299 Rosenbaum JL, Witman GB. Intraflagellar transport. Nature Reviews Molecular Cell Biology 3: 813-825, 2002
ref13 PMID:8710890 Yamazaki, H., T. Nakata, Y. Okada, and N. Hirokawa. Cloning and characterization of KAP3: a novel kinesin superfamily-associated protein of KIF3A/3B. Proceedings of the National Academy of Sciences of the United States of America 93(16): 8443-8448. 1996.
ref14 PMID:10725338 Takeda, S., H. Yamazaki, D. H. Seog, Y. Kanai, S. Terada, and N. Hirokawa. Kinesin superfamily protein 3 (KIF3) motor transports fodrin-associating vesicles important for neurite building. Journal of Cell Biology 148(6): 1255-1265. 2000.
ref15 PMID:22285930 Hirokawa N., Y. Tanaka, and Y. Okada. Cilia, KIF3 Molecular Motor and Nodal Flow. Current Opinion in Cell Biology 24:1-9, 2012.
ref16 PMID:9865700 Nonaka, S., Y. Tanaka, Y. Okada, S. Takeda, A. Harada, Y. Kanai, M. Kido, and N. Hirokawa. Randomization of left-right asymmetry due to loss of nodal cilia generating leftward flow of extraembryonic fluid in mice lacking KIF3B motor protein. Cell 95(6): 829-837. 1998.
ref17 PMID:10330409 Takeda, S., Y. Yonekawa, Y. Tanaka, Y. Okada, S. Nonaka, and N. Hirokawa. Left-right asymmetry and kinesin superfamily protein KIF3A: new insights in determination of laterality and mesoderm induction by kif3A-/- mice analysis. Journal of Cell Biology 145(4): 825-836. 1999.
ref18 PMID:15907475 Okada, Y., S. Takeda, Y. Tanaka, J.-C. I. Belmonte and N. Hirokawa. Mechanism of nodal flow: a conserved symmetry breaking event in left-right axis determination. Cell 121:633-644, 2005.
ref19 PMID:15834408 Teng J., T. Rai, Y. Tanaka, Y. Takei, T. Nakata, M. Hirasawa, A. B. Kulkarni, and N. Hirokawa. The KIF3 motor transports N-cadherin and organizes the developing neuroepithelium. Nature Cell Biology. 7:474-482, 2005.
ref20 PMID:7929562 Sekine, Y., Y. Okada, Y. Noda, S. Kondo, H. Aizawa, R. Takemura, and N. Hirokawa. A novel microtubule-based motor protein (KIF4) for organelle transports, whose expression is regulated developmentally. Journal of Cell Biology 127(1): 187-201. 1994.
ref21 PMID:16630823 Midorikawa R., Y. Takei, and N. Hirokawa. KIF4 motor regulates activity-dependent neuronal survival by suppressing PARP-1 enzymatic activity. Cell 125(2): 371-383, 2006.
ref22 PMID:10964943 Kanai, Y., Y. Okada, Y. Tanaka, A. Harada, S. Terada, and N. Hirokawa. KIF5C, a novel neuronal kinesin enriched in motor neurons. Journal of Neuroscience 20(17): 6374-6384. 2000.
ref23 PMID:9456325 Nakata, T., S. Terada, and N. Hirokawa. Visualization of the dynamics of synaptic vesicle and plasma membrane proteins in living axons. Journal of Cell Biology 140(3): 659-74. 1998.
ref24 PMID:9657148 Tanaka, Y., Y. Kanai, Y. Okada, S. Nonaka, S. Takeda, A. Harada, and N. Hirokawa. Targeted disruption of mouse conventional kinesin heavy chain, kif5B, results in abnormal perinuclear clustering of mitochondria. Cell 93(7): 1147-1158. 1998.
ref25 PMID:11740561 Kamal A., Almenar-Queralt A, LeBlanc JF, Roberts EA and Goldstein LS. Kinesin-mediated axonal transport of a membrane compartment containing beta-secretase and presenilin-1 requires APP. Nature 414: 643-648, 2001.
ref26 PMID:17611281 Cai Q., Pan PY and Sheng ZH. Syntabulin-kinesin-1 family member 5B-mediated axonal transport contributes to activity-dependent presynaptic assembly. Journal of Neuroscience 27 (27), 7284-7296, 2007.
ref27 PMID:19135897 Wang X and Schwarz TL. The mechanism of Ca2+-dependent regulation of kinesin-mediated mitochondorial motility. Cell 136, 163-174, 2009.
ref28 PMID:11986669 Setou, M., D.-H. Seog, Y. Tanaka, Y. Kanai, Y. Takei, M. Kawagishi, and N. Hirokawa. Glutamate-receptor-interacting protein GRIP1 directly steers kinesin to dendrites. Nature 417(6884): 83-87. 2002.
ref29 PMID:20152113 Twelvetrees AE, Yuen EY, Arancibia-Carcamo IL, MacAskill AF, Rostaing P, Lumb MJ, Humbert S, Triller A, Saudou F, Yan Z and Kittler JT. Delivery of GABAARs to synapses is mediated by HAP1-KIF5 and disrupted by mutant huntingtin. Neuron 65, 53-65, 2010.
ref30 PMID:15312650 Kanai, Y., N. Dohmae, and N. Hirokawa. Kinesin transports RNA: isolation and characterization of an RNA-transporting granule. Neuron 43: 513-525, 2004.
ref31 PMID:12355402 Reid E, Kloos M, Ashley-Koch A, Hughes L, Bevan S, Svenson IK, Graham FL, Gaskell PC, Dearlove A, Pericak-Vance MA, Rubinsztein DC and Marchuk DA. A kinesin heavy chain (KIF5A) mutation in hereditary spastic paraplegia(SPG10). American Journal of Human Genetics 71 (5):1189-1194, 2002.
ref32 PMID:11106728 Nakagawa, T., M. Setou, D. Seog, K. Ogasawara, N. Dohmae, K. Takio, and N. Hirokawa. A novel motor, KIF13A, transports mannose-6-phosphate receptor to plasma membrane through direct interaction with AP-1 complex. Cell 103(4): 569-581. 2000.
ref33 PMID:21238925 Ueno, H., X. Huang, Y. Tanaka, and N. Hirokawa. KIF16B/Rab14 molecular motor complex is critical for early embryonic development by transporting FGF receptor. Developmental Cell 20: 60-71, 2011.
ref34 PMID:10846156 Setou, M., T. Nakagawa, D. H. Seog, and N. Hirokawa. Kinesin superfamily motor protein KIF17 and mLin-10 in NMDA receptor-containing vesicle transport. Science 288(5472): 1796-1802. 2000.
ref35 PMID:18066053 Guilaud, L., R. Wong and N. Hirokawa. Disruption of KIF17-Mint1 interation by CamKII-dependent phosphorylation: a molecular model of kinesin-cargo release. Nature Cell Biology 10 (1): 19-29, 2008.
ref36 PMID:12391294 Wong, R. W.-C., M. Setou, J. Teng, Y. Takei, and N. Hirokawa. Overexpression of motor protein KIF17 enhances spatial and working memory in transgenic mice. Proceedings of the National Academy of Sciences of the United States of America 99(22): 14500-14505. 2002.
ref37 PMID:21521616 Yin, X., Y. Takei, M. A. Kido and N. Hirokawa. Molecular motor KIF17 is fundamental for memory and learning via differential support of synaptic NR2A/2B levels. Neuron 70: 310-325, 2011.
ref38 PMID:19914172 Zhou R., S. Niwa, N. Homma, Y. Takei, and N. Hirokawa. KIF26A is an unconventional kinesin and regulates GDNF-Ret signaling in enteric neuronal development. Cell 139 (4): 802-813, 2009.
ref39 PMID:9115736 Saito, N., Y. Okada, Y. Noda, Y. Kinoshita, S. Kondo, and N. Hirokawa. KIFC2 is a novel neuron-specific C-terminal type kinesin superfamily motor for dendritic transport of multivesicular body-like organelles. Neuron 18(3): 425-438. 1997.
ref40 PMID:11581287 Noda, Y., Y. Okada, N. Saito, M. Setou, Y. Xu, Z. Zhang, and N. Hirokawa. KIFC3, a microtubule minus end-directed motor for the apical transport of annexin XIIIb-associated Triton-insoluble membranes. Journal of Cell Biology 155(1): 77-88. 2001.
(執筆者:近藤誠、廣川信隆 担当編集委員:村上富士夫)