「カハール・レチウス細胞」の版間の差分
細編集の要約なし |
Tadashinomura (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
< | 英語名 Cajal-Retzius Cells | ||
<br> | |||
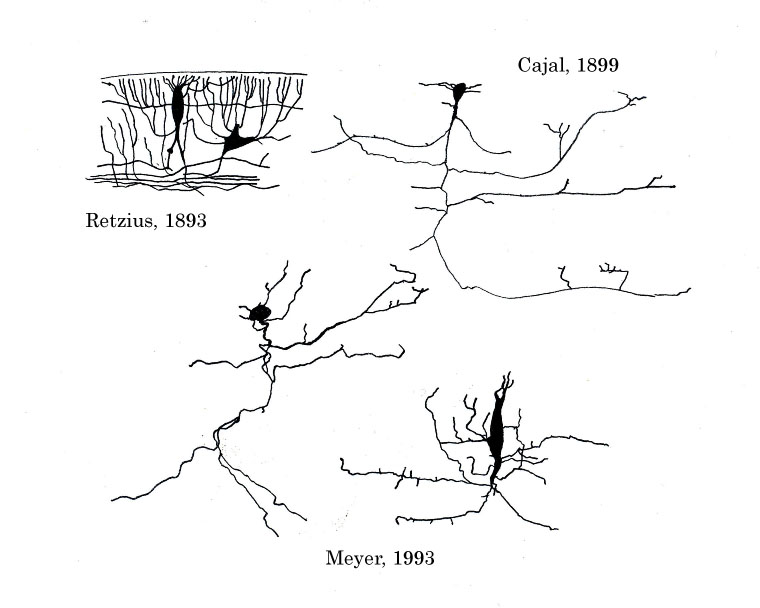
胎生期の哺乳類大脳皮質の辺縁層(第 I 層)に存在する神経細胞の一種。 軟膜面に対し放射状に広がった樹上突起と、水平方向に伸張した軸索を形態的特徴として持つ。大脳皮質神経細胞の移動と層形成に必須の分子であるリーリン (Reelin) を分泌する細胞として、大脳皮質の発生に極めて重要な役割を果たす。 | |||
< | |||
[[Image:カハールレチウス細胞.jpg|ゴルジ染色によるカハールレチウス細胞の形態。文献1を基に筆者描画。]]<br> | |||
【歴史】 | |||
19世紀末にスウェーデンの神経形態学者レチウス(Gustaf Retzius)、スペインのカハール (Ramon y Cajal)らにより、ヒト胎児および新生児大脳皮質辺縁層を構成する神経細胞として同定された。比較解剖学的知見により、同様の神経細胞は哺乳類大脳皮質に共通して存在することが明らかとなっている。レチウスとカハールの同定した細胞は厳密には同一ではないが、両者の細胞に共通した形態的特徴を持ち、特に後述するリーリンを発現する大脳皮質辺縁層の細胞群を一般的にカハールレチウス細胞と呼んでいる1。 | |||
<br> | |||
【発生学的役割】 | |||
細胞外分泌分子であるリーリンタンパク質を発現することにより、大脳皮質の神経細胞の移動と層構造の形成に重要な役割を果たす2,3。実験的にカハールレチウス細胞を除去したマウスでは、大脳皮質の一部の領域で層特異的神経細胞の配置に異常が生じる4。またカハールレチウス細胞はグルタミン酸受容体とGABA受容体の両方を発現している。特に、視床および介在神経細胞からの GABA を介した線維入力は、カハールレチウス細胞と他の第I層の神経細胞の同期的発火に重要な役割を果たす5。 | |||
<br> | |||
【発生学的起源と分化機構】 カハールレチウス細胞は、胎生期大脳皮質原基において最も早く分化する神経細胞の1つである。その出現は一過的であり、生後の大脳皮質においては、細胞死によって数が著しく減少する。大脳皮質の発生初期において、カハールレチウス細胞は同時期に分化する他の神経細胞とともに、プレプレートと呼ばれる神経層を形成する。このプレプレートは、いわゆる皮質板を構成する神経細胞が侵入することによって、カハールレチウス細胞を含む辺縁層とサブプレートの2つの層に分かれる6。カハールレチウス細胞の産生される場所については、ヒト胎児の組織学的観察により嗅皮質周辺部 (retrobulber area)がその発生起源として示唆されてきた。一方、近年分子遺伝学的な手法を用いた細胞標識解析によって、胎生期終脳原基の内側周辺部 (cortical hem)、腹側外套 (ventral pallium) および中隔野 (septum)といった、大脳皮質原基以外の領域からカハールレチウス細胞が発生し、大脳皮質へと移動することが明らかとなっている4,7,8。カハールレチウス細胞には、リーリンの他、カルレチニン (Calretinin)、 カルバインディン (Calbindin)といったカルシウム結合タンパク、細胞周期調節因子であるp73、転写因子をコードするTbr1、Emx1、 Lhx6といった遺伝子が発現しており、これらの分子の発現と発生起源との相違から、カハールレチウス細胞は幾つかのサブタイプに分類されている9。実際に、p73、Tbr1、Emx1はカハールレチウス細胞の発生に必須の機能を果たしていることが、遺伝子機能破壊マウスの解析から明らかとなっている。またフォークヘッドファミリーに属する転写因子であるFoxG1 は、大脳皮質の神経上皮細胞からカハールレチウス細胞が分化することを抑制しており、 FoxG1変異マウスでは皮質のすべての神経細胞がカハールレチウス細胞として分化する10。さらに軟膜から分泌されるタンパク質であるSDF1、およびその受容体であるCXCR7は、カハールレチウス細胞の辺縁層への局在に必須の役割を果たしている11。 | |||
<br> | |||
【大脳皮質進化とカハールレチウス細胞 】 | |||
哺乳類のカハールレチウス細胞と相同と考えられる細胞は、爬虫類や鳥類の終脳背側領域にも存在する。しかしながらその数は哺乳類大脳皮質と比較して著しく少ない。こうした知見から、リーリンを分泌するカハールレチウス細胞の増加が、6層構造を発達、インサイドーアウト様式で発生する哺乳類大脳皮質の進化に大きく貢献した可能性が提唱されている12,13。また近年、non-coding RNA遺伝子である HAR1が、ヒト胎生期大脳皮質のカハールレチウス細胞に特異的に発現していることが報告されている14。HAR1は、特にヒトの系統で高度に塩基配列置換が確認されるゲノム領域 (Human accelerated region) に含まれる遺伝子の1つであり、ヒト大脳皮質の進化との関連が示唆されている。 | |||
<br> | |||
参考文献 | |||
1. Meyer, G., Goffinet, A. M. & Fairen, A. '''What is a Cajal-Retzius cell? A reassessment of a classical cell type based on recent observations in the developing neocortex.''' ''Cereb Cortex: ''1999, 9, 765-775. | |||
2. Ogawa, M. et al. '''The reeler gene-associated antigen on Cajal-Retzius neurons is a crucial molecule for laminar organization of cortical neurons.''' ''Neuron: ''1995, 14, 899-912. | |||
3. D'Arcangelo, G. et al. '''A protein related to extracellular matrix proteins deleted in the mouse mutant reeler'''. ''Nature: ''1995, 374, 719-723. | |||
4. Yoshida, M., Assimacopoulos, S., Jones, K. R. & Grove, E. A. '''Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order.''' ''Development: ''2006'', ''133, 537-545. | |||
5. Soda, T. et al. '''Segregation and coactivation of developing neocortical layer 1 neurons.'''''J Neurosci: '' 23, 6272-6279. | |||
6. Marin-Padilla, M. '''Cajal-Retzius cells and the development of the neocortex. '''''Trends Neurosci: ''1998,'' ''21, 64-71. | |||
7. Takiguchi-Hayashi, K. et al. '''Generation of reelin-positive marginal zone cells from the caudomedial wall of telencephalic vesicles. '''''J Neurosci: ''2004,'' ''24, 2286-2295. | |||
8. Bielle, F. et al. '''Multiple origins of Cajal-Retzius cells at the borders of the developing pallium.''' ''Nat Neurosci: ''2005, 8, 1002-1012. | |||
9. Hevner, R. F., Neogi, T., Englund, C., Daza, R. A. & Fink, A. '''Cajal-Retzius cells in the mouse: transcription factors, neurotransmitters, and birthdays suggest a pallial origin. '''''Brain Res Dev Brain Res:'' 2003, 141, 39-53. | |||
10. Hanashima, C., Li, S. C., Shen, L., Lai, E. & Fishell, G. '''Foxg1 suppresses early cortical cell fate. '''''Science: ''2004, 303, 56-59. | |||
11. Borrell, V. & Marin, O. '''Meninges control tangential migration of hem-derived Cajal-Retzius cells via CXCL12/CXCR4 signaling.''' ''Nat Neurosci: ''2006, 9, 1284-1293. | |||
12. Bar, I., Lambert de Rouvroit, C. & Goffinet, A. M. '''The evolution of cortical development. An hypothesis based on the role of the Reelin signaling pathway.''' ''Trends Neurosci: ''2000,'' ''23, 633-638. | |||
13. Nomura, T., Takahashi, M., Hara, Y. & Osumi, N. '''Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex. '''''PLoS ONE: ''2008,'' ''3, e1454. | |||
14. Pollard, K. S. et al. '''An RNA gene expressed during cortical development evolved rapidly in humans.''' ''Nature:'' 2006, 443, 167-172. | |||
重要な関連語:リーリン、プレプレート | |||
(執筆者:野村真、担当編集委員:大隅典子) | |||
2012年3月23日 (金) 14:17時点における版
英語名 Cajal-Retzius Cells
胎生期の哺乳類大脳皮質の辺縁層(第 I 層)に存在する神経細胞の一種。 軟膜面に対し放射状に広がった樹上突起と、水平方向に伸張した軸索を形態的特徴として持つ。大脳皮質神経細胞の移動と層形成に必須の分子であるリーリン (Reelin) を分泌する細胞として、大脳皮質の発生に極めて重要な役割を果たす。
【歴史】
19世紀末にスウェーデンの神経形態学者レチウス(Gustaf Retzius)、スペインのカハール (Ramon y Cajal)らにより、ヒト胎児および新生児大脳皮質辺縁層を構成する神経細胞として同定された。比較解剖学的知見により、同様の神経細胞は哺乳類大脳皮質に共通して存在することが明らかとなっている。レチウスとカハールの同定した細胞は厳密には同一ではないが、両者の細胞に共通した形態的特徴を持ち、特に後述するリーリンを発現する大脳皮質辺縁層の細胞群を一般的にカハールレチウス細胞と呼んでいる1。
【発生学的役割】
細胞外分泌分子であるリーリンタンパク質を発現することにより、大脳皮質の神経細胞の移動と層構造の形成に重要な役割を果たす2,3。実験的にカハールレチウス細胞を除去したマウスでは、大脳皮質の一部の領域で層特異的神経細胞の配置に異常が生じる4。またカハールレチウス細胞はグルタミン酸受容体とGABA受容体の両方を発現している。特に、視床および介在神経細胞からの GABA を介した線維入力は、カハールレチウス細胞と他の第I層の神経細胞の同期的発火に重要な役割を果たす5。
【発生学的起源と分化機構】 カハールレチウス細胞は、胎生期大脳皮質原基において最も早く分化する神経細胞の1つである。その出現は一過的であり、生後の大脳皮質においては、細胞死によって数が著しく減少する。大脳皮質の発生初期において、カハールレチウス細胞は同時期に分化する他の神経細胞とともに、プレプレートと呼ばれる神経層を形成する。このプレプレートは、いわゆる皮質板を構成する神経細胞が侵入することによって、カハールレチウス細胞を含む辺縁層とサブプレートの2つの層に分かれる6。カハールレチウス細胞の産生される場所については、ヒト胎児の組織学的観察により嗅皮質周辺部 (retrobulber area)がその発生起源として示唆されてきた。一方、近年分子遺伝学的な手法を用いた細胞標識解析によって、胎生期終脳原基の内側周辺部 (cortical hem)、腹側外套 (ventral pallium) および中隔野 (septum)といった、大脳皮質原基以外の領域からカハールレチウス細胞が発生し、大脳皮質へと移動することが明らかとなっている4,7,8。カハールレチウス細胞には、リーリンの他、カルレチニン (Calretinin)、 カルバインディン (Calbindin)といったカルシウム結合タンパク、細胞周期調節因子であるp73、転写因子をコードするTbr1、Emx1、 Lhx6といった遺伝子が発現しており、これらの分子の発現と発生起源との相違から、カハールレチウス細胞は幾つかのサブタイプに分類されている9。実際に、p73、Tbr1、Emx1はカハールレチウス細胞の発生に必須の機能を果たしていることが、遺伝子機能破壊マウスの解析から明らかとなっている。またフォークヘッドファミリーに属する転写因子であるFoxG1 は、大脳皮質の神経上皮細胞からカハールレチウス細胞が分化することを抑制しており、 FoxG1変異マウスでは皮質のすべての神経細胞がカハールレチウス細胞として分化する10。さらに軟膜から分泌されるタンパク質であるSDF1、およびその受容体であるCXCR7は、カハールレチウス細胞の辺縁層への局在に必須の役割を果たしている11。
【大脳皮質進化とカハールレチウス細胞 】
哺乳類のカハールレチウス細胞と相同と考えられる細胞は、爬虫類や鳥類の終脳背側領域にも存在する。しかしながらその数は哺乳類大脳皮質と比較して著しく少ない。こうした知見から、リーリンを分泌するカハールレチウス細胞の増加が、6層構造を発達、インサイドーアウト様式で発生する哺乳類大脳皮質の進化に大きく貢献した可能性が提唱されている12,13。また近年、non-coding RNA遺伝子である HAR1が、ヒト胎生期大脳皮質のカハールレチウス細胞に特異的に発現していることが報告されている14。HAR1は、特にヒトの系統で高度に塩基配列置換が確認されるゲノム領域 (Human accelerated region) に含まれる遺伝子の1つであり、ヒト大脳皮質の進化との関連が示唆されている。
参考文献
1. Meyer, G., Goffinet, A. M. & Fairen, A. What is a Cajal-Retzius cell? A reassessment of a classical cell type based on recent observations in the developing neocortex. Cereb Cortex: 1999, 9, 765-775.
2. Ogawa, M. et al. The reeler gene-associated antigen on Cajal-Retzius neurons is a crucial molecule for laminar organization of cortical neurons. Neuron: 1995, 14, 899-912.
3. D'Arcangelo, G. et al. A protein related to extracellular matrix proteins deleted in the mouse mutant reeler. Nature: 1995, 374, 719-723.
4. Yoshida, M., Assimacopoulos, S., Jones, K. R. & Grove, E. A. Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order. Development: 2006, 133, 537-545.
5. Soda, T. et al. Segregation and coactivation of developing neocortical layer 1 neurons.J Neurosci: 23, 6272-6279.
6. Marin-Padilla, M. Cajal-Retzius cells and the development of the neocortex. Trends Neurosci: 1998, 21, 64-71.
7. Takiguchi-Hayashi, K. et al. Generation of reelin-positive marginal zone cells from the caudomedial wall of telencephalic vesicles. J Neurosci: 2004, 24, 2286-2295.
8. Bielle, F. et al. Multiple origins of Cajal-Retzius cells at the borders of the developing pallium. Nat Neurosci: 2005, 8, 1002-1012.
9. Hevner, R. F., Neogi, T., Englund, C., Daza, R. A. & Fink, A. Cajal-Retzius cells in the mouse: transcription factors, neurotransmitters, and birthdays suggest a pallial origin. Brain Res Dev Brain Res: 2003, 141, 39-53.
10. Hanashima, C., Li, S. C., Shen, L., Lai, E. & Fishell, G. Foxg1 suppresses early cortical cell fate. Science: 2004, 303, 56-59.
11. Borrell, V. & Marin, O. Meninges control tangential migration of hem-derived Cajal-Retzius cells via CXCL12/CXCR4 signaling. Nat Neurosci: 2006, 9, 1284-1293.
12. Bar, I., Lambert de Rouvroit, C. & Goffinet, A. M. The evolution of cortical development. An hypothesis based on the role of the Reelin signaling pathway. Trends Neurosci: 2000, 23, 633-638.
13. Nomura, T., Takahashi, M., Hara, Y. & Osumi, N. Patterns of neurogenesis and amplitude of Reelin expression are essential for making a mammalian-type cortex. PLoS ONE: 2008, 3, e1454.
14. Pollard, K. S. et al. An RNA gene expressed during cortical development evolved rapidly in humans. Nature: 2006, 443, 167-172.
重要な関連語:リーリン、プレプレート
(執筆者:野村真、担当編集委員:大隅典子)