「2光子顕微鏡」の版間の差分
細編集の要約なし |
細 WikiSysop がページ「2光子レーザー走査顕微鏡」を「2光子顕微鏡」に移動しました: 2光子顕微鏡 |
||
| (同じ利用者による、間の5版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/read0123542 野口 潤]</font><br> | <font size="+1">[https://researchmap.jp/read0123542 野口 潤]</font><br> | ||
''国立精神・神経医療研究センター 神経研究所 微細構造研究部''<br> | ''国立精神・神経医療研究センター 神経研究所 微細構造研究部''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2019年12月1日 原稿完成日:201X年X月X日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div></div> | </div></div> | ||
英語名:two-photon microscope 独:Zwei-Photonen-Mikroskop 仏:microscope à deux | 英語名:two-photon microscope 独:Zwei-Photonen-Mikroskop 仏:microscope à deux photons 中:雙光子顯微鏡 | ||
類義語:2光子レーザー走査顕微鏡、多光子顕微鏡 | 類義語:2光子レーザー走査顕微鏡、多光子顕微鏡 | ||
{{box|text= | {{box|text= 2光子顕微鏡はレーザー走査型蛍光顕微鏡の一種である。赤外線超短パルスレーザーを顕微鏡の対物レンズを介して標本に入射して焦点付近の蛍光色素のみを励起し、標本から返ってきた蛍光を検出してコンピュータで画像構築する。赤外線を用いるため組織浸透度に優れており、光散乱をもつ厚い組織においてこれまで最大1.6 mm程度までの深さにおける神経細胞の非侵襲観察が報告されている。また、共焦点顕微鏡に近い高い分解能 (~400 nm) での光学観察ができる。これを利用して、厚みのある生体組織や組織スライス標本における高分解能観察に用いられている。このほか、ケージド試薬の局所光分解などの2光子励起の特徴を利用した応用が行われる。}} | ||
== 2光子顕微鏡(多光子顕微鏡)とは == | == 2光子顕微鏡(多光子顕微鏡)とは == | ||
[[ファイル:Noguchi Fig1.png|サムネイル | [[ファイル:Noguchi Fig1.png|サムネイル|'''図1. 2光子励起について<br>'''1光子励起では、1分子の蛍光色素分子が1個の光子を吸収し、基底状態(s0)からエネルギーの高い励起状態(s1)に励起される。分子内振動で熱エネルギーとして放出する緩和過程を経て励起状態の最も低い準位に至り、その後、数〜数十ナノ秒という時間(蛍光寿命)の後に光子(蛍光)を放出して基底状態に戻る。2光子励起では2つの光子が1つの蛍光分子に同時に吸収されることにより励起状態に至る。2光子励起では、1光子励起に必要な波長の約2倍の波長で励起する。]] | ||
[[ファイル:Noguchi Fig2.png|サムネイル | [[ファイル:Noguchi Fig2.png|サムネイル|'''図2. 2光子顕微鏡と共焦点顕微鏡の比較<br>'''2光子顕微鏡では、標本中の焦点付近のみに位置する蛍光色素分子が励起される(赤点)。これに対して共焦点顕微鏡では励起光(青いシェードの部分)が通過する部分の分子が励起される。2光子顕微鏡では焦点付近から放出された蛍光(緑実線)に加えて、蛍光の散乱光の一部(緑点線)も検出して高感度化できる。共焦点顕微鏡では焦点以外からの蛍光はピンホールで遮られるため原理上検出できない。]] | ||
蛍光分子は光子を吸収して10<sup>-15</sup>秒程度で励起状態に遷移し、10<sup>-9</sup>~10<sup>-8</sup>秒程度の時間(蛍光寿命という)ののちに光子を放出して基底状態に戻る。自然界に一般的に見られる蛍光現象は1つの光子が1つの蛍光分子に吸収される1光子励起によるものである。ところが、特殊な条件下では2個以上の光子が一度に1つの蛍光分子に吸収される多光子励起とよばれる現象が発生する('''図1''')。この多光子励起による蛍光を利用して蛍光分子の分布を光学的に観察する顕微鏡を多光子顕微鏡と呼んでいる。現在実装されているレーザーの性能上の制約から2個の光子が一度に吸収される2光子励起が医学・生物学研究によく用いられており、2光子顕微鏡と呼ぶことも多い。本項でも2光子励起を中心に述べる。 | |||
光子1個が持つエネルギーは波長に反比例する。1つの光子で励起するのと同等のエネルギーを2光子励起では2個の光子で与えて励起すれば良いので、1個の光子あたりのエネルギーは1光子励起の約半分でよいことになる。つまり可視光による1光子励起と同等のことが、波長が約2倍の赤外線(波長700 nm ~ )による2光子励起で行われる。 | 光子1個が持つエネルギーは波長に反比例する。1つの光子で励起するのと同等のエネルギーを2光子励起では2個の光子で与えて励起すれば良いので、1個の光子あたりのエネルギーは1光子励起の約半分でよいことになる。つまり可視光による1光子励起と同等のことが、波長が約2倍の赤外線(波長700 nm ~ )による2光子励起で行われる。 | ||
しかしながら、2個の光子が1つの蛍光分子に同時に吸収される現象は非常に生じにくく、この現象を起こすためには光子の密度つまり光の強度を瞬間的に極度に高める必要がある。そのために超短パルスレーザーが用いられる。これは時間的に光を圧縮してパルス状にすることで、瞬間的な光子密度を劇的に高めたレーザーである。典型的な市販の超短パルスレーザーで光が出ている時間(100 フェムト秒)と出ていない時間(12.5 ナノ秒)の長さの比は1:125,000 であり、いかに光子密度が時間的な圧縮により高められているかがわかる。 | |||
さらに、そのレーザー光を顕微鏡に導き対物レンズで焦点付近に集中させ、空間的にも光子密度を(断面積比で10<sup>7</sup>倍程度に)高めることでようやく2光子励起が生じる。この2光子励起が非常に生じにくいことを利用して、対物レンズの焦点近傍の蛍光分子のみを励起し、光学顕微鏡の解像限界に近い高解像度の断層画像を2光子顕微鏡で得ることができる。2光子励起の生じやすさは光の強度の2乗に比例することから非線形光学現象と呼ばれる。 | |||
実際の顕微鏡では、2光子励起される焦点はスキャンニングミラーを高速で動かすことによって走査される。標本から放出された蛍光は対物レンズで集められ、光電子増倍管(photomultiplier)などで検出して、コンピュータを用いて画像を構築する。 | |||
2光子励起現象はGoeppert-Mayer によって1930年頃理論的な研究が行われた<ref name=Goeppert-Mayer1931>'''Goeppert-Mayer, M. (1931).'''<br>Über Elementarakte mit zwei Quantensprüngen. ''Annal Physik'' 9, 273-294.</ref> 。波長可変の超短パルスレーザーの改良が進むと、とくに1990年代以降から、Denk、Webbその他の研究者によって神経科学分野における高解像度蛍光顕微鏡としての応用が進められた<ref name=Denk1995>'''Denk, W., Piston, D.W., and Webb, W.W. (1995)'''<br>Two-Photon Molecular Excitation in Laser-Scanning Microscopy. In: Pawley J.B. (eds) ''Handbook of Biological Confocal Microscopy.'' (Springer, Boston, MA).></ref><ref name=Denk1997><pubmed> 9115730 </pubmed></ref> 。 | |||
現在では2光子顕微鏡は各顕微鏡メーカーから市販されており、一般的な研究手段として用いられる<ref name=Yuste2005>'''Yuste, R., and Konnerth, A. (2005).'''<br>“Imaging in Neuroscience and Development: A Laboratory Mannual”, (Cold Spring Harbor Laboratory Press).</ref><ref name=塗谷睦生2018>'''塗谷睦生 (2018).'''<br>非線形顕微鏡 ''顕微鏡学ハンドブック'' (朝倉書店).</ref><ref name=岡部繁男2018>'''岡部繁男 (2018).'''<br>生きた個体の観察 ''顕微鏡学ハンドブック'' (朝倉書店).</ref> 。一方、技術的な改良や新たな応用も進められている。今後は、より散乱が少ない長波長(1000 nm ~) | 現在では2光子顕微鏡は各顕微鏡メーカーから市販されており、一般的な研究手段として用いられる<ref name=Yuste2005>'''Yuste, R., and Konnerth, A. (2005).'''<br>“Imaging in Neuroscience and Development: A Laboratory Mannual”, (Cold Spring Harbor Laboratory Press).</ref><ref name=塗谷睦生2018>'''塗谷睦生 (2018).'''<br>非線形顕微鏡 | ||
''顕微鏡学ハンドブック'' (朝倉書店).</ref><ref name=岡部繁男2018>'''岡部繁男 (2018).'''<br>生きた個体の観察 ''顕微鏡学ハンドブック'' (朝倉書店).</ref> 。一方、技術的な改良や新たな応用も進められている。今後は、より散乱が少ない長波長(1000 nm ~)の励起光や赤外領域の蛍光も用いやすくなると思われ、補償光学系の導入もあわせて不規則な散乱のある組織での解像度の向上が期待される。現時点ではガルバノミラーやレゾナントスキャナによるスキャンニング(走査)が主に採用されているが、音響光学素子等の普及によって、より高速で自由なスキャンニングが今後エンドユーザーでも選択可能になっていくと予想している。実験目的に応じて、スキャンニングの高速化や広域化、ライトシート顕微鏡や電子顕微鏡との組み合わせ、超解像法との組み合わせが今後も模索されていくと思われる。 | |||
== 特徴 == | == 特徴 == | ||
* ''' | * '''組織浸透性が高い''' | ||
2光子顕微鏡では共焦点顕微鏡などの蛍光顕微鏡より波長が長い赤外線を励起光として用いるため組織における散乱・吸収が可視光励起より少ない。そのため一般的な蛍光顕微鏡より組織深部の観察に適している。現在では条件を最適化することにより1.6 mm程度の深部までの非侵襲的な生体脳イメージングが可能となっている<ref name=Kawakami2015><pubmed>25798313</pubmed></ref> 。 | |||
* ''' | * '''組織全体の褪色が生じにくい''' | ||
1光子励起では励起光が通過する地点は褪色が生じる可能性がある。2光子顕微鏡では励起は焦点付近でのみ生じるので、励起していない箇所の褪色やラジカルの発生を考慮しなくてよい。 | |||
* '''内部遮蔽効果が生じにくい''' | * '''内部遮蔽効果が生じにくい''' | ||
蛍光色素濃度が大きい場合に、1光子励起では光路上の蛍光色素によって遮られ、励起光が焦点面に十分届かないことがあり、内部遮蔽効果と呼ばれる。2光子励起ではこの現象は回避される。 | 蛍光色素濃度が大きい場合に、1光子励起では光路上の蛍光色素によって遮られ、励起光が焦点面に十分届かないことがあり、内部遮蔽効果と呼ばれる。2光子励起ではこの現象は回避される。 | ||
* '''複数の蛍光色素の同時励起を行いやすい''' | * '''複数の蛍光色素の同時励起を行いやすい''' | ||
蛍光色素の1光子励起の励起スペクトルをちょうど2倍したスペクトルよりも実際の2光子励起波長は短波長側に広がる傾向にある(ブルーシフトと呼ぶ)。この性質により、ひとつの波長の励起光で同時に複数の蛍光色素を励起しやすくなる。複数の蛍光色素をそれぞれ励起するために一般の蛍光顕微鏡では複数の波長の光源や励起フィルターを用意していることが多いが、2光子顕微鏡では1個のレーザーで同時励起できることも多い(ただし個別に励起したいときはデメリットにもなりうる)。 | |||
* '''散乱した蛍光の利用が可能''' | * '''散乱した蛍光の利用が可能''' | ||
共焦点顕微鏡は組織で散乱した蛍光は原理上検出しない。これに対して2光子顕微鏡では、励起する領域を空間的に限局して高解像度を達成するので、散乱される蛍光も含めて検出できればシグナル/ノイズ比を上げることができる。したがって高い開口数かつ視野の広い(しばしば低倍の)対物レンズが2光子励起顕微鏡において検出効率を高くする。もしくは、検出器の位置を標本から見て対物レンズの反対側(トランス側)に置くことも用途によっては可能で、対物レンズよりも開口数と視野の大きい検出用の光学系を配置することもできる。 | |||
* '''空間的に限局した励起の応用''' | * '''空間的に限局した励起の応用''' | ||
2光子励起の空間的に限局された領域のみを励起する性質がイメージング以外にも応用されている。例えば、ケージド試薬(関連事項参照)の光分解は1光子励起でも行われるが、励起光が通過する地点は全て分解されるので空間的な制限を加えることが難しい。これに対して2光子励起では1 µm<sup>3</sup>程度の非常に限局された領域のみで光分解を生じさせることができる。これを利用して、例えば着目する神経細胞のそれぞれの単一シナプスにグルタミン酸やGABAなどの神経伝達物質を投与することが可能となった<ref name=Matsuzaki2011><pubmed>21536760</pubmed></ref><ref name=河西春郎2003>'''河西春郎 (2003).'''<br>新しいケイジドグルタミン酸と2光子励起法を用いた神経機能の解析. ''細胞工学'' 22, 161-164</ref> 。また、photo-activatable [[GFP]](光活性化型GFP)などを用いることによって空間的に限局した領域のタンパク質のみを標識して経過観察することが可能である。逆に単一シナプスの蛍光タンパク質のみを褪色させ、蛍光の回復時間を測定することによって、着目するタンパク質の代謝あるいは拡散速度を求めることも行われる(FRAP: Fluorescence Recovery After Photobleaching)。 | |||
* ''' | * '''蛍光寿命画像顕微鏡(FLIM)やSHG顕微鏡法などとの同時使用''' | ||
2光子顕微鏡ではパルスレーザーを用いるために、蛍光寿命(上述)の測定が比較的容易で、これを実現するために追加する装置が市販されている。[[ | 2光子顕微鏡ではパルスレーザーを用いるために、蛍光寿命(上述)の測定が比較的容易で、これを実現するために追加する装置が市販されている。[[FRET]] ([[Förster共鳴エネルギー移動]])、つまり、蛍光分子同士の近接によるエネルギー移動はドナーの蛍光寿命を短くするので、この蛍光寿命画像顕微鏡法(Fluorescence Lifetime Imaging Microscopy: FLIM)を適用することによって、1種類の蛍光分子の測定で、蛍光分子の濃度によらず高い空間分解能でFRET測定が可能である。 | ||
また、2次高調波発生(Second Harmonic Generation; SHG)は結晶構造(くり返し構造)を持つ分子に当てられた入射光のちょうど半分の波長の光を放出する非線形光学現象であるが、2光子励起と共通のレーザーを用いて実施することができる。実際に、2光子顕微鏡で生体マウスの硬膜を観察した時に硬膜の自家蛍光のように見える光は、硬膜から放出された2次高調波である。このように非線形光学現象を用いる顕微鏡法を2種類以上併用して、さらに情報量の多い測定が可能となる<ref name=塗谷睦生2018 /> 。 | |||
== 関連事項 == | == 関連事項 == | ||
2019年12月1日 (日) 20:13時点における版
野口 潤
国立精神・神経医療研究センター 神経研究所 微細構造研究部
DOI:10.14931/bsd.8019 原稿受付日:2019年12月1日 原稿完成日:201X年X月X日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:two-photon microscope 独:Zwei-Photonen-Mikroskop 仏:microscope à deux photons 中:雙光子顯微鏡
類義語:2光子レーザー走査顕微鏡、多光子顕微鏡
2光子顕微鏡はレーザー走査型蛍光顕微鏡の一種である。赤外線超短パルスレーザーを顕微鏡の対物レンズを介して標本に入射して焦点付近の蛍光色素のみを励起し、標本から返ってきた蛍光を検出してコンピュータで画像構築する。赤外線を用いるため組織浸透度に優れており、光散乱をもつ厚い組織においてこれまで最大1.6 mm程度までの深さにおける神経細胞の非侵襲観察が報告されている。また、共焦点顕微鏡に近い高い分解能 (~400 nm) での光学観察ができる。これを利用して、厚みのある生体組織や組織スライス標本における高分解能観察に用いられている。このほか、ケージド試薬の局所光分解などの2光子励起の特徴を利用した応用が行われる。
2光子顕微鏡(多光子顕微鏡)とは
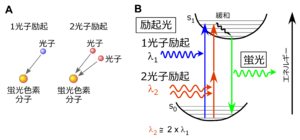
1光子励起では、1分子の蛍光色素分子が1個の光子を吸収し、基底状態(s0)からエネルギーの高い励起状態(s1)に励起される。分子内振動で熱エネルギーとして放出する緩和過程を経て励起状態の最も低い準位に至り、その後、数〜数十ナノ秒という時間(蛍光寿命)の後に光子(蛍光)を放出して基底状態に戻る。2光子励起では2つの光子が1つの蛍光分子に同時に吸収されることにより励起状態に至る。2光子励起では、1光子励起に必要な波長の約2倍の波長で励起する。
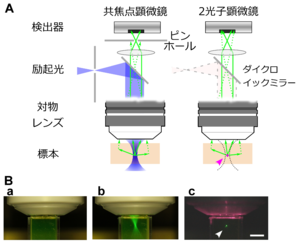
2光子顕微鏡では、標本中の焦点付近のみに位置する蛍光色素分子が励起される(赤点)。これに対して共焦点顕微鏡では励起光(青いシェードの部分)が通過する部分の分子が励起される。2光子顕微鏡では焦点付近から放出された蛍光(緑実線)に加えて、蛍光の散乱光の一部(緑点線)も検出して高感度化できる。共焦点顕微鏡では焦点以外からの蛍光はピンホールで遮られるため原理上検出できない。
蛍光分子は光子を吸収して10-15秒程度で励起状態に遷移し、10-9~10-8秒程度の時間(蛍光寿命という)ののちに光子を放出して基底状態に戻る。自然界に一般的に見られる蛍光現象は1つの光子が1つの蛍光分子に吸収される1光子励起によるものである。ところが、特殊な条件下では2個以上の光子が一度に1つの蛍光分子に吸収される多光子励起とよばれる現象が発生する(図1)。この多光子励起による蛍光を利用して蛍光分子の分布を光学的に観察する顕微鏡を多光子顕微鏡と呼んでいる。現在実装されているレーザーの性能上の制約から2個の光子が一度に吸収される2光子励起が医学・生物学研究によく用いられており、2光子顕微鏡と呼ぶことも多い。本項でも2光子励起を中心に述べる。
光子1個が持つエネルギーは波長に反比例する。1つの光子で励起するのと同等のエネルギーを2光子励起では2個の光子で与えて励起すれば良いので、1個の光子あたりのエネルギーは1光子励起の約半分でよいことになる。つまり可視光による1光子励起と同等のことが、波長が約2倍の赤外線(波長700 nm ~ )による2光子励起で行われる。
しかしながら、2個の光子が1つの蛍光分子に同時に吸収される現象は非常に生じにくく、この現象を起こすためには光子の密度つまり光の強度を瞬間的に極度に高める必要がある。そのために超短パルスレーザーが用いられる。これは時間的に光を圧縮してパルス状にすることで、瞬間的な光子密度を劇的に高めたレーザーである。典型的な市販の超短パルスレーザーで光が出ている時間(100 フェムト秒)と出ていない時間(12.5 ナノ秒)の長さの比は1:125,000 であり、いかに光子密度が時間的な圧縮により高められているかがわかる。
さらに、そのレーザー光を顕微鏡に導き対物レンズで焦点付近に集中させ、空間的にも光子密度を(断面積比で107倍程度に)高めることでようやく2光子励起が生じる。この2光子励起が非常に生じにくいことを利用して、対物レンズの焦点近傍の蛍光分子のみを励起し、光学顕微鏡の解像限界に近い高解像度の断層画像を2光子顕微鏡で得ることができる。2光子励起の生じやすさは光の強度の2乗に比例することから非線形光学現象と呼ばれる。
実際の顕微鏡では、2光子励起される焦点はスキャンニングミラーを高速で動かすことによって走査される。標本から放出された蛍光は対物レンズで集められ、光電子増倍管(photomultiplier)などで検出して、コンピュータを用いて画像を構築する。
2光子励起現象はGoeppert-Mayer によって1930年頃理論的な研究が行われた[1] 。波長可変の超短パルスレーザーの改良が進むと、とくに1990年代以降から、Denk、Webbその他の研究者によって神経科学分野における高解像度蛍光顕微鏡としての応用が進められた[2][3] 。
現在では2光子顕微鏡は各顕微鏡メーカーから市販されており、一般的な研究手段として用いられる[4][5][6] 。一方、技術的な改良や新たな応用も進められている。今後は、より散乱が少ない長波長(1000 nm ~)の励起光や赤外領域の蛍光も用いやすくなると思われ、補償光学系の導入もあわせて不規則な散乱のある組織での解像度の向上が期待される。現時点ではガルバノミラーやレゾナントスキャナによるスキャンニング(走査)が主に採用されているが、音響光学素子等の普及によって、より高速で自由なスキャンニングが今後エンドユーザーでも選択可能になっていくと予想している。実験目的に応じて、スキャンニングの高速化や広域化、ライトシート顕微鏡や電子顕微鏡との組み合わせ、超解像法との組み合わせが今後も模索されていくと思われる。
特徴
- 組織浸透性が高い
2光子顕微鏡では共焦点顕微鏡などの蛍光顕微鏡より波長が長い赤外線を励起光として用いるため組織における散乱・吸収が可視光励起より少ない。そのため一般的な蛍光顕微鏡より組織深部の観察に適している。現在では条件を最適化することにより1.6 mm程度の深部までの非侵襲的な生体脳イメージングが可能となっている[7] 。
- 組織全体の褪色が生じにくい
1光子励起では励起光が通過する地点は褪色が生じる可能性がある。2光子顕微鏡では励起は焦点付近でのみ生じるので、励起していない箇所の褪色やラジカルの発生を考慮しなくてよい。
- 内部遮蔽効果が生じにくい
蛍光色素濃度が大きい場合に、1光子励起では光路上の蛍光色素によって遮られ、励起光が焦点面に十分届かないことがあり、内部遮蔽効果と呼ばれる。2光子励起ではこの現象は回避される。
- 複数の蛍光色素の同時励起を行いやすい
蛍光色素の1光子励起の励起スペクトルをちょうど2倍したスペクトルよりも実際の2光子励起波長は短波長側に広がる傾向にある(ブルーシフトと呼ぶ)。この性質により、ひとつの波長の励起光で同時に複数の蛍光色素を励起しやすくなる。複数の蛍光色素をそれぞれ励起するために一般の蛍光顕微鏡では複数の波長の光源や励起フィルターを用意していることが多いが、2光子顕微鏡では1個のレーザーで同時励起できることも多い(ただし個別に励起したいときはデメリットにもなりうる)。
- 散乱した蛍光の利用が可能
共焦点顕微鏡は組織で散乱した蛍光は原理上検出しない。これに対して2光子顕微鏡では、励起する領域を空間的に限局して高解像度を達成するので、散乱される蛍光も含めて検出できればシグナル/ノイズ比を上げることができる。したがって高い開口数かつ視野の広い(しばしば低倍の)対物レンズが2光子励起顕微鏡において検出効率を高くする。もしくは、検出器の位置を標本から見て対物レンズの反対側(トランス側)に置くことも用途によっては可能で、対物レンズよりも開口数と視野の大きい検出用の光学系を配置することもできる。
- 空間的に限局した励起の応用
2光子励起の空間的に限局された領域のみを励起する性質がイメージング以外にも応用されている。例えば、ケージド試薬(関連事項参照)の光分解は1光子励起でも行われるが、励起光が通過する地点は全て分解されるので空間的な制限を加えることが難しい。これに対して2光子励起では1 µm3程度の非常に限局された領域のみで光分解を生じさせることができる。これを利用して、例えば着目する神経細胞のそれぞれの単一シナプスにグルタミン酸やGABAなどの神経伝達物質を投与することが可能となった[8][9] 。また、photo-activatable GFP(光活性化型GFP)などを用いることによって空間的に限局した領域のタンパク質のみを標識して経過観察することが可能である。逆に単一シナプスの蛍光タンパク質のみを褪色させ、蛍光の回復時間を測定することによって、着目するタンパク質の代謝あるいは拡散速度を求めることも行われる(FRAP: Fluorescence Recovery After Photobleaching)。
- 蛍光寿命画像顕微鏡(FLIM)やSHG顕微鏡法などとの同時使用
2光子顕微鏡ではパルスレーザーを用いるために、蛍光寿命(上述)の測定が比較的容易で、これを実現するために追加する装置が市販されている。FRET (Förster共鳴エネルギー移動)、つまり、蛍光分子同士の近接によるエネルギー移動はドナーの蛍光寿命を短くするので、この蛍光寿命画像顕微鏡法(Fluorescence Lifetime Imaging Microscopy: FLIM)を適用することによって、1種類の蛍光分子の測定で、蛍光分子の濃度によらず高い空間分解能でFRET測定が可能である。
また、2次高調波発生(Second Harmonic Generation; SHG)は結晶構造(くり返し構造)を持つ分子に当てられた入射光のちょうど半分の波長の光を放出する非線形光学現象であるが、2光子励起と共通のレーザーを用いて実施することができる。実際に、2光子顕微鏡で生体マウスの硬膜を観察した時に硬膜の自家蛍光のように見える光は、硬膜から放出された2次高調波である。このように非線形光学現象を用いる顕微鏡法を2種類以上併用して、さらに情報量の多い測定が可能となる[5] 。
関連事項
参考文献
- ↑ Goeppert-Mayer, M. (1931).
Über Elementarakte mit zwei Quantensprüngen. Annal Physik 9, 273-294. - ↑ Denk, W., Piston, D.W., and Webb, W.W. (1995)
Two-Photon Molecular Excitation in Laser-Scanning Microscopy. In: Pawley J.B. (eds) Handbook of Biological Confocal Microscopy. (Springer, Boston, MA).> - ↑
Denk, W., & Svoboda, K. (1997).
Photon upmanship: why multiphoton imaging is more than a gimmick. Neuron, 18(3), 351-7. [PubMed:9115730] [WorldCat] [DOI] - ↑ Yuste, R., and Konnerth, A. (2005).
“Imaging in Neuroscience and Development: A Laboratory Mannual”, (Cold Spring Harbor Laboratory Press). - ↑ 5.0 5.1 塗谷睦生 (2018).
非線形顕微鏡 顕微鏡学ハンドブック (朝倉書店). - ↑ 岡部繁男 (2018).
生きた個体の観察 顕微鏡学ハンドブック (朝倉書店). - ↑
Kawakami, R., Sawada, K., Kusama, Y., Fang, Y.C., Kanazawa, S., Kozawa, Y., ..., & Nemoto, T. (2015).
In vivo two-photon imaging of mouse hippocampal neurons in dentate gyrus using a light source based on a high-peak power gain-switched laser diode. Biomedical optics express, 6(3), 891-901. [PubMed:25798313] [PMC] [WorldCat] [DOI] - ↑
Matsuzaki, M., & Kasai, H. (2011).
Two-photon uncaging microscopy. Cold Spring Harbor protocols, 2011(5), pdb.prot5620. [PubMed:21536760] [WorldCat] [DOI] - ↑ 河西春郎 (2003).
新しいケイジドグルタミン酸と2光子励起法を用いた神経機能の解析. 細胞工学 22, 161-164