「脳の領域化」の版間の差分
細 →関連項目 |
|||
| (同じ利用者による、間の17版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[http://researchmap.jp/ | <font size="+1">[http://researchmap.jp/read0118148 笹井 紀明]</font><br> | ||
''奈良先端科学技術大学院大学''<br> | ''奈良先端科学技術大学院大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年7月18日 原稿完成日:20XX年X月X日<br> | ||
担当編集委員:[https://researchmap.jp/ | 担当編集委員:[https://researchmap.jp/ctx 花嶋 かりな](早稲田大学 教育・総合科学術院 先進理工学研究科)<br> | ||
</div> | </div> | ||
Regionalization of the brain) | |||
{{box|text= | {{box|text= 脳領域に存在する細胞の種類は極めて多岐にわたるが、その多様化・領域化は、脳発生の初期から起こり始めている。この項では、領域化に関与する転写因子と、その発現を誘導するオーガナイザーや分泌因子を中心に、脊椎動物の脳が神経外胚葉から各細胞が分化し、組織内で領域化されるまでの過程を中心に記述する。}}<u>(編集部コメント:…について記述すると行った表現ではなく、抄録をお願いいたします。)</u> | ||
== | == 初期胚におけるおおまかな領域の決定 == | ||
脊椎動物では、原腸形成期に胚の背側に神経板が出現し、原腸形成期の後半からOtx2(Orthodenticle Homeobox 2)という転写因子が、頭部神経板領域(将来前脳・中脳領域に分化する部分)に発現する <ref name=Acampora1995><pubmed>7588062</pubmed></ref> 。Otx2はほかに胚盤葉上層、眼にも発現しており、それぞれに特異的なエンハンサー領域が存在する <ref name=Kurokawa2004><pubmed>15201223</pubmed></ref> 。一方、後脳には別の転写因子Gbx2が発現し <ref name=Islam2006><pubmed>17067785</pubmed></ref> 、Otx2のエンハンサー領域の一部に結合してOtx2の発現領域を制限する <ref name=Inoue2012><pubmed>22566684</pubmed></ref> 。 | |||
== 2次オーガナイザー領域の形成 == | == 2次オーガナイザー領域の形成 == | ||
脳のさらなる領域化には、以下の3つのオーガナイザー領域(シグナリングセンターとして分泌因子を産生する領域)が存在し、FGFやShh、Wntなどの分泌因子を発現し、脳の領域を決定している。(なお以下のオーガナイザー領域の日本語名は、英語名を直訳した試訳である)。 | |||
=== 前部神経端 === | === 前部神経端 === | ||
Anterior Neural Ridge(ANR) | |||
この領域自体は非神経性細胞からなっているが、主にFGF8を発現しており、転写因子BF-1の発現を誘導する。BF-1はANRの機能を相補する(ANRがなくてもBF-1が発現したら終脳が正常に発生する)ため、BF-1はANRによって誘導される主要な因子である <ref name=Shimamura1997><pubmed>9226442</pubmed></ref> 。 | |||
=== Zona limitans intrathalamica === | === Zona limitans intrathalamica === | ||
ZLI | |||
この部分は、前脳から発生した大脳を2つの異なる性質を持つ領域に分ける領域である。大脳部分はプロソメアという区分に従って3つに分割することができるが、前部から順に、p3, p2, p1と分けられる領域のうち、p2とp3を分けるものがZLIである。ZLIが発現するのはソニック・ヘッジホッグ(Sonic Hedgehog; Shh)である<ref name=Kiecker2004><pubmed>15494730</pubmed></ref> 。ZLIの前後では、Shhに対する細胞の反応性が異なり、ZLIよりも前部ではDlx2が、後部ではIrx3、Gbx2の発現が誘導される。 | |||
=== 峡部オーガナイザー === | |||
Isthmic Organiser(IsO): | |||
== | Midbrain-Hindbrain Boundary(MHB):中脳/後脳境界 | ||
この領域からは、FGF8やWnt1などの分泌因子が分泌され、中脳や小脳に発現する転写因子を発現誘導する。MHBにおけるFGF8やWnt1の発現には転写因子Lmx1bが必要だと言われている <ref name=Guo2007><pubmed>17166916</pubmed></ref> 。FGF8はMHBの前後である中脳と後脳に発現する遺伝子を誘導する一方、Wnt1は細胞の増殖などに関与していると考えられている <ref name=Harada2016><pubmed>27273073</pubmed></ref> 。 | |||
== 脳の各領域に発現する転写因子 == | == 脳の各領域に発現する転写因子 == | ||
上述の2次オーガナイザー領域から分泌されたFGFやWntなどのシグナル因子により、転写因子が脳の特定の領域に発現し、各領域を特徴付けている。これらの転写因子のノックアウトマウスは、一部は脳領域の一部を欠損することになり、脳の発達または成長に大きな影響を及ぼすために胚性致死となる。一方、これらの転写因子は、免疫細胞、内分泌系、腎臓や精巣、肺などにも発現する。したがって、各遺伝子の単純なノックアウトでは、表現型が脳以外の領域にも見られるものがある(Irx3、Nkx2.1、Sim-2、Lmx1b、BF2など)。これらの例では、脳領域における機能を明らかにするために、脳特異的なノックアウト(条件付き遺伝子ノックアウト:コンディショナルノックアウト)が作成され、解析が進んでいる。 | |||
{| class="wikitable" | {| class="wikitable" | ||
! 転写因子 遺伝子名 !! 転写因子としてのクラス !! 脳の発生期における発現領域 !! 変異マウスの表現型 !! ヒト疾患との関連 !! 文献 | ! 転写因子 遺伝子名 !! 転写因子としてのクラス !! 脳の発生期における発現領域 !! 変異マウスの表現型 !! ヒト疾患との関連 !! 文献 | ||
|- | |- | ||
! | ! ARX (Aristaless-related Homeobox) | ||
| | | ホメオボックス型 || 終脳(背側)、前脳(視床) || 新生仔死亡(マウスの系統による):脳細胞の増殖抑制により、前脳が矮小化。脳領域のみのコンディショナルノックアウトでは、腹側脳領域の異常拡大。|| 精神遅滞、てんかん、など || <ref name=Bienvenu2002><pubmed>11971879</pubmed></ref> , <ref name=Kitamura2002><pubmed>12379852</pubmed></ref> , <ref name=Collombat2003><pubmed>14561778</pubmed></ref> , <ref name=Lim2019><pubmed>30659230</pubmed></ref> , <ref name=Friocourt2008><pubmed>18509041</pubmed></ref> | ||
|- | |- | ||
! | ! Dlx2 (Distal-less homeobox 2) | ||
| ホメオボックス型 || 前脳(脳室帯、脳室下帯) || Dlx1/ | | ホメオボックス型 || 前脳(脳室帯、脳室下帯) || Dlx1/2のダブルノックアウトが新生仔死亡:終脳の神経分化が抑制され、グリア細胞が増加。網膜の神経節細胞層がアポトーシスを起こす。|| Dix2遺伝子(2番染色体上)を含む領域が自閉症の発症と相関が高いことが示唆されている || <ref name=Qiu1995><pubmed>7590232</pubmed></ref> , <ref name=deMelo2005><pubmed>15604100</pubmed></ref> , <ref name=Liu2009><pubmed>18728693</pubmed></ref> , <ref name=Petryniak2007><pubmed>17678855</pubmed></ref> | ||
|- | |- | ||
! | ! Emx1 (Empty Spiracles Homeobox 1) | ||
| ホメオボックス型 || 前脳 || | | ホメオボックス型 || 前脳 || 生存可能:脳梁(corpus callosum)欠損 || カルマン症候群(Kallmann syndrome:嗅覚低下と性腺機能低下)への関与が示唆されている|| <ref name=Yoshida1997><pubmed>9006071</pubmed></ref> , <ref name=Kim2010><pubmed>20887964</pubmed></ref> , <ref name=Cecchi2000><pubmed>10906797</pubmed></ref> , <ref name=Gulisano1996><pubmed>8743751</pubmed></ref> | ||
|- | |- | ||
! | ! Emx2 (Empty Spiracles Homeobox 2) | ||
| ホメオボックス型 || 前脳 || 皮質領域の矮小化 || | | ホメオボックス型 || 前脳 || 皮質領域の矮小化 || 裂脳症(schizencephaly) || <ref name=Hamasaki2004><pubmed>15294144</pubmed></ref> , <ref name=Brunelli1996><pubmed>8528262</pubmed></ref> , <ref name=Cecchi2000><pubmed>10906797</pubmed></ref> , <ref name=Gulisano1996><pubmed>8743751</pubmed></ref> | ||
|- | |- | ||
! | ! En-1 (Engrailed homeobox-1) | ||
| ホメオボックス型 || 中脳と小脳(R1) || | | ホメオボックス型 || 中脳と小脳(R1) || 胚性致死:視蓋と小脳の発生不全 || パーキンソン病 || <ref name=Wurst1994><pubmed>7925010</pubmed></ref> , <ref name=Rekaik2015><pubmed>26459030</pubmed></ref> , <ref name=Kouwenhoven2016><pubmed>26879466</pubmed></ref> | ||
|- | |- | ||
! | ! En-2 (Engrailed homeobox-2) | ||
| ホメオボックス型 || 中脳、小脳 || 生存可能:神経行動学的、神経化学的異常 || | | ホメオボックス型 || 中脳、小脳 || 生存可能:神経行動学的、神経化学的異常 || 自閉症スペクトラム障害に関与すると示唆されている | ||
||<ref name=Cheh2006><pubmed>16935268</pubmed></ref><ref name=Benayed2005><pubmed>16252243</pubmed></ref><ref name=Genestine2015><pubmed>26220976</pubmed></ref> | || <ref name=Cheh2006><pubmed>16935268</pubmed></ref> , <ref name=Benayed2005><pubmed>16252243</pubmed></ref> , <ref name=Genestine2015><pubmed>26220976</pubmed></ref> | ||
|- | |- | ||
! | ! FEZ/FEZF1/Znf312b (Forebrain Embryonic Zinc-finger 1) | ||
| | | C2H2-type zinc フィンガー | ||
| | | 嗅球、前脳、外套層 || FEZF2とのダブルノックアウトにより、視床、大脳の発生が停止 | ||
| カルマン症候群(Kallmann syndrome):嗅覚低下と性腺機能低下 | | カルマン症候群(Kallmann syndrome):嗅覚低下と性腺機能低下 | ||
| <ref name=Hirata2006><pubmed>16971467</pubmed></ref> | | <ref name=Hirata2006><pubmed>16971467</pubmed></ref> | ||
|- | |- | ||
! | ! FoxD1/BF2 (Brain Factor-2) | ||
| | | Winged-Helix型 || 前脳 || 新生仔死亡:腎臓の間葉系間質細胞の発生に必要||胚発生期では、視床下部前部の神経前駆細胞の分化が抑制される|| <ref name=Hatini1996><pubmed>8666231</pubmed></ref> , {Newman, 2018} | ||
|- | |- | ||
! | ! FoxG1/BF-1 (Brain Factor-1) | ||
| Winged-Helix型 || 終脳 || 新生仔死亡:終脳の矮小化 || Rett症候群 ||<ref name=Xuan1995><pubmed>7605629</pubmed></ref> | | Winged-Helix型 || 終脳 || 新生仔死亡:終脳の矮小化 || Rett症候群 || <ref name=Xuan1995><pubmed>7605629</pubmed></ref> | ||
|- | |- | ||
! | ! Gbx2 (Gastrulation Brain Homeobox 2) | ||
| ホメオボックス型 || 中脳、後脳(R1-R3) || R3領域が矮小化 || 大腸癌(Colon Small Cell | | ホメオボックス型 || 中脳、後脳(R1-R3) || R3領域が矮小化 || 大腸癌(Colon Small Cell Carcinoma)、Optiz-G/BBB Syndrome(オピッツ症候群:脳、顔面、心臓、生殖器などの正中部形成不全) || <ref name=Wassarman1997><pubmed>9247335</pubmed></ref> , <ref name=Waters2006><pubmed>16651541</pubmed></ref> | ||
|- | |- | ||
! | ! Irx3 (Iroquois homeobox 3) | ||
| ホメオボックス型 || | | ホメオボックス型 || 中脳、視蓋前域、視床 || Irx5とのダブルノックアウトで心臓の一部(流出部)の形成異常が見られている || 肥満への関与が示唆されている || <ref name=Bosse1997><pubmed>9486539</pubmed></ref> , <ref name=Gaborit2012><pubmed>22992950</pubmed></ref> , <ref name=Gholamalizadeh2019><pubmed>31538128</pubmed></ref> , <ref name=deAraujo2020><pubmed>32035736</pubmed></ref> | ||
|- | |- | ||
! | ! Lhx2 (LIM/homeobox transcription factor 2) | ||
| | | LIMホメオボックス型 || 前脳 || 眼・前脳の発生、嗅神経細胞の分化異常 || (報告なし) || <ref name=Hirota2004><pubmed>15173589</pubmed></ref> , <ref name=Chou2019><pubmed>29522720</pubmed></ref> , <ref name=Porter1997><pubmed>9247336</pubmed></ref> | ||
|- | |- | ||
! | ! Lmx1b | ||
| LIMホメオボックス型 || 中脳、視蓋前域、視床 || | | LIMホメオボックス型 || 中脳、視蓋前域、視床 || Isthmic Organiserの形成が阻害される分化した糸球体上皮細胞(podocyte)の消滅|| ネイル・パテラ症候群(爪膝蓋骨症候群:爪の変形や腎臓障害など) ||<ref name=Burghardt2013><pubmed>23990680</pubmed></ref> , <ref name=Asbreuk2002><pubmed>12498783</pubmed></ref> , <ref name=Adams2000><pubmed>10751174</pubmed></ref> , <ref name=Guo2007><pubmed>17166916</pubmed></ref> | ||
|- | |- | ||
! | ! Nkx2.1 | ||
| ホメオボックス型 || 視床下部 || | | ホメオボックス型 || 視床下部 || 新生仔死亡:呼吸器官と肺の形成異常視床下部におけるメラノコルチン産生(Pomc陽性)細胞の減少" | ||
| 肺腺癌の重篤化に関わっている ||<ref name=Yuan2000><pubmed>10706142</pubmed></ref><ref name=Winslow2011><pubmed>21471965</pubmed></ref><ref><pubmed>30886014</pubmed></ref> | | 肺腺癌の重篤化に関わっている || <ref name=Yuan2000><pubmed>10706142</pubmed></ref> , <ref name=Winslow2011><pubmed>21471965</pubmed></ref> , <ref><pubmed>30886014</pubmed></ref> | ||
|- | |- | ||
! | ! Nkx6.1 | ||
| ホメオボックス型 || 中脳底板 || | | ホメオボックス型 || 中脳底板 || 膵臓のベータ細胞が減少 || Nkx6.1の強制発現ががん細胞の浸潤を防ぐ効果があると報告されている || <ref name=Sander2000><pubmed>11076772</pubmed></ref> , <ref name=Taylor2013><pubmed>24035389</pubmed></ref> | ||
|- | |- | ||
! | ! Otx2 (Orthodenticle homeobox 2) | ||
| ホメオボックス型 || 前脳、中脳 || 胚性致死:前脳、中脳欠損 || | | ホメオボックス型 || 前脳、中脳 || 胚性致死:前脳、中脳欠損 || 小眼球、網膜変性、複合下垂体ホルモン欠損症 || <ref name=Broccoli1999><pubmed>10490025</pubmed></ref> , <ref name=Vincent2014><pubmed>25293953</pubmed></ref> , <ref name=Patat2013><pubmed>24167467</pubmed></ref> , <ref name=Chassaing2012><pubmed>22577225</pubmed></ref> , <ref name=Acampora1995><pubmed>7588062</pubmed></ref> | ||
|- | |- | ||
! | ! Pax2 (Paired box gene 2) | ||
| | | paired box || 中脳、小脳領域、発生途上の眼、耳 || 耳の形成異常、視神経投射異常 || " 腎細胞においてPax2の恒常的な発現が糸球体硬化(glomerulosclerosis)を引き起こす"|| <ref name=Torres1996><pubmed>8951055</pubmed></ref> , <ref name=Patek2003><pubmed>12915483</pubmed></ref> | ||
|- | |- | ||
! | ! Sim-1 (Single-minded homolog 1) | ||
| | | bHLH-PASドメイン || 視床下部 || 新生仔死亡:視索上核(supraoptic)と室傍核(paraventricular)の形成不全 || 食欲過剰による肥満 || <ref name=Tolson2014><pubmed>24773343</pubmed></ref> , <ref name=Holder2000><pubmed>10587584</pubmed></ref> , <ref name=Michaud2001><pubmed>11448938</pubmed></ref> | ||
|- | |- | ||
! | ! "Sim-2 (Single-minded homolog 2)" | ||
| bHLH-PASドメイン || 視床下部前部 || 新生仔死亡:肺機能不全 || | | bHLH-PASドメイン || 視床下部前部 || 新生仔死亡:肺機能不全 || Sim2遺伝子の増幅によりダウン症が引き起こされると示唆されている || <ref name=Goshu2002><pubmed>12024028</pubmed></ref> , <ref name=Dahmane1995><pubmed>7568099</pubmed></ref> , <ref name=Goshu2004><pubmed>14988428</pubmed></ref> | ||
|- | |- | ||
! | ! Six3 (Sine Oculis Homeobox 3) | ||
| ホメオボックス型 || 発生初期には神経板、眼球、眼杯、中期以降は眼、耳、中脳、視蓋前側、ZLI(zona limitans | | ホメオボックス型 || 発生初期には神経板、眼球、眼杯、中期以降は眼、耳、中脳、視蓋前側、ZLI(zona limitans intrathalamica)、視床外腹側核(rostral ventral thalamus) || 眼を含む前脳の前部を欠損 || 2型全前脳胞症(Holoprosencephaly) || <ref name=Wallis1999><pubmed>10369266</pubmed></ref> , <ref name=Diacou2018><pubmed>30485816</pubmed></ref> , <ref name=Lagutin2003><pubmed>12569128</pubmed></ref> , <ref name=Liu2010><pubmed>20890044</pubmed></ref> | ||
|} | |} | ||
== 関連項目 == | == 関連項目 == | ||
* [[前後軸]] | * [[前後軸]] | ||
== | |||
< | [[ファイル:Sasai Regionalization Fig1.png|サムネイル|'''図1. 脳の領域化と、運命決定図。胚の背側からの模式図'''<br>Developmental Biology(ギルバート・バレッシ著)第11巻をもとに作成。]] | ||
[[ファイル:Sasai Regionalization Fig2.png|サムネイル|'''図2. 前後軸、背腹軸に沿った分泌因子、転写因子の一部の発現領域'''<br><ref name=Harada2016><pubmed>27273073</pubmed></ref><ref name=Martinez2013></ref><ref name=Vieira2010><pubmed>19876817</pubmed></ref> などを参考にして作成]] | |||
[[ファイル:Sasai Regionalization Fig3.png|サムネイル|'''図3. 脳で領域特異的に発現する転写因子の性質・機能と、その変異がヒトにもたらす疾患'''[https://www.omim.org OMIM(Online Mendelian Inheritance in Man)]や[https://ghr.nlm.nih.gov NIH Genetics Home Reference]を参考に作成]] | |||
各参考論文 | |||
<ref name=Bienvenu2002><pubmed>11971879</pubmed></ref> <ref name=Kitamura2002><pubmed>12379852</pubmed></ref> <ref name=Collombat2003><pubmed>14561778</pubmed></ref> <ref name=Lim2019><pubmed>30659230</pubmed></ref> <ref name=Friocourt2008><pubmed>18509041</pubmed></ref> <ref name=Qiu1995><pubmed>7590232</pubmed></ref> <ref name=de Melo2005><pubmed>15604100</pubmed></ref> <ref name=Liu2009><pubmed>18728693</pubmed></ref> <ref name=Petryniak2007><pubmed>17678855</pubmed></ref> <ref name=Yoshida1997><pubmed>9006071</pubmed></ref> <ref name=Kim2010><pubmed>20887964</pubmed></ref> <ref name=Cecchi2000><pubmed>10906797</pubmed></ref> <ref name=Gulisano1996><pubmed>8743751</pubmed></ref> <ref name=Hamasaki2004><pubmed>15294144</pubmed></ref> <ref name=Brunelli1996><pubmed>8528262</pubmed></ref> <ref name=Wurst1994><pubmed>7925010</pubmed></ref> <ref name=Rekaik2015><pubmed>26459030</pubmed></ref> <ref name=Kouwenhoven2016><pubmed>26879466</pubmed></ref> <ref name=Cheh2006><pubmed>16935268</pubmed></ref> <ref name=Benayed2005><pubmed>16252243</pubmed></ref> <ref name=Genestine2015><pubmed>26220976</pubmed></ref> <ref name=Hirata2006><pubmed>16971467</pubmed></ref> <ref name=Wassarman1997><pubmed>9247335</pubmed></ref> <ref name=Waters2006><pubmed>16651541</pubmed></ref> <ref name=Bosse1997><pubmed>9486539</pubmed></ref> <ref name=Gaborit2012><pubmed>22992950</pubmed></ref> <ref name=Gholamalizadeh2019><pubmed>31538128</pubmed></ref> <ref name=de Araujo2020><pubmed>32035736</pubmed></ref> <ref name=Hirota2004><pubmed>15173589</pubmed></ref> <ref name=Chou2019><pubmed>29522720</pubmed></ref> <ref name=Porter1997><pubmed>9247336</pubmed></ref> <ref name=Yuan2000><pubmed>10706142</pubmed></ref> <ref name=Winslow2011><pubmed>21471965</pubmed></ref> <ref name=Sander2000><pubmed>11076772</pubmed></ref> {Winslow, 2011 #58} <ref name=Taylor2013><pubmed>24035389</pubmed></ref> <ref name=Broccoli1999><pubmed>10490025</pubmed></ref> <ref name=Vincent2014><pubmed>25293953</pubmed></ref> <ref name=Patat2013><pubmed>24167467</pubmed></ref> <ref name=Chassaing2012><pubmed>22577225</pubmed></ref> <ref name=Acampora1995><pubmed>7588062</pubmed></ref> <ref name=Torres1996><pubmed>8951055</pubmed></ref> <ref name=Patek2003><pubmed>12915483</pubmed></ref> <ref name=Tolson2014><pubmed>24773343</pubmed></ref> <ref name=Holder2000><pubmed>10587584</pubmed></ref> <ref name=Michaud2001><pubmed>11448938</pubmed></ref> <ref name=Goshu2002><pubmed>12024028</pubmed></ref> <ref name=Dahmane1995><pubmed>7568099</pubmed></ref> <ref name=Goshu2004><pubmed>14988428</pubmed></ref> <ref name=Wallis1999><pubmed>10369266</pubmed></ref> <ref name=Diacou2018><pubmed>30485816</pubmed></ref> <ref name=Lagutin2003><pubmed>12569128</pubmed></ref> <ref name=Liu2010><pubmed>20890044</pubmed></ref> <ref name=Burghardt2013><pubmed>23990680</pubmed></ref> <ref name=Asbreuk2002><pubmed>12498783</pubmed></ref> <ref name=Hatini1996><pubmed>8666231</pubmed></ref> <ref name=Xuan1995><pubmed>7605629</pubmed></ref> <ref name=Guo2007><pubmed>17166916</pubmed></ref> <ref name=Adams2000><pubmed>10751174</pubmed></ref> | |||
2020年7月21日 (火) 23:21時点における版
笹井 紀明
奈良先端科学技術大学院大学
DOI:10.14931/bsd.9270 原稿受付日:2020年7月18日 原稿完成日:20XX年X月X日
担当編集委員:花嶋 かりな(早稲田大学 教育・総合科学術院 先進理工学研究科)
Regionalization of the brain)
脳領域に存在する細胞の種類は極めて多岐にわたるが、その多様化・領域化は、脳発生の初期から起こり始めている。この項では、領域化に関与する転写因子と、その発現を誘導するオーガナイザーや分泌因子を中心に、脊椎動物の脳が神経外胚葉から各細胞が分化し、組織内で領域化されるまでの過程を中心に記述する。
(編集部コメント:…について記述すると行った表現ではなく、抄録をお願いいたします。)
初期胚におけるおおまかな領域の決定
脊椎動物では、原腸形成期に胚の背側に神経板が出現し、原腸形成期の後半からOtx2(Orthodenticle Homeobox 2)という転写因子が、頭部神経板領域(将来前脳・中脳領域に分化する部分)に発現する [1] 。Otx2はほかに胚盤葉上層、眼にも発現しており、それぞれに特異的なエンハンサー領域が存在する [2] 。一方、後脳には別の転写因子Gbx2が発現し [3] 、Otx2のエンハンサー領域の一部に結合してOtx2の発現領域を制限する [4] 。
2次オーガナイザー領域の形成
脳のさらなる領域化には、以下の3つのオーガナイザー領域(シグナリングセンターとして分泌因子を産生する領域)が存在し、FGFやShh、Wntなどの分泌因子を発現し、脳の領域を決定している。(なお以下のオーガナイザー領域の日本語名は、英語名を直訳した試訳である)。
前部神経端
Anterior Neural Ridge(ANR) この領域自体は非神経性細胞からなっているが、主にFGF8を発現しており、転写因子BF-1の発現を誘導する。BF-1はANRの機能を相補する(ANRがなくてもBF-1が発現したら終脳が正常に発生する)ため、BF-1はANRによって誘導される主要な因子である [5] 。
Zona limitans intrathalamica
ZLI この部分は、前脳から発生した大脳を2つの異なる性質を持つ領域に分ける領域である。大脳部分はプロソメアという区分に従って3つに分割することができるが、前部から順に、p3, p2, p1と分けられる領域のうち、p2とp3を分けるものがZLIである。ZLIが発現するのはソニック・ヘッジホッグ(Sonic Hedgehog; Shh)である[6] 。ZLIの前後では、Shhに対する細胞の反応性が異なり、ZLIよりも前部ではDlx2が、後部ではIrx3、Gbx2の発現が誘導される。
峡部オーガナイザー
Isthmic Organiser(IsO): Midbrain-Hindbrain Boundary(MHB):中脳/後脳境界 この領域からは、FGF8やWnt1などの分泌因子が分泌され、中脳や小脳に発現する転写因子を発現誘導する。MHBにおけるFGF8やWnt1の発現には転写因子Lmx1bが必要だと言われている [7] 。FGF8はMHBの前後である中脳と後脳に発現する遺伝子を誘導する一方、Wnt1は細胞の増殖などに関与していると考えられている [8] 。
脳の各領域に発現する転写因子
上述の2次オーガナイザー領域から分泌されたFGFやWntなどのシグナル因子により、転写因子が脳の特定の領域に発現し、各領域を特徴付けている。これらの転写因子のノックアウトマウスは、一部は脳領域の一部を欠損することになり、脳の発達または成長に大きな影響を及ぼすために胚性致死となる。一方、これらの転写因子は、免疫細胞、内分泌系、腎臓や精巣、肺などにも発現する。したがって、各遺伝子の単純なノックアウトでは、表現型が脳以外の領域にも見られるものがある(Irx3、Nkx2.1、Sim-2、Lmx1b、BF2など)。これらの例では、脳領域における機能を明らかにするために、脳特異的なノックアウト(条件付き遺伝子ノックアウト:コンディショナルノックアウト)が作成され、解析が進んでいる。
| 転写因子 遺伝子名 | 転写因子としてのクラス | 脳の発生期における発現領域 | 変異マウスの表現型 | ヒト疾患との関連 | 文献 |
|---|---|---|---|---|---|
| ARX (Aristaless-related Homeobox) | ホメオボックス型 | 終脳(背側)、前脳(視床) | 新生仔死亡(マウスの系統による):脳細胞の増殖抑制により、前脳が矮小化。脳領域のみのコンディショナルノックアウトでは、腹側脳領域の異常拡大。 | 精神遅滞、てんかん、など | [9] , [10] , [11] , [12] , [13] |
| Dlx2 (Distal-less homeobox 2) | ホメオボックス型 | 前脳(脳室帯、脳室下帯) | Dlx1/2のダブルノックアウトが新生仔死亡:終脳の神経分化が抑制され、グリア細胞が増加。網膜の神経節細胞層がアポトーシスを起こす。 | Dix2遺伝子(2番染色体上)を含む領域が自閉症の発症と相関が高いことが示唆されている | [14] , [15] , [16] , [17] |
| Emx1 (Empty Spiracles Homeobox 1) | ホメオボックス型 | 前脳 | 生存可能:脳梁(corpus callosum)欠損 | カルマン症候群(Kallmann syndrome:嗅覚低下と性腺機能低下)への関与が示唆されている | [18] , [19] , [20] , [21] |
| Emx2 (Empty Spiracles Homeobox 2) | ホメオボックス型 | 前脳 | 皮質領域の矮小化 | 裂脳症(schizencephaly) | [22] , [23] , [20] , [21] |
| En-1 (Engrailed homeobox-1) | ホメオボックス型 | 中脳と小脳(R1) | 胚性致死:視蓋と小脳の発生不全 | パーキンソン病 | [24] , [25] , [26] |
| En-2 (Engrailed homeobox-2) | ホメオボックス型 | 中脳、小脳 | 生存可能:神経行動学的、神経化学的異常 | 自閉症スペクトラム障害に関与すると示唆されている | [27] , [28] , [29] |
| FEZ/FEZF1/Znf312b (Forebrain Embryonic Zinc-finger 1) | C2H2-type zinc フィンガー | 嗅球、前脳、外套層 | FEZF2とのダブルノックアウトにより、視床、大脳の発生が停止 | カルマン症候群(Kallmann syndrome):嗅覚低下と性腺機能低下 | [30] |
| FoxD1/BF2 (Brain Factor-2) | Winged-Helix型 | 前脳 | 新生仔死亡:腎臓の間葉系間質細胞の発生に必要 | 胚発生期では、視床下部前部の神経前駆細胞の分化が抑制される | [31] , {Newman, 2018} |
| FoxG1/BF-1 (Brain Factor-1) | Winged-Helix型 | 終脳 | 新生仔死亡:終脳の矮小化 | Rett症候群 | [32] |
| Gbx2 (Gastrulation Brain Homeobox 2) | ホメオボックス型 | 中脳、後脳(R1-R3) | R3領域が矮小化 | 大腸癌(Colon Small Cell Carcinoma)、Optiz-G/BBB Syndrome(オピッツ症候群:脳、顔面、心臓、生殖器などの正中部形成不全) | [33] , [34] |
| Irx3 (Iroquois homeobox 3) | ホメオボックス型 | 中脳、視蓋前域、視床 | Irx5とのダブルノックアウトで心臓の一部(流出部)の形成異常が見られている | 肥満への関与が示唆されている | [35] , [36] , [37] , [38] |
| Lhx2 (LIM/homeobox transcription factor 2) | LIMホメオボックス型 | 前脳 | 眼・前脳の発生、嗅神経細胞の分化異常 | (報告なし) | [39] , [40] , [41] |
| Lmx1b | LIMホメオボックス型 | 中脳、視蓋前域、視床 | Isthmic Organiserの形成が阻害される分化した糸球体上皮細胞(podocyte)の消滅 | ネイル・パテラ症候群(爪膝蓋骨症候群:爪の変形や腎臓障害など) | [42] , [43] , [44] , [7] |
| Nkx2.1 | ホメオボックス型 | 視床下部 | 新生仔死亡:呼吸器官と肺の形成異常視床下部におけるメラノコルチン産生(Pomc陽性)細胞の減少" | 肺腺癌の重篤化に関わっている | [45] , [46] , [47] |
| Nkx6.1 | ホメオボックス型 | 中脳底板 | 膵臓のベータ細胞が減少 | Nkx6.1の強制発現ががん細胞の浸潤を防ぐ効果があると報告されている | [48] , [49] |
| Otx2 (Orthodenticle homeobox 2) | ホメオボックス型 | 前脳、中脳 | 胚性致死:前脳、中脳欠損 | 小眼球、網膜変性、複合下垂体ホルモン欠損症 | [50] , [51] , [52] , [53] , [1] |
| Pax2 (Paired box gene 2) | paired box | 中脳、小脳領域、発生途上の眼、耳 | 耳の形成異常、視神経投射異常 | " 腎細胞においてPax2の恒常的な発現が糸球体硬化(glomerulosclerosis)を引き起こす" | [54] , [55] |
| Sim-1 (Single-minded homolog 1) | bHLH-PASドメイン | 視床下部 | 新生仔死亡:視索上核(supraoptic)と室傍核(paraventricular)の形成不全 | 食欲過剰による肥満 | [56] , [57] , [58] |
| "Sim-2 (Single-minded homolog 2)" | bHLH-PASドメイン | 視床下部前部 | 新生仔死亡:肺機能不全 | Sim2遺伝子の増幅によりダウン症が引き起こされると示唆されている | [59] , [60] , [61] |
| Six3 (Sine Oculis Homeobox 3) | ホメオボックス型 | 発生初期には神経板、眼球、眼杯、中期以降は眼、耳、中脳、視蓋前側、ZLI(zona limitans intrathalamica)、視床外腹側核(rostral ventral thalamus) | 眼を含む前脳の前部を欠損 | 2型全前脳胞症(Holoprosencephaly) | [62] , [63] , [64] , [65] |
関連項目
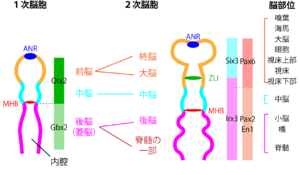
Developmental Biology(ギルバート・バレッシ著)第11巻をもとに作成。
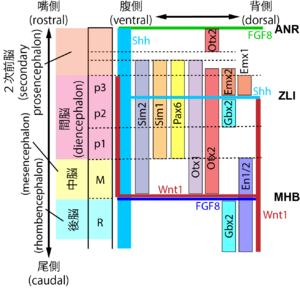
[8][66][67] などを参考にして作成
各参考論文
[9] [10] [11] [12] [13] [14] 引用エラー: <ref> タグ内の引数が無効です [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [33] [34] [35] [36] [37] 引用エラー: <ref> タグ内の引数が無効です [39] [40] [41] [45] [46] [48] {Winslow, 2011 #58} [49] [50] [51] [52] [53] [1] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [42] [43] [31] [32] [7] [44]
- ↑ 1.0 1.1 1.2
Acampora, D., Mazan, S., Lallemand, Y., Avantaggiato, V., Maury, M., Simeone, A., & Brûlet, P. (1995).
Forebrain and midbrain regions are deleted in Otx2-/- mutants due to a defective anterior neuroectoderm specification during gastrulation. Development (Cambridge, England), 121(10), 3279-90. [PubMed:7588062] [WorldCat] - ↑
Kurokawa, D., Takasaki, N., Kiyonari, H., Nakayama, R., Kimura-Yoshida, C., Matsuo, I., & Aizawa, S. (2004).
Regulation of Otx2 expression and its functions in mouse epiblast and anterior neuroectoderm. Development (Cambridge, England), 131(14), 3307-17. [PubMed:15201223] [WorldCat] [DOI] - ↑
Islam, M.E., Kikuta, H., Inoue, F., Kanai, M., Kawakami, A., Parvin, M.S., ..., & Yamasu, K. (2006).
Three enhancer regions regulate gbx2 gene expression in the isthmic region during zebrafish development. Mechanisms of development, 123(12), 907-24. [PubMed:17067785] [WorldCat] [DOI] - ↑
Inoue, F., Kurokawa, D., Takahashi, M., & Aizawa, S. (2012).
Gbx2 directly restricts Otx2 expression to forebrain and midbrain, competing with class III POU factors. Molecular and cellular biology, 32(13), 2618-27. [PubMed:22566684] [PMC] [WorldCat] [DOI] - ↑
Shimamura, K., & Rubenstein, J.L. (1997).
Inductive interactions direct early regionalization of the mouse forebrain. Development (Cambridge, England), 124(14), 2709-18. [PubMed:9226442] [WorldCat] - ↑
Kiecker, C., & Lumsden, A. (2004).
Hedgehog signaling from the ZLI regulates diencephalic regional identity. Nature neuroscience, 7(11), 1242-9. [PubMed:15494730] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Guo, C., Qiu, H.Y., Huang, Y., Chen, H., Yang, R.Q., Chen, S.D., ..., & Ding, Y.Q. (2007).
Lmx1b is essential for Fgf8 and Wnt1 expression in the isthmic organizer during tectum and cerebellum development in mice. Development (Cambridge, England), 134(2), 317-25. [PubMed:17166916] [WorldCat] [DOI] - ↑ 8.0 8.1
Harada, H., Sato, T., & Nakamura, H. (2016).
Fgf8 signaling for development of the midbrain and hindbrain. Development, growth & differentiation, 58(5), 437-45. [PubMed:27273073] [WorldCat] [DOI] - ↑ 9.0 9.1
Bienvenu, T., Poirier, K., Friocourt, G., Bahi, N., Beaumont, D., Fauchereau, F., ..., & Chelly, J. (2002).
ARX, a novel Prd-class-homeobox gene highly expressed in the telencephalon, is mutated in X-linked mental retardation. Human molecular genetics, 11(8), 981-91. [PubMed:11971879] [WorldCat] [DOI] - ↑ 10.0 10.1
Kitamura, K., Yanazawa, M., Sugiyama, N., Miura, H., Iizuka-Kogo, A., Kusaka, M., ..., & Morohashi, K. (2002).
Mutation of ARX causes abnormal development of forebrain and testes in mice and X-linked lissencephaly with abnormal genitalia in humans. Nature genetics, 32(3), 359-69. [PubMed:12379852] [WorldCat] [DOI] - ↑ 11.0 11.1
Collombat, P., Mansouri, A., Hecksher-Sorensen, J., Serup, P., Krull, J., Gradwohl, G., & Gruss, P. (2003).
Opposing actions of Arx and Pax4 in endocrine pancreas development. Genes & development, 17(20), 2591-603. [PubMed:14561778] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Lim, Y., Cho, I.T., Shi, X., Grinspan, J.B., Cho, G., & Golden, J.A. (2019).
Arx Expression Suppresses Ventralization of the Developing Dorsal Forebrain. Scientific reports, 9(1), 226. [PubMed:30659230] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Friocourt, G., Kanatani, S., Tabata, H., Yozu, M., Takahashi, T., Antypa, M., ..., & Parnavelas, J.G. (2008).
Cell-autonomous roles of ARX in cell proliferation and neuronal migration during corticogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(22), 5794-805. [PubMed:18509041] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1
Qiu, M., Bulfone, A., Martinez, S., Meneses, J.J., Shimamura, K., Pedersen, R.A., & Rubenstein, J.L. (1995).
Null mutation of Dlx-2 results in abnormal morphogenesis of proximal first and second branchial arch derivatives and abnormal differentiation in the forebrain. Genes & development, 9(20), 2523-38. [PubMed:7590232] [WorldCat] [DOI] - ↑
de Melo, J., Du, G., Fonseca, M., Gillespie, L.A., Turk, W.J., Rubenstein, J.L., & Eisenstat, D.D. (2005).
Dlx1 and Dlx2 function is necessary for terminal differentiation and survival of late-born retinal ganglion cells in the developing mouse retina. Development (Cambridge, England), 132(2), 311-22. [PubMed:15604100] [WorldCat] [DOI] - ↑ 16.0 16.1
Liu, X., Novosedlik, N., Wang, A., Hudson, M.L., Cohen, I.L., Chudley, A.E., ..., & Holden, J.J. (2009).
The DLX1and DLX2 genes and susceptibility to autism spectrum disorders. European journal of human genetics : EJHG, 17(2), 228-35. [PubMed:18728693] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Petryniak, M.A., Potter, G.B., Rowitch, D.H., & Rubenstein, J.L. (2007).
Dlx1 and Dlx2 control neuronal versus oligodendroglial cell fate acquisition in the developing forebrain. Neuron, 55(3), 417-33. [PubMed:17678855] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Yoshida, M., Suda, Y., Matsuo, I., Miyamoto, N., Takeda, N., Kuratani, S., & Aizawa, S. (1997).
Emx1 and Emx2 functions in development of dorsal telencephalon. Development (Cambridge, England), 124(1), 101-11. [PubMed:9006071] [WorldCat] - ↑ 19.0 19.1
Kim, H.G., Ahn, J.W., Kurth, I., Ullmann, R., Kim, H.T., Kulharya, A., ..., & Layman, L.C. (2010).
WDR11, a WD protein that interacts with transcription factor EMX1, is mutated in idiopathic hypogonadotropic hypogonadism and Kallmann syndrome. American journal of human genetics, 87(4), 465-79. [PubMed:20887964] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
Cecchi, C., & Boncinelli, E. (2000).
Emx homeogenes and mouse brain development. Trends in neurosciences, 23(8), 347-52. [PubMed:10906797] [WorldCat] [DOI] - ↑ 21.0 21.1 21.2
Gulisano, M., Broccoli, V., Pardini, C., & Boncinelli, E. (1996).
Emx1 and Emx2 show different patterns of expression during proliferation and differentiation of the developing cerebral cortex in the mouse. The European journal of neuroscience, 8(5), 1037-50. [PubMed:8743751] [WorldCat] [DOI] - ↑ 22.0 22.1
Hamasaki, T., Leingärtner, A., Ringstedt, T., & O'Leary, D.D. (2004).
EMX2 regulates sizes and positioning of the primary sensory and motor areas in neocortex by direct specification of cortical progenitors. Neuron, 43(3), 359-72. [PubMed:15294144] [WorldCat] [DOI] - ↑ 23.0 23.1
Brunelli, S., Faiella, A., Capra, V., Nigro, V., Simeone, A., Cama, A., & Boncinelli, E. (1996).
Germline mutations in the homeobox gene EMX2 in patients with severe schizencephaly. Nature genetics, 12(1), 94-6. [PubMed:8528262] [WorldCat] [DOI] - ↑ 24.0 24.1
Wurst, W., Auerbach, A.B., & Joyner, A.L. (1994).
Multiple developmental defects in Engrailed-1 mutant mice: an early mid-hindbrain deletion and patterning defects in forelimbs and sternum. Development (Cambridge, England), 120(7), 2065-75. [PubMed:7925010] [WorldCat] - ↑ 25.0 25.1
Rekaik, H., Blaudin de Thé, F.X., Prochiantz, A., Fuchs, J., & Joshi, R.L. (2015).
Dissecting the role of Engrailed in adult dopaminergic neurons--Insights into Parkinson disease pathogenesis. FEBS letters, 589(24 Pt A), 3786-94. [PubMed:26459030] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1
Kouwenhoven, W.M., Veenvliet, J.V., van Hooft, J.A., van der Heide, L.P., & Smidt, M.P. (2016).
Engrailed 1 shapes the dopaminergic and serotonergic landscape through proper isthmic organizer maintenance and function. Biology open, 5(3), 279-88. [PubMed:26879466] [PMC] [WorldCat] [DOI] - ↑ 27.0 27.1
Cheh, M.A., Millonig, J.H., Roselli, L.M., Ming, X., Jacobsen, E., Kamdar, S., & Wagner, G.C. (2006).
En2 knockout mice display neurobehavioral and neurochemical alterations relevant to autism spectrum disorder. Brain research, 1116(1), 166-76. [PubMed:16935268] [WorldCat] [DOI] - ↑ 28.0 28.1
Benayed, R., Gharani, N., Rossman, I., Mancuso, V., Lazar, G., Kamdar, S., ..., & Millonig, J.H. (2005).
Support for the homeobox transcription factor gene ENGRAILED 2 as an autism spectrum disorder susceptibility locus. American journal of human genetics, 77(5), 851-68. [PubMed:16252243] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Genestine, M., Lin, L., Durens, M., Yan, Y., Jiang, Y., Prem, S., ..., & DiCicco-Bloom, E. (2015).
Engrailed-2 (En2) deletion produces multiple neurodevelopmental defects in monoamine systems, forebrain structures and neurogenesis and behavior. Human molecular genetics, 24(20), 5805-27. [PubMed:26220976] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Hirata, T., Nakazawa, M., Muraoka, O., Nakayama, R., Suda, Y., & Hibi, M. (2006).
Zinc-finger genes Fez and Fez-like function in the establishment of diencephalon subdivisions. Development (Cambridge, England), 133(20), 3993-4004. [PubMed:16971467] [WorldCat] [DOI] - ↑ 31.0 31.1
Hatini, V., Huh, S.O., Herzlinger, D., Soares, V.C., & Lai, E. (1996).
Essential role of stromal mesenchyme in kidney morphogenesis revealed by targeted disruption of Winged Helix transcription factor BF-2. Genes & development, 10(12), 1467-78. [PubMed:8666231] [WorldCat] [DOI] - ↑ 32.0 32.1
Xuan, S., Baptista, C.A., Balas, G., Tao, W., Soares, V.C., & Lai, E. (1995).
Winged helix transcription factor BF-1 is essential for the development of the cerebral hemispheres. Neuron, 14(6), 1141-52. [PubMed:7605629] [WorldCat] [DOI] - ↑ 33.0 33.1
Wassarman, K.M., Lewandoski, M., Campbell, K., Joyner, A.L., Rubenstein, J.L., Martinez, S., & Martin, G.R. (1997).
Specification of the anterior hindbrain and establishment of a normal mid/hindbrain organizer is dependent on Gbx2 gene function. Development (Cambridge, England), 124(15), 2923-34. [PubMed:9247335] [WorldCat] - ↑ 34.0 34.1
Waters, S.T., & Lewandoski, M. (2006).
A threshold requirement for Gbx2 levels in hindbrain development. Development (Cambridge, England), 133(10), 1991-2000. [PubMed:16651541] [WorldCat] [DOI] - ↑ 35.0 35.1
Bosse, A., Zülch, A., Becker, M.B., Torres, M., Gómez-Skarmeta, J.L., Modolell, J., & Gruss, P. (1997).
Identification of the vertebrate Iroquois homeobox gene family with overlapping expression during early development of the nervous system. Mechanisms of development, 69(1-2), 169-81. [PubMed:9486539] [WorldCat] [DOI] - ↑ 36.0 36.1
Gaborit, N., Sakuma, R., Wylie, J.N., Kim, K.H., Zhang, S.S., Hui, C.C., & Bruneau, B.G. (2012).
Cooperative and antagonistic roles for Irx3 and Irx5 in cardiac morphogenesis and postnatal physiology. Development (Cambridge, England), 139(21), 4007-19. [PubMed:22992950] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1
Gholamalizadeh, M., Jarrahi, A.M., Akbari, M.E., Rezaei, S., Doaei, S., Mokhtari, Z., & Torki, A. (2019).
The possible mechanisms of the effects of IRX3 gene on body weight: an overview. Archives of medical sciences. Atherosclerotic diseases, 4, e225-e230. [PubMed:31538128] [PMC] [WorldCat] [DOI] - ↑
de Araújo, T.M., & Velloso, L.A. (2020).
Hypothalamic IRX3: A New Player in the Development of Obesity. Trends in endocrinology and metabolism: TEM, 31(5), 368-377. [PubMed:32035736] [WorldCat] [DOI] - ↑ 39.0 39.1
Hirota, J., & Mombaerts, P. (2004).
The LIM-homeodomain protein Lhx2 is required for complete development of mouse olfactory sensory neurons. Proceedings of the National Academy of Sciences of the United States of America, 101(23), 8751-5. [PubMed:15173589] [PMC] [WorldCat] [DOI] - ↑ 40.0 40.1
Chou, S.J., & Tole, S. (2019).
Lhx2, an evolutionarily conserved, multifunctional regulator of forebrain development. Brain research, 1705, 1-14. [PubMed:29522720] [WorldCat] [DOI] - ↑ 41.0 41.1
Porter, F.D., Drago, J., Xu, Y., Cheema, S.S., Wassif, C., Huang, S.P., ..., & Westphal, H. (1997).
Lhx2, a LIM homeobox gene, is required for eye, forebrain, and definitive erythrocyte development. Development (Cambridge, England), 124(15), 2935-44. [PubMed:9247336] [WorldCat] - ↑ 42.0 42.1
Burghardt, T., Kastner, J., Suleiman, H., Rivera-Milla, E., Stepanova, N., Lottaz, C., ..., & Witzgall, R. (2013).
LMX1B is essential for the maintenance of differentiated podocytes in adult kidneys. Journal of the American Society of Nephrology : JASN, 24(11), 1830-48. [PubMed:23990680] [PMC] [WorldCat] [DOI] - ↑ 43.0 43.1
Asbreuk, C.H., Vogelaar, C.F., Hellemons, A., Smidt, M.P., & Burbach, J.P. (2002).
CNS expression pattern of Lmx1b and coexpression with ptx genes suggest functional cooperativity in the development of forebrain motor control systems. Molecular and cellular neurosciences, 21(3), 410-20. [PubMed:12498783] [WorldCat] [DOI] - ↑ 44.0 44.1
Adams, K.A., Maida, J.M., Golden, J.A., & Riddle, R.D. (2000).
The transcription factor Lmx1b maintains Wnt1 expression within the isthmic organizer. Development (Cambridge, England), 127(9), 1857-67. [PubMed:10751174] [WorldCat] - ↑ 45.0 45.1
Yuan, B., Li, C., Kimura, S., Engelhardt, R.T., Smith, B.R., & Minoo, P. (2000).
Inhibition of distal lung morphogenesis in Nkx2.1(-/-) embryos. Developmental dynamics : an official publication of the American Association of Anatomists, 217(2), 180-90. [PubMed:10706142] [WorldCat] [DOI] - ↑ 46.0 46.1
Winslow, M.M., Dayton, T.L., Verhaak, R.G., Kim-Kiselak, C., Snyder, E.L., Feldser, D.M., ..., & Jacks, T. (2011).
Suppression of lung adenocarcinoma progression by Nkx2-1. Nature, 473(7345), 101-4. [PubMed:21471965] [PMC] [WorldCat] [DOI] - ↑
Orquera, D.P., Tavella, M.B., de Souza, F.S.J., Nasif, S., Low, M.J., & Rubinstein, M. (2019).
The Homeodomain Transcription Factor NKX2.1 Is Essential for the Early Specification of Melanocortin Neuron Identity and Activates Pomc Expression in the Developing Hypothalamus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 39(21), 4023-4035. [PubMed:30886014] [PMC] [WorldCat] [DOI] - ↑ 48.0 48.1
Sander, M., Sussel, L., Conners, J., Scheel, D., Kalamaras, J., Dela Cruz, F., ..., & German, M. (2000).
Homeobox gene Nkx6.1 lies downstream of Nkx2.2 in the major pathway of beta-cell formation in the pancreas. Development (Cambridge, England), 127(24), 5533-40. [PubMed:11076772] [WorldCat] - ↑ 49.0 49.1
Taylor, B.L., Liu, F.F., & Sander, M. (2013).
Nkx6.1 is essential for maintaining the functional state of pancreatic beta cells. Cell reports, 4(6), 1262-75. [PubMed:24035389] [PMC] [WorldCat] [DOI] - ↑ 50.0 50.1
Broccoli, V., Boncinelli, E., & Wurst, W. (1999).
The caudal limit of Otx2 expression positions the isthmic organizer. Nature, 401(6749), 164-8. [PubMed:10490025] [WorldCat] [DOI] - ↑ 51.0 51.1
Vincent, A., Forster, N., Maynes, J.T., Paton, T.A., Billingsley, G., Roslin, N.M., ..., & Héon, E. (2014).
OTX2 mutations cause autosomal dominant pattern dystrophy of the retinal pigment epithelium. Journal of medical genetics, 51(12), 797-805. [PubMed:25293953] [WorldCat] [DOI] - ↑ 52.0 52.1
Patat, O., van Ravenswaaij-Arts, C.M., Tantau, J., Corsten-Janssen, N., van Tintelen, J.P., Dijkhuizen, T., ..., & Chassaing, N. (2013).
Otocephaly-Dysgnathia Complex: Description of Four Cases and Confirmation of the Role of OTX2. Molecular syndromology, 4(6), 302-5. [PubMed:24167467] [PMC] [WorldCat] [DOI] - ↑ 53.0 53.1
Chassaing, N., Sorrentino, S., Davis, E.E., Martin-Coignard, D., Iacovelli, A., Paznekas, W., ..., & Jabs, E.W. (2012).
OTX2 mutations contribute to the otocephaly-dysgnathia complex. Journal of medical genetics, 49(6), 373-9. [PubMed:22577225] [WorldCat] [DOI] - ↑ 54.0 54.1
Torres, M., Gómez-Pardo, E., & Gruss, P. (1996).
Pax2 contributes to inner ear patterning and optic nerve trajectory. Development (Cambridge, England), 122(11), 3381-91. [PubMed:8951055] [WorldCat] - ↑ 55.0 55.1
Patek, C.E., Fleming, S., Miles, C.G., Bellamy, C.O., Ladomery, M., Spraggon, L., ..., & Hooper, M.L. (2003).
Murine Denys-Drash syndrome: evidence of podocyte de-differentiation and systemic mediation of glomerulosclerosis. Human molecular genetics, 12(18), 2379-94. [PubMed:12915483] [WorldCat] [DOI] - ↑ 56.0 56.1
Tolson, K.P., Gemelli, T., Meyer, D., Yazdani, U., Kozlitina, J., & Zinn, A.R. (2014).
Inducible neuronal inactivation of Sim1 in adult mice causes hyperphagic obesity. Endocrinology, 155(7), 2436-44. [PubMed:24773343] [PMC] [WorldCat] [DOI] - ↑ 57.0 57.1
Holder, J.L., Butte, N.F., & Zinn, A.R. (2000).
Profound obesity associated with a balanced translocation that disrupts the SIM1 gene. Human molecular genetics, 9(1), 101-8. [PubMed:10587584] [WorldCat] [DOI] - ↑ 58.0 58.1
Michaud, J.L., Boucher, F., Melnyk, A., Gauthier, F., Goshu, E., Lévy, E., ..., & Fan, C.M. (2001).
Sim1 haploinsufficiency causes hyperphagia, obesity and reduction of the paraventricular nucleus of the hypothalamus. Human molecular genetics, 10(14), 1465-73. [PubMed:11448938] [WorldCat] [DOI] - ↑ 59.0 59.1
Goshu, E., Jin, H., Fasnacht, R., Sepenski, M., Michaud, J.L., & Fan, C.M. (2002).
Sim2 mutants have developmental defects not overlapping with those of Sim1 mutants. Molecular and cellular biology, 22(12), 4147-57. [PubMed:12024028] [PMC] [WorldCat] [DOI] - ↑ 60.0 60.1
Dahmane, N., Charron, G., Lopes, C., Yaspo, M.L., Maunoury, C., Decorte, L., ..., & Delabar, J.M. (1995).
Down syndrome-critical region contains a gene homologous to Drosophila sim expressed during rat and human central nervous system development. Proceedings of the National Academy of Sciences of the United States of America, 92(20), 9191-5. [PubMed:7568099] [PMC] [WorldCat] [DOI] - ↑ 61.0 61.1
Goshu, E., Jin, H., Lovejoy, J., Marion, J.F., Michaud, J.L., & Fan, C.M. (2004).
Sim2 contributes to neuroendocrine hormone gene expression in the anterior hypothalamus. Molecular endocrinology (Baltimore, Md.), 18(5), 1251-62. [PubMed:14988428] [WorldCat] [DOI] - ↑ 62.0 62.1
Wallis, D.E., Roessler, E., Hehr, U., Nanni, L., Wiltshire, T., Richieri-Costa, A., ..., & Muenke, M. (1999).
Mutations in the homeodomain of the human SIX3 gene cause holoprosencephaly. Nature genetics, 22(2), 196-8. [PubMed:10369266] [WorldCat] [DOI] - ↑ 63.0 63.1
Diacou, R., Zhao, Y., Zheng, D., Cvekl, A., & Liu, W. (2018).
Six3 and Six6 Are Jointly Required for the Maintenance of Multipotent Retinal Progenitors through Both Positive and Negative Regulation. Cell reports, 25(9), 2510-2523.e4. [PubMed:30485816] [PMC] [WorldCat] [DOI] - ↑ 64.0 64.1
Lagutin, O.V., Zhu, C.C., Kobayashi, D., Topczewski, J., Shimamura, K., Puelles, L., ..., & Oliver, G. (2003).
Six3 repression of Wnt signaling in the anterior neuroectoderm is essential for vertebrate forebrain development. Genes & development, 17(3), 368-79. [PubMed:12569128] [PMC] [WorldCat] [DOI] - ↑ 65.0 65.1
Liu, W., Lagutin, O., Swindell, E., Jamrich, M., & Oliver, G. (2010).
Neuroretina specification in mouse embryos requires Six3-mediated suppression of Wnt8b in the anterior neural plate. The Journal of clinical investigation, 120(10), 3568-77. [PubMed:20890044] [PMC] [WorldCat] [DOI] - ↑ 引用エラー: 無効な
<ref>タグです。「Martinez2013」という名前の注釈に対するテキストが指定されていません - ↑
Vieira, C., Pombero, A., García-Lopez, R., Gimeno, L., Echevarria, D., & Martínez, S. (2010).
Molecular mechanisms controlling brain development: an overview of neuroepithelial secondary organizers. The International journal of developmental biology, 54(1), 7-20. [PubMed:19876817] [WorldCat] [DOI]