「Αシヌクレイン」の版間の差分
細 →プリオン様伝播 |
細編集の要約なし |
||
| (同じ利用者による、間の11版が非表示) | |||
| 1行目: | 1行目: | ||
αシヌクレイン | |||
英語名:α-Synuclein/Alpha-Synuclein | |||
ドイツ語:α-Synuklein/Alfa-Synuklein | |||
長谷川 隆文 | |||
東北大学大学院医学系研究科 神経・感覚器病態学講座 神経内科学分野 | |||
{{box|text= | {{box|text= αシヌクレインはSNCA遺伝子(4q21.3-q22)によりコードされる140アミノ酸からなる分子量14.5 kDaのタンパクである。中枢神経系なかでもシナプス前末端に豊富に存在し、シナプス機能制御や神経可塑性に関与していると推定されている。SNCA遺伝子のミスセンス変異・遺伝子重複は遺伝性パーキンソン病(PARK1/4)を発症させる。また、孤発性パーキンソン病およびLewy小体型認知症の神経細胞内にみられるLewy小体、および多系統萎縮症のオリゴデンドロサイト内にみられるグリア細胞内封入体(Glial cytoplasmic inclusion)の主要構成成分は、高度にリン酸化し異常凝集したαシヌクレインであることが知られている。凝集したαシヌクレインは細胞毒性を有し、同分子はシヌクレイノパチー(Synucleinopathy)と総称される上記疾患群の病態において中心的役割を担うと考えられている。}} | ||
== 歴史的背景 == | == 歴史的背景 == | ||
シヌクレインは、北東太平洋に生息するゴマフシビレエイTorpedo californicaの発電器官由来のコリン作動性シナプス小胞に対するポリクローナル抗体を用い、λgt11発現ライブラリーから1988年にcDNAクローニングされた<ref name=Maroteaux1988><pubmed>3411354</pubmed></ref> 。免疫染色でシナプス小胞に加え核周囲にも発現を認めたことから“Synaptic & nuclear protein”としてシヌクレイン(Synuclein)と命名され、神経系、特にシナプス機能に関連する分子と推定された。 | |||
神経変性疾患研究者の間でシヌクレインが最初に注目されたのは、アルツハイマー病(AD)研究との関わりからであった。アルツハイマー病脳の老人斑から分離されたアミロイドβタンパク以外の成分(Non-amyloid β protein component, NAC)として報告された部分ペプチド配列が、上述のシビレエイおよびそのホモログであるラット脳由来のシヌクレインと相同性があり、140アミノ酸からなるヒトのシヌクレイン(αシヌクレイン)と判明した<ref name=Ueda1993><pubmed>8248242</pubmed></ref> 。また、1994年にウシ脳由来のphosphoneuroprotein-14と相同性を示すヒト脳由来の134アミノ酸からなるタンパク(βシヌクレイン)が存在することも判明し、ヒト脳シヌクレインファミリーの存在が提示された<ref name=Nakajo1993><pubmed>8223629</pubmed></ref><ref name=Jakes1994><pubmed>8194594</pubmed></ref> 。α、βの接頭辞については、陽イオン交換HPLCカラムにて140アミノ酸タンパクは134アミノ酸タンパクより先に溶出されたことに由来する。 | |||
1998年にはα/βシヌクレインの塩基配列情報を元にしたデータベース解析から、先に乳癌特異的遺伝子産物として報告されていた127アミノ酸のBreast cancer-specific gene 1 (BCSG1)が3番目のシヌクレイン分子種(γシヌクレイン)であることが判明した<ref name=Ji1997><pubmed>9044857</pubmed></ref><ref name=Lavedan1998><pubmed>9737786</pubmed></ref> 。時を同じくして、αシヌクレイン遺伝子(SNCA)のミスセンス変異(A53T、A30P)が家族性パーキンソン病(パーキンソン病)の原因遺伝子PARK1として初めて報告され<ref name=Polymeropoulos1997><pubmed>9197268</pubmed></ref><ref name=Kruger1998><pubmed>9462735</pubmed></ref> 、さらに孤発性パーキンソン病やレビー小体型認知症(Dementia with Lewy bodies, DLB)の神経病理学的指標である神経細胞内封入体(Lewy小体)の主要構成成分がαシヌクレインであることが相次いで判明し<ref name=Spillantini1997><pubmed>9278044</pubmed></ref><ref name=Baba1998><pubmed>9546347</pubmed></ref> 、同分子はパーキンソン病関連疾患の病態に中心的な役割を担うことが確立され今日に至っている<ref name=Goedert2017><pubmed>28282814</pubmed></ref> 。 | |||
[[ファイル:Hasegawa alpha synuclein Fig1.png|サムネイル| | [[ファイル:Hasegawa alpha synuclein Fig1.png|サムネイル| | ||
'''図1. ヒトαシヌクレインの構造'''<br> | '''図1. ヒトαシヌクレインの構造'''<br> | ||
A. 両親和性を有し生体膜リン脂質との結合性を示すアミノ末端、中央部の疎水性に富み線維化に関与する領域、および陰性荷電を示すカルボキシル末端から構成される。<br>'''B.''' Nativeな状態のαシヌクレインは、特定の2次構造をとらない可溶性モノマーとして存在するか、αヘリックス構造をとり生体膜に結合して存在する。一方、ストレス状況下では凝集性を増し、オリゴマーとよばれる中間体を経て線維化を生じる。]] | |||
== 構造 == | == 構造 == | ||
=== ドメイン構造 === | === ドメイン構造 === | ||
ほ乳動物の3種類のシヌクレインパラログは何れもアミノ末端側に高い相同性を示し、それぞれKT(A)KE(Q)G(Q)Vの不完全なアミノ酸繰り返し配列を有している<ref name=Goedert2001><pubmed>11433374</pubmed></ref><ref name=Dev2003><pubmed>12814657</pubmed></ref> 。構造上、ヒトαシヌクレインは3つのドメイン、すなわち両親和性を有し生体膜リン脂質との結合性を示すアミノ末端領域(1-60アミノ酸)、中央部の疎水性に富み線維化に関与する領域(61-95アミノ酸、前述のNon-amyloid β protein componentに相当)、およびプロリンに富み陰性荷電し各種リガンドや金属イオンと結合性を示すカルボキシル末端領域(96-140アミノ酸)から構成される<ref name=Wang2016><pubmed>27378848</pubmed></ref> ('''図1A''')。 | |||
=== 翻訳後修飾 === | === 翻訳後修飾 === | ||
αシヌクレインの翻訳後修飾として、リン酸化、ユビキチン化、SUMO (Small ubiquitin-like modifier)化、ニトロ化、O-GlcNAcylation化、アセチル化などがあり<ref name=Zhang2019><pubmed>31057362</pubmed></ref> 。これらの修飾はαシヌクレインの凝集性を変化させたり、生体膜への結合性に影響を与える。 | |||
正常脳においてαシヌクレインの殆どはリン酸化を受けないが、パーキンソン病患者のLewy小体に含まれる異常凝集したαシヌクレインは90%以上が129番目のSerがリン酸化されており、病的意義があると推定されている<ref name=Saito2003><pubmed>12834109</pubmed></ref><ref name=Okochi2000><pubmed>10617630</pubmed></ref><ref name=Fujiwara2002><pubmed>11813001</pubmed></ref> | 正常脳においてαシヌクレインの殆どはリン酸化を受けないが、パーキンソン病患者のLewy小体に含まれる異常凝集したαシヌクレインは90%以上が129番目のSerがリン酸化されており、病的意義があると推定されている<ref name=Saito2003><pubmed>12834109</pubmed></ref><ref name=Okochi2000><pubmed>10617630</pubmed></ref><ref name=Fujiwara2002><pubmed>11813001</pubmed></ref> 。S129リン酸化を触媒するキナーゼとしては、カゼインキナーゼII (CKII)、G共役型受容体キナーゼ(GRKs)、ポロ様キナーゼ (polo-like kinases, PLKs) などが知られている<ref name=Arawaka2006><pubmed>16957079</pubmed></ref><ref name=Inglis2009><pubmed>19004816</pubmed></ref><ref name=Ishii2007><pubmed>17868672</pubmed></ref> 。 | ||
Lewy小体中には完全長のαシヌクレインに加え複数のtruncated formが確認される。C末端でのαシヌクレイン切断に関与する酵素として20Sプロテアソーム、カルパインI、アスパラギンエンドペプチダーゼ (AEP)、カスパーゼI、ニューロシン、プラスミン、カテプシンB/D/L、およびマトリックスメタロプロテアーゼ1/3 (MMP1/3) などが報告されている<ref name=Sung2005><pubmed>15863497</pubmed></ref><ref name=Sevlever2008><pubmed>18702517</pubmed></ref><ref name=Zhang2017><pubmed>28671665</pubmed></ref><ref name=Dufty2007><pubmed>17456777</pubmed></ref><ref name=Wang2016><pubmed>27482083</pubmed></ref><ref name=Kasai2008><pubmed>18358605</pubmed></ref><ref name=Sorrentino2020><pubmed>32424039</pubmed></ref> 。 | |||
[[ファイル:Hasegawa alpha synuclein Fig2.png|サムネイル|'''図2. シヌクレインファミリーの分子系統樹'''<br> | [[ファイル:Hasegawa alpha synuclein Fig2.png|サムネイル|'''図2. シヌクレインファミリーの分子系統樹'''<br> | ||
各枝の数字はブートストラップ値を示す。スケールバーはサイト毎のアミノ酸置換を示す。(文献41から一部改変し引用)]] | |||
[[ファイル:Hasegawa alpha synuclein Fig3.png|サムネイル|'''図3. | [[ファイル:Hasegawa alpha synuclein Fig3.png|サムネイル|'''図3. ヒトシヌクレインファミリーの一次構造比'''較<br> | ||
αシヌクレインを基準に、N末端、NAC領域およびC末端領域のアミノ酸相同性を示した。]] | αシヌクレインを基準に、N末端、NAC領域およびC末端領域のアミノ酸相同性を示した。]] | ||
[[ファイル:Hasegawa alpha synuclein Fig4.png|サムネイル|'''図4. ヒトαシヌクレイン遺伝子'''<br> | [[ファイル:Hasegawa alpha synuclein Fig4.png|サムネイル|'''図4. ヒトαシヌクレイン遺伝子'''<br> | ||
| 42行目: | 38行目: | ||
Nativeな状態におけるαシヌクレインは、特定の2次構造をとらない可溶性のモノマーとして存在するか、あるいは一部にαヘリックス構造をもって生体膜に結合して存在すると推定されている<ref name=Weinreb1996><pubmed>8901511</pubmed></ref><ref name=Pirc2015><pubmed>26119565</pubmed></ref> 。一方、2011年に米国のSelkoeらがヒト生体内におけるαシヌクレインが4量体として存在する可能性を報告し、激しい議論が巻き起こった<ref name=Bartels2011><pubmed>21841800</pubmed></ref> 。ヒト赤血球から抽出したαシヌクレインについては、X線小角散乱法による解析から従来説通り特定の構造をもたないモノマーとして存在する可能性が示されている<ref name=Araki2016><pubmed>27469540</pubmed></ref> 。 | Nativeな状態におけるαシヌクレインは、特定の2次構造をとらない可溶性のモノマーとして存在するか、あるいは一部にαヘリックス構造をもって生体膜に結合して存在すると推定されている<ref name=Weinreb1996><pubmed>8901511</pubmed></ref><ref name=Pirc2015><pubmed>26119565</pubmed></ref> 。一方、2011年に米国のSelkoeらがヒト生体内におけるαシヌクレインが4量体として存在する可能性を報告し、激しい議論が巻き起こった<ref name=Bartels2011><pubmed>21841800</pubmed></ref> 。ヒト赤血球から抽出したαシヌクレインについては、X線小角散乱法による解析から従来説通り特定の構造をもたないモノマーとして存在する可能性が示されている<ref name=Araki2016><pubmed>27469540</pubmed></ref> 。 | ||
αシヌクレインは点変異やC末配列の欠損、酸化的ストレスあるいはオートファジー・リソソーム系やユビキチン・プロテアソームといったタンパク品質管理機構の破綻などによる病的代謝下では凝集性を増し、オリゴマーとよばれる中間体を経てβ-pleated sheetsからなるアミロイド様線維を形成する<ref name=Wang2016><pubmed>27378848</pubmed></ref><ref name=Hasegawa2006><pubmed>16567160</pubmed></ref><ref name=Oshima2016><pubmed>27112194</pubmed></ref><ref name=Ma2018><pubmed>30290273</pubmed></ref><ref name=Li2001><pubmed>11560511</pubmed></ref><ref name=McNaught2002><pubmed>12064477</pubmed></ref><ref name=Matsuzaki2004><pubmed>15033422</pubmed></ref> ('''図1B''')。線維化の過程においては、前述のNACコア領域の12アミノ酸配列(71-82aa)が特に重要であると推定されている<ref name=Bédard2014><pubmed>25255476</pubmed></ref> 。なお、ヒトと95%の相同性をもつマウスαシヌクレインの53番目アミノ酸はヒト家族性パーキンソン病のA53T変異と同じ配列となっており、より高い凝集性を示すことが判っている<ref name=Rochet2000><pubmed>10978144</pubmed></ref> 。 | |||
==サブファミリー == | ==サブファミリー == | ||
系統発生上、3つのシヌクレインパラログ(α、β、γ)のうちγシヌクレインが最も古い分子種であると考えられている<ref name=Siddiqui2016><pubmed>27080380</pubmed></ref> ('''図2''')。うち最大の分子量をもつのがαシヌクレインで、脊椎動物以上に存在しその一次構造は種を超えて保存されている。アミノ酸レベルでのヒトαシヌクレインに対する相同性はβシヌクレインが78%、γシヌクレインが60%で、アミノ末端が良く保存されているのに対しカルボキシル末端は相同性が低くなっている<ref name=Frey2020><pubmed>32772367</pubmed></ref> ('''図3''')。また、NAC領域を欠くβシヌクレインは凝集性が低いことが知られている<ref name=Uversky2002><pubmed>11812782</pubmed></ref> | 系統発生上、3つのシヌクレインパラログ(α、β、γ)のうちγシヌクレインが最も古い分子種であると考えられている<ref name=Siddiqui2016><pubmed>27080380</pubmed></ref> ('''図2''')。うち最大の分子量をもつのがαシヌクレインで、脊椎動物以上に存在しその一次構造は種を超えて保存されている。アミノ酸レベルでのヒトαシヌクレインに対する相同性はβシヌクレインが78%、γシヌクレインが60%で、アミノ末端が良く保存されているのに対しカルボキシル末端は相同性が低くなっている<ref name=Frey2020><pubmed>32772367</pubmed></ref> ('''図3''')。また、NAC領域を欠くβシヌクレインは凝集性が低いことが知られている<ref name=Uversky2002><pubmed>11812782</pubmed></ref> 。ヒト染色体におけるこれら3つのシヌクレイン遺伝子(SNCA、SNCB、SNCG)の遺伝子座はそれぞれ4q21.3-q22、5q35、10q23に位置している<ref name=Lavedan1998><pubmed>9737786</pubmed></ref><ref name=Spillantini1995><pubmed>7558013</pubmed></ref><ref name=Chen1995><pubmed>7601479</pubmed></ref> 。SNCA遺伝子は6つのexonを有し、140アミノ酸からなるmain transcriptのほか、選択的スプライシングによりexon 3、exon 5およびその両者が欠けた少なくとも3種のアイソフォームを生じる<ref name=Gámez-Valero2018><pubmed>29370097</pubmed></ref> ('''図4''')。 | ||
== 発現分布 == | == 発現分布 == | ||
=== 組織発現 === | === 組織発現 === | ||
組織分布上、αシヌクレインはヒト成人では中枢神経系で特に高発現し、脳可溶性蛋白の約1%を占め前シナプス末端に豊富に分布する<ref name=Goedert2001><pubmed>11433374</pubmed></ref> 。ノザンブロット解析では脳のほか腎臓、肺、胎盤などで発現がみられ<ref name=Ueda1993><pubmed>8248242</pubmed></ref> 、タンパクレベルでは赤血球でも豊富に存在している<ref name=Araki2016><pubmed>27469540</pubmed></ref> 。一方、ヒト胎児では脳、肝臓、心臓、精巣、肺、腎臓、副腎などより広範な臓器で比較的高い発現が確認され、αシヌクレインは発達過程においてダイナミックな発現制御を受ける可能性が示唆されている<ref name=Ltic2004><pubmed>14997013</pubmed></ref> 。 | |||
=== 細胞内分布 === | === 細胞内分布 === | ||
細胞内においてαシヌクレインの大半は細胞質中に存在し、一部はシナプス小胞などの生体膜と結合して存在している<ref name=Maroteaux1988><pubmed>3411354</pubmed></ref><ref name=Pirc2015><pubmed>26119565</pubmed></ref> | 細胞内においてαシヌクレインの大半は細胞質中に存在し、一部はシナプス小胞などの生体膜と結合して存在している<ref name=Maroteaux1988><pubmed>3411354</pubmed></ref><ref name=Pirc2015><pubmed>26119565</pubmed></ref> 。このほか、ミトコンドリア内膜、小胞体とミトコンドリアの接触領域(Mitochondria-associated membrane, MAM)、ゴルジ体、エンドソームなどにも存在が確認されている<ref name=Tompkins2003><pubmed>12932858</pubmed></ref><ref name=Li2007><pubmed>17885598</pubmed></ref><ref name=Guardia-Laguarta2014><pubmed>24381286</pubmed></ref><ref name=Hasegawa2011><pubmed></pubmed></ref> 。名前の由来となった核におけるαシヌクレインの存在はほ乳動物においては微量と考えられているが、ヒストンあるいはDNA結合タンパクとして機能し、種々の遺伝子発現制御に関与する可能性が指摘されている<ref name=Sugeno2016><pubmed>27808254</pubmed></ref><ref name=Goers2003><pubmed>12859192</pubmed></ref><ref name=Jiang2018><pubmed>30102440</pubmed></ref> 。この様にαシヌクレインは主に細胞内で機能するタンパクと考えられているが、一方で脳脊髄液や血清、尿などの体液中や培養神経細胞の培地上清にも微量ながら検出され<ref name=Hasegawa2011><pubmed></pubmed></ref><ref name=Tokuda2006><pubmed>16930553</pubmed></ref><ref name=El-Agnaf2006><pubmed>16507759</pubmed></ref><ref name=Eller2009><pubmed>19724250</pubmed></ref> 、一部は細胞外に分泌されると推定されている<ref name=Hasegawa2017><pubmed>28539529</pubmed></ref> 。細胞外αシヌクレインは、後述するLewy病理のプリオン様伝播との関連で注目されている。 | ||
== 機能 == | == 機能 == | ||
αシヌクレインはシナプス前末端に多く局在することや、キンカチョウ(錦花鳥、''Taeniopygia guttata'')がさえずりを学習する時期に神経系で発現が上昇することから、当初からシナプス機能や神経可塑性に関与すると推察されてきた<ref name=Maroteaux1988><pubmed>3411354</pubmed></ref><ref name=George1995><pubmed>7646890</pubmed></ref><ref name=Quilty2003><pubmed>12821390</pubmed></ref> 。一方、その生理的機能については未だ十分には解明されていない。 | |||
意外にもαシヌクレインのノックアウトマウスは目立った表現型を示さず神経変性も生じない<ref name=Abeliovich2000><pubmed>10707987</pubmed></ref> 。一方、同マウスは線条体ドパミン放出量の増加を示し、アンフェタミンに対するドパミン依存性の運動反応が減弱していた。また、α、β、γ全てのシヌクレインを欠失したマウスは寿命がやや短縮しシナプスサイズや密度が縮小していた<ref name=Greten-Harrison2010><pubmed>20974939</pubmed></ref> 。シヌクレインのトリプルノックアウトマウスは若年ではシナプス伝達の促進を示したが、加齢に伴いその機能は低下していた。複数の研究から、αシヌクレインはシナプス小胞のリサイクリングや癒合に重要なSNARE(soluble N-ethylmaleimide-sensitive fusion attachment protein receptor)蛋白質の会合に関与することが示されている<ref name=Hasegawa2017><pubmed>28539529</pubmed></ref><ref name=Huang2019><pubmed>30745863</pubmed></ref> 。一例としてαシヌクレインはSNAREシャペロンの一種であるcysteine string protein(CSPα)欠失を補助する能力を有し、同分子がCSPαと同様にシャペロンとして機能することが示唆されている<ref name=Gundersen2020><pubmed>32044380</pubmed></ref><ref name=Hasegawa</pubmed></ref> 。 | |||
なお、αシヌクレインは赤血球にも多く含まれるが、赤芽球の成熟時にその発現が増加し脱核直前に減少することから、赤芽球系細胞の分化成熟に関与すると推定されている<ref name=Araki2016><pubmed>27469540</pubmed></ref> 。 | なお、αシヌクレインは赤血球にも多く含まれるが、赤芽球の成熟時にその発現が増加し脱核直前に減少することから、赤芽球系細胞の分化成熟に関与すると推定されている<ref name=Araki2016><pubmed>27469540</pubmed></ref> 。 | ||
[[ファイル:Hasegawa alpha synuclein Fig5.png|サムネイル|'''図5. レビー小体とグリア細胞内封入体'''<br> | [[ファイル:Hasegawa alpha synuclein Fig5.png|サムネイル|'''図5.レビー小体とグリア細胞内封入体'''<br> | ||
A. パーキンソン病中脳黒質神経細胞にみられるLewy小体。左にヘマトキシリン・エオジン染色像、右にαシヌクレイン抗体染色像を示す。(Scale bar=10 μm)B. 多系統萎縮症患者前頭葉白質にみられるグリア細胞内封入体。文献72, 74から一部改変し引用。]] | |||
[[ファイル:Hasegawa alpha synuclein Fig6.png|サムネイル|'''図6. シヌクレイノパチーの関係図'''<br> | [[ファイル:Hasegawa alpha synuclein Fig6.png|サムネイル|'''図6. シヌクレイノパチーの関係図'''<br>Lewy小体を特徴とする疾患としてパーキンソン病、認知症を併発するパーキンソン病、レビー小体型認知症のほか、レム睡眠行動障害、純粋自律神経不全症などの病型が存在する。また、グリア細胞内封入体を病理学的指標とする疾患としてMSAがある。これらの疾患は完全に独立しておらず、重複してみられる場合もある。レム睡眠行動障害で発症し後にパーキンソン病と診断されるなど、経過中に病型が変化する例も少なくない。]] | ||
== 疾患との関わり == | == 疾患との関わり == | ||
=== 家族性パーキンソン病の原因遺伝子として === | === 家族性パーキンソン病の原因遺伝子として === | ||
1997年イタリア起源の優性遺伝形式をとる家族性パーキンソン病の家系で最初のαシヌクレイン遺伝子の点変異(A53T)家系が報告され<ref name=Polymeropoulos1997><pubmed>9197268</pubmed></ref> 、次いでドイツから異なる変異(A30P)を有する第二の家系が見つかりPARK1と命名された<ref name=Kruger1998><pubmed>9462735</pubmed></ref> | 1997年イタリア起源の優性遺伝形式をとる家族性パーキンソン病の家系で最初のαシヌクレイン遺伝子の点変異(A53T)家系が報告され<ref name=Polymeropoulos1997><pubmed>9197268</pubmed></ref> 、次いでドイツから異なる変異(A30P)を有する第二の家系が見つかりPARK1と命名された<ref name=Kruger1998><pubmed>9462735</pubmed></ref> 。前者は比較的若年発症、後者は中年発症という差があるものの、両者ともレボドパ反応性のパーキンソニズムを呈し神経病理学的にも孤発性パーキンソン病類似の所見を認めたため、αシヌクレインは孤発性パーキンソン病の病態解明に結びつくkey moleculeとして衆目を集めることとなった。 | ||
これまでに家族性パーキンソン病を来すSNCAミスセンス変異として、E46K、H50Q、G51D、A53Eを加えた6種類が報告されている<ref name=Zarranz2004><pubmed>14755719</pubmed></ref><ref name=Kiely2013><pubmed>23404372</pubmed></ref><ref name=Appel-Cresswell2013><pubmed>23457019</pubmed></ref><ref name=Pasanen2014><pubmed>24746362</pubmed></ref> | これまでに家族性パーキンソン病を来すSNCAミスセンス変異として、E46K、H50Q、G51D、A53Eを加えた6種類が報告されている<ref name=Zarranz2004><pubmed>14755719</pubmed></ref><ref name=Kiely2013><pubmed>23404372</pubmed></ref><ref name=Appel-Cresswell2013><pubmed>23457019</pubmed></ref><ref name=Pasanen2014><pubmed>24746362</pubmed></ref> 。さらに、これらの点変異に加えαシヌクレイン遺伝子の重複でも家族性パーキンソン病が発症することが明らかになっている。この家系は、第4染色体長腕にマッピングされるもののPARK1変異が証明されないため当初別の遺伝子座(PARK4)として分類されていたが、後にαシヌクレイン遺伝子が三重重複していることが判明した<ref name=Singleton2003><pubmed>14593171</pubmed></ref> 。臨床的には認知症を呈し、病理学的にもLewy小体が黒質や青斑核よりもマイネルト基底核や海馬、側頭葉に目立つ特徴があった。その後さらに二重重複家系も報告されたが、こちらは認知機能は保たれ中年発症のパーキンソニズムを示していた<ref name=Chartier-Harlin2004><pubmed>15451224</pubmed></ref> 。これらの家系は正常型αシヌクレインの遺伝子量がそのままパーキンソン病からレビー小体型認知症までの臨床像を連続的に説明し得ることを示唆しており興味深い。 | ||
=== Lewy小体・グリア細胞内封入体の構成成分として === | === Lewy小体・グリア細胞内封入体の構成成分として === | ||
パーキンソン病患者の中脳黒質や青斑核などにはヘマトキシン・エオジン染色でエオジン好性のコアを明瞭なハロが取り囲む直径5-20 μm程度の類円形の封入体が認められ、発見者であるFriedrich Heinrich Lewyの名にちなみLewy小体とよばれる<ref name=Wakabayashi2007><pubmed>18018486</pubmed></ref> ('''図5A''')。1997年Spillantiniらは家族性パーキンソン病の原因としてαシヌクレイン遺伝子が報告されたことをヒントに孤発性パーキンソン病およびレビー小体型認知症患者脳を用いた免疫染色を実施し、Lewy小体がαシヌクレイン抗体で強く染色されることを世界に先駆けて報告した<ref name=Spillantini1997><pubmed>9278044</pubmed></ref> 。その翌年、Iwatsuboらはレビー小体型認知症剖検脳から単離・精製したLewy小体を抗原として複数の抗体を作製し、うち幾つかがαシヌクレインを認識することを証明し、αシヌクレインがLewy小体の主要構成成分であるとの直接証拠を提示した<ref name=Baba1998><pubmed>9546347</pubmed></ref> 。さらに、多系統萎縮症(multiple system atrophy, MSA)患者のオリゴデンドログリア内に多発するグリア細胞内封入体がやはりαシヌクレイン陽性であることが確認され('''図5B''')<ref name=Hasegawa2013><pubmed></pubmed></ref><ref name=Wakabayashi1998><pubmed>9682846</pubmed></ref> 、αシヌクレインが病態機序の中心的役割を担うと想定される神経疾患群を総称するumbrella termとして “シヌクレイノパチー”が提唱されることとなった<ref name=Goedert2001><pubmed>11433374</pubmed></ref> ('''図6''')。 | |||
=== αシヌクレインと神経変性 === | === αシヌクレインと神経変性 === | ||
培養細胞および動物モデルを用いた膨大な知見の積み重ねから、異常凝集したαシヌクレインは細胞毒性を有し神経細胞死を惹起することが判っている<ref name=Goedert2017><pubmed>28282814</pubmed></ref> | 培養細胞および動物モデルを用いた膨大な知見の積み重ねから、異常凝集したαシヌクレインは細胞毒性を有し神経細胞死を惹起することが判っている<ref name=Goedert2017><pubmed>28282814</pubmed></ref> 。具体的には、酸化的ストレス、小胞体ストレス、ミトコンドリア障害、細胞・オルガネラ膜破綻、小胞輸送障害などの経路を介し細胞毒性を獲得すると考えられている。以下順に解説する。 | ||
==== 酸化的ストレス ==== | ==== 酸化的ストレス ==== | ||
活性酸素は細胞内タンパクやオルガネラを傷害することにより細胞死を誘導する。αシヌクレインオリゴマーは金属イオンと結合することで活性酸素種を発生させる<ref name=Deas2016><pubmed>26564470</pubmed></ref> 。あるいは、リソソームやミトコンドリア障害などを誘導し酸化的ストレスを惹起する一因となる<ref name=Luth2014><pubmed>24942732</pubmed></ref><ref name=Freeman2013><pubmed>23634225</pubmed></ref> 。また、ドパミン酸化物のキノン体はαシヌクレインオリゴマーを安定化させる作用をもつことが示されている<ref name=Conway2001><pubmed>11701929</pubmed></ref> 。 | |||
==== 小胞体ストレス ==== | ==== 小胞体ストレス ==== | ||
| 87行目: | 80行目: | ||
==== ミトコンドリア障害 ==== | ==== ミトコンドリア障害 ==== | ||
パーキンソン病患者脳でミトコンドリア呼吸鎖の障害を認めることや<ref name=Mizuno1998><pubmed>9749580</pubmed></ref> | パーキンソン病患者脳でミトコンドリア呼吸鎖の障害を認めることや<ref name=Mizuno1998><pubmed>9749580</pubmed></ref> 、ミトコンドリア障害を惹起する薬剤(1-Methyl-4-phenyl- 1,2,3,6-tetrahydropyridine/MPTP、ロテノンなど)がドパミン神経細胞死を誘導すること<ref name=Bhurtel2019><pubmed>30605763</pubmed></ref> 、さらにミトコンドリア品質管理を担うPINK1 (PTEN-induced kinase 1)やParkinなどの遺伝子変異により家族性パーキンソン病が発症することから<ref name=Ge2020><pubmed>32169097</pubmed></ref> 、ミトコンドリア障害はパーキンソン病病態において重要な役割をもつと考えられている。細胞内においてミトコンドリアは活性酸素種の主たる産生部位であり、その障害により酸化的ストレスが増大する。一方、αシヌクレインはミトコンドリアの分裂・融合、凝集に関与すること<ref name=PozoDevoto2017a><pubmed>28883016</pubmed></ref> 、野生型・変異型αシヌクレインの過剰発現はミトコンドリア断片化・機能障害をもたらすことが示されている<ref name=PozoDevoto2017b><pubmed>28698628</pubmed></ref> 。 | ||
==== 細胞・オルガネラ膜破綻 ==== | ==== 細胞・オルガネラ膜破綻 ==== | ||
シヌクレイン凝集過程で生じるプロトフィブリルは、生体膜上に環状のポア構造を形成することで膜透過性を亢進させ、細胞傷害性をもたらす可能性が推定されている<ref name=Furukawa2006><pubmed>16606366</pubmed></ref><ref name=Ding2002><pubmed>12162735</pubmed></ref> 。実際、凝集したαシヌクレインはリソソーム膜を破壊することでその内容物を細胞質へ漏出させ酸化的ストレスを引き起こすことが示されている<ref name=Freeman2013><pubmed>23634225</pubmed></ref> 。また、細胞外にある凝集αシヌクレインは、エンドサイトーシスにより細胞内へ取り込まれた後にエンドソーム膜を破壊して細胞質へと漏出し、自らが鋳型となって内在性のαシヌクレインを凝集させる現象も報告されている<ref name=Flavin2017><pubmed>28527044</pubmed></ref> 。 | |||
==== 小胞輸送障害 ==== | ==== 小胞輸送障害 ==== | ||
小胞輸送は積荷タンパクのオルガネラ間あるいは細胞内外での輸送を担う普遍的な細胞内ロジスティクスである。パーキンソン病の原因・リスク遺伝子には小胞輸送制御に関与するものが多く、αシヌクレインもRab GTPaseやSNARE構成分子の機能に影響を与えることで小胞輸送系を間接的に制御していると推定されている<ref name=Hasegawa2017><pubmed>28539529</pubmed></ref><ref name=Huang2019><pubmed>30745863</pubmed></ref><ref name=Gundersen2020><pubmed>32044380</pubmed></ref> 。小胞輸送障害はタンパク分解機構の破綻、αシヌクレインの凝集・蓄積、ミトコンドリア障害など様々な機序を介し神経細胞死を誘導する<ref name=Oshima2016><pubmed>27112194</pubmed></ref><ref name=Hasegawa2017><pubmed>28539529</pubmed></ref><ref name=Yoshida2018><pubmed>29309590</pubmed></ref><ref name=Miura2014><pubmed>25107340</pubmed></ref><ref name=Mazzulli2011><pubmed>21700325</pubmed></ref> 。 | |||
==== プリオン様伝播 ==== | ==== プリオン様伝播 ==== | ||
2003年ドイツの神経病理学者Braakは、パーキンソン病患者脳内においてαシヌクレイン/Lewy病理は病初期に延髄迷走神経背側核に出現し、その後中脳から大脳辺縁系・新皮質へ拡大するという病変進展モデル(Braak仮説)を発表した<ref name=Braak2003><pubmed>12498954</pubmed></ref> 。さらに、胎児黒質組織片移植後を受けたパーキンソン病剖検脳において、ドナーである胎児由来の神経細胞内にαシヌクレイン陽性のLewy小体様封入体が確認されたという事実が報告され<ref name=Kordower2008><pubmed>18391962</pubmed></ref> 、αシヌクレインが細胞間を伝播して病変を拡大させる可能性が示された。伝播現象は感染性タンパク粒子であるプリオンと類似性があることからプリオン様伝播とも表現される<ref name=Hasegawa2017><pubmed>28539529</pubmed></ref> 。疫学および病理学的検討から、αシヌクレイン病理は消化管粘膜や心臓交感神経など末梢神経系に出現し、一定の年月を経て中枢神経系に移行する可能性が指摘されている<ref name=Van Den Berge2019><pubmed>31254094</pubmed></ref><ref name=Borghammer2019><pubmed>31498132</pubmed></ref> 。細胞間を伝播するαシヌクレインは、ワクチン・抗体療法などの治療標的としても注目されている<ref name=Castonguay2020><pubmed>33104039</pubmed></ref> 。 | |||
== 関連語 == | == 関連語 == | ||
2020年11月14日 (土) 08:34時点における版
αシヌクレイン 英語名:α-Synuclein/Alpha-Synuclein ドイツ語:α-Synuklein/Alfa-Synuklein
長谷川 隆文
東北大学大学院医学系研究科 神経・感覚器病態学講座 神経内科学分野
αシヌクレインはSNCA遺伝子(4q21.3-q22)によりコードされる140アミノ酸からなる分子量14.5 kDaのタンパクである。中枢神経系なかでもシナプス前末端に豊富に存在し、シナプス機能制御や神経可塑性に関与していると推定されている。SNCA遺伝子のミスセンス変異・遺伝子重複は遺伝性パーキンソン病(PARK1/4)を発症させる。また、孤発性パーキンソン病およびLewy小体型認知症の神経細胞内にみられるLewy小体、および多系統萎縮症のオリゴデンドロサイト内にみられるグリア細胞内封入体(Glial cytoplasmic inclusion)の主要構成成分は、高度にリン酸化し異常凝集したαシヌクレインであることが知られている。凝集したαシヌクレインは細胞毒性を有し、同分子はシヌクレイノパチー(Synucleinopathy)と総称される上記疾患群の病態において中心的役割を担うと考えられている。
歴史的背景
シヌクレインは、北東太平洋に生息するゴマフシビレエイTorpedo californicaの発電器官由来のコリン作動性シナプス小胞に対するポリクローナル抗体を用い、λgt11発現ライブラリーから1988年にcDNAクローニングされた[1] 。免疫染色でシナプス小胞に加え核周囲にも発現を認めたことから“Synaptic & nuclear protein”としてシヌクレイン(Synuclein)と命名され、神経系、特にシナプス機能に関連する分子と推定された。
神経変性疾患研究者の間でシヌクレインが最初に注目されたのは、アルツハイマー病(AD)研究との関わりからであった。アルツハイマー病脳の老人斑から分離されたアミロイドβタンパク以外の成分(Non-amyloid β protein component, NAC)として報告された部分ペプチド配列が、上述のシビレエイおよびそのホモログであるラット脳由来のシヌクレインと相同性があり、140アミノ酸からなるヒトのシヌクレイン(αシヌクレイン)と判明した[2] 。また、1994年にウシ脳由来のphosphoneuroprotein-14と相同性を示すヒト脳由来の134アミノ酸からなるタンパク(βシヌクレイン)が存在することも判明し、ヒト脳シヌクレインファミリーの存在が提示された[3][4] 。α、βの接頭辞については、陽イオン交換HPLCカラムにて140アミノ酸タンパクは134アミノ酸タンパクより先に溶出されたことに由来する。
1998年にはα/βシヌクレインの塩基配列情報を元にしたデータベース解析から、先に乳癌特異的遺伝子産物として報告されていた127アミノ酸のBreast cancer-specific gene 1 (BCSG1)が3番目のシヌクレイン分子種(γシヌクレイン)であることが判明した[5][6] 。時を同じくして、αシヌクレイン遺伝子(SNCA)のミスセンス変異(A53T、A30P)が家族性パーキンソン病(パーキンソン病)の原因遺伝子PARK1として初めて報告され[7][8] 、さらに孤発性パーキンソン病やレビー小体型認知症(Dementia with Lewy bodies, DLB)の神経病理学的指標である神経細胞内封入体(Lewy小体)の主要構成成分がαシヌクレインであることが相次いで判明し[9][10] 、同分子はパーキンソン病関連疾患の病態に中心的な役割を担うことが確立され今日に至っている[11] 。
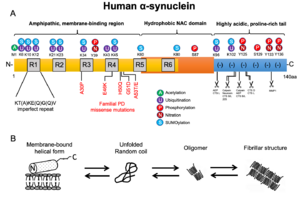
A. 両親和性を有し生体膜リン脂質との結合性を示すアミノ末端、中央部の疎水性に富み線維化に関与する領域、および陰性荷電を示すカルボキシル末端から構成される。
B. Nativeな状態のαシヌクレインは、特定の2次構造をとらない可溶性モノマーとして存在するか、αヘリックス構造をとり生体膜に結合して存在する。一方、ストレス状況下では凝集性を増し、オリゴマーとよばれる中間体を経て線維化を生じる。
構造
ドメイン構造
ほ乳動物の3種類のシヌクレインパラログは何れもアミノ末端側に高い相同性を示し、それぞれKT(A)KE(Q)G(Q)Vの不完全なアミノ酸繰り返し配列を有している[12][13] 。構造上、ヒトαシヌクレインは3つのドメイン、すなわち両親和性を有し生体膜リン脂質との結合性を示すアミノ末端領域(1-60アミノ酸)、中央部の疎水性に富み線維化に関与する領域(61-95アミノ酸、前述のNon-amyloid β protein componentに相当)、およびプロリンに富み陰性荷電し各種リガンドや金属イオンと結合性を示すカルボキシル末端領域(96-140アミノ酸)から構成される[14] (図1A)。
翻訳後修飾
αシヌクレインの翻訳後修飾として、リン酸化、ユビキチン化、SUMO (Small ubiquitin-like modifier)化、ニトロ化、O-GlcNAcylation化、アセチル化などがあり[15] 。これらの修飾はαシヌクレインの凝集性を変化させたり、生体膜への結合性に影響を与える。
正常脳においてαシヌクレインの殆どはリン酸化を受けないが、パーキンソン病患者のLewy小体に含まれる異常凝集したαシヌクレインは90%以上が129番目のSerがリン酸化されており、病的意義があると推定されている[16][17][18] 。S129リン酸化を触媒するキナーゼとしては、カゼインキナーゼII (CKII)、G共役型受容体キナーゼ(GRKs)、ポロ様キナーゼ (polo-like kinases, PLKs) などが知られている[19][20][21] 。
Lewy小体中には完全長のαシヌクレインに加え複数のtruncated formが確認される。C末端でのαシヌクレイン切断に関与する酵素として20Sプロテアソーム、カルパインI、アスパラギンエンドペプチダーゼ (AEP)、カスパーゼI、ニューロシン、プラスミン、カテプシンB/D/L、およびマトリックスメタロプロテアーゼ1/3 (MMP1/3) などが報告されている[22][23][24][25][14][26][27] 。
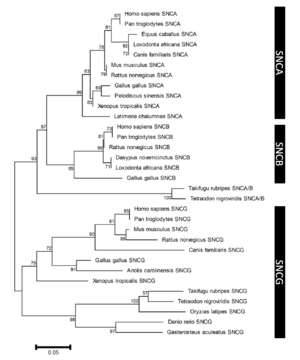
各枝の数字はブートストラップ値を示す。スケールバーはサイト毎のアミノ酸置換を示す。(文献41から一部改変し引用)
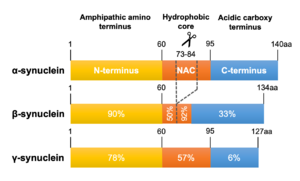
αシヌクレインを基準に、N末端、NAC領域およびC末端領域のアミノ酸相同性を示した。
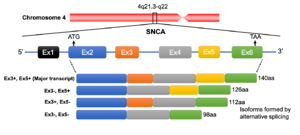
SNCA遺伝子座は4q21.3-q22に存在し6つのエクソンで構成される。選択的スプライシングによりexon 3、exon 5およびその両者が欠けた3種のアイソフォームを生じる。
コンフォメーション変化
Nativeな状態におけるαシヌクレインは、特定の2次構造をとらない可溶性のモノマーとして存在するか、あるいは一部にαヘリックス構造をもって生体膜に結合して存在すると推定されている[28][29] 。一方、2011年に米国のSelkoeらがヒト生体内におけるαシヌクレインが4量体として存在する可能性を報告し、激しい議論が巻き起こった[30] 。ヒト赤血球から抽出したαシヌクレインについては、X線小角散乱法による解析から従来説通り特定の構造をもたないモノマーとして存在する可能性が示されている[31] 。
αシヌクレインは点変異やC末配列の欠損、酸化的ストレスあるいはオートファジー・リソソーム系やユビキチン・プロテアソームといったタンパク品質管理機構の破綻などによる病的代謝下では凝集性を増し、オリゴマーとよばれる中間体を経てβ-pleated sheetsからなるアミロイド様線維を形成する[14][32][33][34][35][36][37] (図1B)。線維化の過程においては、前述のNACコア領域の12アミノ酸配列(71-82aa)が特に重要であると推定されている[38] 。なお、ヒトと95%の相同性をもつマウスαシヌクレインの53番目アミノ酸はヒト家族性パーキンソン病のA53T変異と同じ配列となっており、より高い凝集性を示すことが判っている[39] 。
サブファミリー
系統発生上、3つのシヌクレインパラログ(α、β、γ)のうちγシヌクレインが最も古い分子種であると考えられている[40] (図2)。うち最大の分子量をもつのがαシヌクレインで、脊椎動物以上に存在しその一次構造は種を超えて保存されている。アミノ酸レベルでのヒトαシヌクレインに対する相同性はβシヌクレインが78%、γシヌクレインが60%で、アミノ末端が良く保存されているのに対しカルボキシル末端は相同性が低くなっている[41] (図3)。また、NAC領域を欠くβシヌクレインは凝集性が低いことが知られている[42] 。ヒト染色体におけるこれら3つのシヌクレイン遺伝子(SNCA、SNCB、SNCG)の遺伝子座はそれぞれ4q21.3-q22、5q35、10q23に位置している[6][43][44] 。SNCA遺伝子は6つのexonを有し、140アミノ酸からなるmain transcriptのほか、選択的スプライシングによりexon 3、exon 5およびその両者が欠けた少なくとも3種のアイソフォームを生じる[45] (図4)。
発現分布
組織発現
組織分布上、αシヌクレインはヒト成人では中枢神経系で特に高発現し、脳可溶性蛋白の約1%を占め前シナプス末端に豊富に分布する[12] 。ノザンブロット解析では脳のほか腎臓、肺、胎盤などで発現がみられ[2] 、タンパクレベルでは赤血球でも豊富に存在している[31] 。一方、ヒト胎児では脳、肝臓、心臓、精巣、肺、腎臓、副腎などより広範な臓器で比較的高い発現が確認され、αシヌクレインは発達過程においてダイナミックな発現制御を受ける可能性が示唆されている[46] 。
細胞内分布
細胞内においてαシヌクレインの大半は細胞質中に存在し、一部はシナプス小胞などの生体膜と結合して存在している[1][29] 。このほか、ミトコンドリア内膜、小胞体とミトコンドリアの接触領域(Mitochondria-associated membrane, MAM)、ゴルジ体、エンドソームなどにも存在が確認されている[47][48][49][50] 。名前の由来となった核におけるαシヌクレインの存在はほ乳動物においては微量と考えられているが、ヒストンあるいはDNA結合タンパクとして機能し、種々の遺伝子発現制御に関与する可能性が指摘されている[51][52][53] 。この様にαシヌクレインは主に細胞内で機能するタンパクと考えられているが、一方で脳脊髄液や血清、尿などの体液中や培養神経細胞の培地上清にも微量ながら検出され[50][54][55][56] 、一部は細胞外に分泌されると推定されている[57] 。細胞外αシヌクレインは、後述するLewy病理のプリオン様伝播との関連で注目されている。
機能
αシヌクレインはシナプス前末端に多く局在することや、キンカチョウ(錦花鳥、Taeniopygia guttata)がさえずりを学習する時期に神経系で発現が上昇することから、当初からシナプス機能や神経可塑性に関与すると推察されてきた[1][58][59] 。一方、その生理的機能については未だ十分には解明されていない。
意外にもαシヌクレインのノックアウトマウスは目立った表現型を示さず神経変性も生じない[60] 。一方、同マウスは線条体ドパミン放出量の増加を示し、アンフェタミンに対するドパミン依存性の運動反応が減弱していた。また、α、β、γ全てのシヌクレインを欠失したマウスは寿命がやや短縮しシナプスサイズや密度が縮小していた[61] 。シヌクレインのトリプルノックアウトマウスは若年ではシナプス伝達の促進を示したが、加齢に伴いその機能は低下していた。複数の研究から、αシヌクレインはシナプス小胞のリサイクリングや癒合に重要なSNARE(soluble N-ethylmaleimide-sensitive fusion attachment protein receptor)蛋白質の会合に関与することが示されている[57][62] 。一例としてαシヌクレインはSNAREシャペロンの一種であるcysteine string protein(CSPα)欠失を補助する能力を有し、同分子がCSPαと同様にシャペロンとして機能することが示唆されている[63][64] 。
なお、αシヌクレインは赤血球にも多く含まれるが、赤芽球の成熟時にその発現が増加し脱核直前に減少することから、赤芽球系細胞の分化成熟に関与すると推定されている[31] 。
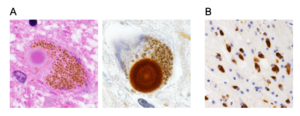
A. パーキンソン病中脳黒質神経細胞にみられるLewy小体。左にヘマトキシリン・エオジン染色像、右にαシヌクレイン抗体染色像を示す。(Scale bar=10 μm)B. 多系統萎縮症患者前頭葉白質にみられるグリア細胞内封入体。文献72, 74から一部改変し引用。
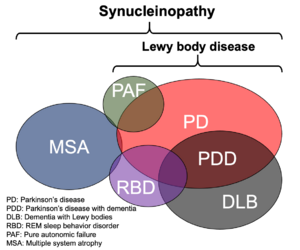
Lewy小体を特徴とする疾患としてパーキンソン病、認知症を併発するパーキンソン病、レビー小体型認知症のほか、レム睡眠行動障害、純粋自律神経不全症などの病型が存在する。また、グリア細胞内封入体を病理学的指標とする疾患としてMSAがある。これらの疾患は完全に独立しておらず、重複してみられる場合もある。レム睡眠行動障害で発症し後にパーキンソン病と診断されるなど、経過中に病型が変化する例も少なくない。
疾患との関わり
家族性パーキンソン病の原因遺伝子として
1997年イタリア起源の優性遺伝形式をとる家族性パーキンソン病の家系で最初のαシヌクレイン遺伝子の点変異(A53T)家系が報告され[7] 、次いでドイツから異なる変異(A30P)を有する第二の家系が見つかりPARK1と命名された[8] 。前者は比較的若年発症、後者は中年発症という差があるものの、両者ともレボドパ反応性のパーキンソニズムを呈し神経病理学的にも孤発性パーキンソン病類似の所見を認めたため、αシヌクレインは孤発性パーキンソン病の病態解明に結びつくkey moleculeとして衆目を集めることとなった。
これまでに家族性パーキンソン病を来すSNCAミスセンス変異として、E46K、H50Q、G51D、A53Eを加えた6種類が報告されている[65][66][67][68] 。さらに、これらの点変異に加えαシヌクレイン遺伝子の重複でも家族性パーキンソン病が発症することが明らかになっている。この家系は、第4染色体長腕にマッピングされるもののPARK1変異が証明されないため当初別の遺伝子座(PARK4)として分類されていたが、後にαシヌクレイン遺伝子が三重重複していることが判明した[69] 。臨床的には認知症を呈し、病理学的にもLewy小体が黒質や青斑核よりもマイネルト基底核や海馬、側頭葉に目立つ特徴があった。その後さらに二重重複家系も報告されたが、こちらは認知機能は保たれ中年発症のパーキンソニズムを示していた[70] 。これらの家系は正常型αシヌクレインの遺伝子量がそのままパーキンソン病からレビー小体型認知症までの臨床像を連続的に説明し得ることを示唆しており興味深い。
Lewy小体・グリア細胞内封入体の構成成分として
パーキンソン病患者の中脳黒質や青斑核などにはヘマトキシン・エオジン染色でエオジン好性のコアを明瞭なハロが取り囲む直径5-20 μm程度の類円形の封入体が認められ、発見者であるFriedrich Heinrich Lewyの名にちなみLewy小体とよばれる[71] (図5A)。1997年Spillantiniらは家族性パーキンソン病の原因としてαシヌクレイン遺伝子が報告されたことをヒントに孤発性パーキンソン病およびレビー小体型認知症患者脳を用いた免疫染色を実施し、Lewy小体がαシヌクレイン抗体で強く染色されることを世界に先駆けて報告した[9] 。その翌年、Iwatsuboらはレビー小体型認知症剖検脳から単離・精製したLewy小体を抗原として複数の抗体を作製し、うち幾つかがαシヌクレインを認識することを証明し、αシヌクレインがLewy小体の主要構成成分であるとの直接証拠を提示した[10] 。さらに、多系統萎縮症(multiple system atrophy, MSA)患者のオリゴデンドログリア内に多発するグリア細胞内封入体がやはりαシヌクレイン陽性であることが確認され(図5B)[72][73] 、αシヌクレインが病態機序の中心的役割を担うと想定される神経疾患群を総称するumbrella termとして “シヌクレイノパチー”が提唱されることとなった[12] (図6)。
αシヌクレインと神経変性
培養細胞および動物モデルを用いた膨大な知見の積み重ねから、異常凝集したαシヌクレインは細胞毒性を有し神経細胞死を惹起することが判っている[11] 。具体的には、酸化的ストレス、小胞体ストレス、ミトコンドリア障害、細胞・オルガネラ膜破綻、小胞輸送障害などの経路を介し細胞毒性を獲得すると考えられている。以下順に解説する。
酸化的ストレス
活性酸素は細胞内タンパクやオルガネラを傷害することにより細胞死を誘導する。αシヌクレインオリゴマーは金属イオンと結合することで活性酸素種を発生させる[74] 。あるいは、リソソームやミトコンドリア障害などを誘導し酸化的ストレスを惹起する一因となる[75][76] 。また、ドパミン酸化物のキノン体はαシヌクレインオリゴマーを安定化させる作用をもつことが示されている[77] 。
小胞体ストレス
種々のストレスにより正常な構造をとれず折りたたみ異常(ミスフォールディング)を来したタンパクが小胞体に蓄積すると、小胞体ストレスとよばれるシグナルが誘導され細胞死が誘導される。小胞体ストレスの発現には前述の酸化的ストレスも寄与する。培養細胞を用いた実験結果から、変異型あるいはS129リン酸化αシヌクレインは小胞体ストレスを誘導し、細胞死をもたらすことが示されている[78][79] 。
ミトコンドリア障害
パーキンソン病患者脳でミトコンドリア呼吸鎖の障害を認めることや[80] 、ミトコンドリア障害を惹起する薬剤(1-Methyl-4-phenyl- 1,2,3,6-tetrahydropyridine/MPTP、ロテノンなど)がドパミン神経細胞死を誘導すること[81] 、さらにミトコンドリア品質管理を担うPINK1 (PTEN-induced kinase 1)やParkinなどの遺伝子変異により家族性パーキンソン病が発症することから[82] 、ミトコンドリア障害はパーキンソン病病態において重要な役割をもつと考えられている。細胞内においてミトコンドリアは活性酸素種の主たる産生部位であり、その障害により酸化的ストレスが増大する。一方、αシヌクレインはミトコンドリアの分裂・融合、凝集に関与すること[83] 、野生型・変異型αシヌクレインの過剰発現はミトコンドリア断片化・機能障害をもたらすことが示されている[84] 。
細胞・オルガネラ膜破綻
シヌクレイン凝集過程で生じるプロトフィブリルは、生体膜上に環状のポア構造を形成することで膜透過性を亢進させ、細胞傷害性をもたらす可能性が推定されている[85][86] 。実際、凝集したαシヌクレインはリソソーム膜を破壊することでその内容物を細胞質へ漏出させ酸化的ストレスを引き起こすことが示されている[76] 。また、細胞外にある凝集αシヌクレインは、エンドサイトーシスにより細胞内へ取り込まれた後にエンドソーム膜を破壊して細胞質へと漏出し、自らが鋳型となって内在性のαシヌクレインを凝集させる現象も報告されている[87] 。
小胞輸送障害
小胞輸送は積荷タンパクのオルガネラ間あるいは細胞内外での輸送を担う普遍的な細胞内ロジスティクスである。パーキンソン病の原因・リスク遺伝子には小胞輸送制御に関与するものが多く、αシヌクレインもRab GTPaseやSNARE構成分子の機能に影響を与えることで小胞輸送系を間接的に制御していると推定されている[57][62][63] 。小胞輸送障害はタンパク分解機構の破綻、αシヌクレインの凝集・蓄積、ミトコンドリア障害など様々な機序を介し神経細胞死を誘導する[33][57][88][89][90] 。
プリオン様伝播
2003年ドイツの神経病理学者Braakは、パーキンソン病患者脳内においてαシヌクレイン/Lewy病理は病初期に延髄迷走神経背側核に出現し、その後中脳から大脳辺縁系・新皮質へ拡大するという病変進展モデル(Braak仮説)を発表した[91] 。さらに、胎児黒質組織片移植後を受けたパーキンソン病剖検脳において、ドナーである胎児由来の神経細胞内にαシヌクレイン陽性のLewy小体様封入体が確認されたという事実が報告され[92] 、αシヌクレインが細胞間を伝播して病変を拡大させる可能性が示された。伝播現象は感染性タンパク粒子であるプリオンと類似性があることからプリオン様伝播とも表現される[57] 。疫学および病理学的検討から、αシヌクレイン病理は消化管粘膜や心臓交感神経など末梢神経系に出現し、一定の年月を経て中枢神経系に移行する可能性が指摘されている引用エラー: <ref> タグ内の引数が無効です[93] 。細胞間を伝播するαシヌクレインは、ワクチン・抗体療法などの治療標的としても注目されている[94] 。
関連語
参考文献
- ↑ 1.0 1.1 1.2
Maroteaux, L., Campanelli, J.T., & Scheller, R.H. (1988).
Synuclein: a neuron-specific protein localized to the nucleus and presynaptic nerve terminal. The Journal of neuroscience : the official journal of the Society for Neuroscience, 8(8), 2804-15. [PubMed:3411354] [PMC] [WorldCat] - ↑ 2.0 2.1
Uéda, K., Fukushima, H., Masliah, E., Xia, Y., Iwai, A., Yoshimoto, M., ..., & Saitoh, T. (1993).
Molecular cloning of cDNA encoding an unrecognized component of amyloid in Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America, 90(23), 11282-6. [PubMed:8248242] [PMC] [WorldCat] [DOI] - ↑
Nakajo, S., Tsukada, K., Omata, K., Nakamura, Y., & Nakaya, K. (1993).
A new brain-specific 14-kDa protein is a phosphoprotein. Its complete amino acid sequence and evidence for phosphorylation. European journal of biochemistry, 217(3), 1057-63. [PubMed:8223629] [WorldCat] [DOI] - ↑
Jakes, R., Spillantini, M.G., & Goedert, M. (1994).
Identification of two distinct synucleins from human brain. FEBS letters, 345(1), 27-32. [PubMed:8194594] [WorldCat] [DOI] - ↑
Ji, H., Liu, Y.E., Jia, T., Wang, M., Liu, J., Xiao, G., ..., & Shi, Y.E. (1997).
Identification of a breast cancer-specific gene, BCSG1, by direct differential cDNA sequencing. Cancer research, 57(4), 759-64. [PubMed:9044857] [WorldCat] - ↑ 6.0 6.1
Lavedan, C., Leroy, E., Dehejia, A., Buchholtz, S., Dutra, A., Nussbaum, R.L., & Polymeropoulos, M.H. (1998).
Identification, localization and characterization of the human gamma-synuclein gene. Human genetics, 103(1), 106-12. [PubMed:9737786] [WorldCat] [DOI] - ↑ 7.0 7.1
Polymeropoulos, M.H., Lavedan, C., Leroy, E., Ide, S.E., Dehejia, A., Dutra, A., ..., & Nussbaum, R.L. (1997).
Mutation in the alpha-synuclein gene identified in families with Parkinson's disease. Science (New York, N.Y.), 276(5321), 2045-7. [PubMed:9197268] [WorldCat] [DOI] - ↑ 8.0 8.1
Krüger, R., Kuhn, W., Müller, T., Woitalla, D., Graeber, M., Kösel, S., ..., & Riess, O. (1998).
Ala30Pro mutation in the gene encoding alpha-synuclein in Parkinson's disease. Nature genetics, 18(2), 106-8. [PubMed:9462735] [WorldCat] [DOI] - ↑ 9.0 9.1
Spillantini, M.G., Schmidt, M.L., Lee, V.M., Trojanowski, J.Q., Jakes, R., & Goedert, M. (1997).
Alpha-synuclein in Lewy bodies. Nature, 388(6645), 839-40. [PubMed:9278044] [WorldCat] [DOI] - ↑ 10.0 10.1
Baba, M., Nakajo, S., Tu, P.H., Tomita, T., Nakaya, K., Lee, V.M., ..., & Iwatsubo, T. (1998).
Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology, 152(4), 879-84. [PubMed:9546347] [PMC] [WorldCat] - ↑ 11.0 11.1
Goedert, M., Jakes, R., & Spillantini, M.G. (2017).
The Synucleinopathies: Twenty Years On. Journal of Parkinson's disease, 7(s1), S51-S69. [PubMed:28282814] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2
Goedert, M. (2001).
Alpha-synuclein and neurodegenerative diseases. Nature reviews. Neuroscience, 2(7), 492-501. [PubMed:11433374] [WorldCat] [DOI] - ↑
Dev, K.K., Hofele, K., Barbieri, S., Buchman, V.L., & van der Putten, H. (2003).
Part II: alpha-synuclein and its molecular pathophysiological role in neurodegenerative disease. Neuropharmacology, 45(1), 14-44. [PubMed:12814657] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Wang, C., Zhao, C., Li, D., Tian, Z., Lai, Y., Diao, J., & Liu, C. (2016).
Versatile Structures of α-Synuclein. Frontiers in molecular neuroscience, 9, 48. [PubMed:27378848] [PMC] [WorldCat] [DOI] 引用エラー: 無効な<ref>タグ; name "Wang2016"が異なる内容で複数回定義されています - ↑
Zhang, J., Li, X., & Li, J.D. (2019).
The Roles of Post-translational Modifications on α-Synuclein in the Pathogenesis of Parkinson's Diseases. Frontiers in neuroscience, 13, 381. [PubMed:31057362] [PMC] [WorldCat] [DOI] - ↑
Saito, Y., Kawashima, A., Ruberu, N.N., Fujiwara, H., Koyama, S., Sawabe, M., ..., & Murayama, S. (2003).
Accumulation of phosphorylated alpha-synuclein in aging human brain. Journal of neuropathology and experimental neurology, 62(6), 644-54. [PubMed:12834109] [WorldCat] [DOI] - ↑
Okochi, M., Walter, J., Koyama, A., Nakajo, S., Baba, M., Iwatsubo, T., ..., & Haass, C. (2000).
Constitutive phosphorylation of the Parkinson's disease associated alpha-synuclein. The Journal of biological chemistry, 275(1), 390-7. [PubMed:10617630] [WorldCat] [DOI] - ↑
Fujiwara, H., Hasegawa, M., Dohmae, N., Kawashima, A., Masliah, E., Goldberg, M.S., ..., & Iwatsubo, T. (2002).
alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nature cell biology, 4(2), 160-4. [PubMed:11813001] [WorldCat] [DOI] - ↑
Arawaka, S., Wada, M., Goto, S., Karube, H., Sakamoto, M., Ren, C.H., ..., & Kato, T. (2006).
The role of G-protein-coupled receptor kinase 5 in pathogenesis of sporadic Parkinson's disease. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(36), 9227-38. [PubMed:16957079] [PMC] [WorldCat] [DOI] - ↑
Inglis, K.J., Chereau, D., Brigham, E.F., Chiou, S.S., Schöbel, S., Frigon, N.L., ..., & Anderson, J.P. (2009).
Polo-like kinase 2 (PLK2) phosphorylates alpha-synuclein at serine 129 in central nervous system. The Journal of biological chemistry, 284(5), 2598-602. [PubMed:19004816] [PMC] [WorldCat] [DOI] - ↑
Ishii, A., Nonaka, T., Taniguchi, S., Saito, T., Arai, T., Mann, D., ..., & Hasegawa, M. (2007).
Casein kinase 2 is the major enzyme in brain that phosphorylates Ser129 of human alpha-synuclein: Implication for alpha-synucleinopathies. FEBS letters, 581(24), 4711-7. [PubMed:17868672] [WorldCat] [DOI] - ↑
Sung, J.Y., Park, S.M., Lee, C.H., Um, J.W., Lee, H.J., Kim, J., ..., & Chung, K.C. (2005).
Proteolytic cleavage of extracellular secreted {alpha}-synuclein via matrix metalloproteinases. The Journal of biological chemistry, 280(26), 25216-24. [PubMed:15863497] [WorldCat] [DOI] - ↑
Sevlever, D., Jiang, P., & Yen, S.H. (2008).
Cathepsin D is the main lysosomal enzyme involved in the degradation of alpha-synuclein and generation of its carboxy-terminally truncated species. Biochemistry, 47(36), 9678-87. [PubMed:18702517] [PMC] [WorldCat] [DOI] - ↑
Zhang, Z., Kang, S.S., Liu, X., Ahn, E.H., Zhang, Z., He, L., ..., & Ye, K. (2017).
Asparagine endopeptidase cleaves α-synuclein and mediates pathologic activities in Parkinson's disease. Nature structural & molecular biology, 24(8), 632-642. [PubMed:28671665] [PMC] [WorldCat] [DOI] - ↑
Dufty, B.M., Warner, L.R., Hou, S.T., Jiang, S.X., Gomez-Isla, T., Leenhouts, K.M., ..., & Rohn, T.T. (2007).
Calpain-cleavage of alpha-synuclein: connecting proteolytic processing to disease-linked aggregation. The American journal of pathology, 170(5), 1725-38. [PubMed:17456777] [PMC] [WorldCat] [DOI] - ↑
Kasai, T., Tokuda, T., Yamaguchi, N., Watanabe, Y., Kametani, F., Nakagawa, M., & Mizuno, T. (2008).
Cleavage of normal and pathological forms of alpha-synuclein by neurosin in vitro. Neuroscience letters, 436(1), 52-6. [PubMed:18358605] [WorldCat] [DOI] - ↑
Sorrentino, Z.A., & Giasson, B.I. (2020).
The emerging role of α-synuclein truncation in aggregation and disease. The Journal of biological chemistry, 295(30), 10224-10244. [PubMed:32424039] [PMC] [WorldCat] [DOI] - ↑
Weinreb, P.H., Zhen, W., Poon, A.W., Conway, K.A., & Lansbury, P.T. (1996).
NACP, a protein implicated in Alzheimer's disease and learning, is natively unfolded. Biochemistry, 35(43), 13709-15. [PubMed:8901511] [WorldCat] [DOI] - ↑ 29.0 29.1
Pirc, K., & Ulrih, N.P. (2015).
α-Synuclein interactions with phospholipid model membranes: Key roles for electrostatic interactions and lipid-bilayer structure. Biochimica et biophysica acta, 1848(10 Pt A), 2002-12. [PubMed:26119565] [WorldCat] [DOI] - ↑
Bartels, T., Choi, J.G., & Selkoe, D.J. (2011).
α-Synuclein occurs physiologically as a helically folded tetramer that resists aggregation. Nature, 477(7362), 107-10. [PubMed:21841800] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1 31.2
Araki, K., Yagi, N., Nakatani, R., Sekiguchi, H., So, M., Yagi, H., ..., & Mochizuki, H. (2016).
A small-angle X-ray scattering study of alpha-synuclein from human red blood cells. Scientific reports, 6, 30473. [PubMed:27469540] [PMC] [WorldCat] [DOI] - ↑
Hasegawa, T., Matsuzaki-Kobayashi, M., Takeda, A., Sugeno, N., Kikuchi, A., Furukawa, K., ..., & Itoyama, Y. (2006).
Alpha-synuclein facilitates the toxicity of oxidized catechol metabolites: implications for selective neurodegeneration in Parkinson's disease. FEBS letters, 580(8), 2147-52. [PubMed:16567160] [WorldCat] [DOI] - ↑ 33.0 33.1
Oshima, R., Hasegawa, T., Tamai, K., Sugeno, N., Yoshida, S., Kobayashi, J., ..., & Tanaka, N. (2016).
ESCRT-0 dysfunction compromises autophagic degradation of protein aggregates and facilitates ER stress-mediated neurodegeneration via apoptotic and necroptotic pathways. Scientific reports, 6, 24997. [PubMed:27112194] [PMC] [WorldCat] [DOI] - ↑
Ma, L., Yang, C., Zhang, X., Li, Y., Wang, S., Zheng, L., & Huang, K. (2018).
C-terminal truncation exacerbates the aggregation and cytotoxicity of α-Synuclein: A vicious cycle in Parkinson's disease. Biochimica et biophysica acta. Molecular basis of disease, 1864(12), 3714-3725. [PubMed:30290273] [WorldCat] [DOI] - ↑
Li, J., Uversky, V.N., & Fink, A.L. (2001).
Effect of familial Parkinson's disease point mutations A30P and A53T on the structural properties, aggregation, and fibrillation of human alpha-synuclein. Biochemistry, 40(38), 11604-13. [PubMed:11560511] [WorldCat] [DOI] - ↑
McNaught, K.S., Mytilineou, C., Jnobaptiste, R., Yabut, J., Shashidharan, P., Jennert, P., & Olanow, C.W. (2002).
Impairment of the ubiquitin-proteasome system causes dopaminergic cell death and inclusion body formation in ventral mesencephalic cultures. Journal of neurochemistry, 81(2), 301-6. [PubMed:12064477] [WorldCat] [DOI] - ↑
Matsuzaki, M., Hasegawa, T., Takeda, A., Kikuchi, A., Furukawa, K., Kato, Y., & Itoyama, Y. (2004).
Histochemical features of stress-induced aggregates in alpha-synuclein overexpressing cells. Brain research, 1004(1-2), 83-90. [PubMed:15033422] [WorldCat] [DOI] - ↑
Bédard, L., Lefèvre, T., Morin-Michaud, É., & Auger, M. (2014).
Besides fibrillization: putative role of the peptide fragment 71-82 on the structural and assembly behavior of α-synuclein. Biochemistry, 53(41), 6463-72. [PubMed:25255476] [WorldCat] [DOI] - ↑
Rochet, J.C., Conway, K.A., & Lansbury, P.T. (2000).
Inhibition of fibrillization and accumulation of prefibrillar oligomers in mixtures of human and mouse alpha-synuclein. Biochemistry, 39(35), 10619-26. [PubMed:10978144] [WorldCat] [DOI] - ↑
Siddiqui, I.J., Pervaiz, N., & Abbasi, A.A. (2016).
The Parkinson Disease gene SNCA: Evolutionary and structural insights with pathological implication. Scientific reports, 6, 24475. [PubMed:27080380] [PMC] [WorldCat] [DOI] - ↑
Frey, B., AlOkda, A., Jackson, M.P., Riguet, N., Duce, J.A., & Lashuel, H.A. (2020).
Monitoring alpha-synuclein oligomerization and aggregation using bimolecular fluorescence complementation assays: What you see is not always what you get. Journal of neurochemistry. [PubMed:32772367] [WorldCat] [DOI] - ↑
Uversky, V.N., Li, J., Souillac, P., Millett, I.S., Doniach, S., Jakes, R., ..., & Fink, A.L. (2002).
Biophysical properties of the synucleins and their propensities to fibrillate: inhibition of alpha-synuclein assembly by beta- and gamma-synucleins. The Journal of biological chemistry, 277(14), 11970-8. [PubMed:11812782] [WorldCat] [DOI] - ↑
Spillantini, M.G., Divane, A., & Goedert, M. (1995).
Assignment of human alpha-synuclein (SNCA) and beta-synuclein (SNCB) genes to chromosomes 4q21 and 5q35. Genomics, 27(2), 379-81. [PubMed:7558013] [WorldCat] [DOI] - ↑
Chen, X., de Silva, H.A., Pettenati, M.J., Rao, P.N., St George-Hyslop, P., Roses, A.D., ..., & Saitoh, T. (1995).
The human NACP/alpha-synuclein gene: chromosome assignment to 4q21.3-q22 and TaqI RFLP analysis. Genomics, 26(2), 425-7. [PubMed:7601479] [WorldCat] [DOI] - ↑
Gámez-Valero, A., & Beyer, K. (2018).
Alternative Splicing of Alpha- and Beta-Synuclein Genes Plays Differential Roles in Synucleinopathies. Genes, 9(2). [PubMed:29370097] [PMC] [WorldCat] [DOI] - ↑
Ltic, S., Perovic, M., Mladenovic, A., Raicevic, N., Ruzdijic, S., Rakic, L., & Kanazir, S. (2004).
Alpha-synuclein is expressed in different tissues during human fetal development. Journal of molecular neuroscience : MN, 22(3), 199-204. [PubMed:14997013] [WorldCat] [DOI] - ↑
Tompkins, M.M., Gai, W.P., Douglas, S., & Bunn, S.J. (2003).
Alpha-synuclein expression localizes to the Golgi apparatus in bovine adrenal medullary chromaffin cells. Brain research, 984(1-2), 233-6. [PubMed:12932858] [WorldCat] [DOI] - ↑
Li, W.W., Yang, R., Guo, J.C., Ren, H.M., Zha, X.L., Cheng, J.S., & Cai, D.F. (2007).
Localization of alpha-synuclein to mitochondria within midbrain of mice. Neuroreport, 18(15), 1543-6. [PubMed:17885598] [WorldCat] [DOI] - ↑
Guardia-Laguarta, C., Area-Gomez, E., Rüb, C., Liu, Y., Magrané, J., Becker, D., ..., & Przedborski, S. (2014).
α-Synuclein is localized to mitochondria-associated ER membranes. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(1), 249-59. [PubMed:24381286] [PMC] [WorldCat] [DOI] - ↑ 50.0 50.1 Resource not found in PubMed.
- ↑
Sugeno, N., Jäckel, S., Voigt, A., Wassouf, Z., Schulze-Hentrich, J., & Kahle, P.J. (2016).
α-Synuclein enhances histone H3 lysine-9 dimethylation and H3K9me2-dependent transcriptional responses. Scientific reports, 6, 36328. [PubMed:27808254] [PMC] [WorldCat] [DOI] - ↑
Goers, J., Manning-Bog, A.B., McCormack, A.L., Millett, I.S., Doniach, S., Di Monte, D.A., ..., & Fink, A.L. (2003).
Nuclear localization of alpha-synuclein and its interaction with histones. Biochemistry, 42(28), 8465-71. [PubMed:12859192] [WorldCat] [DOI] - ↑
Jiang, K., Rocha, S., Westling, A., Kesarimangalam, S., Dorfman, K.D., Wittung-Stafshede, P., & Westerlund, F. (2018).
Alpha-Synuclein Modulates the Physical Properties of DNA. Chemistry (Weinheim an der Bergstrasse, Germany), 24(58), 15685-15690. [PubMed:30102440] [PMC] [WorldCat] [DOI] - ↑
Tokuda, T., Salem, S.A., Allsop, D., Mizuno, T., Nakagawa, M., Qureshi, M.M., ..., & El-Agnaf, O.M. (2006).
Decreased alpha-synuclein in cerebrospinal fluid of aged individuals and subjects with Parkinson's disease. Biochemical and biophysical research communications, 349(1), 162-6. [PubMed:16930553] [WorldCat] [DOI] - ↑
El-Agnaf, O.M., Salem, S.A., Paleologou, K.E., Curran, M.D., Gibson, M.J., Court, J.A., ..., & Allsop, D. (2006).
Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson's disease. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 20(3), 419-25. [PubMed:16507759] [WorldCat] [DOI] - ↑
Eller, M., & Williams, D.R. (2009).
Biological fluid biomarkers in neurodegenerative parkinsonism. Nature reviews. Neurology, 5(10), 561-70. [PubMed:19724250] [WorldCat] [DOI] - ↑ 57.0 57.1 57.2 57.3 57.4
Hasegawa, T., Sugeno, N., Kikuchi, A., Baba, T., & Aoki, M. (2017).
Membrane Trafficking Illuminates a Path to Parkinson's Disease. The Tohoku journal of experimental medicine, 242(1), 63-76. [PubMed:28539529] [WorldCat] [DOI] - ↑
George, J.M., Jin, H., Woods, W.S., & Clayton, D.F. (1995).
Characterization of a novel protein regulated during the critical period for song learning in the zebra finch. Neuron, 15(2), 361-72. [PubMed:7646890] [WorldCat] [DOI] - ↑
Quilty, M.C., Gai, W.P., Pountney, D.L., West, A.K., & Vickers, J.C. (2003).
Localization of alpha-, beta-, and gamma-synuclein during neuronal development and alterations associated with the neuronal response to axonal trauma. Experimental neurology, 182(1), 195-207. [PubMed:12821390] [WorldCat] [DOI] - ↑
Abeliovich, A., Schmitz, Y., Fariñas, I., Choi-Lundberg, D., Ho, W.H., Castillo, P.E., ..., & Rosenthal, A. (2000).
Mice lacking alpha-synuclein display functional deficits in the nigrostriatal dopamine system. Neuron, 25(1), 239-52. [PubMed:10707987] [WorldCat] [DOI] - ↑
Greten-Harrison, B., Polydoro, M., Morimoto-Tomita, M., Diao, L., Williams, A.M., Nie, E.H., ..., & Chandra, S.S. (2010).
αβγ-Synuclein triple knockout mice reveal age-dependent neuronal dysfunction. Proceedings of the National Academy of Sciences of the United States of America, 107(45), 19573-8. [PubMed:20974939] [PMC] [WorldCat] [DOI] - ↑ 62.0 62.1
Huang, M., Wang, B., Li, X., Fu, C., Wang, C., & Kang, X. (2019).
α-Synuclein: A Multifunctional Player in Exocytosis, Endocytosis, and Vesicle Recycling. Frontiers in neuroscience, 13, 28. [PubMed:30745863] [PMC] [WorldCat] [DOI] - ↑ 63.0 63.1
Gundersen, C.B. (2020).
Cysteine string proteins. Progress in neurobiology, 188, 101758. [PubMed:32044380] [WorldCat] [DOI] - ↑ 引用エラー: 無効な
<ref>タグです。「Hasegawa</pubmed」という名前の注釈に対するテキストが指定されていません - ↑
Zarranz, J.J., Alegre, J., Gómez-Esteban, J.C., Lezcano, E., Ros, R., Ampuero, I., ..., & de Yebenes, J.G. (2004).
The new mutation, E46K, of alpha-synuclein causes Parkinson and Lewy body dementia. Annals of neurology, 55(2), 164-73. [PubMed:14755719] [WorldCat] [DOI] - ↑
Kiely, A.P., Asi, Y.T., Kara, E., Limousin, P., Ling, H., Lewis, P., ..., & Holton, J.L. (2013).
α-Synucleinopathy associated with G51D SNCA mutation: a link between Parkinson's disease and multiple system atrophy? Acta neuropathologica, 125(5), 753-69. [PubMed:23404372] [PMC] [WorldCat] [DOI] - ↑
Appel-Cresswell, S., Vilarino-Guell, C., Encarnacion, M., Sherman, H., Yu, I., Shah, B., ..., & Farrer, M.J. (2013).
Alpha-synuclein p.H50Q, a novel pathogenic mutation for Parkinson's disease. Movement disorders : official journal of the Movement Disorder Society, 28(6), 811-3. [PubMed:23457019] [WorldCat] [DOI] - ↑
Pasanen, P., Myllykangas, L., Siitonen, M., Raunio, A., Kaakkola, S., Lyytinen, J., ..., & Paetau, A. (2014).
Novel α-synuclein mutation A53E associated with atypical multiple system atrophy and Parkinson's disease-type pathology. Neurobiology of aging, 35(9), 2180.e1-5. [PubMed:24746362] [WorldCat] [DOI] - ↑
Singleton, A.B., Farrer, M., Johnson, J., Singleton, A., Hague, S., Kachergus, J., ..., & Gwinn-Hardy, K. (2003).
alpha-Synuclein locus triplication causes Parkinson's disease. Science (New York, N.Y.), 302(5646), 841. [PubMed:14593171] [WorldCat] [DOI] - ↑
Chartier-Harlin, M.C., Kachergus, J., Roumier, C., Mouroux, V., Douay, X., Lincoln, S., ..., & Destée, A. (2004).
Alpha-synuclein locus duplication as a cause of familial Parkinson's disease. Lancet (London, England), 364(9440), 1167-9. [PubMed:15451224] [WorldCat] [DOI] - ↑
Wakabayashi, K., Tanji, K., Mori, F., & Takahashi, H. (2007).
The Lewy body in Parkinson's disease: molecules implicated in the formation and degradation of alpha-synuclein aggregates. Neuropathology : official journal of the Japanese Society of Neuropathology, 27(5), 494-506. [PubMed:18018486] [WorldCat] [DOI] - ↑ Resource not found in PubMed.
- ↑
Wakabayashi, K., Yoshimoto, M., Tsuji, S., & Takahashi, H. (1998).
Alpha-synuclein immunoreactivity in glial cytoplasmic inclusions in multiple system atrophy. Neuroscience letters, 249(2-3), 180-2. [PubMed:9682846] [WorldCat] [DOI] - ↑
Deas, E., Cremades, N., Angelova, P.R., Ludtmann, M.H., Yao, Z., Chen, S., ..., & Abramov, A.Y. (2016).
Alpha-Synuclein Oligomers Interact with Metal Ions to Induce Oxidative Stress and Neuronal Death in Parkinson's Disease. Antioxidants & redox signaling, 24(7), 376-91. [PubMed:26564470] [PMC] [WorldCat] [DOI] - ↑
Luth, E.S., Stavrovskaya, I.G., Bartels, T., Kristal, B.S., & Selkoe, D.J. (2014).
Soluble, prefibrillar α-synuclein oligomers promote complex I-dependent, Ca2+-induced mitochondrial dysfunction. The Journal of biological chemistry, 289(31), 21490-507. [PubMed:24942732] [PMC] [WorldCat] [DOI] - ↑ 76.0 76.1
Freeman, D., Cedillos, R., Choyke, S., Lukic, Z., McGuire, K., Marvin, S., ..., & Campbell, E.M. (2013).
Alpha-synuclein induces lysosomal rupture and cathepsin dependent reactive oxygen species following endocytosis. PloS one, 8(4), e62143. [PubMed:23634225] [PMC] [WorldCat] [DOI] - ↑
Conway, K.A., Rochet, J.C., Bieganski, R.M., & Lansbury, P.T. (2001).
Kinetic stabilization of the alpha-synuclein protofibril by a dopamine-alpha-synuclein adduct. Science (New York, N.Y.), 294(5545), 1346-9. [PubMed:11701929] [WorldCat] [DOI] - ↑
Smith, W.W., Jiang, H., Pei, Z., Tanaka, Y., Morita, H., Sawa, A., ..., & Ross, C.A. (2005).
Endoplasmic reticulum stress and mitochondrial cell death pathways mediate A53T mutant alpha-synuclein-induced toxicity. Human molecular genetics, 14(24), 3801-11. [PubMed:16239241] [WorldCat] [DOI] - ↑
Sugeno, N., Takeda, A., Hasegawa, T., Kobayashi, M., Kikuchi, A., Mori, F., ..., & Itoyama, Y. (2008).
Serine 129 phosphorylation of alpha-synuclein induces unfolded protein response-mediated cell death. The Journal of biological chemistry, 283(34), 23179-88. [PubMed:18562315] [WorldCat] [DOI] - ↑
Mizuno, Y., Yoshino, H., Ikebe, S., Hattori, N., Kobayashi, T., Shimoda-Matsubayashi, S., ..., & Kondo, T. (1998).
Mitochondrial dysfunction in Parkinson's disease. Annals of neurology, 44(3 Suppl 1), S99-109. [PubMed:9749580] [WorldCat] [DOI] - ↑
Bhurtel, S., Katila, N., Srivastav, S., Neupane, S., & Choi, D.Y. (2019).
Mechanistic comparison between MPTP and rotenone neurotoxicity in mice. Neurotoxicology, 71, 113-121. [PubMed:30605763] [WorldCat] [DOI] - ↑
Ge, P., Dawson, V.L., & Dawson, T.M. (2020).
PINK1 and Parkin mitochondrial quality control: a source of regional vulnerability in Parkinson's disease. Molecular neurodegeneration, 15(1), 20. [PubMed:32169097] [PMC] [WorldCat] [DOI] - ↑
Pozo Devoto, V.M., & Falzone, T.L. (2017).
Mitochondrial dynamics in Parkinson's disease: a role for α-synuclein? Disease models & mechanisms, 10(9), 1075-1087. [PubMed:28883016] [PMC] [WorldCat] [DOI] - ↑
Pozo Devoto, V.M., Dimopoulos, N., Alloatti, M., Pardi, M.B., Saez, T.M., Otero, M.G., ..., & Falzone, T.L. (2017).
αSynuclein control of mitochondrial homeostasis in human-derived neurons is disrupted by mutations associated with Parkinson's disease. Scientific reports, 7(1), 5042. [PubMed:28698628] [PMC] [WorldCat] [DOI] - ↑
Furukawa, K., Matsuzaki-Kobayashi, M., Hasegawa, T., Kikuchi, A., Sugeno, N., Itoyama, Y., ..., & Takeda, A. (2006).
Plasma membrane ion permeability induced by mutant alpha-synuclein contributes to the degeneration of neural cells. Journal of neurochemistry, 97(4), 1071-7. [PubMed:16606366] [WorldCat] [DOI] - ↑
Ding, T.T., Lee, S.J., Rochet, J.C., & Lansbury, P.T. (2002).
Annular alpha-synuclein protofibrils are produced when spherical protofibrils are incubated in solution or bound to brain-derived membranes. Biochemistry, 41(32), 10209-17. [PubMed:12162735] [WorldCat] [DOI] - ↑
Flavin, W.P., Bousset, L., Green, Z.C., Chu, Y., Skarpathiotis, S., Chaney, M.J., ..., & Campbell, E.M. (2017).
Endocytic vesicle rupture is a conserved mechanism of cellular invasion by amyloid proteins. Acta neuropathologica, 134(4), 629-653. [PubMed:28527044] [WorldCat] [DOI] - ↑
Yoshida, S., Hasegawa, T., Suzuki, M., Sugeno, N., Kobayashi, J., Ueyama, M., ..., & Aoki, M. (2018).
Parkinson's disease-linked DNAJC13 mutation aggravates alpha-synuclein-induced neurotoxicity through perturbation of endosomal trafficking. Human molecular genetics, 27(5), 823-836. [PubMed:29309590] [WorldCat] [DOI] - ↑
Miura, E., Hasegawa, T., Konno, M., Suzuki, M., Sugeno, N., Fujikake, N., ..., & Aoki, M. (2014).
VPS35 dysfunction impairs lysosomal degradation of α-synuclein and exacerbates neurotoxicity in a Drosophila model of Parkinson's disease. Neurobiology of disease, 71, 1-13. [PubMed:25107340] [WorldCat] [DOI] - ↑
Mazzulli, J.R., Xu, Y.H., Sun, Y., Knight, A.L., McLean, P.J., Caldwell, G.A., ..., & Krainc, D. (2011).
Gaucher disease glucocerebrosidase and α-synuclein form a bidirectional pathogenic loop in synucleinopathies. Cell, 146(1), 37-52. [PubMed:21700325] [PMC] [WorldCat] [DOI] - ↑
Braak, H., Del Tredici, K., Rüb, U., de Vos, R.A., Jansen Steur, E.N., & Braak, E. (2002).
Staging of brain pathology related to sporadic Parkinson's disease. Neurobiology of aging, 24(2), 197-211. [PubMed:12498954] [WorldCat] [DOI] - ↑
Kordower, J.H., Chu, Y., Hauser, R.A., Freeman, T.B., & Olanow, C.W. (2008).
Lewy body-like pathology in long-term embryonic nigral transplants in Parkinson's disease. Nature medicine, 14(5), 504-6. [PubMed:18391962] [WorldCat] [DOI] - ↑
Borghammer, P., & Van Den Berge, N. (2019).
Brain-First versus Gut-First Parkinson's Disease: A Hypothesis. Journal of Parkinson's disease, 9(s2), S281-S295. [PubMed:31498132] [PMC] [WorldCat] [DOI] - ↑
Castonguay, A.M., Gravel, C., & Lévesque, M. (2020).
Treating Parkinson's Disease with Antibodies: Previous Studies and Future Directions. Journal of Parkinson's disease. [PubMed:33104039] [WorldCat] [DOI]