「TAR DNA-binding protein of 43 kDa」の版間の差分
細 →機能 |
細 →機能 |
||
| 22行目: | 22行目: | ||
== 機能 == | == 機能 == | ||
TDP-43はGly-richドメインを含むC末端領域を介して他のRNA結合タンパク質と結合し、タンパク質複合体を形成することによってスプライシングの調節に作用する。例えば、上述のようにTDP-43はCFTRのエクソン9をスキップさせ、スプライシング抑制因子として機能する<ref name=Buratti2001b><pubmed>11285240</pubmed></ref>ことが判明した。またこのタンパク質は、ヒト[[ニューロフィラメント軽鎖]] | TDP-43はGly-richドメインを含むC末端領域を介して他のRNA結合タンパク質と結合し、タンパク質複合体を形成することによってスプライシングの調節に作用する。例えば、上述のようにTDP-43はCFTRのエクソン9をスキップさせ、スプライシング抑制因子として機能する<ref name=Buratti2001b><pubmed>11285240</pubmed></ref>ことが判明した。またこのタンパク質は、ヒト[[ニューロフィラメント軽鎖]](hNFL)mRNAの安定化<ref name=Strong2011><pubmed>17481916</pubmed></ref>、[[cyclin-dependent kinase 6]]([[Cdk6]])の発現抑制<ref name=Ayala2008><pubmed>18305152</pubmed></ref>、[[survival of motor neuron 2]]遺伝子([[SMN2]])のエクソン7のスプライシング促進<ref name=Bose2008><pubmed>18703504</pubmed></ref>などと関連することが報告されている。それ以外にも、[[マイクロRNA]]の生合成、[[長鎖ノンコーディングRNA]]との関与、[[ストレス顆粒]]の形成にも関連することが知られている。 | ||
またTDP-43遺伝子欠損マウスの解析より胎生致死となることが報告され、[[哺乳類]]においてTDP-43は必須であることが判明した<ref name=Wu2010><pubmed>20014337</pubmed></ref><ref name=Sephton2010><pubmed>20040602</pubmed></ref><ref name=Kraemer2010><pubmed>20198480</pubmed></ref>。さらにTDP-43は自分自身でその発現量を厳密にコントロールしていることも明らかとなった。すなわちTDP-43が自身のmRNAの3'UTRに結合し,近傍の選択的スプライシングやpolyA付加を変化させることにより,自身の発現を制御していることが報告された<ref name=Polymenidou2011><pubmed>21358643</pubmed></ref><ref name=Ayala2011><pubmed>21131904</pubmed></ref><ref name=Avendanño-Vázquez2012><pubmed>22855830</pubmed></ref>。この制御機構の破綻とALSやFTLDの発症との関連性が注目されている。 | またTDP-43遺伝子欠損マウスの解析より胎生致死となることが報告され、[[哺乳類]]においてTDP-43は必須であることが判明した<ref name=Wu2010><pubmed>20014337</pubmed></ref><ref name=Sephton2010><pubmed>20040602</pubmed></ref><ref name=Kraemer2010><pubmed>20198480</pubmed></ref>。さらにTDP-43は自分自身でその発現量を厳密にコントロールしていることも明らかとなった。すなわちTDP-43が自身のmRNAの3'UTRに結合し,近傍の選択的スプライシングやpolyA付加を変化させることにより,自身の発現を制御していることが報告された<ref name=Polymenidou2011><pubmed>21358643</pubmed></ref><ref name=Ayala2011><pubmed>21131904</pubmed></ref><ref name=Avendanño-Vázquez2012><pubmed>22855830</pubmed></ref>。この制御機構の破綻とALSやFTLDの発症との関連性が注目されている。 | ||
2021年1月8日 (金) 09:01時点における版
野中 隆
東京都医学総合研究所・認知症プロジェクト
DOI:10.14931/bsd.9560 原稿受付日:2020年11月27日 原稿完成日:2021年1月8日
担当編集委員:山中 宏二(名古屋大学 環境医学研究所 病態神経科学)
英略語:TDP-43
TAR DNA-binding protein of 43 kDa(TDP-43)は核に局在するRNA結合タンパク質であり、様々な遺伝子の転写やスプライシングに関与している。2006年、筋萎縮性側索硬化症(ALS)や一部の前頭側頭葉変性症(FTLD)の神経細胞やグリア細胞に認められるユビキチン陽性封入体の主要な構成タンパク質としてTDP-43が同定された。TDP-43の凝集体形成と神経細胞脱落との関連が示唆されているが、その詳細は不明である。最近では、TDP-43凝集体のプリオン様性質が注目されており、凝集体が細胞間を伝播し、伝播した先の細胞内で凝集のシードとして機能し、その結果異常病変が経時的に拡がるという新たな病態メカニズムが考えられている。
TDP-43とは
TAR DNA-binding protein of 43 kDa(TDP-43)は、ヒトエイズウイルス(HIV-1)遺伝子の末端反復配列中に存在するtrans activation responsive region (TAR)と呼ばれるRNA調節配列に結合するタンパク質として1995年に最初に同定された[1] 。その後、嚢胞性線維症の原因遺伝子であるcystic fibrosis transmembrane conductance regulator(CFTR)のスプライシング調節因子としてTDP-43が同定され、TDP-43がCFTRのpre-mRNAに結合し、エクソン9のスプライシングを抑制することが報告された[2][3]。
2006年には、筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)およびタウ陰性の前頭側頭葉変性症(frontotemporal lobar degeneration:FTLD) に出現するユビキチン陽性封入体の主要な構成タンパク質として同定され[4][5]、その後、TDP-43遺伝子のミスセンス変異[6]が家族性ALSやFTLDの原因となることが遺伝学的に示されたことから、TDP-43の異常がこれらの疾患の発症と関連することが判明した。

TDP-43は414アミノ酸からなるタンパク質である。分子内には、核移行シグナル(NLS)、2ヶ所のRNA認識配列(RRM)、Glyに富む領域(Gly-rich)、Gln/Asnに富む領域(Q/N-rich)が存在する。家族性ALSやFTLDなどの遺伝子解析より見いだされたミスセンス変異はC末端領域に集中しており、またこの領域はプリオンとの相同性が高い[7]。
構造
TDP-43は414アミノ酸からなる一本鎖ポリペプチドであり、核に局在する核タンパク質である。N末端側には核移行シグナルを有し、2つのRNA認識配列(RRM1/2)およびグリシンに富む領域(Gly-rich)が存在する(図)。分子の中央付近には核外搬出シグナルも存在するが、核移行シグナルが優位に機能するため主に核に局在する。このタンパク質は、不均一核内リボ核酸タンパク質(heterogeneous nuclear ribonucleoprotein:hnRNP)の一種であり、Gly-richドメインを含むC末端領域を介してhnRNP A2/B1やhnRNP A1などの他のRNA結合タンパク質と結合し、タンパク質複合体を形成することが知られている。一方、N末端側の領域はTDP-43の多量化に関与することも報告されている。
2008年には、家族性ALSにおいてTDP-43遺伝子のミスセンス変異[6]が相次いで報告され、TDP-43の異常と神経変性の直接的な関係が明らかとなった。TDP-43遺伝子は、染色体1p36.21上に存在し、6個のエクソンを含む。これまでに30以上のミスセンス変異が報告されているが、その殆どがC末端領域(239~414残基)をコードするエクソン6に見いだされている。TDP-43のC末端領域はGly-richドメインを有するため安定な立体構造を形成しにくいと推測され、またこの領域にはGln/Asnに富むQ/N-richドメインも存在し、プリオンの一次構造と類似性があることが報告されている[7]。このような領域に変異が多数集中していることから、これらの変異がTDP-43の立体構造に影響を及ぼす可能性が考えられるが、現在のところ、これらの変異効果についてははっきりした結果は得られていない。
機能
TDP-43はGly-richドメインを含むC末端領域を介して他のRNA結合タンパク質と結合し、タンパク質複合体を形成することによってスプライシングの調節に作用する。例えば、上述のようにTDP-43はCFTRのエクソン9をスキップさせ、スプライシング抑制因子として機能する[3]ことが判明した。またこのタンパク質は、ヒトニューロフィラメント軽鎖(hNFL)mRNAの安定化[8]、cyclin-dependent kinase 6(Cdk6)の発現抑制[9]、survival of motor neuron 2遺伝子(SMN2)のエクソン7のスプライシング促進[10]などと関連することが報告されている。それ以外にも、マイクロRNAの生合成、長鎖ノンコーディングRNAとの関与、ストレス顆粒の形成にも関連することが知られている。
またTDP-43遺伝子欠損マウスの解析より胎生致死となることが報告され、哺乳類においてTDP-43は必須であることが判明した[11][12][13]。さらにTDP-43は自分自身でその発現量を厳密にコントロールしていることも明らかとなった。すなわちTDP-43が自身のmRNAの3'UTRに結合し,近傍の選択的スプライシングやpolyA付加を変化させることにより,自身の発現を制御していることが報告された[14][15][16]。この制御機構の破綻とALSやFTLDの発症との関連性が注目されている。
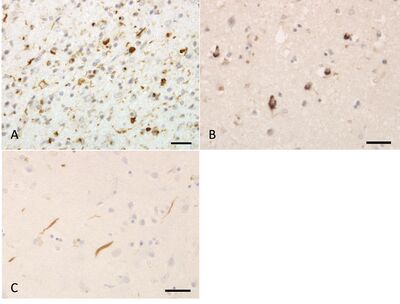
A. Type A病理。
B. Type B病理。
C. Type C病理。
いずれもリン酸化TDP-43免疫染色(pS409/410-2)で、スケールバーは30 μm。横田 修、小森憲治郎ら意味性認知症の項目より。
発現
TDP-43はほとんどすべての細胞に発現する核タンパク質であり、核内にびまん性に局在している。患者脳ではこの正常の局在が失われ、核内の一部や細胞質、神経突起などに異常な翻訳後修飾(リン酸化、ユビキチン化および断片化など)を受けた TDP-43が凝集体を形成し、それぞれ核内封入体 (neuronal intranuclear inclusion: NII)、細胞内封入体 (neuronal cytoplasmic inclusion: NCI)、変性神経突起 (dystrophic neurite: DN)と呼ばれる。さらに神経細胞のみならずオリゴデンドロサイトの細胞質内にも凝集体を形成する。これらはグリア細胞質内封入体 (glial cytoplasmic inclusion: GCI) と呼ばれ、その出現部位は多様である。
これらのTDP-43陽性構造物は無作為に出現するのではなく、患者ごとにある程度の出現パターンが存在し、細胞内封入体と短い変性神経突起が主に皮質第2層に混在して蓄積するタイプA、細胞内封入体が皮質全層に認められるタイプB、長い変性神経突起が皮質第2層に蓄積するタイプC、短い変性神経突起と核内封入体が全層に蓄積するタイプDの4型に主に分類される(表、図2)[17]。これらの病理型は、不溶化TDP-43が呈する生化学的特徴とも相関しており、患者脳から抽出した界面活性剤不溶性画分のウェスタンブロット解析において、TDP-43のC末端断片のパターンは病理学的サブタイプごとに異なっている[18]。
| タイプ | 組織学的初見 |
|---|---|
| タイプA | 細胞内封入体と短い変性神経突起が主に皮質第2層に混在して蓄積 |
| タイプB | 細胞内封入体が皮質全層に認められる |
| タイプC | 長い変性神経突起が皮質第2層に蓄積 |
| タイプD | 短い変性神経突起と核内封入体が全層に蓄積 |
疾患との関わり
家族性あるいは孤発性ALSやFTLDで見いだされたミスセンス変異と疾患との関わりとして、ミスセンス変異によりTDP-43の断片化が促進されること[19][20]、あるいは凝集性の高いC末端断片(162-414残基)にミスセンス変異を導入すると、その凝集性が増加することが報告されており[21]、ミスセンス変異によるgain of toxic-functionの可能性が示唆されている。
一方で、患者脳においてTDP-43の細胞質封入体が存在する細胞の核からTDP-43の染色性が消失すること[4][5] 、および培養細胞モデルを用いた解析により、C末端断片の凝集体に全長TDP-43も巻き込まれて蓄積すること[21]から、核におけるTDP-43の生理機能の喪失により神経細胞死が誘導される可能性(loss of function)も考えられており、現在のところ統一的な見解は得られていない。TDP-43の疾患モデル動物として種々のトランスジェニック動物が産出されているが、ヒト疾患とは異なる症状を呈する報告も散見されており、現在のところgold standardとなるモデルが出来ていない。
また最近では、患者脳内で蓄積・凝集した不溶化TDP-43が、異常プリオンタンパク質と同様な性質を有することが示されており、TDP-43の凝集体が細胞から細胞へと伝播し、自身を鋳型として本来なら凝集しないはずの正常TDP-43を次々と凝集させ、最終的に細胞死を誘導するという機構が考えられている[22]。近年、タンパク質凝集の新たなメカニズムとして液-液相分離という現象が注目されており、TDP-43の凝集に関してもこの現象が関与することが多数報告されている[6]。
関連項目
参考文献
- ↑
Ou, S.H., Wu, F., Harrich, D., García-Martínez, L.F., & Gaynor, R.B. (1995).
Cloning and characterization of a novel cellular protein, TDP-43, that binds to human immunodeficiency virus type 1 TAR DNA sequence motifs. Journal of virology, 69(6), 3584-96. [PubMed:7745706] [PMC] [WorldCat] [DOI] - ↑
Buratti, E., & Baralle, F.E. (2001).
Characterization and functional implications of the RNA binding properties of nuclear factor TDP-43, a novel splicing regulator of CFTR exon 9. The Journal of biological chemistry, 276(39), 36337-43. [PubMed:11470789] [WorldCat] [DOI] - ↑ 3.0 3.1
Buratti, E., Dörk, T., Zuccato, E., Pagani, F., Romano, M., & Baralle, F.E. (2001).
Nuclear factor TDP-43 and SR proteins promote in vitro and in vivo CFTR exon 9 skipping. The EMBO journal, 20(7), 1774-84. [PubMed:11285240] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Arai, T., Hasegawa, M., Akiyama, H., Ikeda, K., Nonaka, T., Mori, H., ..., & Oda, T. (2006).
TDP-43 is a component of ubiquitin-positive tau-negative inclusions in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Biochemical and biophysical research communications, 351(3), 602-11. [PubMed:17084815] [WorldCat] [DOI] - ↑ 5.0 5.1
Neumann, M., Sampathu, D.M., Kwong, L.K., Truax, A.C., Micsenyi, M.C., Chou, T.T., ..., & Lee, V.M. (2006).
Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science (New York, N.Y.), 314(5796), 130-3. [PubMed:17023659] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Prasad, A., Bharathi, V., Sivalingam, V., Girdhar, A., & Patel, B.K. (2019).
Molecular Mechanisms of TDP-43 Misfolding and Pathology in Amyotrophic Lateral Sclerosis. Frontiers in molecular neuroscience, 12, 25. [PubMed:30837838] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Guo, W., Chen, Y., Zhou, X., Kar, A., Ray, P., Chen, X., ..., & Wu, J.Y. (2011).
An ALS-associated mutation affecting TDP-43 enhances protein aggregation, fibril formation and neurotoxicity. Nature structural & molecular biology, 18(7), 822-30. [PubMed:21666678] [PMC] [WorldCat] [DOI] - ↑
Strong, M.J., Volkening, K., Hammond, R., Yang, W., Strong, W., Leystra-Lantz, C., & Shoesmith, C. (2007).
TDP43 is a human low molecular weight neurofilament (hNFL) mRNA-binding protein. Molecular and cellular neurosciences, 35(2), 320-7. [PubMed:17481916] [WorldCat] [DOI] - ↑
Ayala, Y.M., Misteli, T., & Baralle, F.E. (2008).
TDP-43 regulates retinoblastoma protein phosphorylation through the repression of cyclin-dependent kinase 6 expression. Proceedings of the National Academy of Sciences of the United States of America, 105(10), 3785-9. [PubMed:18305152] [PMC] [WorldCat] [DOI] - ↑
Bose, J.K., Wang, I.F., Hung, L., Tarn, W.Y., & Shen, C.K. (2008).
TDP-43 overexpression enhances exon 7 inclusion during the survival of motor neuron pre-mRNA splicing. The Journal of biological chemistry, 283(43), 28852-9. [PubMed:18703504] [PMC] [WorldCat] [DOI] - ↑
Wu, L.S., Cheng, W.C., Hou, S.C., Yan, Y.T., Jiang, S.T., & Shen, C.K. (2010).
TDP-43, a neuro-pathosignature factor, is essential for early mouse embryogenesis. Genesis (New York, N.Y. : 2000), 48(1), 56-62. [PubMed:20014337] [WorldCat] [DOI] - ↑
Sephton, C.F., Good, S.K., Atkin, S., Dewey, C.M., Mayer, P., Herz, J., & Yu, G. (2010).
TDP-43 is a developmentally regulated protein essential for early embryonic development. The Journal of biological chemistry, 285(9), 6826-34. [PubMed:20040602] [PMC] [WorldCat] [DOI] - ↑
Kraemer, B.C., Schuck, T., Wheeler, J.M., Robinson, L.C., Trojanowski, J.Q., Lee, V.M., & Schellenberg, G.D. (2010).
Loss of murine TDP-43 disrupts motor function and plays an essential role in embryogenesis. Acta neuropathologica, 119(4), 409-19. [PubMed:20198480] [PMC] [WorldCat] [DOI] - ↑
Polymenidou, M., Lagier-Tourenne, C., Hutt, K.R., Huelga, S.C., Moran, J., Liang, T.Y., ..., & Cleveland, D.W. (2011).
Long pre-mRNA depletion and RNA missplicing contribute to neuronal vulnerability from loss of TDP-43. Nature neuroscience, 14(4), 459-68. [PubMed:21358643] [PMC] [WorldCat] [DOI] - ↑
Ayala, Y.M., De Conti, L., Avendaño-Vázquez, S.E., Dhir, A., Romano, M., D'Ambrogio, A., ..., & Baralle, F.E. (2011).
TDP-43 regulates its mRNA levels through a negative feedback loop. The EMBO journal, 30(2), 277-88. [PubMed:21131904] [PMC] [WorldCat] [DOI] - ↑
Avendaño-Vázquez, S.E., Dhir, A., Bembich, S., Buratti, E., Proudfoot, N., & Baralle, F.E. (2012).
Autoregulation of TDP-43 mRNA levels involves interplay between transcription, splicing, and alternative polyA site selection. Genes & development, 26(15), 1679-84. [PubMed:22855830] [PMC] [WorldCat] [DOI] - ↑
Irwin, D.J., Cairns, N.J., Grossman, M., McMillan, C.T., Lee, E.B., Van Deerlin, V.M., ..., & Trojanowski, J.Q. (2015).
Frontotemporal lobar degeneration: defining phenotypic diversity through personalized medicine. Acta neuropathologica, 129(4), 469-91. [PubMed:25549971] [PMC] [WorldCat] [DOI] - ↑
Hasegawa, M., Arai, T., Nonaka, T., Kametani, F., Yoshida, M., Hashizume, Y., ..., & Akiyama, H. (2008).
Phosphorylated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Annals of neurology, 64(1), 60-70. [PubMed:18546284] [PMC] [WorldCat] [DOI] - ↑
Kabashi, E., Valdmanis, P.N., Dion, P., Spiegelman, D., McConkey, B.J., Vande Velde, C., ..., & Rouleau, G.A. (2008).
TARDBP mutations in individuals with sporadic and familial amyotrophic lateral sclerosis. Nature genetics, 40(5), 572-4. [PubMed:18372902] [WorldCat] [DOI] - ↑
Sreedharan, J., Blair, I.P., Tripathi, V.B., Hu, X., Vance, C., Rogelj, B., ..., & Shaw, C.E. (2008).
TDP-43 mutations in familial and sporadic amyotrophic lateral sclerosis. Science (New York, N.Y.), 319(5870), 1668-72. [PubMed:18309045] [WorldCat] [DOI] - ↑ 21.0 21.1
Nonaka, T., Kametani, F., Arai, T., Akiyama, H., & Hasegawa, M. (2009).
Truncation and pathogenic mutations facilitate the formation of intracellular aggregates of TDP-43. Human molecular genetics, 18(18), 3353-64. [PubMed:19515851] [WorldCat] [DOI] - ↑
Nonaka, T., Masuda-Suzukake, M., Arai, T., Hasegawa, Y., Akatsu, H., Obi, T., ..., & Hasegawa, M. (2013).
Prion-like properties of pathological TDP-43 aggregates from diseased brains. Cell reports, 4(1), 124-34. [PubMed:23831027] [WorldCat] [DOI]