「くも膜下出血」の版間の差分
細編集の要約なし |
細 →脳血管攣縮 |
||
| (同じ利用者による、間の1版が非表示) | |||
| 22行目: | 22行目: | ||
家族歴が危険因子とする報告もわが国から報告されている<ref name=Okamoto2003><pubmed>12574554</pubmed></ref>。脳動脈瘤の保有に関しては一親等以内に脳動脈瘤を有する者の4%に脳動脈瘤が認められる<ref name=Magnetic1999><pubmed>10536126</pubmed></ref>。 | 家族歴が危険因子とする報告もわが国から報告されている<ref name=Okamoto2003><pubmed>12574554</pubmed></ref>。脳動脈瘤の保有に関しては一親等以内に脳動脈瘤を有する者の4%に脳動脈瘤が認められる<ref name=Magnetic1999><pubmed>10536126</pubmed></ref>。 | ||
夏より冬に多いという季節性はあるが、気候との関連は示されていない<ref name= | 夏より冬に多いという季節性はあるが、気候との関連は示されていない<ref name=de Steenhuijsen Piters2013><pubmed>23070464</pubmed></ref>。 | ||
==病態== | ==病態== | ||
| 104行目: | 104行目: | ||
[[ファイル:Tsuji SAH Fig1.png|サムネイル|'''図1. くも膜下出血の単純CT画像とCT血管造影像'''<br>黄色矢印にてくも膜下出血を示すCT値の上昇(高吸収)と、右内頚動脈の動脈瘤の存在を示す(自験例)]] | [[ファイル:Tsuji SAH Fig1.png|サムネイル|'''図1. くも膜下出血の単純CT画像とCT血管造影像'''<br>黄色矢印にてくも膜下出血を示すCT値の上昇(高吸収)と、右内頚動脈の動脈瘤の存在を示す(自験例)]] | ||
===検査=== | ===検査=== | ||
くも膜下出血を疑う場合に最初に行うべき画像診断は頭部[[単純CT]]である('''図1''')。動脈瘤破裂後48時間以内に、単純CTで患者の95 %でくも膜下出血の所見が認められる。CT上の出血の局在により破裂動脈瘤の位置推定が、また出血の量は脳血管攣縮による遅発性脳虚血症状が生ずる蓋然性を予測することができる。CTにて出血が指摘できない場合でも臨床症状からくも膜下出血を疑う場合には、占拠性病変や[[閉塞性水頭症]]がないことを確認したうえで[[腰椎穿刺]]を行い血性[[脳脊髄液]]の有無を確認する<ref name= | くも膜下出血を疑う場合に最初に行うべき画像診断は頭部[[単純CT]]である('''図1''')。動脈瘤破裂後48時間以内に、単純CTで患者の95 %でくも膜下出血の所見が認められる。CT上の出血の局在により破裂動脈瘤の位置推定が、また出血の量は脳血管攣縮による遅発性脳虚血症状が生ずる蓋然性を予測することができる。CTにて出血が指摘できない場合でも臨床症状からくも膜下出血を疑う場合には、占拠性病変や[[閉塞性水頭症]]がないことを確認したうえで[[腰椎穿刺]]を行い血性[[脳脊髄液]]の有無を確認する<ref name=van der Wee1995><pubmed>7897421</pubmed></ref>。微量の出血の検出には[[MRI]]の[[FLAIR]] ([[fluid attenuated inversion recovery]])撮像が有用である。 | ||
前項で記したCTおよびMRIによるくも膜下出血の存在診断に引き続き、出血源確認目的で行うべき検査は脳血管撮影である。これは破裂動脈瘤の部位と形態、血管内治療を想定した場合には関連する血管解剖を明らかにするため再出血予防目的の治療介入前に必須の検査である。迅速な検査と低侵襲性から、[[CT血管撮影]]([[CT Angiography]]:CTA)が頻用され、脳血管撮影に近い情報が得られるとする報告が多い<ref name=Wintermark2003><pubmed>12691409</pubmed></ref>。アレルギーなどのためにCTAには必須である[[ヨード造影剤]]の使用できない患者では、[[MR血管撮影]]([[MR Angigraphy]]:MRA)による評価も行われる。 | 前項で記したCTおよびMRIによるくも膜下出血の存在診断に引き続き、出血源確認目的で行うべき検査は脳血管撮影である。これは破裂動脈瘤の部位と形態、血管内治療を想定した場合には関連する血管解剖を明らかにするため再出血予防目的の治療介入前に必須の検査である。迅速な検査と低侵襲性から、[[CT血管撮影]]([[CT Angiography]]:CTA)が頻用され、脳血管撮影に近い情報が得られるとする報告が多い<ref name=Wintermark2003><pubmed>12691409</pubmed></ref>。アレルギーなどのためにCTAには必須である[[ヨード造影剤]]の使用できない患者では、[[MR血管撮影]]([[MR Angigraphy]]:MRA)による評価も行われる。 | ||
2021年7月5日 (月) 23:41時点における版
辻 篤司
滋賀医科大学医学部医学科脳神経外科学講座
DOI:10.14931/bsd.9864 原稿受付日:2021年5月6日 原稿完成日:2021年7月5日
担当編集委員:漆谷 真(滋賀医科大学 医学部 脳神経内科)
英:subarachnoid hemorrhage 独:Subarachnoidalblutung 仏:hémorragie sous-arachnoïdienne
英略語:SAH
くも膜下腔へ出血をきたした疾患がくも膜下出血である。外傷等を除いた内因性疾患ではその原因の85 %は脳動脈瘤破裂によるもので、10%が原因不明、5 %が脳動静脈奇形など他の疾患によるとされる。突発する強度の頭痛、悪心嘔吐、意識障害が特徴的臨床症状である。確定診断には単純CT、MRIのFLAIR画像上、くも膜下腔内の血液の存在を確認する。脳動脈瘤の部位、形状の診断には脳血管撮影、3D-CT血管撮影、MR血管撮影が用いられる。再出血は初回出血の24時間以内にピークがあり、1カ月以内に20~30%が再出血し、その後の再出血率は年3%となる。再出血予防のための治療には開頭クリッピング術または血管内治療によるコイル塞栓術が行われる。破裂脳動脈瘤によるくも膜下出血の三大予後不良因子は 直接的脳損傷、再出血、脳血管攣縮である。危険因子としては喫煙、高血圧、大量飲酒および家族歴がある。
くも膜下出血とは
くも膜下腔へ出血をきたした疾患がくも膜下出血である。外傷等を除いた内因性疾患ではその原因の85 %は脳動脈瘤破裂によるもので、10%が原因不明、5 %が脳動静脈奇形など他の疾患によるとされる[1]。破裂脳動脈瘤では、急性期の再破裂防止の問題とともに、脳血管攣縮による脳虚血や正常圧水頭症などのさまざまな問題が、発症後およそ1ヶ月の間に続発し、治療法が進歩した現代においても、死亡率・神経学的後遺障害ともに未だ高く、克服するべき脳卒中の代表疾患の一つである。
疫学
くも膜下出血の発症率には国別地域差、民族差、人種差があり、日本では人口10万人あたり約20人と白人に比して多く、死亡は10人程度である[2][3]。脳血管障害に占めるくも膜下出血の割合は近年やや増加傾向にある。死亡率では女性の増加が際立ち、年齢調整後でも女性が男性に比べ2倍近い頻度で多い[2][3]。
危険因子としては高血圧、過度の飲酒、喫煙があり、特に喫煙は一日20本以上の男性、15本以上の女性はとともに有意に高値であるが、禁煙すると非喫煙者と同等になる[4][5]。日本のコホート研究では、高血圧、脳卒中の家族歴、喫煙、塩分摂取、輸血の既往、痩せた男性(BMI<18.5) 、女性ではストレスなどが有意に高い[6]。
家族歴が危険因子とする報告もわが国から報告されている[7]。脳動脈瘤の保有に関しては一親等以内に脳動脈瘤を有する者の4%に脳動脈瘤が認められる[8]。
夏より冬に多いという季節性はあるが、気候との関連は示されていない引用エラー: <ref> タグ内の引数が無効です。
病態
病態生理
頭蓋内動脈には、頭蓋外動脈と異なり外弾性板が存在せず、内皮細胞・内弾性板・中膜・外膜によって構成される。脳動脈瘤では、内弾性板の消失や中膜平滑筋細胞の脱落・消失などの血管壁の退行性変化が認められる。外膜に好中球・リンパ球・マクロファージなどの炎症細胞の浸潤がみられ、外膜から中膜にかけて補体や免疫グロブリンの沈着が認められる。脳動脈瘤壁における中膜の菲薄化、膠原線維の減少、平滑筋細胞の脱落と炎症所見は破裂脳動脈瘤で顕著である[9]。
脳動脈瘤の発生機序として、脳動脈瘤形成初期には、脳血管分岐部の内皮細胞層において血行力学的なストレスとそれに起因する内皮細胞の機能的・器質的損傷により炎症関連転写因子 nuclear factor kappa B(NF-κB)が活性化され、様々な炎症関連遺伝子の発現を塞栓させ、monocyte chemoattractant protein-1(MCP-1)の発現亢進がマクロファージを脳血管分岐部へ動員させ、脳動脈瘤形成に重要な役割を果たすと考えられている。これらの血管壁の慢性炎症に伴い、タンパク質分解酵素の発現亢進、活性酸素産生、サイトカイン分泌、アポトーシス誘導などを介して脳動脈瘤が形成される[10]。
血行力学的なストレスにはwall shear stressのみならずmechanical stretchも関与していることや、瘤形成初期からのマクロファージの関与、動脈瘤壁の線維芽細胞の活性化、新生血管の増生と破裂リスクの上昇なども報告されており、今後これらの解析により、破裂に関わる因子、動脈瘤壁の画像診断による脆弱性評価、破裂予防のための薬物治療介入などの開発につながることが期待される[11]。
臨床病態
脳動脈瘤破裂によるくも膜下出血の病態を特徴づける直接的脳損傷は、本疾患が頭蓋内という閉鎖空間で、その内圧の調整機能を担っている脳脊髄液内に、動脈血(圧)の出血が生じることで、ほぼ瞬時に頭蓋内圧が収縮期血圧まで上昇するため、重症例では脳灌流圧が著しく低下する高度の脳虚血が全脳的に発生する状態と言い換えることができる。これを後述する脳血管攣縮後の遅発性虚血性神経障害 (delayed ischemic neurological deficits : DIND)と対比させて急性虚血性神経障害(acute ischemic neurological deficits : AIND)と呼称する場合がある。特徴的症状である「突発する激しい頭痛と嘔吐、意識障害」はこのAINDと出血自身による髄膜刺激症候からなる。
くも膜下出血の予後を最も決定する因子は直接的脳損傷であり、発症時から高度の意識障害を示す重症例の予後は非常に悪いことから、来院時や治療前の意識障害に基づく重症度分類が広く用いられている。Hunt & Hess分類[12](表1)、Hunt & Kosnik分類[13] (表2) と、これらに グラスゴー・コーマ・スケール (Glasgow Coma Scale、GCS)での意識障害の点数を加味した国際脳神経外科連合(World Federation of Neuro-logical Societies:WFNS)によるWFNS分類を示す[14](表3))。WFNS分類ではGrade2とGrade3では片麻痺・失語症といった脳局所症状の有無で重症度を分類しているが、予後との相関に乏しく、GCSのみによるmodified WFNS分類(表4)の有用性も報告されている[15]。
| Grade 1 | 無症状か、最小限の頭痛および軽度の項部硬直をみる |
| Grade 2 | 中等度から強度の頭痛、項部硬直をみるが、脳神経麻痺以外の神経学的失調はみられない |
| Grade 3 | 傾眠状態、錯乱状態、または軽度の巣症状を示す |
| Grade 4 | 昏迷状態で、中等度から重篤な片麻痺があり、早期除脳硬直および自律神経障害を伴うこともある |
| Grade 5 | 深昏睡状態で除脳硬直を示し、瀕死の様相を示す |
| Grade 0 | 未破裂動脈瘤 |
| Grade 1 | 意識清明で神経症状のないもの、またはあってもごく軽度の頭痛、項部硬直のあるもの |
| Grade 1a | 急性の髄膜または脳症状はないが、固定した神経脱落症状があるもの |
| Grade 2 | 意識清明で中等度から高度の頭痛、項部硬直はあるが、神経症状(脳神経麻痺を除く)を欠くもの |
| Grade 3 | 傾眠状態、錯乱状態、または軽度の局所症状をもつもの |
| Grade 4 | 昏迷状態、中等度から重度の片麻痺、ときに早期除脳硬直、自律神経障害を示すもの |
| Grade 5 | 深昏睡、除脳硬直、瀕死の状態のもの |
| Grade 1 | GCS 15 |
| Grade 2 | GCS 14~13 神経症状(片麻痺あるいは失語症)なし |
| Grade 3 | GCS 14~13 神経症状あり |
| Grade 4 | GCS 12~7 |
| Grade 5 | GCS 6~3 |
GCS: グラスゴー・コーマ・スケール
| Grade 1 | GCS 15 |
| Grade 2 | GCS 14 |
| Grade 3 | GCS 13 |
| Grade 4 | GCS 12~7 |
| Grade 5 | GCS 6~3 |
症状と診断
臨床所見
「突発する激しい頭痛」と「嘔吐」「意識障害」は特徴的な症状である。患者の45%は労作に伴う激しい頭痛を訴えるが、意識消失がない。突然の頭痛に嶇吐を伴う場合には強くくも膜下出血を疑う必要がある。運動麻痺や言語障害などの「局所症状を伴わない突然の激しい頭痛」も特徴であるが、内頚動脈後交通動脈瘤破裂の場合には同側の動眼神経麻痺を認めたり、中大脳動脈分岐部の動脈瘤破裂で、側頭葉内またはシルビウス裂内に大きな血腫を伴っている場合には運動麻痺を認めたりするなど、多彩な神経症状を呈しうる。
強い頭痛や意識障害といった破裂動脈瘤によるくも膜下出血の症状を呈する数日前に、少量の出血あるいは動脈瘤の急速な増大・変形によると考えられる頭痛が先行する場合があり「警告症状 (warning sign)」といわれている[16]。くも膜下出血患者の25%が中核病院を受診する前に診療を受けているにもかかわらず、診断がついておらず、そのうちの38%が軽微なくも膜下出血であったという報告もあり、鑑別は頭痛診断における重要なpitfallである[17]。
くも膜下出血の外科治療が慢性期に行われていた時代の教科書には項部硬直や髄膜刺激症状(ケルニッヒ徴候 (Kernig's sign)、ブルジンスキー徴候 (Brudzinski's sign)など)をくも膜下出血の特徴的所見としていたものが多い。しかしながら項部硬直は発症初期にはみられないことが少なからずあり、項部硬直が認められないことをもってくも膜下出血を否定できないため、2003年の『EBMに基づくクモ膜下出血診療ガイドライン』からその旨が明記されるようになった[18]。脳動脈瘤破裂によるくも膜下出血は、診断の遅れが再出血の増加、予後の悪化につながるため、迅速で的確な診断と専門医による治療の必要性が『脳卒中治療ガイドライン2015[追補2019]』ではグレードA(行うよう強く勧められる)で強く推奨されている。
診断された場合には、発症直後は再出血を予防するため、十分な鎮痛、鎮静、降圧が望ましく、以下の検査においてこれを徹底することが重要である[19]。

黄色矢印にてくも膜下出血を示すCT値の上昇(高吸収)と、右内頚動脈の動脈瘤の存在を示す(自験例)
検査
くも膜下出血を疑う場合に最初に行うべき画像診断は頭部単純CTである(図1)。動脈瘤破裂後48時間以内に、単純CTで患者の95 %でくも膜下出血の所見が認められる。CT上の出血の局在により破裂動脈瘤の位置推定が、また出血の量は脳血管攣縮による遅発性脳虚血症状が生ずる蓋然性を予測することができる。CTにて出血が指摘できない場合でも臨床症状からくも膜下出血を疑う場合には、占拠性病変や閉塞性水頭症がないことを確認したうえで腰椎穿刺を行い血性脳脊髄液の有無を確認する引用エラー: <ref> タグ内の引数が無効です。微量の出血の検出にはMRIのFLAIR (fluid attenuated inversion recovery)撮像が有用である。
前項で記したCTおよびMRIによるくも膜下出血の存在診断に引き続き、出血源確認目的で行うべき検査は脳血管撮影である。これは破裂動脈瘤の部位と形態、血管内治療を想定した場合には関連する血管解剖を明らかにするため再出血予防目的の治療介入前に必須の検査である。迅速な検査と低侵襲性から、CT血管撮影(CT Angiography:CTA)が頻用され、脳血管撮影に近い情報が得られるとする報告が多い[20]。アレルギーなどのためにCTAには必須であるヨード造影剤の使用できない患者では、MR血管撮影(MR Angigraphy:MRA)による評価も行われる。
治療
くも膜下出血急性期の基本的治療方針は、初回出血に伴う頭蓋内圧亢進・急性水頭症などに対する直接的脳損傷の増悪軽減のための対症的治療と、再出血防止のための外科的治療介入(開頭クリッピング術、あるいは血管内治療コイル塞栓術) 、および発症数日後より顕在化する脳血管攣縮の予防・治療に要約される。積極的な脳血管攣縮の予防・治療には、破裂脳動脈瘤の再出血防止が完了していることが前提となる場合が多く、早期手術の方針は国内外のガイドラインで示されている。
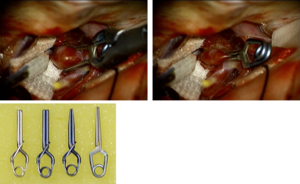
上.未破裂の脳動脈瘤のクリップ直前(左)と直後(右)(自験例)
下. 用いられるクリップの例(ブレード長10mm)
開頭クリッピング術
脳動脈瘤をクリッピングすることにより血流を遮断する方法である。開頭手術が必要となるため、患者への侵襲が大きい(図2)。
血管内治療が導入される以前のクリッピング術後の転帰については、1990年にバージニアのKassellらにより発表された国際共同研究がある。6カ月後の転帰をGlasgow Outcome Scaleでみるとgood recovery (GR) 67.9 %、moderately disabled (MD)10.4 %、severely disabled (SD) 5.7%、vegetative survival (VS) 1.7% 、dead (D) 14.3%であった[21]。時代背景も考慮する必要があり、この研究が行われた当時の日本では86%が早期手術であったのに対し、国際共同研究では早期手術の割合が42 %であった。一方で、Day 7~10でのクリッビング例ではGRは56% 、死亡率は28%と早期、晩期に比べて有意に劣った[21]。これらを受けて早期手術は1980年代後半よりわが国が先行して一般化しており、破裂脳動脈瘤に対するクリッピング術は出血後 72時間以内の早期に行うことがグレードB(行うよう勧められる)で勧められている[19]。
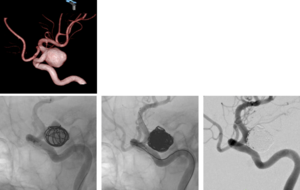
上.脳動脈瘤の3D-回転血管造影像
下. (左)動脈瘤内にコイルで外枠となるフレームを作成し、(中)その中を密に充填することで、(右)動脈瘤内への血流を遮断した。(自験例)
血管内コイル塞栓術
脳動脈瘤コイル塞栓術とは血管造影下、血管内から動脈瘤内にアプローチし、コイルで外枠となるフレームを作成し、さらにその中を密に充填することで、動脈瘤内への血流を遮断する手法である。開頭を伴わない血管内手術であり、患者への侵襲が開頭クリッピング術と比較して少ない(図3)。
1990年に臨床応用されてから、1992年にはヨーロッパ、1995年に米国FDAの認可を取得して世界に広まり、わが国では1997年3月から保険診療として開始された。以後、わが国でも破裂脳動脈瘤に対してコイル塞栓術を行う施設が急増しており、2011年には破裂脳動脈瘤治療の約3割がコイル塞栓術と推定されているが、この比率は欧米と逆であり、日本におけるコイル塞栓術は今後も増加すると推測される。なお、血管内治療も外科的治療同様、出血後早期に施行することが『脳卒中治療ガイドライン2015[追補2019]』で推奨されている(グレードC1。行うことを考慮しても良いが、十分な科学的根拠がない) [19]。
開頭クリッピング術とコイル塞栓術の比較
破裂脳動脈瘤に対する開頭クリッピング術とコイル塞栓術とのランダム化比較試験としてInternational Subarachnoid Aneurysm Trial (ISAT) とThe Barrow Ruptured Aneurysm Trial (BRAT)がある。
ISATは、英国を中心とした多施設前向きランダム化試験で、2002年に初期治療成績[22]、2005年に中間報告とサプ解析[23]、2009年と2015年に長期追跡結果[24][25]が発表された。10年後の生存・介助不要の可能性はコイル群のほうが高かった。1年後以降のくも膜下出血再発は33例、うち治療した動脈瘤からの再出血は17例でコイル群のほうが多かった。従って、長期の治療成績もコイル群のほうが良好であり。再出血はコイル群のほうが多かったものの、リスクは非常に低いという結果であった。
BRATは単一施設(Barrow Neurological Institute)における前向きランダム化試験で、2003年からの5年間の連続症例を一例ごとにそれぞれの治療に割り付け、471例に対して同じく治療企図解析 (intention to treat analysis, ITT解析)で10年後まで経過観察したものである[26][27]。その結果、再治療はクリッピング術で少ないものの、1年後、10年後の時点で、両治療群の予後不良率に差がなかったこと、後頭蓋窩動脈瘤ではコイル塞栓術の治療成績が良好であることが示された。
コイル塞栓術は当初、長期成績が不明であることや治療デバイスが十分でなかったため、クリッピング術困難な症例、全身麻酔困難な例、高齢者などのくも膜下出血患者に限定されて行われてきたが、手技、機器の進歩により治療対象症例が増加している。現時点で瘤内塞栓術に適した動脈瘤の条件は、動脈瘤頚部が小さい(4~5mm以下) 、動脈瘤が小さい(15mm以下) 、dome/neck ratio(再大横径と頚部径の比)が2以上であることとされている[19]。動脈瘤コイル塞栓術の最大の問題は再開通であるが、動脈瘤頚部が広い、大型動脈瘤に対して、破裂慢性期でのフローダイバーター留置による治療成績は良好である[28]と報告され、日本国内においても2015年以降に再発症例にも広く適応されており、破裂脳動脈瘤に対するコイル塞栓術の更なる適応拡大が期待される。
転機
くも膜下出血急性期死亡率は、その集団において治療に至らない重症例がどの程度含まれるかによって異なるが、おおよそ25~50%になると推測される。米国では、くも膜下出血死亡率は全脳卒中死亡率の4.4%にすぎないが他の脳卒中に比べて若い世代に起こり、特に65歳以下の脳卒中死亡患者の実に25%以上が くも膜下出血であると報告されている[29]。詳しくみると14%が搬送前に死亡、初回発作に起囚する総死亡率は43 %に上るとする報告や、10%が発作直後に死亡、25%が重篤となると推定されている[30]。日本からは、28日以内の死亡率30%、死亡退院率35%という結果が報告されている[2]。
脳動脈瘤破裂によるくも膜下出血の三大予後不良因子は直接的脳損傷(病態の項を参照)、再出血、脳血管攣縮であり[31]、合併症として正常圧水頭症が重要である。
再出血
破裂脳動脈瘤からの再出血は、初回出血後に自然止血されていた破裂脳動脈瘤の出血部位が全身血圧の上昇、線溶系の亢進を直接の原因として破綻し、多くの場合に初回出血より出血量が多くなるため頭蓋内灌流の低下などその病態は大幅に悪化する。この再出血の頻度は約30 %と高く、これが発症早期の羅病率と死亡率を有意に悪化させている。くも膜下出血は発症後の時間経過に従って病態の変化する疾患であるため、自然経過における再出血の頻度や程度を急性期治療が一般化した最近の臨床報告から得ることは困難である。待機的治療を行っていた時代からの報告からこれをみると、発症時の意識が傾眠レベルもしくは頭痛のみの症状の患者(Hunt & Kosnik分類grade1-3)のうち、62%が再破裂のため重大な神経脱落症状を残し、そのうち31%が死亡している[32][33]。最も再破裂が多いのは最初の24時間以内で、全体の4.1%の患者がこの時期の再出血のために状態が悪化している。以後は1.5 % /日の再出血率で、14日間の総再出血率は19%であった。Iカ月以内に20~30%が再出血し、その後は年3 %となる[34]。上記は破裂脳動脈瘤の多くを占める嚢状動脈瘤についてであり、これとは異なり、くも膜下出血発症の解離性脳動脈瘤では特に発症早期の急性期再破裂が更に多い傾向にある。
脳血管攣縮
脳血管攣縮は、その現象については1950年代から知られており、脳底槽のくも膜下腔に広がった血液に由来するヘモグロビン分解産物が原因となって、そのほかに多因子的要素(頭蓋内圧亢進、炎症、電解質異常など)も付加されて脳主幹動脈に病的・構造的変化を伴う持続性の血管狭窄を生ずるものである。出血後3~4日目から生じ5~14日後にピークを迎え、2~4週間で消退する[34]、合目的的に考えれば再出血に防御的に作用する生体反応と考えられるが、現在でもその機序は完全に解明されておらず、根治的な予防・治療方法も確立されていない。
脳血管攣縮による遅発性虚血性神経障害を呈すると、重症例では脳梗塞に移行する。Dolschらによると遅発性神経学的脱落症状は32.5 %に認められ、そのうちの30%が死亡、34%に永続的な神経脱落症状が生じた[35]。脳血管攣縮の頻度は、脳血管撮影上は50%以上、症候性のものは25.9 % 、CT上は全体で26% 、そのうち脳底槽で血腫量の多いくも膜下出血 (Fisher grade 3に相当)では38.5 %に認められた[36]。治療方法による脳血管攣縮の頻度は、クリッピング術、コイル塞栓術で脳梗塞の発生頻度や予後に有意な差はみられないとする報告もあれば血管内治療で優れるとするものもある[37][38]。
脳血管攣縮の重症度とくも膜下腔の血管周囲の血腫量との間には相関があるため[39]早期手術の目的の一つとして脳槽内への組織プラスミノゲンアクチベーター (t-PA) の術中投与[40](保険適応外)や、手術時に設置した脳槽ドレナージを用いた術後ウロキナーゼ灌流療法(保険適応外)の脳血管攣縮予防における有用性も報告されている[41]。 脳血管攣縮に対する治療では、薬物療法としてわが国ではニゾフェノン[42]、ファスジル[43]、オザグレルナトリウム[44]が承認・使用されている。海外ではカルシウムチャンネル拮抗薬ニモジピンが有効と報告されている[45]が、ニモジピンはわが国では未承認であり、他のカルシウムチャンネル拮抗薬の有効性は示されていない。またスタチン系製剤の投与で、脳血管攣縮の頻度および遅発性脳虚血症状の頻度がともに減少することが報告されている[46]。
薬物療法以外では、hypertension/ hypervolemia/ hemodilutionのトリプルH療法[47]、脳槽灌流療法[48]、また血管内治療(血管拡張薬の選択的動注療法と経皮的血管形成術) も行われることがある。これらはいずれも『脳卒中治療ガイドライン2015[追補2019]』における推奨グレードはC1(行うことを考慮しても良いが、十分な科学的根拠がない)である[19]。
正常圧水頭症
くも膜下出血数週間後に記銘力障害、尿失禁、歩行障害を三主徴とする正常圧水頭症(normal pressure hydrocephalus : NPH)が10~37%の頻度で起こり、脳室腹腔短絡術や腰椎腹腔短絡術が行われる。一般的には治療による症状改善が期待され、クリッピング術とコイル塞栓術との間での発症率の差はないと報告されている[49]。
参考文献
- ↑
van Gijn, J., & Rinkel, G.J. (2001).
Subarachnoid haemorrhage: diagnosis, causes and management. Brain : a journal of neurology, 124(Pt 2), 249-78. [PubMed:11157554] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Takashima, N., Arima, H., Kita, Y., Fujii, T., Miyamatsu, N., Komori, M., ..., & Nozaki, K. (2017).
Incidence, Management and Short-Term Outcome of Stroke in a General Population of 1.4 Million Japanese - Shiga Stroke Registry. Circulation journal : official journal of the Japanese Circulation Society, 81(11), 1636-1646. [PubMed:28579600] [WorldCat] [DOI] - ↑ 3.0 3.1
de Rooij, N.K., Linn, F.H., van der Plas, J.A., Algra, A., & Rinkel, G.J. (2007).
Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. Journal of neurology, neurosurgery, and psychiatry, 78(12), 1365-72. [PubMed:17470467] [PMC] [WorldCat] [DOI] - ↑
Kurth, T., Kase, C.S., Berger, K., Gaziano, J.M., Cook, N.R., & Buring, J.E. (2003).
Smoking and risk of hemorrhagic stroke in women. Stroke, 34(12), 2792-5. [PubMed:14615625] [WorldCat] [DOI] - ↑
Vlak, M.H., Algra, A., Brandenburg, R., & Rinkel, G.J. (2011).
Prevalence of unruptured intracranial aneurysms, with emphasis on sex, age, comorbidity, country, and time period: a systematic review and meta-analysis. The Lancet. Neurology, 10(7), 626-36. [PubMed:21641282] [WorldCat] [DOI] - ↑
Yamada, S., Koizumi, A., Iso, H., Wada, Y., Watanabe, Y., Date, C., ..., & Japan Collaborative Cohort Study Group (2003).
Risk factors for fatal subarachnoid hemorrhage: the Japan Collaborative Cohort Study. Stroke, 34(12), 2781-7. [PubMed:14657543] [WorldCat] [DOI] - ↑
Okamoto, K., Horisawa, R., Kawamura, T., Asai, A., Ogino, M., Takagi, T., & Ohno, Y. (2003).
Family history and risk of subarachnoid hemorrhage: a case-control study in Nagoya, Japan. Stroke, 34(2), 422-6. [PubMed:12574554] [WorldCat] [DOI] - ↑
Magnetic Resonance Angiography in Relatives of Patients with Subarachnoid Hemorrhage Study Group (1999).
Risks and benefits of screening for intracranial aneurysms in first-degree relatives of patients with sporadic subarachnoid hemorrhage. The New England journal of medicine, 341(18), 1344-50. [PubMed:10536126] [WorldCat] [DOI] - ↑
Frösen, J., Tulamo, R., Paetau, A., Laaksamo, E., Korja, M., Laakso, A., ..., & Hernesniemi, J. (2012).
Saccular intracranial aneurysm: pathology and mechanisms. Acta neuropathologica, 123(6), 773-86. [PubMed:22249619] [WorldCat] [DOI] - ↑
Shimizu, K., Kushamae, M., Mizutani, T., & Aoki, T. (2019).
Intracranial Aneurysm as a Macrophage-mediated Inflammatory Disease. Neurologia medico-chirurgica, 59(4), 126-132. [PubMed:30867357] [PMC] [WorldCat] [DOI] - ↑
Koseki, H., Miyata, H., Shimo, S., Ohno, N., Mifune, K., Shimano, K., ..., & Aoki, T. (2020).
Two Diverse Hemodynamic Forces, a Mechanical Stretch and a High Wall Shear Stress, Determine Intracranial Aneurysm Formation. Translational stroke research, 11(1), 80-92. [PubMed:30737656] [WorldCat] [DOI] - ↑ 12.0 12.1
Hunt, W.E., & Hess, R.M. (1968).
Surgical risk as related to time of intervention in the repair of intracranial aneurysms. Journal of neurosurgery, 28(1), 14-20. [PubMed:5635959] [WorldCat] [DOI] - ↑ 13.0 13.1
Hunt, W.E., & Kosnik, E.J. (1974).
Timing and perioperative care in intracranial aneurysm surgery. Clinical neurosurgery, 21, 79-89. [PubMed:4608645] [WorldCat] [DOI] - ↑ 14.0 14.1
(1988).
Report of World Federation of Neurological Surgeons Committee on a Universal Subarachnoid Hemorrhage Grading Scale. Journal of neurosurgery, 68(6), 985-6. [PubMed:3131498] [WorldCat] [DOI] - ↑ 15.0 15.1
Sano, H., Satoh, A., Murayama, Y., Kato, Y., Origasa, H., Inamasu, J., ..., & members of the 38 registered institutions and WFNS Cerebrovascular Disease & Treatment Committee (2015).
Modified World Federation of Neurosurgical Societies subarachnoid hemorrhage grading system. World neurosurgery, 83(5), 801-7. [PubMed:25535068] [WorldCat] [DOI] - ↑
Bassi, P., Bandera, R., Loiero, M., Tognoni, G., & Mangoni, A. (1991).
Warning signs in subarachnoid hemorrhage: a cooperative study. Acta neurologica Scandinavica, 84(4), 277-81. [PubMed:1771999] [WorldCat] [DOI] - ↑
Mayer, P.L., Awad, I.A., Todor, R., Harbaugh, K., Varnavas, G., Lansen, T.A., ..., & Hopkins, L.N. (1996).
Misdiagnosis of symptomatic cerebral aneurysm. Prevalence and correlation with outcome at four institutions. Stroke, 27(9), 1558-63. [PubMed:8784130] [WorldCat] [DOI] - ↑ 吉峰俊樹編. (2003)
科学的根拠に基づくくも膜下出血診療ガイドライン.脳卒中の外科 31(増刊号(I)):1-60. - ↑ 19.0 19.1 19.2 19.3 19.4 日本脳卒中学会 脳卒中ガイドライン[追補2019]委員会 編. (2019).
脳卒中ガイドライン2015[追補2019]、協和企画、東京. - ↑
Wintermark, M., Uske, A., Chalaron, M., Regli, L., Maeder, P., Meuli, R., ..., & Binaghi, S. (2003).
Multislice computerized tomography angiography in the evaluation of intracranial aneurysms: a comparison with intraarterial digital subtraction angiography. Journal of neurosurgery, 98(4), 828-36. [PubMed:12691409] [WorldCat] [DOI] - ↑ 21.0 21.1
Kassell, N.F., Torner, J.C., Haley, E.C., Jane, J.A., Adams, H.P., & Kongable, G.L. (1990).
The International Cooperative Study on the Timing of Aneurysm Surgery. Part 1: Overall management results. Journal of neurosurgery, 73(1), 18-36. [PubMed:2191090] [WorldCat] [DOI] - ↑
Molyneux, A., Kerr, R., Stratton, I., Sandercock, P., Clarke, M., Shrimpton, J., ..., & International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group (2002).
International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised trial. Lancet (London, England), 360(9342), 1267-74. [PubMed:12414200] [WorldCat] [DOI] - ↑
Molyneux, A.J., Kerr, R.S., Yu, L.M., Clarke, M., Sneade, M., Yarnold, J.A., ..., & International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group (2005).
International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet (London, England), 366(9488), 809-17. [PubMed:16139655] [WorldCat] [DOI] - ↑
Molyneux, A.J., Kerr, R.S., Birks, J., Ramzi, N., Yarnold, J., Sneade, M., ..., & ISAT Collaborators (2009).
Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up. The Lancet. Neurology, 8(5), 427-33. [PubMed:19329361] [PMC] [WorldCat] [DOI] - ↑
Molyneux, A.J., Birks, J., Clarke, A., Sneade, M., & Kerr, R.S. (2015).
The durability of endovascular coiling versus neurosurgical clipping of ruptured cerebral aneurysms: 18 year follow-up of the UK cohort of the International Subarachnoid Aneurysm Trial (ISAT). Lancet (London, England), 385(9969), 691-7. [PubMed:25465111] [PMC] [WorldCat] [DOI] - ↑
Spetzler, R.F., McDougall, C.G., Albuquerque, F.C., Zabramski, J.M., Hills, N.K., Partovi, S., ..., & Wallace, R.C. (2013).
The Barrow Ruptured Aneurysm Trial: 3-year results. Journal of neurosurgery, 119(1), 146-57. [PubMed:23621600] [WorldCat] [DOI] - ↑
Spetzler, R.F., McDougall, C.G., Zabramski, J.M., Albuquerque, F.C., Hills, N.K., Nakaji, P., ..., & Wallace, R.C. (2019).
Ten-year analysis of saccular aneurysms in the Barrow Ruptured Aneurysm Trial. Journal of neurosurgery, 132(3), 771-776. [PubMed:30849758] [WorldCat] [DOI] - ↑
Chancellor, B., Raz, E., Shapiro, M., Tanweer, O., Nossek, E., Riina, H.A., & Nelson, P.K. (2020).
Flow Diversion for Intracranial Aneurysm Treatment: Trials Involving Flow Diverters and Long-Term Outcomes. Neurosurgery, 86(Suppl 1), S36-S45. [PubMed:31838533] [WorldCat] [DOI] - ↑
Johnston, S.C., Selvin, S., & Gress, D.R. (1998).
The burden, trends, and demographics of mortality from subarachnoid hemorrhage. Neurology, 50(5), 1413-8. [PubMed:9595997] [WorldCat] [DOI] - ↑
Kassell, N.F., & Drake, C.G. (1982).
Timing of aneurysm surgery. Neurosurgery, 10(4), 514-9. [PubMed:7099404] [WorldCat] [DOI] - ↑
Kassell, N.F., Torner, J.C., Jane, J.A., Haley, E.C., & Adams, H.P. (1990).
The International Cooperative Study on the Timing of Aneurysm Surgery. Part 2: Surgical results. Journal of neurosurgery, 73(1), 37-47. [PubMed:2191091] [WorldCat] [DOI] - ↑
Nieuwkamp, D.J., Setz, L.E., Algra, A., Linn, F.H., de Rooij, N.K., & Rinkel, G.J. (2009).
Changes in case fatality of aneurysmal subarachnoid haemorrhage over time, according to age, sex, and region: a meta-analysis. The Lancet. Neurology, 8(7), 635-42. [PubMed:19501022] [WorldCat] [DOI] - ↑
Sundt, T.M., & Whisnant, J.P. (1978).
Subarachnoid hemorrhage from intracranial aneurysms. Surgical management and natural history of disease. The New England journal of medicine, 299(3), 116-22. [PubMed:661871] [WorldCat] [DOI] - ↑ 34.0 34.1
Mayberg, M.R., Batjer, H.H., Dacey, R., Diringer, M., Haley, E.C., Heros, R.C., ..., & Feinberg, W. (1994).
Guidelines for the management of aneurysmal subarachnoid hemorrhage. A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke, 25(11), 2315-28. [PubMed:7974568] [WorldCat] [DOI] - ↑
Dorsch, N.W., & King, M.T. (1994).
A review of cerebral vasospasm in aneurysmal subarachnoid haemorrhage Part I: Incidence and effects. Journal of clinical neuroscience : official journal of the Neurosurgical Society of Australasia, 1(1), 19-26. [PubMed:18638721] [WorldCat] [DOI] - ↑
Adams, H.P., Kassell, N.F., Torner, J.C., & Haley, E.C. (1987).
Predicting cerebral ischemia after aneurysmal subarachnoid hemorrhage: influences of clinical condition, CT results, and antifibrinolytic therapy. A report of the Cooperative Aneurysm Study. Neurology, 37(10), 1586-91. [PubMed:3658161] [WorldCat] [DOI] - ↑
Goddard, A.J., Raju, P.P., & Gholkar, A. (2004).
Does the method of treatment of acutely ruptured intracranial aneurysms influence the incidence and duration of cerebral vasospasm and clinical outcome? Journal of neurology, neurosurgery, and psychiatry, 75(6), 868-72. [PubMed:15146002] [PMC] [WorldCat] [DOI] - ↑
Rabinstein, A.A., Pichelmann, M.A., Friedman, J.A., Piepgras, D.G., Nichols, D.A., McIver, J.I., ..., & Wijdicks, E.F. (2003).
Symptomatic vasospasm and outcomes following aneurysmal subarachnoid hemorrhage: a comparison between surgical repair and endovascular coil occlusion. Journal of neurosurgery, 98(2), 319-25. [PubMed:12593618] [WorldCat] [DOI] - ↑
Dehdashti, A.R., Mermillod, B., Rufenacht, D.A., Reverdin, A., & de Tribolet, N. (2004).
Does treatment modality of intracranial ruptured aneurysms influence the incidence of cerebral vasospasm and clinical outcome? Cerebrovascular diseases (Basel, Switzerland), 17(1), 53-60. [PubMed:14530638] [WorldCat] [DOI] - ↑
Findlay, J.M., Kassell, N.F., Weir, B.K., Haley, E.C., Kongable, G., Germanson, T., ..., & Knuckey, N.W. (1995).
A randomized trial of intraoperative, intracisternal tissue plasminogen activator for the prevention of vasospasm. Neurosurgery, 37(1), 168-76; discussion 177-8. [PubMed:8587685] [WorldCat] - ↑
Kodama, N., Sasaki, T., Kawakami, M., Sato, M., & Asari, J. (2000).
Cisternal irrigation therapy with urokinase and ascorbic acid for prevention of vasospasm after aneurysmal subarachnoid hemorrhage. Outcome in 217 patients. Surgical neurology, 53(2), 110-7; discussion 117-8. [PubMed:10713187] [WorldCat] [DOI] - ↑
Saito, I., Asano, T., Ochiai, C., Takakura, K., Tamura, A., & Sano, K. (1983).
A double-blind clinical evaluation of the effect of Nizofenone (Y-9179) on delayed ischemic neurological deficits following aneurysmal rupture. Neurological research, 5(4), 29-47. [PubMed:6149485] [WorldCat] [DOI] - ↑
Shibuya, M., Suzuki, Y., Sugita, K., Saito, I., Sasaki, T., Takakura, K., ..., & Hidaka, H. (1992).
Effect of AT877 on cerebral vasospasm after aneurysmal subarachnoid hemorrhage. Results of a prospective placebo-controlled double-blind trial. Journal of neurosurgery, 76(4), 571-7. [PubMed:1545249] [WorldCat] [DOI] - ↑
Suzuki, S., Sano, K., Handa, H., Asano, T., Tamura, A., Yonekawa, Y., ..., & Hanaoka, K. (1989).
Clinical study of OKY-046, a thromboxane synthetase inhibitor, in prevention of cerebral vasospasms and delayed cerebral ischaemic symptoms after subarachnoid haemorrhage due to aneurysmal rupture: a randomized double-blind study. Neurological research, 11(2), 79-88. [PubMed:2569686] [WorldCat] [DOI] - ↑
Allen, G.S., Ahn, H.S., Preziosi, T.J., Battye, R., Boone, S.C., Boone, S.C., ..., & Transou, C.R. (1983).
Cerebral arterial spasm--a controlled trial of nimodipine in patients with subarachnoid hemorrhage. The New England journal of medicine, 308(11), 619-24. [PubMed:6338383] [WorldCat] [DOI] - ↑
Tseng, M.Y., Czosnyka, M., Richards, H., Pickard, J.D., & Kirkpatrick, P.J. (2005).
Effects of acute treatment with pravastatin on cerebral vasospasm, autoregulation, and delayed ischemic deficits after aneurysmal subarachnoid hemorrhage: a phase II randomized placebo-controlled trial. Stroke, 36(8), 1627-32. [PubMed:16049199] [WorldCat] [DOI] - ↑
Sen, J., Belli, A., Albon, H., Morgan, L., Petzold, A., & Kitchen, N. (2003).
Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage. The Lancet. Neurology, 2(10), 614-21. [PubMed:14505583] [WorldCat] [DOI] - ↑
Amin-Hanjani, S., Ogilvy, C.S., & Barker, F.G. (2004).
Does intracisternal thrombolysis prevent vasospasm after aneurysmal subarachnoid hemorrhage? A meta-analysis. Neurosurgery, 54(2), 326-34; discussion 334-5. [PubMed:14744278] [WorldCat] [DOI] - ↑
Zeng, J., Qin, L., Wang, D., Gong, J., Pan, J., Zhu, Y., ..., & Zhan, R. (2019).
Comparing the Risk of Shunt-Dependent Hydrocephalus in Patients with Ruptured Intracranial Aneurysms Treated by Endovascular Coiling or Surgical Clipping: An Updated Meta-Analysis. World neurosurgery, 121, e731-e738. [PubMed:30308338] [WorldCat] [DOI]