「全胚培養」の版間の差分
細編集の要約なし |
Takakokikkawa (トーク | 投稿記録) 細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/t-kikkawa 吉川 貴子]、[http://researchmap.jp/noriko1128 大隅 典子]</font><br> | <font size="+1">[http://researchmap.jp/t-kikkawa 吉川 貴子]、[http://researchmap.jp/noriko1128 大隅 典子]</font><br> | ||
''東北大学大学院医学系研究科''<br> | ''東北大学大学院医学系研究科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2012年5月7日 原稿完成日:2012年10月25日<br> | ||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
2021年8月2日 (月) 13:05時点における版
吉川 貴子、大隅 典子
東北大学大学院医学系研究科
DOI:10.14931/bsd.1202 原稿受付日:2012年5月7日 原稿完成日:2012年10月25日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英:whole embryo culture 英略語:WEC
同義語:子宮外培養法 (ex utero culture)
全胚培養とは、着床後の哺乳類胚を母体から取り出し、一定期間試験管の中で培養する手法である。全胚培養法の確立により、哺乳類胚においても局所標識による細胞系譜の追跡、移植実験、組織・領域特異的な 遺伝子導入などが可能なった。ラット、マウスだけではなく、ハムスター、モル モット、ウサギ、スンクスなどの動物種でも培養可能である。
歴史
哺乳類の胎児は子宮の中で発育することから、鳥類や魚類のようには発生段階を時間に沿って観察することが出来ない。哺乳類の胎児を体外へと取り出して観察する試みは古くから試されてはいたものの、1920年代までは初期胚(卵、胞胚)に関する報告しかなかった。
1930年代になってようやく、着床後の胚を培養する試みが始まり、その後1960年代のサリドマイド事件により催奇形性に関する社会の関心が増大したことなどを背景に、哺乳類の器官形成期を研究するための方法に新たな興味が注がれるようになった。この時期に開発されたのが、Watch glass cultureと呼ばれる方法である[1]。Watch glass cultureでは、培養液(血清)と胚を入れた時計皿をシャーレの中に入れ、高湿度を保ちながら高酸素分圧下でインキュベートするものであった。そして、より長時間の培養を可能にするために、培養液を循環させるCirculator systemと呼ばれる方法が試みられた[2]。しかしながら、胚を固定した状態で観察できる反面、複雑な装置を必要とし、操作が煩雑な上に培養胚へのアクセスが容易ではないという欠点を持ち合わせていた。
この問題を解決するために、今日広く用いられている手法の基本形となるRoller bottle/tube systemがNewらによって1970年代に開発された[3]。Roller bottle/tube systemは、胚を培養液の入っている培養ビンに移した後、その中に混合ガス(酸素、二酸化炭素、窒素)を吹き入れ、インキュベーターの中のローラー上に置き、回転して培養する方法である。回転によってビンの中のガスは培養液によく吸収され、胚が培養液中で揺さぶられることによって、体表よりガスと栄養の吸収を活発に行うことが出来る。欠点として、一定時間ごとにガスを培養ビンに吹き込む必要があり、十分なガス供給を必要とする器官形成期中期以降の胚の培養には不向きであった。
このような歴史を経て、現在実際的に使用されているのは、主にRotator systemである[4]。この方法は、培養液と胚を入れたガラスビンを中空のドラム(ローター)に穴空きのシリコン栓を介して取り付けて回転培養するもので、培養期間中を通してガスを連続的に供給することができる。混合ガスはボンベのレギュレーターから流量計を介して、ローターの軸受け部にあるインレット管に接続している。適切な酸素濃度の混合ガスが送り込まれ、回転によって培養液が撹拌されてガスが培養液中に拡散され、軸受け部にあるアウトレット管を通って排出される仕組みになっている。培養胚の時期を選択しない汎用性、ガス組成や流量を調節する際の確実性、培養中の胚へのアクセスの容易さなどから最も優れた方法であると考えられる。
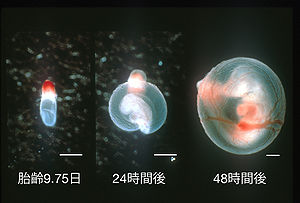
胎齡9.75日に摘出し(左図)、培養液に移して24時間(中図)、および48時間(右図)培養したラット胚。スケールバー : 500μm
培養可能な発生段階と培養期間
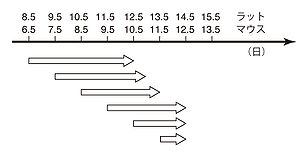
全胚培養に用いられる胚の発生段階は、器官形成初期(膣栓確認日を0日として、ラットなら胎齡8日目、マウスなら6日目)から、器官形成後期(ラット13日目、マウス11日目)までである(図1、図2)[5]。ラット11.5日、マウス9.5日以降の胚の発育は胎盤機能に依存するところが大きいため、この時期以降の培養可能器官は短くなる。この期間に起こる発生事象であれば、全胚培養法を用いて解析可能と言える。詳細な実験手法については文献を参照されたい[6][7]。なお、ウサギやスンクスなどは卵黄嚢膜の形態がげっ歯類と若干異なるために、胚操作の方法もやや異なる。
発生学への応用
全胚培養で用いる胚の発生段階は器官形成期という最もダイナミックな形態形成が行われる時期であり、細胞増殖、細胞移動、細胞分化などの重要な発生事象が起こる。この発生段階に色素を用いた細胞標識、細胞移植など[8]を行うことにより、細胞系譜や分化運命のポテンシャルを検討することができる。また、薬剤や生理活性物質を培養液に添加することにより、発生毒性・胎児代謝の研究に応用されており、医薬品の安全性試験としても使用されている。
胚発生における特定遺伝子の機能を知るためには、時間的、空間的に制御可能な遺伝子操作が必要である。近年の遺伝子工学技術はめざましく、トランスジェニック動物やノックアウト動物などの技術が開発され、さらにcre-loxPシステムによる条件つき遺伝子改変が可能になったものの、その作製労力を考えると決して簡便ではない。全胚培養法を用いれば、電気穿孔法(エレクトロポレーション法)を組み合わせることによって、他の方法の適用が困難な発生の早期においても遺伝子を直接細胞内に導入することができる[9]。導入する遺伝子は単独である必要はなく、複数の遺伝子を導入時に、あるいは時間差で導入することも可能である。また、ドミナントネガティブ分子による機能阻害実験、siRNAによるノックダウン実験[10]、およびウィルスベクターを用いた遺伝子導入も可能である。これらの技術は基礎研究だけでなく、特定の疾患モデル動物を対象とした遺伝子治療の研究にも有効であると考えられる。
なお、多能性幹細胞からの初期胚の培養法が進展してきたことにより、着床前の胚の全胚培養(子宮外培養)と組み合わせることが可能になれば、さらに長期にわたって哺乳類胚を子宮外で培養することが可能になる。この点は生命倫理的な問題も含むことに注意しておくべきである。
参考文献
- ↑
New, D.A. (1966).
Development of rat embryos cultured in blood sera. Journal of reproduction and fertility, 12(3), 509-24. [PubMed:5928270] [WorldCat] [DOI] - ↑
New, D.A. (1967).
Development of explanted rat embryos in circulating medium. Journal of embryology and experimental morphology, 17(3), 513-25. [PubMed:4860575] [WorldCat] - ↑
New, D.A., Coppola, P.T., & Terry, S. (1973).
Culture of explanted rat embryos in rotating tubes. Journal of reproduction and fertility, 35(1), 135-8. [PubMed:4742154] [WorldCat] [DOI] - ↑
Eto, K., & Takakubo, F. (1985).
Improved development of rat embryos in culture during the period of craniofacial morphogenesis. Journal of craniofacial genetics and developmental biology, 5(4), 351-5. [PubMed:4077955] [WorldCat] - ↑ 大隅典子、二宮洋一郎、江藤一洋
ニューロサイエンス・ラボマニュアル3 神経生物学のための胚と個体の遺伝子操作法 3.4神経発生研究における哺乳類全胚培養法
シュプリンガー・フェアラーク東京:1997 - ↑
Takahashi, M., Nomura, T., & Osumi, N. (2008).
Transferring genes into cultured mammalian embryos by electroporation. Development, growth & differentiation, 50(6), 485-97. [PubMed:18505466] [WorldCat] [DOI] - ↑
Takahashi, M., & Osumi, N. (2010).
The method of rodent whole embryo culture using the rotator-type bottle culture system. Journal of visualized experiments : JoVE, (42). [PubMed:20834217] [PMC] [WorldCat] [DOI] - ↑
Matsuo, T., Osumi-Yamashita, N., Noji, S., Ohuchi, H., Koyama, E., Myokai, F., ..., & Iseki, S. (1993).
A mutation in the Pax-6 gene in rat small eye is associated with impaired migration of midbrain crest cells. Nature genetics, 3(4), 299-304. [PubMed:7981749] [WorldCat] [DOI] - ↑
Osumi, N., & Inoue, T. (2001).
Gene transfer into cultured mammalian embryos by electroporation. Methods (San Diego, Calif.), 24(1), 35-42. [PubMed:11327800] [WorldCat] [DOI] - ↑
Arai, Y., Funatsu, N., Numayama-Tsuruta, K., Nomura, T., Nakamura, S., & Osumi, N. (2005).
Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(42), 9752-61. [PubMed:16237179] [PMC] [WorldCat] [DOI]