「機能欠失実験」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の17版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0204069 平林 敬浩]、[http://researchmap.jp/read0076409 八木 健]</font><br> | <font size="+1">[http://researchmap.jp/read0204069 平林 敬浩]、[http://researchmap.jp/read0076409 八木 健]</font><br> | ||
''大阪大学 大学院生命機能研究科''<br> | ''大阪大学 大学院生命機能研究科''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2013年2月12日 原稿完成日:2016年5月2日<br> | ||
担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
| 9行目: | 9行目: | ||
{{box|text= | {{box|text= | ||
ある[[ | ある[[wj:遺伝子|遺伝子]]の機能を調べる際にその遺伝子の発現量や分子機能を減弱させることで機能を類推する実験手法。逆に遺伝子の機能や発現量を増強させる実験は[[機能獲得実験]]と呼ばれる。 | ||
}} | }} | ||
| 24行目: | 24行目: | ||
==== ジーンターゲティング==== | ==== ジーンターゲティング==== | ||
目的の遺伝子に任意の変異を導入する手法をジーンターゲティングという。本法による遺伝子破壊を動物個体レベルで行うためには[[ES細胞]]が必要であったため[[マウス]] | 目的の遺伝子に任意の変異を導入する手法をジーンターゲティングという。本法による遺伝子破壊を動物個体レベルで行うためには[[ES細胞]]が必要であったため[[マウス]]でのみ可能であったが[[ラット]]でもES細胞が樹立されジーンターゲティングによる遺伝子ノックアウトが可能になった<ref><pubmed> 19109898 </pubmed></ref>。また、ES細胞の代わりにiPS細胞を用いたジーンターゲティングも行われるようになった。 | ||
==== 人工ヌクレアーゼ==== | ==== 人工ヌクレアーゼ==== | ||
[[Image:Takahirohirabayashi fig 1.jpg|thumb|right|300px|'''図1.人工ヌクレアーゼの構造''']] | [[Image:Takahirohirabayashi fig 1.jpg|thumb|right|300px|'''図1.人工ヌクレアーゼの構造''']] | ||
[[Image:Takahirohirabayashi fig 2.jpg|thumb|right|300px|''' | [[Image:Takahirohirabayashi fig 2.jpg|thumb|right|300px|'''図2.DNA切断に伴う塩基対の欠失・挿入''']] | ||
[[ | [[wj:人工ヌクレアーゼ|人工ヌクレアーゼ]]は、任意の塩基配列に結合するようにデザインされたDNA結合ドメインとDNA切断酵素の切断ドメインを連結させたタンパク質であり、任意の塩基配列を切断すること可能な酵素である(図1)。この人工ヌクレアーゼにはDNA配列を認識し、切断するという原理は共通だが、ジンクフィンガーのDNA結合ドメインを利用してDNA配列を認識する[[w:Zinc Finger nuclease|Zinc Finger nuclease]] (ZFN), [[w:TALEs|TALEs]]のDNA結合ドメインを利用しDNA配列を認識する[[w:TALEN|TALEN]] の2種類が主に使用されている。 | ||
これら人工ヌクレアーゼを導入した細胞内では特定の[[ | これら人工ヌクレアーゼを導入した細胞内では特定の[[wj:DNA|DNA]]がdouble-strand breakするが、これを修復するためにNHEJ ([[w:Non-Homologous End Joining|Non-Homologous End Joining]]機構が働く。この際、高頻度で[[wj:塩基対|塩基対]]の欠失、挿入などの[[wj:修復エラー|修復エラー]]が生じ、結果的に[[wj:フレームシフト|フレームシフト]]を起こすことで遺伝子がノックアウトされる(図2)。この手法はES細胞を必要としないため、これまでES細胞が樹立されておらずジーンターゲティングによる遺伝子ノックアウトが不可能であった動物種でも使用できる。 | ||
==== CRISPR/Cas9==== | ==== CRISPR/Cas9==== | ||
[[Image:機能欠失実験図3.jpg|thumb|right|300px|''' | [[Image:機能欠失実験図3.jpg|thumb|right|300px|'''図3.CRISPR/Cas9によるDNA切断機構 ''']] | ||
[[CRISPR/Cas]] (clustered regularly interspaced short palindromic repeats/CRISPR-associated protein)システムは、バクテリアが有するウイルスなど対する免疫機構である。ウイルスやプラスミドなどの外来DNA断片が侵入してくると、バクテリアは自身のゲノム中の[[CRISPR]]座位と呼ばれる遺伝子領域に取り込み、これを鋳型にした短鎖CRISPR RNA (crRNA)を合成する。このcrRNAは[[トランス活性化型crRNA]] ([[tracrRNA]])および[[Cas9ヌクレアーゼ]]と複合体を形成して、標的配列のDNAを切断する。この機構により再び侵入してきた外来DNAを切断することが出来る(図3A)<ref><pubmed> 20056882 </pubmed></ref><ref><pubmed> 21455174 </pubmed></ref>。 | |||
近年、この[[CRISPR/Cas9]]システムを応用してゲノムDNA上の任意の塩基配列を切断できる技術が開発された<ref><pubmed> 23287718 </pubmed></ref>。この方法では切断したい任意の塩基配列を持つcrRNAとtracrRNAを1分子の[[ガイドRNA]] ([[gRNA]])として、Cas9の[[mRNA]]またはタンパク質と共に細胞に導入することで任意の塩基配列を切断すること可能である('''図3B''')。切断されたDNAは上述の人工ヌクレアーゼと同様に高頻度で塩基対の欠失、挿入などの修復エラーが生じるため、結果的に遺伝子がノックアウトされる遺伝子がノックアウトされる('''図2''')。本法は[[ZFN]]や[[TALEN]]と同じく[[ES細胞]]が樹立していない動物種でも使用でき、さらにこれらに比して標的配列デザインの容易性などから頻用されている。 | |||
<ref><pubmed> 23287718 </pubmed></ref> | |||
=== 遺伝子発現量減少(遺伝子ノックダウン) === | === 遺伝子発現量減少(遺伝子ノックダウン) === | ||
| 48行目: | 47行目: | ||
==== ジーンターゲティングによる遺伝子発現量減少 ==== | ==== ジーンターゲティングによる遺伝子発現量減少 ==== | ||
ジーンターゲティングによる遺伝子ノックアウトが遺伝子中の[[ | ジーンターゲティングによる遺伝子ノックアウトが遺伝子中の[[wj:翻訳|翻訳]]領域を破壊するのに対し、遺伝子ノックダウンでは遺伝子中の[[wj:polyA付加配列|polyA付加配列]]など[[wj:発現制御|発現制御]]領域を欠損、あるいは変異を導入することでおこなわれる。本法も動物個体レベルで行うためにはES細胞が必要であるため、適用できる動物種に限りがある。 | ||
==== アンチセンスオリゴヌクレオチド==== | ==== アンチセンスオリゴヌクレオチド==== | ||
標的とする遺伝子のmRNA配列に対し相補的な塩基配列を持つ短い[[ | 標的とする遺伝子のmRNA配列に対し相補的な塩基配列を持つ短い[[wj:核酸|核酸]]([[wj:アンチセンスオリゴヌクレオチド|アンチセンスオリゴヌクレオチド]])を細胞外から導入すると、目的のmRNAと結合しその翻訳を阻害しその発現を抑制する。 このアンチセンスオリゴヌクレオチドは細胞内で不安定であるためリン酸基の酸素の一つが[[wj:チオール|チオール]](-SH)化(-SH)した[[wj:ホスホロチオエート結合オリゴ|ホスホロチオエート結合オリゴ]] (s-oligo)や、RNAオリゴヌクレオチドのリボースを[[wj:モルフォリノ環|モルフォリノ環]]、リン酸基を[[wj:ホスホロジアミダイト|ホスホロジアミダイト]]へ、[[wj:ウラシル|ウラシル]]を[[wj:チミン|チミン]]にそれぞれ置換し、安定性の向上、細胞毒性の軽減させたモルフォリノアンチセンスオリゴ<ref><pubmed> 17493584 </pubmed></ref>などが開発されてきた。しかし、現在では遺伝子発現抑制効果が高い2本鎖RNAによる[[RNA干渉]]を利用した方法に移行している。 | ||
==== RNA干渉==== | ==== RNA干渉==== | ||
RNA干渉とは21-23塩基からなる対からなる[[short interfering RNA]]([[siRNA]])と呼ばれる2本鎖RNAが相補的な配列を持つ生体内のmRNAと結合し、そのmRNAを分解する現象である<ref><pubmed> 11373684 </pubmed></ref>。 この現象はウイルスなどに対する生体防御機構と考えられているが、近年ではこの現象を利用して特定の遺伝子発現の抑制を誘導する実験系が種々の動植物で確立され、さらにこれらを応用した疾患に対する治療法が開発されている。siRNAそのものを細胞内へ導入し、遺伝子発現抑制を誘導するためには大量のsiRNAが必要であることやその効果が一過性であることから、近年ではこのsiRNAを発現する[[ | RNA干渉とは21-23塩基からなる対からなる[[short interfering RNA]]([[siRNA]])と呼ばれる2本鎖RNAが相補的な配列を持つ生体内のmRNAと結合し、そのmRNAを分解する現象である<ref><pubmed> 11373684 </pubmed></ref>。 この現象はウイルスなどに対する生体防御機構と考えられているが、近年ではこの現象を利用して特定の遺伝子発現の抑制を誘導する実験系が種々の動植物で確立され、さらにこれらを応用した疾患に対する治療法が開発されている。siRNAそのものを細胞内へ導入し、遺伝子発現抑制を誘導するためには大量のsiRNAが必要であることやその効果が一過性であることから、近年ではこのsiRNAを発現する[[wj:ベクター|ベクター]]として導入する方法が多く用いられている。 | ||
== 機能の減弱 == | == 機能の減弱 == | ||
[[Image:機能欠失実験図4.jpg|thumb|right|300px|''' | [[Image:機能欠失実験図4.jpg|thumb|right|300px|'''図4.機能ドメイン欠失変異体発現による機能の減弱 ''']] | ||
機能を減弱させた変異体を発現することで内在性の正常遺伝子に対して優位に働き正常な機能を減弱させることができる。この変異を[[ | 機能を減弱させた変異体を発現することで内在性の正常遺伝子に対して優位に働き正常な機能を減弱させることができる。この変異を[[wj:ドミナントネガティブ体|ドミナントネガティブ体]]とよぶ。機能を減弱させる変異体には酵素活性部位などの機能ドメインを欠失させたものが使用される。 | ||
例えば受容体の場合、受容体の細胞内領域にシグナルを伝達するドメインを欠いた変異体を過剰発現させると、リガンドがその変異体にも結合するため結果としてその受容体が介するシグナルは減弱する(図4)。 | 例えば受容体の場合、受容体の細胞内領域にシグナルを伝達するドメインを欠いた変異体を過剰発現させると、リガンドがその変異体にも結合するため結果としてその受容体が介するシグナルは減弱する(図4)。 | ||
[[Image:機能欠失実験図5.jpg|thumb|right|300px|'''図5.アミノ酸置換変異基質の発現によるリン酸化酵素の機能減弱 ''']] | |||
また、目的のタンパク質が持つアミノ酸が[[リン酸化]]されることでその機能が増強する場合、そのアミノ酸をリン酸化を受けない他のアミノ酸に置換した変異体を発現することで目的タンパク質のリン酸化による機能の増強を抑制することができる。 一般的には[[wj:セリン|セリン]]、[[wj:スレオニン|スレオニン]]は[[wj:アラニン|アラニン]]、[[wj:チロシン|チロシン]]は[[wj:フェニルアラニン|フェニルアラニン]]、のように類似構造のアミノ酸に置換する。 | |||
[[Image:機能欠失実験図5.jpg|thumb|right|300px|''' | |||
また、目的のタンパク質が持つアミノ酸が[[リン酸化]]されることでその機能が増強する場合、そのアミノ酸をリン酸化を受けない他のアミノ酸に置換した変異体を発現することで目的タンパク質のリン酸化による機能の増強を抑制することができる。 一般的には[[ | |||
==関連項目== | ==関連項目== | ||
2021年12月15日 (水) 20:33時点における最新版
平林 敬浩、八木 健
大阪大学 大学院生命機能研究科
DOI:10.14931/bsd.2181 原稿受付日:2013年2月12日 原稿完成日:2016年5月2日
担当編集委員:上口 裕之(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:loss of function
機能欠失実験とは
ある遺伝子の生理機能を解析する際、動物個体や細胞でその遺伝子の機能を減弱させて得られた変化を基に機能を類推する実験手法を機能欠失実験という。 機能欠失実験には発現量の減少または分子機能を失わせる方法がある。
発現量の減少
遺伝子破壊(遺伝子ノックアウト)
目的とする遺伝子そのものを破壊することで目的遺伝子の発現あるいは機能を完全に抑制させる。
ジーンターゲティング
目的の遺伝子に任意の変異を導入する手法をジーンターゲティングという。本法による遺伝子破壊を動物個体レベルで行うためにはES細胞が必要であったためマウスでのみ可能であったがラットでもES細胞が樹立されジーンターゲティングによる遺伝子ノックアウトが可能になった[1]。また、ES細胞の代わりにiPS細胞を用いたジーンターゲティングも行われるようになった。
人工ヌクレアーゼ
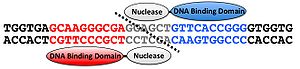
人工ヌクレアーゼは、任意の塩基配列に結合するようにデザインされたDNA結合ドメインとDNA切断酵素の切断ドメインを連結させたタンパク質であり、任意の塩基配列を切断すること可能な酵素である(図1)。この人工ヌクレアーゼにはDNA配列を認識し、切断するという原理は共通だが、ジンクフィンガーのDNA結合ドメインを利用してDNA配列を認識するZinc Finger nuclease (ZFN), TALEsのDNA結合ドメインを利用しDNA配列を認識するTALEN の2種類が主に使用されている。
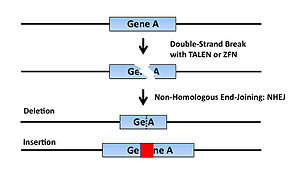
これら人工ヌクレアーゼを導入した細胞内では特定のDNAがdouble-strand breakするが、これを修復するためにNHEJ (Non-Homologous End Joining機構が働く。この際、高頻度で塩基対の欠失、挿入などの修復エラーが生じ、結果的にフレームシフトを起こすことで遺伝子がノックアウトされる(図2)。この手法はES細胞を必要としないため、これまでES細胞が樹立されておらずジーンターゲティングによる遺伝子ノックアウトが不可能であった動物種でも使用できる。
CRISPR/Cas9
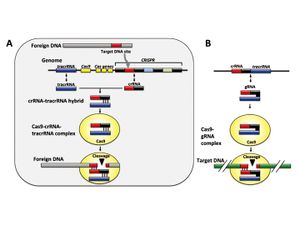
CRISPR/Cas (clustered regularly interspaced short palindromic repeats/CRISPR-associated protein)システムは、バクテリアが有するウイルスなど対する免疫機構である。ウイルスやプラスミドなどの外来DNA断片が侵入してくると、バクテリアは自身のゲノム中のCRISPR座位と呼ばれる遺伝子領域に取り込み、これを鋳型にした短鎖CRISPR RNA (crRNA)を合成する。このcrRNAはトランス活性化型crRNA (tracrRNA)およびCas9ヌクレアーゼと複合体を形成して、標的配列のDNAを切断する。この機構により再び侵入してきた外来DNAを切断することが出来る(図3A)[2][3]。
近年、このCRISPR/Cas9システムを応用してゲノムDNA上の任意の塩基配列を切断できる技術が開発された[4]。この方法では切断したい任意の塩基配列を持つcrRNAとtracrRNAを1分子のガイドRNA (gRNA)として、Cas9のmRNAまたはタンパク質と共に細胞に導入することで任意の塩基配列を切断すること可能である(図3B)。切断されたDNAは上述の人工ヌクレアーゼと同様に高頻度で塩基対の欠失、挿入などの修復エラーが生じるため、結果的に遺伝子がノックアウトされる遺伝子がノックアウトされる(図2)。本法はZFNやTALENと同じくES細胞が樹立していない動物種でも使用でき、さらにこれらに比して標的配列デザインの容易性などから頻用されている。
遺伝子発現量減少(遺伝子ノックダウン)
特定の遺伝子の発現量を減少させるが遺伝子ノックアウトとは異なり、完全に発現が失われるわけではないので、遺伝子ノックアウトでは動物個体が目的の時期より以前に死に至るため解析が困難な場合などに有効な手法である。
ジーンターゲティングによる遺伝子発現量減少
ジーンターゲティングによる遺伝子ノックアウトが遺伝子中の翻訳領域を破壊するのに対し、遺伝子ノックダウンでは遺伝子中のpolyA付加配列など発現制御領域を欠損、あるいは変異を導入することでおこなわれる。本法も動物個体レベルで行うためにはES細胞が必要であるため、適用できる動物種に限りがある。
アンチセンスオリゴヌクレオチド
標的とする遺伝子のmRNA配列に対し相補的な塩基配列を持つ短い核酸(アンチセンスオリゴヌクレオチド)を細胞外から導入すると、目的のmRNAと結合しその翻訳を阻害しその発現を抑制する。 このアンチセンスオリゴヌクレオチドは細胞内で不安定であるためリン酸基の酸素の一つがチオール(-SH)化(-SH)したホスホロチオエート結合オリゴ (s-oligo)や、RNAオリゴヌクレオチドのリボースをモルフォリノ環、リン酸基をホスホロジアミダイトへ、ウラシルをチミンにそれぞれ置換し、安定性の向上、細胞毒性の軽減させたモルフォリノアンチセンスオリゴ[5]などが開発されてきた。しかし、現在では遺伝子発現抑制効果が高い2本鎖RNAによるRNA干渉を利用した方法に移行している。
RNA干渉
RNA干渉とは21-23塩基からなる対からなるshort interfering RNA(siRNA)と呼ばれる2本鎖RNAが相補的な配列を持つ生体内のmRNAと結合し、そのmRNAを分解する現象である[6]。 この現象はウイルスなどに対する生体防御機構と考えられているが、近年ではこの現象を利用して特定の遺伝子発現の抑制を誘導する実験系が種々の動植物で確立され、さらにこれらを応用した疾患に対する治療法が開発されている。siRNAそのものを細胞内へ導入し、遺伝子発現抑制を誘導するためには大量のsiRNAが必要であることやその効果が一過性であることから、近年ではこのsiRNAを発現するベクターとして導入する方法が多く用いられている。
機能の減弱
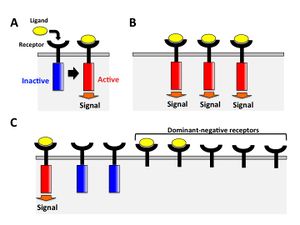
機能を減弱させた変異体を発現することで内在性の正常遺伝子に対して優位に働き正常な機能を減弱させることができる。この変異をドミナントネガティブ体とよぶ。機能を減弱させる変異体には酵素活性部位などの機能ドメインを欠失させたものが使用される。 例えば受容体の場合、受容体の細胞内領域にシグナルを伝達するドメインを欠いた変異体を過剰発現させると、リガンドがその変異体にも結合するため結果としてその受容体が介するシグナルは減弱する(図4)。
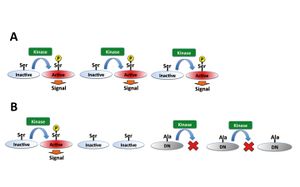
また、目的のタンパク質が持つアミノ酸がリン酸化されることでその機能が増強する場合、そのアミノ酸をリン酸化を受けない他のアミノ酸に置換した変異体を発現することで目的タンパク質のリン酸化による機能の増強を抑制することができる。 一般的にはセリン、スレオニンはアラニン、チロシンはフェニルアラニン、のように類似構造のアミノ酸に置換する。
関連項目
参考文献
- ↑
Li, P., Tong, C., Mehrian-Shai, R., Jia, L., Wu, N., Yan, Y., ..., & Ying, Q.L. (2008).
Germline competent embryonic stem cells derived from rat blastocysts. Cell, 135(7), 1299-310. [PubMed:19109898] [PMC] [WorldCat] [DOI] - ↑
Horvath, P., & Barrangou, R. (2010).
CRISPR/Cas, the immune system of bacteria and archaea. Science (New York, N.Y.), 327(5962), 167-70. [PubMed:20056882] [WorldCat] [DOI] - ↑
Deltcheva, E., Chylinski, K., Sharma, C.M., Gonzales, K., Chao, Y., Pirzada, Z.A., ..., & Charpentier, E. (2011).
CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature, 471(7340), 602-7. [PubMed:21455174] [PMC] [WorldCat] [DOI] - ↑
Cong, L., Ran, F.A., Cox, D., Lin, S., Barretto, R., Habib, N., ..., & Zhang, F. (2013).
Multiplex genome engineering using CRISPR/Cas systems. Science (New York, N.Y.), 339(6121), 819-23. [PubMed:23287718] [PMC] [WorldCat] [DOI] - ↑
Morcos, P.A. (2007).
Achieving targeted and quantifiable alteration of mRNA splicing with Morpholino oligos. Biochemical and biophysical research communications, 358(2), 521-7. [PubMed:17493584] [WorldCat] [DOI] - ↑
Elbashir, S.M., Harborth, J., Lendeckel, W., Yalcin, A., Weber, K., & Tuschl, T. (2001).
Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature, 411(6836), 494-8. [PubMed:11373684] [WorldCat] [DOI]