「Forkhead box protein P2」の版間の差分
細編集の要約なし |
細 →発現 |
||
| (4人の利用者による、間の43版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">[http://researchmap.jp/Taku-Sugiyama 杉山 拓]</font><br> | <font size="+1">[http://researchmap.jp/Taku-Sugiyama 杉山 拓]</font><br> | ||
'' | ''国立研究開発法人理化学研究所 脳神経科学研究センター''<br> | ||
DOI:<selfdoi /> | <font size="+1">[http://researchmap.jp/noriko1128 大隅 典子]</font><br> | ||
担当編集委員:[ | ''東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野''<br> | ||
DOI:<selfdoi /> 原稿受付日:2014年6月2日 原稿完成日:2022年3月26日<br> | |||
担当編集委員:[https://researchmap.jp/yamagatm 山形 方人](ハーバード大学・脳科学センター)<br> | |||
</div> | </div> | ||
英略語:FOXP2 | |||
== | {{box|text= Forkhead box protein P2タンパク質はDNA結合領域をもつ転写制御因子であり、多くの遺伝子の発現を制御する。発話障害または言語障害をもつ家系の遺伝子解析から見出され、言語機能の発達に関与する遺伝子として着目されている。FOXP2は進化的に保存され、鳴禽類でも歌学習に関わる脳領域に発現が認められる。鳴禽類の歌学習に関与する神経回路はヒトの前頭葉と線条体に相同であることから、鳴禽類FoxP2の研究によって、ヒト脳とFOXP2との機能的な関連が見出される可能性も期待されている。他の動物種には無いヒト特有のアミノ酸配列を持つFOXP2が、ヒトの言語・発話機能の進化に寄与したとする仮説が提示され、大きな注目を集めた。この仮説の基となった初期の研究では、現生人類が他のヒト族(ネアンデルタール人など)と進化的に分かれた後に現生人類特有のFOXP2アミノ酸配列が決定した、と結論づけた。しかし、この結論は近年の研究結果から覆され、現在では、''FOXP2''だけによって言語・発話機能の進化がもたらされたとは考えられていないが、この発見を契機に、主に言語学と心理学が対象としていたヒト言語に対して、神経科学の側面からのアプローチが可能となった。}} | ||
{{PBB/93986}} | |||
==FOXP2とは== | |||
1900年に、重篤な[[発話障害]]または[[言語障害]]がある家系(KE家)が報告された<ref><pubmed> 2332125 </pubmed></ref>。3世代にわたって総計37名中15名で言語障害が認められたが<ref><pubmed> 11872605</pubmed></ref>、[[聾]]や[[精神遅滞]]などの非言語的障害はなく、言語獲得にのみ障害が認められた。多くの例において、発語において文法的な誤りがあり、さまざまな段階での言語理解が難しいという特徴があった。また運動面においても症状があり、四肢などに運動障害は認められないが、口周囲や顔面の[[運動失調]]が報告されている<ref><pubmed> 11872604</pubmed></ref>。[[MRI]]を用いた研究から、言語機能と関連する脳領域における異常がある可能性が示された<ref><pubmed>14555953</pubmed></ref>。 | |||
KE家の詳細な遺伝学的解析から、発話・言語障害の原因となる遺伝子座(SPCH1)が第7染色体長腕上の7q31という領域にあることが同定された<ref><pubmed> 9462748 </pubmed></ref>。さらに、KE家とは血縁関係になく、類似の発話・言語機能障害を持つC.S.氏の遺伝子を解析することにより、発話・言語機能障害の原因となる遺伝子領域が絞りこまれ、発話・言語障害の原因遺伝子として[[転写制御因子]]をコードするForkhead box protein P2 (FOXP2)が同定された<ref><pubmed> 10880297 </pubmed></ref><ref name=Lai2001><pubmed> 11586359 </pubmed></ref>。 | |||
[[ | [[言語]]は単なる音声ではなく、意思疎通を取るためのコミュニケーションツールの一つである。言語は、[[視覚]]や[[聴覚]]という[[感覚系]]を介して脳に情報を入力し、発話や筆記、[[ジェスチャー]]といった運動系によって出力される。感覚系と運動系の間の脳における情報処理は、言語における重要な特質である。これまで言語の研究は伝統的には、言語学や心理学の観点から為されてきたが、[[fMRI]]等の脳画像情報が得られるようになり、認知科学者も参画するようになった。さらに、ヒトの発話・言語機能の発達に関わる遺伝子''FOXP2''の発見により、言語の起源や獲得、神経生物学的側面についても研究が進むようになった。 | ||
== | ==構造== | ||
[[ファイル:FOXP2.png|thumb|right|350px|'''図1. FOXP2のドメイン構造'''<br>Zn: C2H2型Znフィンガードメイン]] | |||
FOXP2はFoxファミリータンパク質のひとつである。Foxファミリータンパク質は80-100アミノ酸残基からなる3つの[[αヘリックス]]と3つの[[βシート]]、および2つのwing領域(3つ目のβシートを挟むように配置されたループ)からなるDNA結合領域である[[Fork-headドメイン]](あるいはfork head box/winged-helix (FOX)ドメイン)という基本構造をもつ<ref name=Hannenhalli2009><pubmed>19274050</pubmed></ref><ref name=Lai2001 /><ref name=Shu2001><pubmed> 11358962 </pubmed></ref><ref><pubmed> 16407075 </pubmed></ref>。 | |||
さらに、FOXP2/Foxp2は[[グルタミン]]リッチ(Gln-rich)、[[C2H2型ジンクフィンガー]](Zn)、[[ロイシンジッパー]]、C末端結合ドメイン1(CTBP1-binding)といったドメインを有している<ref name=Li2004 />('''図1''')。 | |||
== | ==ファミリー== | ||
Fork headドメインの相同性の程度によって、Foxファミリータンパク質は[[FOXA]]から[[FOXS]]までの19のサブクラスに分類される<ref name=Kaestner2000 /><ref name=Hannenhalli2009 />。ヒトでは50種類、マウスでは44種類のFOX遺伝子(Fox遺伝子)がコードされている<ref><pubmed>20650821</pubmed></ref>('''表1''')。Foxファミリータンパク質は進化を通して高度に保存されており、例えばショウジョウバエのfork headタンパク質とヒトのFOXA1タンパク質のDNA結合ドメインの相同性は90%である<ref name=Hannenhalli2009 />。FOXファミリーにおいて、[[αヘリックス]]と[[βシート]]は高度に保存されており、2つ目と3つ目のαヘリックスの間に構造的な違いがある<ref><pubmed>33303287</pubmed></ref>。 | |||
[[ヒト]]''FOXP2''の[[相同遺伝子]]([[オーソログ]])は、[[サル]]や[[マウス]]などの[[哺乳類]]だけでなく、[[鳥類]]([[キンカチョウ]]など)から[[魚類]]([[ゼブラフィッシュ]]など)に至るまで同定されている<ref><pubmed> 16028276</pubmed></ref><ref name=Ferland2003><pubmed> 12687690 </pubmed></ref><ref name=Takahashi2008 /><ref name=Teramitsu2004><pubmed> 15056695 </pubmed></ref>。本項では、ヒト''FOXP2''に対応するマウスのオーソログは''Foxp2''、それ以外の動物種のオーソログは''FoxP2''と表記する<ref name=Kaestner2000><pubmed>10702024</pubmed></ref>。また、ヒトFOXP2に対応するタンパク質は、Foxp2(マウス)、FoxP2(それ以外の動物種)と表記する。 | |||
FOXP2タンパク質と同様な[[ジンクフィンガー]]および[[ロイシンジッパー]]ドメインを持つFOXPタンパク質ファミリーは、Drosophilaなどの無脊椎動物にもみられるが、脊椎動物ではFOXP1, FOXP3, FOXP4が知られている<ref name=Co2020><pubmed>31999079</pubmed></ref><ref name=Santos2010><pubmed>20651048</pubmed></ref>。マウスの脳内にては、Foxp1, Foxp2, Foxp4が発現しており、1つの細胞に共発現している場合がある<ref><pubmed>14516685</pubmed></ref><ref name=Mendoza2015><pubmed>25556631</pubmed></ref><ref name=Spaeth2015><pubmed>26021489</pubmed></ref>。これら3つのFOX(or Fox)タンパク質の発現は、細胞種および脳領域によって異なるだけでなく、発生段階によっても変動する<ref name=Co2020 />。一方、Foxp3は[[免疫]]系の[[T regulatory細胞]]において、発現が確認されている<ref><pubmed>19114986</pubmed></ref>。また、哺乳類の''FOXP''遺伝子に相当する遺伝子がショウジョウバエにも1つあることが確認されている<ref name=Santos2010 />。 | |||
ヒト(またはマウス)細胞内において(in vitro experiment)、FOXP2が機能するためには、FOXP2同士によるホモダイマー形成または、FOXP1(またはFOXP4)とのヘテロダイマーを形成する必要がある、と報告されている<ref><pubmed>14701752</pubmed></ref><ref><pubmed>25027557</pubmed></ref>。同様に、[[キンカチョウ]]([[ゼブラフィンチ]])のArea Xにおいても、FoxP1, FoxP2, FoxP4がタンパク質ホモダイマーまたはヘテロダイマーを形成し、その組み合わせによって制御する遺伝子が異なることが報告されている<ref name=Mendoza2017><pubmed>28507505</pubmed></ref>。 | |||
{| class="wikitable" | |||
|+表1. FOXファミリータンパク質 | |||
! align="center"| 分類||サブタイプ | |||
|- | |||
|FOXA|| [[FOXA1]], [[FOXA2]], [[FOXA3]] | |||
|- | |||
|FOXB|| [[FOXB1]], [[FOXB2]] | |||
|- | |||
|FOXC|| [[FOXC1]], [[FOXC2]] | |||
|- | |||
|FOXD|| [[FOXD1]], [[FOXD2]], [[FOXD3]], [[FOXD4]], [[FOXD5]], [[FOXPD6]] | |||
|- | |||
|FOXE|| [[FOXE1]], [[FOXE2]], [[FOXE3]] | |||
|- | |||
|FOXF|| [[FOXF1]], [[FOXF2]] | |||
|- | |||
|FOXG|| [[FOXG1]] | |||
|- | |||
|FOXH|| [[FOXH1]] | |||
|- | |||
|FOXI|| [[FOXI1]], [[FOXI2]] | |||
|- | |||
|FOXJ|| [[FOXJ1]], [[FOXJ2]], [[FOXJ3]] | |||
|- | |||
|FOXK|| [[FOXK1]], [[FOXK2]] | |||
|- | |||
|FOXL|| [[FOXL1]], [[FOXL2]] | |||
|- | |||
|FOXM|| [[FOXM1]] | |||
|- | |||
|FOXN|| [[FOXN1]], [[FOXN2]], [[FOXN3]], [[FOXN4]] | |||
|- | |||
|FOXO|| [[FOXO1A|FOXO1]], [[FOXO2]], [[FOXO3]], [[FOXO4]] | |||
|- | |||
|FOXP|| [[FOXP1]], [[FOXP2]], [[FOXP3]], [[FOXP4]] | |||
|- | |||
|FOXQ|| [[FOXQ1]] | |||
|- | |||
|FOXR|| [[FOXR1]], [[FOXR2]] | |||
|} | |||
Wikipediaより改変。 | |||
==発現== | |||
[[ファイル:Sugiyama&Osumi_figure2.jpg|300px|thumb|'''図2.Foxp2の発現パターン'''<br> (A)マウス14日齢の大脳新皮質領域<br>(B)マウス30日齢の小脳皮質領域]] | [[ファイル:Sugiyama&Osumi_figure2.jpg|300px|thumb|'''図2.Foxp2の発現パターン'''<br> (A)マウス14日齢の大脳新皮質領域<br>(B)マウス30日齢の小脳皮質領域]] | ||
ヒト''FOXP2''(および[[齧歯類]]''Foxp2'')の発現部位に関しては、齧歯類の胚と成体、胎生期のヒトにおいて解析が為されている(鳴禽については別の項で記述する)。''FOXP2''/''Foxp2''は、感覚受容に関わる領域(視床など)、[[大脳]][[辺縁系]]、大脳[[新皮質]]、そして運動機能に関わる領域([[小脳]]や[[線条体]]、[[橋]]など)、[[網膜]]において広範な発現パターンを示す ('''表2''')<ref name=Ferland2003 /><ref name=Gray2008><pubmed> 18218908 </pubmed></ref><ref><pubmed> 12876151 </pubmed></ref><ref><pubmed> 19463901 </pubmed></ref><ref name=Takahashi2003><pubmed>12815709</pubmed></ref><ref name=Teramitsu2004 />。なお、Foxp2は脳だけでなく、[[肺]]や[[心臓]]、[[腸]]にも発現が見られ<ref name=Shu2001 />、肺発生においては[[肺胞上皮]]細胞の分化にFoxp2が関与していることが報告されている<ref name=Shu2001 />。また''Foxp2''は[[呼吸中枢]]の[[橋]]背側部にも発現が認められている<ref name=Gray2008 />。'''図2'''にマウス脳における''Foxp2''発現パターンの例を示す。 | |||
{| class="wikitable" | |||
|+表2.ヒト''FOXP2''および齧歯類''Foxp2''の発現部位 | |||
|- | |||
|'''・感覚受容に関わる領域'''<br> | |||
- ヒト(胎児期)および齧歯類(胚および成体)<br> | |||
[[嗅球]]、[[上丘]]、[[下丘]]、[[視床]]([[後外側腹側核]]、[[後内側腹側核]]、[[外側膝状体|外側]]・[[内側膝状体]]) | |||
|- | |||
|'''・大脳辺縁系'''<br> | |||
- ヒト(胎児期)<br> | |||
視床([[背側前核]]、[[背内側核]])<br> | |||
- 齧歯類(胚および成体)<br> | |||
[[扁桃体]]、[[中隔核]]、視床、[[視床下部]]([[視床下部室傍核|室傍核]]) | |||
|- | |||
|'''・大脳新皮質'''<br> | |||
- 齧歯類(胚および成体)<br> | |||
第VI層 | |||
|- | |||
|'''・運動機能に関わる領域'''<br> | |||
- ヒト(胎児期)<br> | |||
[[淡蒼球]]内節、視床下部、視床([[内側腹側核]]、[[中心正中核]]、[[束傍核]])<br> | |||
- 齧歯類(胚および成体)<br> | |||
[[線条体]]([[尾状核]]、[[被殻]])、[[側坐核]]、[[黒質]]、[[視床]](内側腹側核、中心正中核、束傍核)<br> | |||
小脳(プルキンエ細胞)、橋(背側呼吸群)、[[下オリーブ核]]、[[脊髄]](腹側部) | |||
|- | |||
|} | |||
== | 以下、FOXP1/2/4(およびこれらのオーソログ)の脳内の各領域における発現パターンについて記述する。 | ||
===大脳皮質=== | |||
脊椎動物の皮質領域において、''FOXP1''と''FOXP2''(およびこれらのオーソログ)の発現は相補的である。マウス脳にて、Foxp1は[[終脳内投射神経細胞]](intra-telencephalic projection neurons および[[第VIa層]]の[[皮質-視床路投射神経細胞]](cortico-thalamic projection neuron) に発現している<ref name=Hisaoka2010><pubmed>20040367</pubmed></ref>。一方、Foxp2は[[第VI層]]皮質-視床路投射神経細胞と[[第V層]][[錐体路]]神経細胞に発現している<ref name=Campbell2009><pubmed>18972576</pubmed></ref><ref name=Hisaoka2010 /><ref><pubmed>31099752</pubmed></ref><ref><pubmed>24014670</pubmed></ref>。このマウス皮質領域における''Foxp1''と''Foxp2''の発現パターンは(''Foxp1''は上層側、''Foxp2''は下層側)、他の脊椎動物([[コウモリ]]、サル、ヒト)においても保存される傾向にある<ref name=RodenasCuadrado2018 ><pubmed>29297931</pubmed></ref><ref name=Takahashi2008 /><ref name=Teramitsu2004 />。''FOXP4''およびこのオーソログの発現は、[[ラット]]皮質では一過性の発現が確認されているが、成体期のゼブラフィンチでは広範な皮質領域に発現が見られる<ref name=Mendoza2015 />。 | |||
== | ===海馬体=== | ||
[[ | 哺乳類において、''FOXP1''とそのオーソログの発現は[[CA1]]および[[海馬台]]に見られる<ref name=Ferland2003 /><ref name=Takahashi2008><pubmed>18461604</pubmed></ref>。''FOXP2''とそのオーソログの発現は種によって異なり、マウスではほとんど発現していないが、コウモリのCA1では高い発現レベルを示すことが報告されている<ref name=Ferland2003 />b<ref name=Takahashi2008 /><ref name= RodenasCuadrado2018 />。''FOXP4''とそのオーソログは胎生期の齧歯類[[海馬体]]領域にて、一時的に広範な発現が見られるが、生後になってからその発現レベルは低下する<ref name=Ferland2003 /><ref name=Takahashi2003 /><ref name=Takahashi2008 />。 | ||
===扁桃体=== | |||
脊椎動物の[[扁桃体]]抑制性[[介在細胞]]群([[intercalated nucleus]], [[ITC]])において、''FOXP2''およびそのオーソログの発現は高度に保存されている<ref name=Campbell2009 /><ref name=Ferland2003 /><ref name=Kaoru2010><pubmed>20004711</pubmed></ref><ref name=Takahashi2008 /><ref name=Vicario2017><pubmed>27160258</pubmed></ref>。齧歯類の扁桃体において、''Foxp1''/''2''/''4''の発現はほとんど重ならないことが報告されている<ref name=Campbell2009 /><ref name=Ferland2003 /><ref name=Kaoru2010 /><ref name=Takahashi2008 />。 | |||
===大脳基底核=== | |||
脊椎動物の大脳[[基底核]]において、''FOXP1''/''2''(およびそれらのオーソログ)の発現パターンは保存されている。線条体では、広範な領域に''FOXP1''(およびそのオーソログ)が発現しており、''FOXP2''(およびそのオーソログ)の発現は限定的である<ref name=Takahashi2003 /><ref name=Takahashi2008 /><ref name=Fong2018><pubmed>30031127</pubmed></ref><ref name=Saunders2018><pubmed>30096299</pubmed></ref><ref name=Vernes2011><pubmed>21765815</pubmed></ref><ref name=Campbell2009><pubmed>18972576</pubmed></ref><ref name=Lai2003><pubmed>12876151</pubmed></ref><ref name=Teramitsu2004 /><ref name=Haesler2007><pubmed>18052609</pubmed></ref>。[[淡蒼球]]では、''FOXP1''(およびそのオーソログ)の発現は無く、''FOXP2''(およびそのオーソログ)の発現レベルは低い<ref name=Ferland2003 /><ref name=Lai2003 /><ref name=Teramitsu2004 />。齧歯類''Foxp4''の発現は発達期に限定しているが、ゼブラフィンチでは成体期まで''FoxP4''の発現は維持される<ref name=Mendoza2015 />。 | |||
== | ===その他の脳領域=== | ||
[[視床]]や小脳、[[嗅球]]などにおいても''Foxp1''/''2''/''4''(およびそれらのオーソログ)の発現は確認されている。発現している領域や動物種によって、''Foxp1''/''2''/''4''(およびそれらのオーソログ)の発現は発達期だけの場合もあれば、成体期まで継続する場合がある<ref name=Co2021><pubmed>31999079</pubmed></ref><ref name=Ferland2003 /><ref name=Takahashi2008 /><ref name=Lai2003 /><ref name=Teramitsu2004 /><ref name=Fujita2012><pubmed>21935935</pubmed></ref><ref name=Tam2011><pubmed>20951773</pubmed></ref><ref name=Haesler2004><pubmed>15056696</pubmed></ref><ref name=Campbell2009><pubmed>18972576</pubmed></ref><ref name=Morikawa2009><pubmed>19463901</pubmed></ref><ref name=Morikawa2009b><pubmed>19797899</pubmed></ref>。 | |||
==機能== | |||
===転写制御=== | |||
FOXP2/Foxp2タンパク質は転写制御因子として、標的遺伝子の転写調節領域に結合し、転写抑制の制御を行う<ref name=Li2004><pubmed> 14701752 </pubmed></ref><ref name=Shu2001 />。FOXP2/Foxp2がどのような遺伝子の発現を制御しているかについて網羅的な解析がなされ、そのうちのいくつか([[アポリポタンパク質D]] ([[APOD]])、[[コレシストキニン]] ([[CCK]])、[[コレシストキニンA受容体]] ([[CCK-AR]])、[[サイクリンD2]]、([[CCND2]])、[[CD5]]、[[DISC1]]、[[ドーパミンD2受容体]] ([[DRD2]])、[[GABA受容体#GABAB.E5.8F.97.E5.AE.B9.E4.BD.93|GABA<sub>B</sub>受容体]] ([[GABBR1]])、[[メタロチオネイン2A]] ([[MT2A]])、神経型[[一酸化窒素合成酵素]] ([[NOS1]])、[[paired-like homeobox 2b]] ([[PMX2B]])、[[トリプトファン-2,3-ジオキシゲナーゼ]] ([[TDO2]])、[[TIMELESS]]、[[Wnt1|WNT1]]、[[Znフィンガータンパク質74]] ([[ZNF74]]))は言語発達との関連があると言われている<ref><pubmed> 17999357 </pubmed></ref><ref><pubmed> 17999362 </pubmed></ref>。逆に、Foxp2自身を制御する上流因子もしくは相互作用する因子の候補として、脳の発生発達に重要な[[PAX6|Pax6]]が挙げられる<ref><pubmed>21617155 </pubmed></ref>。 | |||
転写制御因子であるFOXP2の①発現を制御する分子群、②FOXP2と相互作用することで機能する分子群、および③FOXP2によって発現が制御される分子群が次々に明らかにされてきている。これらの分子によって構成される「FOXP2の分子ネットワーク」を解明することが、FOXP2がどのようにして神経系の発達に寄与するのかといった手がかりとなり、究極的にはヒトの言語・発話機能の獲得がどのようにしてなされるのか、その解明へとつながることが期待される<ref name=denHoed2021><pubmed>34260143</pubmed></ref>。 | |||
===言語機能との関わり=== | |||
====遺伝子変異==== | |||
KE家の遺伝子変異はFOXP2配列の553番目のアミノ酸が[[アルギニン]]から[[ヒスチジン]]に変わっており(R553H)、この遺伝子変異はKE家の中でも障害を抱えるメンバーのみに起こり、障害を抱えないKE家のメンバーは健常者と同様に遺伝子変異は見られなかった<ref name=French2007><pubmed>17619227</pubmed></ref>。FOXP2において、この553番目のアルギニンはFOXP2がDNAに結合するための主要な構成要素である。553番目のアルギニンがヒスチジンに置換されると、FOXP2タンパク質とDNAとの結合は阻害されることが示唆されている<ref><pubmed> 8332212 </pubmed></ref>。一方、C.S.氏の遺伝子変異はKE家の遺伝子変異とは異なり、''FOXP2''遺伝子上にて転座が生じたためにDNA結合領域が壊されている<ref name=Lai2001 />。 | |||
Foxp2タンパク質の生体における機能を知るため、発生工学的に遺伝子機能を欠損させたノックアウトマウスや<ref name=French2007 />[18]、KE家に見られる遺伝子変異に対応した変異(R552H)に置換したノックインマウスが作製された<ref name=Fujita2008><pubmed>18287060</pubmed></ref><ref name=Groszer2008><pubmed>18328704</pubmed></ref>。''Foxp2''のノックアウトマウスでは小脳の縮小が見られた<ref name=Clark1993><pubmed>8332212</pubmed></ref>。同様に''Foxp2''の変異ノックインホモ接合マウス(R552H/R552H)でも小脳の縮小、小脳[[プルキンエ細胞]]数の減少、さらにプルキンエ細胞の[[樹状突起]]が存在する分子層において、[[シナプス前部]]の分子マーカーである[[シナプトフィジン]]の発現量も減少していた<ref name=Fujita2008 />。またホモ接合ノックインマウスは新生仔が発する[[超音波]]による鳴き声([[ultrasonic vocalization]], [[USV]])の減少という表現型が得られた<ref name=Fujita2008 />。一方、ヘテロ接合ノックインマウスR552H/+では、形態的に小脳は正常なマウスとほとんど変わらなかったが、行動学的には、全般的な運動機能の障害や、線条体と小脳の神経回路における[[シナプス可塑性]]の異常、ホモ接合ノックインマウスに比べて軽度なUSVの異常が見られた<ref name=Fujita2008 /><ref name=Groszer2008 />。 | |||
====FOXP2発現に依拠した神経回路モデル==== | |||
[[ファイル:Sugiyama&Osumi_figure6.jpg|300px|thumb|'''図3.FOXP2発現脳領域間で形成される神経回路モデル (A) 前頭葉-線条体経路 (B) 前頭葉-小脳経路''' ]] | |||
Vargha-Khademらは、FOXP2を発現している脳領域間で形成される神経回路が発話・言語を制御する、という神経回路モデルを提唱している<ref><pubmed> 15685218 </pubmed></ref>。この神経回路モデルでは、前頭葉-線条体経路と前頭葉-小脳経路の2つの経路がある('''図3A,B''')。これらの神経回路において[[橋]][[灰白質]]以外は全てFOXP2の発現が見られる領域である。運動機能に関わる領域において、広範なFOXP2の発現が見られる意義は、まだ不明な点が多い。しかし、KE家での遺伝子変異の表現型が示すように、FOXP2を発現している神経細胞とその神経細胞によって構成される神経回路は、口腔や顔面の運動制御に重要な役割を果たしていると考えられる。 | |||
====鳴禽の歌学習==== | |||
[[ファイル:Sugiyama&Osumi_fig4.jpg|300px|thumb|'''図4.鳴禽類の歌学習に関わる神経回路の模式図''']] | |||
鳴禽は、生得的に歌うだけでなく、[[模倣]]することを通して歌学習を行う。鳴禽が歌うことに関わる脳領域にFoxP2の発現が見られることが報告されている(詳細は後述)。このことから種間を超えたFOXP2/FoxP2の類似点に注目が集まり、研究が進められてきた。進化の過程で哺乳類と鳥類が分かれたのは3億年前と言われている。鳴禽の一種であるゼブラフィンチ(''[[Taeniopygia guttata]]'')とマウスのFoxp2タンパク質の違いは5アミノ酸であり、ゼブラフィンチとヒトでは8アミノ酸異なる<ref name=Haesler2004 />。つまり、ヒトとゼブラフィンチの間でFOXP2/FoxP2タンパク質は98%が同一である。また、ゼブラフィンチ脳内でのFoxP2の発現パターンはヒト胎児脳の発現パターンと非常に類似していることが報告されている<ref name=Teramitsu2004 />。 | |||
鳴禽の歌学習に関わる神経回路においてFoxP2が発現していることは非常に興味深い。ヒトの前頭葉-線条体経路と相同の神経回路が鳴禽の脳内に存在する。ヒトの大脳皮質に相当する鳥類の[[皮質領野]]([[high vocal center]], [[HVC]])とヒトの線条体に相当する鳥類の[[Area X]]にFoxP2が発現している[23]。HVCからArea Xへ、Area Xは視床の[[背外側視床内側核]]([[DLM]]核]])へ、DLM核は皮質の前線条体の[[外側大細胞部]]([[LMAN]])へと[[軸索]]が投射され、LMANは歌の生成に関わる神経回路に軸索投射する('''図4''')<ref name=Scharff2004><pubmed> 15313783 </pubmed></ref>。またFoxP2はArea Xに発現があるだけでなく、鳴禽の歌学習時に発現量が上昇する<ref name=Haesler2004 />。HVCとLMANからの投射がある[[終脳核]]([[robustus arcopallialis]], RA)は歌の機能に関わる[[運動ニューロン]]に投射する<ref name=Scharff2004 /><ref name=Teramitsu2004 />。 | |||
FoxP2が鳴禽の歌学習と歌の制御にどのような影響を与えるのか、[[ノックダウン]](KD)実験が行われた。胎生期から''Foxp2''遺伝子を欠損した遺伝子組換え動物では、''Foxp2''遺伝子が欠損した影響が蓄積してしまうため、特定の時期(例. 歌を学習する幼若期、歌の学習を完了した成熟期など)におけるFoxp2の機能を正確に調べることが難しい。そこで''FoxP2''の発現を抑制するタイミングを任意に決めることができる[[ウイルスベクター]]が用いられた。幼若期のゼブラフィンチは、成熟したゼブラフィンチの歌を模倣することで歌を学習する。[[レンチウイルスベクター]]によってArea Xに局在している神経細胞の''FoxP2''をKDすると、歌の模倣が阻害されるという結果が得られた<ref name=Haesler2007><pubmed>18052609</pubmed></ref>。 | |||
''FoxP2''だけでなく、''FoxP1''および''FoxP4''のKD実験も実施され、[[歌学習]]への影響の違いが検討された。Area X内の多くの神経細胞において、FoxP2陽性細胞はFoxP1およびFoxP4を共発現している<ref name=Mendoza2015 />。前述したように、FoxP2はFoxP2同士のホモダイマー、またはFoxP1、FoxP4とのヘテロダイマーを形成して機能する<ref name=Mendoza2017 />。''FoxP2'', ''FoxP1'', ''FoxP4''のどれか1つをKDすると歌学習は阻害されたのが、それぞれのKDによる表現型は部分的に同じではあるものの若干異なるという結果が得られた。<ref name=Norton2019><pubmed>31641053</pubmed></ref>。 | |||
一方、成熟期のゼブラフィンチは文脈依存的に歌の音節を変動させることが知られており、メスに求愛するときに歌っているときと比べて、単独で歌っているときは歌の音節の変動が大きくなる<ref name=Kao2006><pubmed>16723412</pubmed></ref><ref name=Kao2005><pubmed>15703748</pubmed></ref>。しかし、Area Xの''FoxP2''をKDすると、この2つの文脈同士の違いが見られなくなったので、FoxP2は歌の音節変動の制御に寄与していることが示唆された<ref name=Murugan2013><pubmed>24268418</pubmed></ref>。 | |||
==進化== | |||
ヒトのFOXP2タンパク質と、他の[[霊長類]]や哺乳類のFoxp2タンパク質とを比較した結果、FOXP2は最も保存されたタンパク質5%の中に含まれることが明らかにされた<ref name=Enard2002><pubmed> 12192408 </pubmed></ref><ref><pubmed> 21690130 </pubmed></ref><ref name=Zhang2002><pubmed> 12524352 </pubmed></ref>。またFOXP2のアミノ酸配列は人種間に差異がほとんど見られないことから、現代人においてFOXP2配列は保存されていると考えられる<ref name=Enard2002 /><ref name=Zhang2002 />。ヒトとマウスの種が分かれたのは7000万年前と言われており、''FOXP2''遺伝子には多くの塩基置換が蓄積されてきたが、FOXP2タンパク質のアミノ酸配列に変化があったのは3箇所だけであり、変化のあった3箇所のうち2つがヒト特有で、[[チンパンジー]]や[[オランウータン]]、[[ゴリラ]]には見られなかった<ref name=Enard2002 /><ref name=Zhang2002 />。ヒト特有のFOXP2の変化が起きたのはチンパンジーと分かれた400~600万年前と推定されている。 | |||
FOXP2のアミノ酸置換をもとに予測されるのは、ヒト特有のアミノ酸置換がFOXP2の機能を変えたであろうということである。例えば325番目のアスパラギンからセリンへの置換は[[リン酸]]化の部位を付与し、[[転写抑制因子]]としての機能に影響を与えた可能性がある。しかしながら、ヒト特有のアミノ酸置換が現代人の言語・発話機能に与えた影響については未だ明らかにされていない。また、[[非コード領域]]における遺伝子変異が、どのようにFoxp2の発現領域を変えたかについても、まだ未知となっている<ref name=Enard2002 /><ref name=Zhang2002 />。 | |||
上記のヒトFOXP2特有のアミノ酸置換をマウスのFoxp2に導入した研究が報告されている。ヒトFOXP2特有のアミノ酸置換(T303N, N325S)を部分的に模倣したオーソログをもつ遺伝子組換えマウス(''Foxp2''<sup>hum/hum</sup>マウス: T302N, N324S)が作製され、その表現型が調べられた<ref name=Enard2009><pubmed>19490899</pubmed></ref>。''Foxp2''<sup>hum/hum</sup>マウスは、''Foxp2'' KOマウスとは異なり、生後3週間で死亡するようなことはなく<ref name=French2007 /><ref name=Fujita2008><pubmed>18287060</pubmed></ref><ref name=Groszer2008><pubmed>18328704</pubmed></ref><ref name=Shu2005><pubmed>15983371</pubmed></ref>、多くの生理学的パラメータおよび行動において、''Foxp2''<sup>hum/hum</sup>マウスと野生型マウスとの間に違いは見られなかった。ただし、[[探索行動]]の低下とUSVのパターンが異なるという結果が得られた。これらの''Foxp2''<sup>hum/hum</sup>マウスの行動レベルでの表現型は、''Foxp2''<sup>wt/KO</sup>マウスとは真逆であったことから、Foxp2の部分的なアミノ酸置換(T302N, N324S)は機能欠損したFoxp2とは異なることが示唆されている。野生型と比べて、''Foxp2''<sup>hum/hum</sup>マウス大脳基底核における[[中型有棘神経細胞]]([[medium spiny neuron]], [[MSN]])の[[樹状突起]]は長い、[[シナプス長期抑制]]([[LTD]])がより強く生じるといったことが報告されている。''Foxp2''<sup>hum/hum</sup>マウスのMSNのこれらの性質は、Foxp2が皮質脊髄路の発達と機能に関与するという報告と一致している<ref name=Vernes2011><pubmed>21765815</pubmed></ref><ref name=French2012><pubmed>21876543</pubmed></ref><ref name=French2019><pubmed>30108312</pubmed></ref><ref name=Chen2016><pubmed>27595386</pubmed></ref><ref name=Hachigian2017><pubmed>29212017</pubmed></ref><ref name=vanRhijn2018><pubmed>30187194</pubmed></ref>。 | |||
2002年に発表された[[wd:Wolfgang Enard|Enard]]らの研究から<ref name=Enard2002 />、FOXP2の現生人類特有の2つのアミノ酸置換が、言語・発話機能の進化の要因である、という考え方が広まり、定着した。しかし、近年の研究から、この考え方を改める必要性が提示されている。FOXP2が言語・発話機能の進化において重要だと考えられるようになったのは、''FOXP2''遺伝子の[[選択的スイープ]](selective sweep、ある集団において、新規の有益な変異が、塩基配列の多様性を減少させること)は100-200万年前に生じたとする結果が報告されたからである<ref name=Enard2002 />。100-200万年前とは、現生人類が出現した、または出現した後の期間に該当する<ref name=Klein2010>'''Richard G. Klein. (1989).'''<br>The Human Career, Human Biological and Cultural Origins<br>Univ, Chicago Press. ISBN-10 : 0226439658</ref>(Klein, 1989, the Human Career, Human Biological and Cultural Origins, Unic, Chicago Press)。従って、現生人類が出現してから生じた''FOXP2''遺伝子の選択的スイープが言語・発話機能の進化において重要な役割を果たしている、と考えられるようになった。 | |||
現生人類の祖先と[[ネアンデルタール人]]とは400,000 - 700,000年前に分かれたと考えられている。[[w:Johannes Krause|Krause]]らの研究によって、現生人類とネアンデルタール人の''FOXP2''配列(Exon7の911と977番目の塩基を含むDNA領域。このDNA領域から、現生人類特有のアミノ酸配列が生み出される。)は非常に類似していることが明らかにされた<ref name=Krause2007><pubmed>17949978</pubmed></ref>。この結果は、''FOXP2''の選択的スイープが生じたのが比較的最近とするEnardらの仮説(100,000 - 200,000年前)に反するものであった。Krauseらの研究によって、現生人類とネアンデルタール人の共通の祖先の時代に、''FOXP2''の選択的スイープが生じたことが示唆された。 | |||
さらに、近年、''FOXP2''の選択的スイープが比較的最近生じたとする仮説を支持しないさらなる知見が提示された。巨大な次世代型遺伝情報データベース ([https://www.internationalgenome.org The 1000 Genomes project Consortium])<ref name=Henn2016><pubmed>26712023</pubmed></ref>を用いたAtkinsonらの研究から、現生人類とネアンデルタール人との間には、現生人類特有のFOXP2のアミノ酸配列の変化は認められない、という結果が示された<ref name=Atkinson2018><pubmed>30078708</pubmed></ref>。また、Atkinsonらは、サンプルの大きさと構成(75%のサンプルを非アフリカ系のヒト由来にする等)を変化させるとEnardら<ref name=Enard2002 />の結果を再現できることを示した。つまり、サンプルのサイズが小さく、サンプルの構成に偏りがあったためにEnardら<ref name=Enard2002 />の結果に有意差が生じた可能性が高い。従って、''FOXP2''の選択的スイープが比較的最近生じたとする仮説(100,000 - 200,000年前)は支持されず、現生人類とネアンデルタール人との共通祖先の時期(400,000 - 700,000年前)に選択的スイープは生じたとする仮説が支持されるようになった<ref name=Fisher2019><pubmed>30668952</pubmed></ref>。 | |||
''FOXP2''はヒトの言語・発話機能において非常に重要な役割を果たしていることは明らかである。しかし、たった1つの遺伝子によってヒトの言語・発話機能が進化したと考えるのではなく、より多くの遺伝子によってこの進化が起きたのではないか、という提案がなされている<ref name=Hunter2019><pubmed>30635342</pubmed></ref>。これからの研究で、ヒト特有の言語・発話機能がどのようにして進化してきたのか、その解明が期待される。 | |||
==関連項目== | |||
*[[転写制御因子]] | |||
*[[言語]] | |||
*[[音声学習]] | |||
==参考文献== | ==参考文献== | ||
<references/> | <references/> | ||
2022年12月1日 (木) 08:22時点における最新版
杉山 拓
国立研究開発法人理化学研究所 脳神経科学研究センター
大隅 典子
東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野
DOI:10.14931/bsd.4872 原稿受付日:2014年6月2日 原稿完成日:2022年3月26日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英略語:FOXP2
Forkhead box protein P2タンパク質はDNA結合領域をもつ転写制御因子であり、多くの遺伝子の発現を制御する。発話障害または言語障害をもつ家系の遺伝子解析から見出され、言語機能の発達に関与する遺伝子として着目されている。FOXP2は進化的に保存され、鳴禽類でも歌学習に関わる脳領域に発現が認められる。鳴禽類の歌学習に関与する神経回路はヒトの前頭葉と線条体に相同であることから、鳴禽類FoxP2の研究によって、ヒト脳とFOXP2との機能的な関連が見出される可能性も期待されている。他の動物種には無いヒト特有のアミノ酸配列を持つFOXP2が、ヒトの言語・発話機能の進化に寄与したとする仮説が提示され、大きな注目を集めた。この仮説の基となった初期の研究では、現生人類が他のヒト族(ネアンデルタール人など)と進化的に分かれた後に現生人類特有のFOXP2アミノ酸配列が決定した、と結論づけた。しかし、この結論は近年の研究結果から覆され、現在では、FOXP2だけによって言語・発話機能の進化がもたらされたとは考えられていないが、この発見を契機に、主に言語学と心理学が対象としていたヒト言語に対して、神経科学の側面からのアプローチが可能となった。
FOXP2とは
1900年に、重篤な発話障害または言語障害がある家系(KE家)が報告された[1]。3世代にわたって総計37名中15名で言語障害が認められたが[2]、聾や精神遅滞などの非言語的障害はなく、言語獲得にのみ障害が認められた。多くの例において、発語において文法的な誤りがあり、さまざまな段階での言語理解が難しいという特徴があった。また運動面においても症状があり、四肢などに運動障害は認められないが、口周囲や顔面の運動失調が報告されている[3]。MRIを用いた研究から、言語機能と関連する脳領域における異常がある可能性が示された[4]。
KE家の詳細な遺伝学的解析から、発話・言語障害の原因となる遺伝子座(SPCH1)が第7染色体長腕上の7q31という領域にあることが同定された[5]。さらに、KE家とは血縁関係になく、類似の発話・言語機能障害を持つC.S.氏の遺伝子を解析することにより、発話・言語機能障害の原因となる遺伝子領域が絞りこまれ、発話・言語障害の原因遺伝子として転写制御因子をコードするForkhead box protein P2 (FOXP2)が同定された[6][7]。
言語は単なる音声ではなく、意思疎通を取るためのコミュニケーションツールの一つである。言語は、視覚や聴覚という感覚系を介して脳に情報を入力し、発話や筆記、ジェスチャーといった運動系によって出力される。感覚系と運動系の間の脳における情報処理は、言語における重要な特質である。これまで言語の研究は伝統的には、言語学や心理学の観点から為されてきたが、fMRI等の脳画像情報が得られるようになり、認知科学者も参画するようになった。さらに、ヒトの発話・言語機能の発達に関わる遺伝子FOXP2の発見により、言語の起源や獲得、神経生物学的側面についても研究が進むようになった。
構造
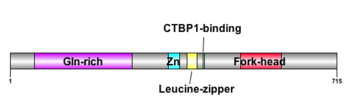
Zn: C2H2型Znフィンガードメイン
FOXP2はFoxファミリータンパク質のひとつである。Foxファミリータンパク質は80-100アミノ酸残基からなる3つのαヘリックスと3つのβシート、および2つのwing領域(3つ目のβシートを挟むように配置されたループ)からなるDNA結合領域であるFork-headドメイン(あるいはfork head box/winged-helix (FOX)ドメイン)という基本構造をもつ[8][7][9][10]。
さらに、FOXP2/Foxp2はグルタミンリッチ(Gln-rich)、C2H2型ジンクフィンガー(Zn)、ロイシンジッパー、C末端結合ドメイン1(CTBP1-binding)といったドメインを有している[11](図1)。
ファミリー
Fork headドメインの相同性の程度によって、Foxファミリータンパク質はFOXAからFOXSまでの19のサブクラスに分類される[12][8]。ヒトでは50種類、マウスでは44種類のFOX遺伝子(Fox遺伝子)がコードされている[13](表1)。Foxファミリータンパク質は進化を通して高度に保存されており、例えばショウジョウバエのfork headタンパク質とヒトのFOXA1タンパク質のDNA結合ドメインの相同性は90%である[8]。FOXファミリーにおいて、αヘリックスとβシートは高度に保存されており、2つ目と3つ目のαヘリックスの間に構造的な違いがある[14]。
ヒトFOXP2の相同遺伝子(オーソログ)は、サルやマウスなどの哺乳類だけでなく、鳥類(キンカチョウなど)から魚類(ゼブラフィッシュなど)に至るまで同定されている[15][16][17][18]。本項では、ヒトFOXP2に対応するマウスのオーソログはFoxp2、それ以外の動物種のオーソログはFoxP2と表記する[12]。また、ヒトFOXP2に対応するタンパク質は、Foxp2(マウス)、FoxP2(それ以外の動物種)と表記する。
FOXP2タンパク質と同様なジンクフィンガーおよびロイシンジッパードメインを持つFOXPタンパク質ファミリーは、Drosophilaなどの無脊椎動物にもみられるが、脊椎動物ではFOXP1, FOXP3, FOXP4が知られている[19][20]。マウスの脳内にては、Foxp1, Foxp2, Foxp4が発現しており、1つの細胞に共発現している場合がある[21][22][23]。これら3つのFOX(or Fox)タンパク質の発現は、細胞種および脳領域によって異なるだけでなく、発生段階によっても変動する[19]。一方、Foxp3は免疫系のT regulatory細胞において、発現が確認されている[24]。また、哺乳類のFOXP遺伝子に相当する遺伝子がショウジョウバエにも1つあることが確認されている[20]。
ヒト(またはマウス)細胞内において(in vitro experiment)、FOXP2が機能するためには、FOXP2同士によるホモダイマー形成または、FOXP1(またはFOXP4)とのヘテロダイマーを形成する必要がある、と報告されている[25][26]。同様に、キンカチョウ(ゼブラフィンチ)のArea Xにおいても、FoxP1, FoxP2, FoxP4がタンパク質ホモダイマーまたはヘテロダイマーを形成し、その組み合わせによって制御する遺伝子が異なることが報告されている[27]。
| 分類 | サブタイプ |
|---|---|
| FOXA | FOXA1, FOXA2, FOXA3 |
| FOXB | FOXB1, FOXB2 |
| FOXC | FOXC1, FOXC2 |
| FOXD | FOXD1, FOXD2, FOXD3, FOXD4, FOXD5, FOXPD6 |
| FOXE | FOXE1, FOXE2, FOXE3 |
| FOXF | FOXF1, FOXF2 |
| FOXG | FOXG1 |
| FOXH | FOXH1 |
| FOXI | FOXI1, FOXI2 |
| FOXJ | FOXJ1, FOXJ2, FOXJ3 |
| FOXK | FOXK1, FOXK2 |
| FOXL | FOXL1, FOXL2 |
| FOXM | FOXM1 |
| FOXN | FOXN1, FOXN2, FOXN3, FOXN4 |
| FOXO | FOXO1, FOXO2, FOXO3, FOXO4 |
| FOXP | FOXP1, FOXP2, FOXP3, FOXP4 |
| FOXQ | FOXQ1 |
| FOXR | FOXR1, FOXR2 |
Wikipediaより改変。
発現
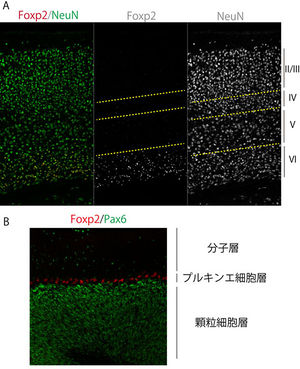
(A)マウス14日齢の大脳新皮質領域
(B)マウス30日齢の小脳皮質領域
ヒトFOXP2(および齧歯類Foxp2)の発現部位に関しては、齧歯類の胚と成体、胎生期のヒトにおいて解析が為されている(鳴禽については別の項で記述する)。FOXP2/Foxp2は、感覚受容に関わる領域(視床など)、大脳辺縁系、大脳新皮質、そして運動機能に関わる領域(小脳や線条体、橋など)、網膜において広範な発現パターンを示す (表2)[16][28][29][30][31][18]。なお、Foxp2は脳だけでなく、肺や心臓、腸にも発現が見られ[9]、肺発生においては肺胞上皮細胞の分化にFoxp2が関与していることが報告されている[9]。またFoxp2は呼吸中枢の橋背側部にも発現が認められている[28]。図2にマウス脳におけるFoxp2発現パターンの例を示す。
| ・感覚受容に関わる領域 |
| ・大脳辺縁系 |
| ・大脳新皮質 - 齧歯類(胚および成体) |
| ・運動機能に関わる領域 - ヒト(胎児期) |
以下、FOXP1/2/4(およびこれらのオーソログ)の脳内の各領域における発現パターンについて記述する。
大脳皮質
脊椎動物の皮質領域において、FOXP1とFOXP2(およびこれらのオーソログ)の発現は相補的である。マウス脳にて、Foxp1は終脳内投射神経細胞(intra-telencephalic projection neurons および第VIa層の皮質-視床路投射神経細胞(cortico-thalamic projection neuron) に発現している[32]。一方、Foxp2は第VI層皮質-視床路投射神経細胞と第V層錐体路神経細胞に発現している[33][32][34][35]。このマウス皮質領域におけるFoxp1とFoxp2の発現パターンは(Foxp1は上層側、Foxp2は下層側)、他の脊椎動物(コウモリ、サル、ヒト)においても保存される傾向にある[36][17][18]。FOXP4およびこのオーソログの発現は、ラット皮質では一過性の発現が確認されているが、成体期のゼブラフィンチでは広範な皮質領域に発現が見られる[22]。
海馬体
哺乳類において、FOXP1とそのオーソログの発現はCA1および海馬台に見られる[16][17]。FOXP2とそのオーソログの発現は種によって異なり、マウスではほとんど発現していないが、コウモリのCA1では高い発現レベルを示すことが報告されている[16]b[17][36]。FOXP4とそのオーソログは胎生期の齧歯類海馬体領域にて、一時的に広範な発現が見られるが、生後になってからその発現レベルは低下する[16][31][17]。
扁桃体
脊椎動物の扁桃体抑制性介在細胞群(intercalated nucleus, ITC)において、FOXP2およびそのオーソログの発現は高度に保存されている[33][16][37][17][38]。齧歯類の扁桃体において、Foxp1/2/4の発現はほとんど重ならないことが報告されている[33][16][37][17]。
大脳基底核
脊椎動物の大脳基底核において、FOXP1/2(およびそれらのオーソログ)の発現パターンは保存されている。線条体では、広範な領域にFOXP1(およびそのオーソログ)が発現しており、FOXP2(およびそのオーソログ)の発現は限定的である[31][17][39][40][41][33][42][18][43]。淡蒼球では、FOXP1(およびそのオーソログ)の発現は無く、FOXP2(およびそのオーソログ)の発現レベルは低い[16][42][18]。齧歯類Foxp4の発現は発達期に限定しているが、ゼブラフィンチでは成体期までFoxP4の発現は維持される[22]。
その他の脳領域
視床や小脳、嗅球などにおいてもFoxp1/2/4(およびそれらのオーソログ)の発現は確認されている。発現している領域や動物種によって、Foxp1/2/4(およびそれらのオーソログ)の発現は発達期だけの場合もあれば、成体期まで継続する場合がある[44][16][17][42][18][45][46][47][33][48][49]。
機能
転写制御
FOXP2/Foxp2タンパク質は転写制御因子として、標的遺伝子の転写調節領域に結合し、転写抑制の制御を行う[11][9]。FOXP2/Foxp2がどのような遺伝子の発現を制御しているかについて網羅的な解析がなされ、そのうちのいくつか(アポリポタンパク質D (APOD)、コレシストキニン (CCK)、コレシストキニンA受容体 (CCK-AR)、サイクリンD2、(CCND2)、CD5、DISC1、ドーパミンD2受容体 (DRD2)、GABAB受容体 (GABBR1)、メタロチオネイン2A (MT2A)、神経型一酸化窒素合成酵素 (NOS1)、paired-like homeobox 2b (PMX2B)、トリプトファン-2,3-ジオキシゲナーゼ (TDO2)、TIMELESS、WNT1、Znフィンガータンパク質74 (ZNF74))は言語発達との関連があると言われている[50][51]。逆に、Foxp2自身を制御する上流因子もしくは相互作用する因子の候補として、脳の発生発達に重要なPax6が挙げられる[52]。
転写制御因子であるFOXP2の①発現を制御する分子群、②FOXP2と相互作用することで機能する分子群、および③FOXP2によって発現が制御される分子群が次々に明らかにされてきている。これらの分子によって構成される「FOXP2の分子ネットワーク」を解明することが、FOXP2がどのようにして神経系の発達に寄与するのかといった手がかりとなり、究極的にはヒトの言語・発話機能の獲得がどのようにしてなされるのか、その解明へとつながることが期待される[53]。
言語機能との関わり
遺伝子変異
KE家の遺伝子変異はFOXP2配列の553番目のアミノ酸がアルギニンからヒスチジンに変わっており(R553H)、この遺伝子変異はKE家の中でも障害を抱えるメンバーのみに起こり、障害を抱えないKE家のメンバーは健常者と同様に遺伝子変異は見られなかった[54]。FOXP2において、この553番目のアルギニンはFOXP2がDNAに結合するための主要な構成要素である。553番目のアルギニンがヒスチジンに置換されると、FOXP2タンパク質とDNAとの結合は阻害されることが示唆されている[55]。一方、C.S.氏の遺伝子変異はKE家の遺伝子変異とは異なり、FOXP2遺伝子上にて転座が生じたためにDNA結合領域が壊されている[7]。
Foxp2タンパク質の生体における機能を知るため、発生工学的に遺伝子機能を欠損させたノックアウトマウスや[54][18]、KE家に見られる遺伝子変異に対応した変異(R552H)に置換したノックインマウスが作製された[56][57]。Foxp2のノックアウトマウスでは小脳の縮小が見られた[58]。同様にFoxp2の変異ノックインホモ接合マウス(R552H/R552H)でも小脳の縮小、小脳プルキンエ細胞数の減少、さらにプルキンエ細胞の樹状突起が存在する分子層において、シナプス前部の分子マーカーであるシナプトフィジンの発現量も減少していた[56]。またホモ接合ノックインマウスは新生仔が発する超音波による鳴き声(ultrasonic vocalization, USV)の減少という表現型が得られた[56]。一方、ヘテロ接合ノックインマウスR552H/+では、形態的に小脳は正常なマウスとほとんど変わらなかったが、行動学的には、全般的な運動機能の障害や、線条体と小脳の神経回路におけるシナプス可塑性の異常、ホモ接合ノックインマウスに比べて軽度なUSVの異常が見られた[56][57]。
FOXP2発現に依拠した神経回路モデル
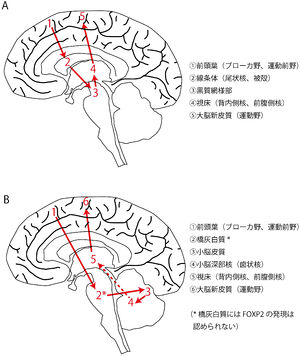
Vargha-Khademらは、FOXP2を発現している脳領域間で形成される神経回路が発話・言語を制御する、という神経回路モデルを提唱している[59]。この神経回路モデルでは、前頭葉-線条体経路と前頭葉-小脳経路の2つの経路がある(図3A,B)。これらの神経回路において橋灰白質以外は全てFOXP2の発現が見られる領域である。運動機能に関わる領域において、広範なFOXP2の発現が見られる意義は、まだ不明な点が多い。しかし、KE家での遺伝子変異の表現型が示すように、FOXP2を発現している神経細胞とその神経細胞によって構成される神経回路は、口腔や顔面の運動制御に重要な役割を果たしていると考えられる。
鳴禽の歌学習
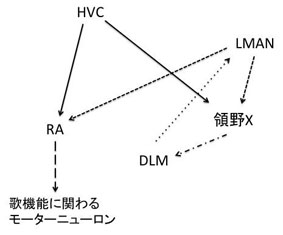
鳴禽は、生得的に歌うだけでなく、模倣することを通して歌学習を行う。鳴禽が歌うことに関わる脳領域にFoxP2の発現が見られることが報告されている(詳細は後述)。このことから種間を超えたFOXP2/FoxP2の類似点に注目が集まり、研究が進められてきた。進化の過程で哺乳類と鳥類が分かれたのは3億年前と言われている。鳴禽の一種であるゼブラフィンチ(Taeniopygia guttata)とマウスのFoxp2タンパク質の違いは5アミノ酸であり、ゼブラフィンチとヒトでは8アミノ酸異なる[47]。つまり、ヒトとゼブラフィンチの間でFOXP2/FoxP2タンパク質は98%が同一である。また、ゼブラフィンチ脳内でのFoxP2の発現パターンはヒト胎児脳の発現パターンと非常に類似していることが報告されている[18]。
鳴禽の歌学習に関わる神経回路においてFoxP2が発現していることは非常に興味深い。ヒトの前頭葉-線条体経路と相同の神経回路が鳴禽の脳内に存在する。ヒトの大脳皮質に相当する鳥類の皮質領野(high vocal center, HVC)とヒトの線条体に相当する鳥類のArea XにFoxP2が発現している[23]。HVCからArea Xへ、Area Xは視床の背外側視床内側核(DLM核]])へ、DLM核は皮質の前線条体の外側大細胞部(LMAN)へと軸索が投射され、LMANは歌の生成に関わる神経回路に軸索投射する(図4)[60]。またFoxP2はArea Xに発現があるだけでなく、鳴禽の歌学習時に発現量が上昇する[47]。HVCとLMANからの投射がある終脳核(robustus arcopallialis, RA)は歌の機能に関わる運動ニューロンに投射する[60][18]。
FoxP2が鳴禽の歌学習と歌の制御にどのような影響を与えるのか、ノックダウン(KD)実験が行われた。胎生期からFoxp2遺伝子を欠損した遺伝子組換え動物では、Foxp2遺伝子が欠損した影響が蓄積してしまうため、特定の時期(例. 歌を学習する幼若期、歌の学習を完了した成熟期など)におけるFoxp2の機能を正確に調べることが難しい。そこでFoxP2の発現を抑制するタイミングを任意に決めることができるウイルスベクターが用いられた。幼若期のゼブラフィンチは、成熟したゼブラフィンチの歌を模倣することで歌を学習する。レンチウイルスベクターによってArea Xに局在している神経細胞のFoxP2をKDすると、歌の模倣が阻害されるという結果が得られた[43]。
FoxP2だけでなく、FoxP1およびFoxP4のKD実験も実施され、歌学習への影響の違いが検討された。Area X内の多くの神経細胞において、FoxP2陽性細胞はFoxP1およびFoxP4を共発現している[22]。前述したように、FoxP2はFoxP2同士のホモダイマー、またはFoxP1、FoxP4とのヘテロダイマーを形成して機能する[27]。FoxP2, FoxP1, FoxP4のどれか1つをKDすると歌学習は阻害されたのが、それぞれのKDによる表現型は部分的に同じではあるものの若干異なるという結果が得られた。[61]。 一方、成熟期のゼブラフィンチは文脈依存的に歌の音節を変動させることが知られており、メスに求愛するときに歌っているときと比べて、単独で歌っているときは歌の音節の変動が大きくなる[62][63]。しかし、Area XのFoxP2をKDすると、この2つの文脈同士の違いが見られなくなったので、FoxP2は歌の音節変動の制御に寄与していることが示唆された[64]。
進化
ヒトのFOXP2タンパク質と、他の霊長類や哺乳類のFoxp2タンパク質とを比較した結果、FOXP2は最も保存されたタンパク質5%の中に含まれることが明らかにされた[65][66][67]。またFOXP2のアミノ酸配列は人種間に差異がほとんど見られないことから、現代人においてFOXP2配列は保存されていると考えられる[65][67]。ヒトとマウスの種が分かれたのは7000万年前と言われており、FOXP2遺伝子には多くの塩基置換が蓄積されてきたが、FOXP2タンパク質のアミノ酸配列に変化があったのは3箇所だけであり、変化のあった3箇所のうち2つがヒト特有で、チンパンジーやオランウータン、ゴリラには見られなかった[65][67]。ヒト特有のFOXP2の変化が起きたのはチンパンジーと分かれた400~600万年前と推定されている。
FOXP2のアミノ酸置換をもとに予測されるのは、ヒト特有のアミノ酸置換がFOXP2の機能を変えたであろうということである。例えば325番目のアスパラギンからセリンへの置換はリン酸化の部位を付与し、転写抑制因子としての機能に影響を与えた可能性がある。しかしながら、ヒト特有のアミノ酸置換が現代人の言語・発話機能に与えた影響については未だ明らかにされていない。また、非コード領域における遺伝子変異が、どのようにFoxp2の発現領域を変えたかについても、まだ未知となっている[65][67]。
上記のヒトFOXP2特有のアミノ酸置換をマウスのFoxp2に導入した研究が報告されている。ヒトFOXP2特有のアミノ酸置換(T303N, N325S)を部分的に模倣したオーソログをもつ遺伝子組換えマウス(Foxp2hum/humマウス: T302N, N324S)が作製され、その表現型が調べられた[68]。Foxp2hum/humマウスは、Foxp2 KOマウスとは異なり、生後3週間で死亡するようなことはなく[54][56][57][69]、多くの生理学的パラメータおよび行動において、Foxp2hum/humマウスと野生型マウスとの間に違いは見られなかった。ただし、探索行動の低下とUSVのパターンが異なるという結果が得られた。これらのFoxp2hum/humマウスの行動レベルでの表現型は、Foxp2wt/KOマウスとは真逆であったことから、Foxp2の部分的なアミノ酸置換(T302N, N324S)は機能欠損したFoxp2とは異なることが示唆されている。野生型と比べて、Foxp2hum/humマウス大脳基底核における中型有棘神経細胞(medium spiny neuron, MSN)の樹状突起は長い、シナプス長期抑制(LTD)がより強く生じるといったことが報告されている。Foxp2hum/humマウスのMSNのこれらの性質は、Foxp2が皮質脊髄路の発達と機能に関与するという報告と一致している[41][70][71][72][73][74]。
2002年に発表されたEnardらの研究から[65]、FOXP2の現生人類特有の2つのアミノ酸置換が、言語・発話機能の進化の要因である、という考え方が広まり、定着した。しかし、近年の研究から、この考え方を改める必要性が提示されている。FOXP2が言語・発話機能の進化において重要だと考えられるようになったのは、FOXP2遺伝子の選択的スイープ(selective sweep、ある集団において、新規の有益な変異が、塩基配列の多様性を減少させること)は100-200万年前に生じたとする結果が報告されたからである[65]。100-200万年前とは、現生人類が出現した、または出現した後の期間に該当する[75](Klein, 1989, the Human Career, Human Biological and Cultural Origins, Unic, Chicago Press)。従って、現生人類が出現してから生じたFOXP2遺伝子の選択的スイープが言語・発話機能の進化において重要な役割を果たしている、と考えられるようになった。
現生人類の祖先とネアンデルタール人とは400,000 - 700,000年前に分かれたと考えられている。Krauseらの研究によって、現生人類とネアンデルタール人のFOXP2配列(Exon7の911と977番目の塩基を含むDNA領域。このDNA領域から、現生人類特有のアミノ酸配列が生み出される。)は非常に類似していることが明らかにされた[76]。この結果は、FOXP2の選択的スイープが生じたのが比較的最近とするEnardらの仮説(100,000 - 200,000年前)に反するものであった。Krauseらの研究によって、現生人類とネアンデルタール人の共通の祖先の時代に、FOXP2の選択的スイープが生じたことが示唆された。
さらに、近年、FOXP2の選択的スイープが比較的最近生じたとする仮説を支持しないさらなる知見が提示された。巨大な次世代型遺伝情報データベース (The 1000 Genomes project Consortium)[77]を用いたAtkinsonらの研究から、現生人類とネアンデルタール人との間には、現生人類特有のFOXP2のアミノ酸配列の変化は認められない、という結果が示された[78]。また、Atkinsonらは、サンプルの大きさと構成(75%のサンプルを非アフリカ系のヒト由来にする等)を変化させるとEnardら[65]の結果を再現できることを示した。つまり、サンプルのサイズが小さく、サンプルの構成に偏りがあったためにEnardら[65]の結果に有意差が生じた可能性が高い。従って、FOXP2の選択的スイープが比較的最近生じたとする仮説(100,000 - 200,000年前)は支持されず、現生人類とネアンデルタール人との共通祖先の時期(400,000 - 700,000年前)に選択的スイープは生じたとする仮説が支持されるようになった[79]。
FOXP2はヒトの言語・発話機能において非常に重要な役割を果たしていることは明らかである。しかし、たった1つの遺伝子によってヒトの言語・発話機能が進化したと考えるのではなく、より多くの遺伝子によってこの進化が起きたのではないか、という提案がなされている[80]。これからの研究で、ヒト特有の言語・発話機能がどのようにして進化してきたのか、その解明が期待される。
関連項目
参考文献
- ↑
Hurst, J.A., Baraitser, M., Auger, E., Graham, F., & Norell, S. (1990).
An extended family with a dominantly inherited speech disorder. Developmental medicine and child neurology, 32(4), 352-5. [PubMed:2332125] [WorldCat] [DOI] - ↑
Watkins, K.E., Vargha-Khadem, F., Ashburner, J., Passingham, R.E., Connelly, A., Friston, K.J., ..., & Gadian, D.G. (2002).
MRI analysis of an inherited speech and language disorder: structural brain abnormalities. Brain : a journal of neurology, 125(Pt 3), 465-78. [PubMed:11872605] [WorldCat] [DOI] - ↑
Watkins, K.E., Dronkers, N.F., & Vargha-Khadem, F. (2002).
Behavioural analysis of an inherited speech and language disorder: comparison with acquired aphasia. Brain : a journal of neurology, 125(Pt 3), 452-64. [PubMed:11872604] [WorldCat] [DOI] - ↑
Liégeois, F., Baldeweg, T., Connelly, A., Gadian, D.G., Mishkin, M., & Vargha-Khadem, F. (2003).
Language fMRI abnormalities associated with FOXP2 gene mutation. Nature neuroscience, 6(11), 1230-7. [PubMed:14555953] [WorldCat] [DOI] - ↑
Fisher, S.E., Vargha-Khadem, F., Watkins, K.E., Monaco, A.P., & Pembrey, M.E. (1998).
Localisation of a gene implicated in a severe speech and language disorder. Nature genetics, 18(2), 168-70. [PubMed:9462748] [WorldCat] [DOI] - ↑
Lai, C.S., Fisher, S.E., Hurst, J.A., Levy, E.R., Hodgson, S., Fox, M., ..., & Monaco, A.P. (2000).
The SPCH1 region on human 7q31: genomic characterization of the critical interval and localization of translocations associated with speech and language disorder. American journal of human genetics, 67(2), 357-68. [PubMed:10880297] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Lai, C.S., Fisher, S.E., Hurst, J.A., Vargha-Khadem, F., & Monaco, A.P. (2001).
A forkhead-domain gene is mutated in a severe speech and language disorder. Nature, 413(6855), 519-23. [PubMed:11586359] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Hannenhalli, S., & Kaestner, K.H. (2009).
The evolution of Fox genes and their role in development and disease. Nature reviews. Genetics, 10(4), 233-40. [PubMed:19274050] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2 9.3
Shu, W., Yang, H., Zhang, L., Lu, M.M., & Morrisey, E.E. (2001).
Characterization of a new subfamily of winged-helix/forkhead (Fox) genes that are expressed in the lung and act as transcriptional repressors. The Journal of biological chemistry, 276(29), 27488-97. [PubMed:11358962] [WorldCat] [DOI] - ↑
Stroud, J.C., Wu, Y., Bates, D.L., Han, A., Nowick, K., Paabo, S., ..., & Chen, L. (2006).
Structure of the forkhead domain of FOXP2 bound to DNA. Structure (London, England : 1993), 14(1), 159-66. [PubMed:16407075] [WorldCat] [DOI] - ↑ 11.0 11.1
Li, S., Weidenfeld, J., & Morrisey, E.E. (2004).
Transcriptional and DNA binding activity of the Foxp1/2/4 family is modulated by heterotypic and homotypic protein interactions. Molecular and cellular biology, 24(2), 809-22. [PubMed:14701752] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Kaestner, K.H., Knochel, W., & Martinez, D.E. (2000).
Unified nomenclature for the winged helix/forkhead transcription factors. Genes & development, 14(2), 142-6. [PubMed:10702024] [WorldCat] - ↑
Jackson, B.C., Carpenter, C., Nebert, D.W., & Vasiliou, V. (2010).
Update of human and mouse forkhead box (FOX) gene families. Human genomics, 4(5), 345-52. [PubMed:20650821] [PMC] [WorldCat] [DOI] - ↑
Herman, L., Todeschini, A.L., & Veitia, R.A. (2021).
Forkhead Transcription Factors in Health and Disease. Trends in genetics : TIG, 37(5), 460-475. [PubMed:33303287] [WorldCat] [DOI] - ↑
Bonkowsky, J.L., & Chien, C.B. (2005).
Molecular cloning and developmental expression of foxP2 in zebrafish. Developmental dynamics : an official publication of the American Association of Anatomists, 234(3), 740-6. [PubMed:16028276] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3 16.4 16.5 16.6 16.7 16.8
Ferland, R.J., Cherry, T.J., Preware, P.O., Morrisey, E.E., & Walsh, C.A. (2003).
Characterization of Foxp2 and Foxp1 mRNA and protein in the developing and mature brain. The Journal of comparative neurology, 460(2), 266-79. [PubMed:12687690] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3 17.4 17.5 17.6 17.7 17.8
Takahashi, K., Liu, F.C., Oishi, T., Mori, T., Higo, N., Hayashi, M., ..., & Takahashi, H. (2008).
Expression of FOXP2 in the developing monkey forebrain: comparison with the expression of the genes FOXP1, PBX3, and MEIS2. The Journal of comparative neurology, 509(2), 180-9. [PubMed:18461604] [WorldCat] [DOI] - ↑ 18.0 18.1 18.2 18.3 18.4 18.5 18.6 18.7
Teramitsu, I., Kudo, L.C., London, S.E., Geschwind, D.H., & White, S.A. (2004).
Parallel FoxP1 and FoxP2 expression in songbird and human brain predicts functional interaction. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(13), 3152-63. [PubMed:15056695] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Co, M., Anderson, A.G., & Konopka, G. (2020).
FOXP transcription factors in vertebrate brain development, function, and disorders. Wiley interdisciplinary reviews. Developmental biology, 9(5), e375. [PubMed:31999079] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1
Santos, M.E., Athanasiadis, A., Leitão, A.B., DuPasquier, L., & Sucena, E. (2011).
Alternative splicing and gene duplication in the evolution of the FoxP gene subfamily. Molecular biology and evolution, 28(1), 237-47. [PubMed:20651048] [PMC] [WorldCat] [DOI] - ↑
Lu, M.M., Li, S., Yang, H., & Morrisey, E.E. (2002).
Foxp4: a novel member of the Foxp subfamily of winged-helix genes co-expressed with Foxp1 and Foxp2 in pulmonary and gut tissues. Mechanisms of development, 119 Suppl 1, S197-202. [PubMed:14516685] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2 22.3
Mendoza, E., Tokarev, K., Düring, D.N., Retamosa, E.C., Weiss, M., Arpenik, N., & Scharff, C. (2015).
Differential coexpression of FoxP1, FoxP2, and FoxP4 in the Zebra Finch (Taeniopygia guttata) song system. The Journal of comparative neurology, 523(9), 1318-40. [PubMed:25556631] [WorldCat] [DOI] - ↑
Spaeth, J.M., Hunter, C.S., Bonatakis, L., Guo, M., French, C.A., Slack, I., ..., & Stein, R. (2015).
The FOXP1, FOXP2 and FOXP4 transcription factors are required for islet alpha cell proliferation and function in mice. Diabetologia, 58(8), 1836-44. [PubMed:26021489] [PMC] [WorldCat] [DOI] - ↑
Huehn, J., Polansky, J.K., & Hamann, A. (2009).
Epigenetic control of FOXP3 expression: the key to a stable regulatory T-cell lineage? Nature reviews. Immunology, 9(2), 83-9. [PubMed:19114986] [WorldCat] [DOI] - ↑
Li, S., Weidenfeld, J., & Morrisey, E.E. (2004).
Transcriptional and DNA binding activity of the Foxp1/2/4 family is modulated by heterotypic and homotypic protein interactions. Molecular and cellular biology, 24(2), 809-22. [PubMed:14701752] [PMC] [WorldCat] [DOI] - ↑
Sin, C., Li, H., & Crawford, D.A. (2015).
Transcriptional regulation by FOXP1, FOXP2, and FOXP4 dimerization. Journal of molecular neuroscience : MN, 55(2), 437-48. [PubMed:25027557] [WorldCat] [DOI] - ↑ 27.0 27.1
Mendoza, E., & Scharff, C. (2017).
Protein-Protein Interaction Among the FoxP Family Members and their Regulation of Two Target Genes, VLDLR and CNTNAP2 in the Zebra Finch Song System. Frontiers in molecular neuroscience, 10, 112. [PubMed:28507505] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1
Gray, P.A. (2008).
Transcription factors and the genetic organization of brain stem respiratory neurons. Journal of applied physiology (Bethesda, Md. : 1985), 104(5), 1513-21. [PubMed:18218908] [WorldCat] [DOI] - ↑
Lai, C.S., Gerrelli, D., Monaco, A.P., Fisher, S.E., & Copp, A.J. (2003).
FOXP2 expression during brain development coincides with adult sites of pathology in a severe speech and language disorder. Brain : a journal of neurology, 126(Pt 11), 2455-62. [PubMed:12876151] [WorldCat] [DOI] - ↑
Morikawa, Y., Hisaoka, T., & Senba, E. (2009).
Characterization of Foxp2-expressing cells in the developing spinal cord. Neuroscience, 162(4), 1150-62. [PubMed:19463901] [WorldCat] [DOI] - ↑ 31.0 31.1 31.2
Takahashi, K., Liu, F.C., Hirokawa, K., & Takahashi, H. (2003).
Expression of Foxp2, a gene involved in speech and language, in the developing and adult striatum. Journal of neuroscience research, 73(1), 61-72. [PubMed:12815709] [WorldCat] [DOI] - ↑ 32.0 32.1
Hisaoka, T., Nakamura, Y., Senba, E., & Morikawa, Y. (2010).
The forkhead transcription factors, Foxp1 and Foxp2, identify different subpopulations of projection neurons in the mouse cerebral cortex. Neuroscience, 166(2), 551-63. [PubMed:20040367] [WorldCat] [DOI] - ↑ 33.0 33.1 33.2 33.3 33.4
Campbell, P., Reep, R.L., Stoll, M.L., Ophir, A.G., & Phelps, S.M. (2009).
Conservation and diversity of Foxp2 expression in muroid rodents: functional implications. The Journal of comparative neurology, 512(1), 84-100. [PubMed:18972576] [PMC] [WorldCat] [DOI] - ↑
Kast, R.J., Lanjewar, A.L., Smith, C.D., & Levitt, P. (2019).
FOXP2 exhibits projection neuron class specific expression, but is not required for multiple aspects of cortical histogenesis. eLife, 8. [PubMed:31099752] [PMC] [WorldCat] [DOI] - ↑
Sorensen, S.A., Bernard, A., Menon, V., Royall, J.J., Glattfelder, K.J., Desta, T., ..., & Lein, E.S. (2015).
Correlated gene expression and target specificity demonstrate excitatory projection neuron diversity. Cerebral cortex (New York, N.Y. : 1991), 25(2), 433-49. [PubMed:24014670] [WorldCat] [DOI] - ↑ 36.0 36.1
Rodenas-Cuadrado, P.M., Mengede, J., Baas, L., Devanna, P., Schmid, T.A., Yartsev, M., ..., & Vernes, S.C. (2018).
Mapping the distribution of language related genes FoxP1, FoxP2, and CntnaP2 in the brains of vocal learning bat species. The Journal of comparative neurology, 526(8), 1235-1266. [PubMed:29297931] [PMC] [WorldCat] [DOI] - ↑ 37.0 37.1
Kaoru, T., Liu, F.C., Ishida, M., Oishi, T., Hayashi, M., Kitagawa, M., ..., & Takahashi, H. (2010).
Molecular characterization of the intercalated cell masses of the amygdala: implications for the relationship with the striatum. Neuroscience, 166(1), 220-30. [PubMed:20004711] [WorldCat] [DOI] - ↑
Vicario, A., Mendoza, E., Abellán, A., Scharff, C., & Medina, L. (2017).
Genoarchitecture of the extended amygdala in zebra finch, and expression of FoxP2 in cell corridors of different genetic profile. Brain structure & function, 222(1), 481-514. [PubMed:27160258] [PMC] [WorldCat] [DOI] - ↑
Fong, W.L., Kuo, H.Y., Wu, H.L., Chen, S.Y., & Liu, F.C. (2018).
Differential and Overlapping Pattern of Foxp1 and Foxp2 Expression in the Striatum of Adult Mouse Brain. Neuroscience, 388, 214-223. [PubMed:30031127] [WorldCat] [DOI] - ↑
Saunders, A., Macosko, E.Z., Wysoker, A., Goldman, M., Krienen, F.M., de Rivera, H., ..., & McCarroll, S.A. (2018).
Molecular Diversity and Specializations among the Cells of the Adult Mouse Brain. Cell, 174(4), 1015-1030.e16. [PubMed:30096299] [PMC] [WorldCat] [DOI] - ↑ 41.0 41.1
Vernes, S.C., Oliver, P.L., Spiteri, E., Lockstone, H.E., Puliyadi, R., Taylor, J.M., ..., & Fisher, S.E. (2011).
Foxp2 regulates gene networks implicated in neurite outgrowth in the developing brain. PLoS genetics, 7(7), e1002145. [PubMed:21765815] [PMC] [WorldCat] [DOI] - ↑ 42.0 42.1 42.2
Lai, C.S., Gerrelli, D., Monaco, A.P., Fisher, S.E., & Copp, A.J. (2003).
FOXP2 expression during brain development coincides with adult sites of pathology in a severe speech and language disorder. Brain : a journal of neurology, 126(Pt 11), 2455-62. [PubMed:12876151] [WorldCat] [DOI] - ↑ 43.0 43.1
Haesler, S., Rochefort, C., Georgi, B., Licznerski, P., Osten, P., & Scharff, C. (2007).
Incomplete and inaccurate vocal imitation after knockdown of FoxP2 in songbird basal ganglia nucleus Area X. PLoS biology, 5(12), e321. [PubMed:18052609] [PMC] [WorldCat] [DOI] - ↑
Co, M., Anderson, A.G., & Konopka, G. (2020).
FOXP transcription factors in vertebrate brain development, function, and disorders. Wiley interdisciplinary reviews. Developmental biology, 9(5), e375. [PubMed:31999079] [PMC] [WorldCat] [DOI] - ↑
Fujita, H., & Sugihara, I. (2012).
FoxP2 expression in the cerebellum and inferior olive: development of the transverse stripe-shaped expression pattern in the mouse cerebellar cortex. The Journal of comparative neurology, 520(3), 656-77. [PubMed:21935935] [WorldCat] [DOI] - ↑
Tam, W.Y., Leung, C.K., Tong, K.K., & Kwan, K.M. (2011).
Foxp4 is essential in maintenance of Purkinje cell dendritic arborization in the mouse cerebellum. Neuroscience, 172, 562-71. [PubMed:20951773] [WorldCat] [DOI] - ↑ 47.0 47.1 47.2
Haesler, S., Wada, K., Nshdejan, A., Morrisey, E.E., Lints, T., Jarvis, E.D., & Scharff, C. (2004).
FoxP2 expression in avian vocal learners and non-learners. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(13), 3164-75. [PubMed:15056696] [PMC] [WorldCat] [DOI] - ↑
Morikawa, Y., Hisaoka, T., & Senba, E. (2009).
Characterization of Foxp2-expressing cells in the developing spinal cord. Neuroscience, 162(4), 1150-62. [PubMed:19463901] [WorldCat] [DOI] - ↑
Morikawa, Y., Komori, T., Hisaoka, T., & Senba, E. (2009).
Detailed expression pattern of Foxp1 and its possible roles in neurons of the spinal cord during embryogenesis. Developmental neuroscience, 31(6), 511-22. [PubMed:19797899] [WorldCat] [DOI] - ↑
Spiteri, E., Konopka, G., Coppola, G., Bomar, J., Oldham, M., Ou, J., ..., & Geschwind, D.H. (2007).
Identification of the transcriptional targets of FOXP2, a gene linked to speech and language, in developing human brain. American journal of human genetics, 81(6), 1144-57. [PubMed:17999357] [PMC] [WorldCat] [DOI] - ↑
Vernes, S.C., Spiteri, E., Nicod, J., Groszer, M., Taylor, J.M., Davies, K.E., ..., & Fisher, S.E. (2007).
High-throughput analysis of promoter occupancy reveals direct neural targets of FOXP2, a gene mutated in speech and language disorders. American journal of human genetics, 81(6), 1232-50. [PubMed:17999362] [PMC] [WorldCat] [DOI] - ↑
Coutinho, P., Pavlou, S., Bhatia, S., Chalmers, K.J., Kleinjan, D.A., & van Heyningen, V. (2011).
Discovery and assessment of conserved Pax6 target genes and enhancers. Genome research, 21(8), 1349-59. [PubMed:21617155] [PMC] [WorldCat] [DOI] - ↑
den Hoed, J., Devaraju, K., & Fisher, S.E. (2021).
Molecular networks of the FOXP2 transcription factor in the brain. EMBO reports, 22(8), e52803. [PubMed:34260143] [PMC] [WorldCat] [DOI] - ↑ 54.0 54.1 54.2
French, C.A., Groszer, M., Preece, C., Coupe, A.M., Rajewsky, K., & Fisher, S.E. (2007).
Generation of mice with a conditional Foxp2 null allele. Genesis (New York, N.Y. : 2000), 45(7), 440-6. [PubMed:17619227] [PMC] [WorldCat] [DOI] - ↑
Clark, K.L., Halay, E.D., Lai, E., & Burley, S.K. (1993).
Co-crystal structure of the HNF-3/fork head DNA-recognition motif resembles histone H5. Nature, 364(6436), 412-20. [PubMed:8332212] [WorldCat] [DOI] - ↑ 56.0 56.1 56.2 56.3 56.4
Fujita, E., Tanabe, Y., Shiota, A., Ueda, M., Suwa, K., Momoi, M.Y., & Momoi, T. (2008).
Ultrasonic vocalization impairment of Foxp2 (R552H) knockin mice related to speech-language disorder and abnormality of Purkinje cells. Proceedings of the National Academy of Sciences of the United States of America, 105(8), 3117-22. [PubMed:18287060] [PMC] [WorldCat] [DOI] - ↑ 57.0 57.1 57.2
Groszer, M., Keays, D.A., Deacon, R.M., de Bono, J.P., Prasad-Mulcare, S., Gaub, S., ..., & Fisher, S.E. (2008).
Impaired synaptic plasticity and motor learning in mice with a point mutation implicated in human speech deficits. Current biology : CB, 18(5), 354-62. [PubMed:18328704] [PMC] [WorldCat] [DOI] - ↑
Clark, K.L., Halay, E.D., Lai, E., & Burley, S.K. (1993).
Co-crystal structure of the HNF-3/fork head DNA-recognition motif resembles histone H5. Nature, 364(6436), 412-20. [PubMed:8332212] [WorldCat] [DOI] - ↑
Vargha-Khadem, F., Gadian, D.G., Copp, A., & Mishkin, M. (2005).
FOXP2 and the neuroanatomy of speech and language. Nature reviews. Neuroscience, 6(2), 131-8. [PubMed:15685218] [WorldCat] [DOI] - ↑ 60.0 60.1
Scharff, C., & White, S.A. (2004).
Genetic components of vocal learning. Annals of the New York Academy of Sciences, 1016, 325-47. [PubMed:15313783] [WorldCat] [DOI] - ↑
Norton, P., Barschke, P., Scharff, C., & Mendoza, E. (2019).
Differential Song Deficits after Lentivirus-Mediated Knockdown of FoxP1, FoxP2, or FoxP4 in Area X of Juvenile Zebra Finches. The Journal of neuroscience : the official journal of the Society for Neuroscience, 39(49), 9782-9796. [PubMed:31641053] [PMC] [WorldCat] [DOI] - ↑
Kao, M.H., & Brainard, M.S. (2006).
Lesions of an avian basal ganglia circuit prevent context-dependent changes to song variability. Journal of neurophysiology, 96(3), 1441-55. [PubMed:16723412] [WorldCat] [DOI] - ↑
Kao, M.H., Doupe, A.J., & Brainard, M.S. (2005).
Contributions of an avian basal ganglia-forebrain circuit to real-time modulation of song. Nature, 433(7026), 638-43. [PubMed:15703748] [WorldCat] [DOI] - ↑
Murugan, M., Harward, S., Scharff, C., & Mooney, R. (2013).
Diminished FoxP2 levels affect dopaminergic modulation of corticostriatal signaling important to song variability. Neuron, 80(6), 1464-76. [PubMed:24268418] [PMC] [WorldCat] [DOI] - ↑ 65.0 65.1 65.2 65.3 65.4 65.5 65.6 65.7
Enard, W., Przeworski, M., Fisher, S.E., Lai, C.S., Wiebe, V., Kitano, T., ..., & Pääbo, S. (2002).
Molecular evolution of FOXP2, a gene involved in speech and language. Nature, 418(6900), 869-72. [PubMed:12192408] [WorldCat] [DOI] - ↑
Scharff, C., & Petri, J. (2011).
Evo-devo, deep homology and FoxP2: implications for the evolution of speech and language. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 366(1574), 2124-40. [PubMed:21690130] [PMC] [WorldCat] [DOI] - ↑ 67.0 67.1 67.2 67.3
Zhang, J., Webb, D.M., & Podlaha, O. (2002).
Accelerated protein evolution and origins of human-specific features: Foxp2 as an example. Genetics, 162(4), 1825-35. [PubMed:12524352] [PMC] [WorldCat] - ↑
Enard, W., Gehre, S., Hammerschmidt, K., Hölter, S.M., Blass, T., Somel, M., ..., & Pääbo, S. (2009).
A humanized version of Foxp2 affects cortico-basal ganglia circuits in mice. Cell, 137(5), 961-71. [PubMed:19490899] [WorldCat] [DOI] - ↑
Shu, W., Cho, J.Y., Jiang, Y., Zhang, M., Weisz, D., Elder, G.A., ..., & Buxbaum, J.D. (2005).
Altered ultrasonic vocalization in mice with a disruption in the Foxp2 gene. Proceedings of the National Academy of Sciences of the United States of America, 102(27), 9643-8. [PubMed:15983371] [PMC] [WorldCat] [DOI] - ↑
French, C.A., Jin, X., Campbell, T.G., Gerfen, E., Groszer, M., Fisher, S.E., & Costa, R.M. (2012).
An aetiological Foxp2 mutation causes aberrant striatal activity and alters plasticity during skill learning. Molecular psychiatry, 17(11), 1077-85. [PubMed:21876543] [PMC] [WorldCat] [DOI] - ↑
French, C.A., Vinueza Veloz, M.F., Zhou, K., Peter, S., Fisher, S.E., Costa, R.M., & De Zeeuw, C.I. (2019).
Differential effects of Foxp2 disruption in distinct motor circuits. Molecular psychiatry, 24(3), 447-462. [PubMed:30108312] [PMC] [WorldCat] [DOI] - ↑
Chen, Y.C., Kuo, H.Y., Bornschein, U., Takahashi, H., Chen, S.Y., Lu, K.M., ..., & Liu, F.C. (2016).
Foxp2 controls synaptic wiring of corticostriatal circuits and vocal communication by opposing Mef2c. Nature neuroscience, 19(11), 1513-1522. [PubMed:27595386] [PMC] [WorldCat] [DOI] - ↑
Hachigian, L.J., Carmona, V., Fenster, R.J., Kulicke, R., Heilbut, A., Sittler, A., ..., & Heiman, M. (2017).
Control of Huntington's Disease-Associated Phenotypes by the Striatum-Enriched Transcription Factor Foxp2. Cell reports, 21(10), 2688-2695. [PubMed:29212017] [WorldCat] [DOI] - ↑
van Rhijn, J.R., Fisher, S.E., Vernes, S.C., & Nadif Kasri, N. (2018).
Foxp2 loss of function increases striatal direct pathway inhibition via increased GABA release. Brain structure & function, 223(9), 4211-4226. [PubMed:30187194] [PMC] [WorldCat] [DOI] - ↑ Richard G. Klein. (1989).
The Human Career, Human Biological and Cultural Origins
Univ, Chicago Press. ISBN-10 : 0226439658 - ↑
Krause, J., Lalueza-Fox, C., Orlando, L., Enard, W., Green, R.E., Burbano, H.A., ..., & Pääbo, S. (2007).
The derived FOXP2 variant of modern humans was shared with Neandertals. Current biology : CB, 17(21), 1908-12. [PubMed:17949978] [WorldCat] [DOI] - ↑
Henn, B.M., Botigué, L.R., Peischl, S., Dupanloup, I., Lipatov, M., Maples, B.K., ..., & Bustamante, C.D. (2016).
Distance from sub-Saharan Africa predicts mutational load in diverse human genomes. Proceedings of the National Academy of Sciences of the United States of America, 113(4), E440-9. [PubMed:26712023] [PMC] [WorldCat] [DOI] - ↑
Atkinson, E.G., Audesse, A.J., Palacios, J.A., Bobo, D.M., Webb, A.E., Ramachandran, S., & Henn, B.M. (2018).
No Evidence for Recent Selection at FOXP2 among Diverse Human Populations. Cell, 174(6), 1424-1435.e15. [PubMed:30078708] [PMC] [WorldCat] [DOI] - ↑
Fisher, S.E. (2019).
Human Genetics: The Evolving Story of FOXP2. Current biology : CB, 29(2), R65-R67. [PubMed:30668952] [WorldCat] [DOI] - ↑
Hunter, P. (2019).
The riddle of speech: After FOXP2 dominated research on the origins of speech, other candidate genes have recently emerged. EMBO reports, 20(2). [PubMed:30635342] [PMC] [WorldCat] [DOI]