「カルシトニン遺伝子関連ペプチド」の版間の差分
細 →疾患との関わり |
細編集の要約なし |
||
| (同じ利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
{{box|text= カルシトニン遺伝子関連ペプチド(CGRP)は1982年に発見され、強力な血管拡張作用を持つ多機能神経ペプチドとして研究が進められてきた。主な作用はGsタンパク質を介したcAMP-PKA経路を主とし、さまざまな生理機能を示す。CREBやERKの活性化、グルタミン酸放出にも関与し、より複雑な神経修飾作用を持つ。CGRPの異常な増加は片頭痛の発症に関与し、これを標的としたモノクローナル抗体や小分子受容体拮抗薬が開発され、片頭痛治療において有効性が示されている。一方で、CGRPはストレス応答の抑制や炎症制御を介して生体を保護する役割も果たす。そのため、生体の恒常性維持には、CGRPの濃度は多すぎず、少なすぎず適切に調節されることが重要である。}} | |||
{{box|text= カルシトニン遺伝子関連ペプチド(CGRP) | |||
== カルシトニン遺伝子関連ペプチドとは == | == カルシトニン遺伝子関連ペプチドとは == | ||
1982年に[[ラット]][[甲状腺]]から発見された<ref name=Amara1982><pubmed>6283379</pubmed></ref> | 1982年に[[ラット]][[甲状腺]]から発見された<ref name=Amara1982><pubmed>6283379</pubmed></ref>1。当初は[[選択的スプライシング]]の一例として注目され、[[カルシトニン]]をコードする[[エクソン]]が除去されることで、CGRPをコードする新たな下流エクソンと、新たな[[ポリアデニル化部位]]が含まれることが明らかとなった。そのため、この転写物は「カルシトニン遺伝子関連ペプチド」と命名された。その後の研究によりCGRPは多機能性をもつ重要な[[神経ペプチド]]として認識されるに至った。 | ||
強力な[[血管]]拡張作用を有することから、[[降圧薬]]としての応用が期待された。しかし、高血圧におけるCGRPの役割は一定の方向を示さず、CGRPの減少が高血圧の発症に寄与する可能性は示唆されたものの<ref name=Kee2018><pubmed>30283343</pubmed></ref>2、正常状態での血圧制御には関与しない可能性も指摘されており<ref name=Russell2014><pubmed>25287861</pubmed></ref>3、コンセンサスは得られていない。そのため、降圧薬としての開発には至らなかった。 | |||
1980年代にはCGRPが[[三叉神経]]で発現していることが明らかとなり<ref name=OConnor1988><pubmed>2470872</pubmed></ref>4、1990年代には、[[片頭痛]]患者の[[唾液]]中にCGRPが多く含まれていることが報告された<ref name=Nicolodi1990><pubmed>1690601</pubmed></ref>5。2000年代に入ると、CGRPの[[静脈]]内投与が片頭痛を誘発することが示され<ref name=Lassen2002><pubmed>11993614</pubmed></ref>6、片頭痛治療薬の標的として注目された。CGRP[[受容体]][[拮抗薬]]([[olcegepant]]や[[telcegepant]])の開発は、重篤な肝障害の発生により中止されたが、2010年代以降、CGRPまたはその受容体を標的とする[[モノクローナル抗体]]医薬品の開発が進展した。2018年には米国で初のCGRP関連抗体医薬品が承認され、片頭痛治療に貢献している。 | |||
[[ファイル:Hashikawa CGRP Fig1.png|サムネイル|'''図1. カルシトニンとαCGRPの選択的スプライシングの概略図'''<br>CALCA遺伝子には6つのエクソンが含まれており、第4エクソンはカルシトニン、第5エクソンはCGRPをコードしている。選択的スプライシングによって、それぞれ異なるmRNAが生成され、カルシトニンまたはCGRPが翻訳される。 文献<ref name=Sexton1991 />10より改変]] | |||
== 構造 == | == 構造 == | ||
37個のアミノ酸からなるペプチドであり、最初の7個のアミノ酸がジスルフィド結合により環状構造を形成する。この環状構造がCGRP受容体であるcalcitonin receptor-like receptor (CRLR)の膜貫通ドメインと相互作用し、受容体を活性化する<ref name=Conner2002><pubmed>12196113</pubmed></ref>7。残りのアミノ酸残基、8~37領域も受容体と直接結合するため、ペプチド性受容体拮抗薬としてCGRP (8-37)が用いられる<ref name=Hughes1991><pubmed>1797334</pubmed></ref>8。 | |||
CGRPはカルシトニン、アミリン、アドレノメデュリン、アドレノメデュリン2(インターメディン)とともにファミリーを形成している<ref name=Hay2018a><pubmed>29059473</pubmed></ref>9。CGRPにはαCGRPとβCGRPの2種類のアイソフォームが存在する。αCGRPは中枢および末梢神経系に多く発現し、血管拡張作用や、神経原性炎症(感覚神経が炎症を促進するメディエーターを放出する)の調節に関与する。一方、βCGRPは主に腸管神経系に発現しており、消化管の運動調節に関与すると考えられている。ヒトにおいてはαCGRPとβCGRPは3アミノ酸の違いがあるが、90%の相同性を有し、両者の生理機能に大きな差異はない<ref name=Sexton1991><pubmed>1668388</pubmed></ref>10。 | |||
CALCA遺伝子は選択的スプライシングを受け、カルシトニンまたはαCGRPのいずれかを産生する。一方、βCGRPはCALCB遺伝子から転写される。CALCA遺伝子からカルシトニンを生成するにはエクソン4が成熟タンパク質として発現される必要があるが、エクソン5とエクソン6が発現するとαCGRPが生成される(図1)。本稿では、特にことわりのない限り「CGRP」はαCGRPを指すものとする。 | |||
==組織分布 == | ==組織分布 == | ||
CGRPは中枢神経および末梢神経に広く分布している。中枢神経では扁桃体、傍視床下核、青斑核に主に発現するほか、脊髄後角や血管周囲神経、知覚神経にも存在する<ref name=Russo2023><pubmed>36454715</pubmed></ref>11。CGRPの合成は主に三叉神経節細胞および脊髄後根神経節で行われ<ref name=Gibson1984><pubmed>6209366</pubmed></ref>12、無髄C線維の感覚神経中にサブスタンスPと共存することが知られている<ref name=Gibson1984 />12。また、運動神経においてはアセチルコリンの受容体の合成を増加させる栄養因子としての役割が示唆されている<ref name=New1986><pubmed>3490625</pubmed></ref>13。 | |||
脳内におけるCGRPの発現は広範囲に及び、脳幹から大脳皮質にまで広がっている。大脳皮質、小脳、海馬、視床、視床下部、脳幹の核においてほとんどすべてのニューロンがCGRPまたはCGRP受容体を発現している<ref name=Warfvinge2019><pubmed>28856910</pubmed></ref>14。 | |||
== 細胞内分布 == | == 細胞内分布 == | ||
CGRPは合成後、感覚神経末端内の小胞体に貯蔵され、神経の脱分極に伴いカルシウム依存性エキソサイトーシスを介して放出される<ref name=Meng2007><pubmed>17666428</pubmed></ref>15。放出されたCGRPは受容体と結合し、シグナル伝達を活性化する。一方で、余剰のCGRPは膜結合ペプチダーゼである中性エンドペプチダーゼ(ネプリライシン)により分解され、作用を失う<ref name=Katayama1991><pubmed>1717955</pubmed></ref>16。また、エンドセリン変換酵素によっても分解され、マウスの肺線維症を悪化させる可能性が示されている<ref name=Hartopo2013><pubmed>23306833</pubmed></ref>17。 | |||
[[ファイル:Hashikawa CGRP Fig2.png|サムネイル|'''図2. CGRPによる細胞内情報伝達'''<br> | [[ファイル:Hashikawa CGRP Fig2.png|サムネイル|'''図2. CGRPによる細胞内情報伝達'''<br>CGRPは神経終末から遊離され、CRLR-RAMP1あるいはCTR-RAMP1二量体を介して細胞内にシグナルを伝達する。CGRPはGタンパク質を介してアデニル酸シクラーゼ(adenylyl cyclase; AC)を活性化し、セカンドメッセンジャーであるcAMPの産生を促進する。cAMPはプロテインキナーゼA (PKA)やcAMP応答配列結合タンパク質(CREB)を活性化し、リン酸化CREB (p-CREB)が核内でmRNA転写を促進する。また、PKAはATP感受性K<sup>+</sup>チャネルを開口し、細胞外へのK+を促す。さらにCGRPによって活性化されたPKAは、一酸化窒素合成酵素(NOS)や、細胞外シグナル調節キナーゼ(ERK)を活性化し、グルタミン酸の放出を促進する。文献<ref name=Hay2018b><pubmed>29059473</pubmed></ref><ref name=Liu2020><pubmed>32151282</pubmed></ref><ref name=Eftekhari2016><pubmed>26105175</pubmed></ref>33, 34, 35より改変]] | ||
==受容体== | ==受容体== | ||
CGRPは神経修飾因子(neuromodulator)として中枢神経において多彩な機能を果たす。CGRPは以下の2種類の受容体を介して作用する(図2)。 | |||
=== CGRP受容体 === | |||
:'''構造''':カルシトニン受容体様受容体(CRLR)と受容体活性修飾タンパク質(receptor activity-modifying protein 1; RAMP1)の複合体(CRLR/RMAP1複合体)<br> | |||
:'''シグナル伝達経路''':Gsタンパク質を介してアデニル酸シクラーゼ(AC)を活性化し、cAMP-PKA経路を活性化する<br> | |||
:'''主な発現部位''':頭蓋内血管<ref name=Eftekhari2013><pubmed>23958278</pubmed></ref><ref name=Edvinsson2010><pubmed>20416945</pubmed></ref>18, 19硬膜<ref name=Eftekhari2013 /><ref name=Lennerz2008><pubmed>18186028</pubmed></ref>18, 20三叉神経節<ref name=Eftekhari2010><pubmed>20472035</pubmed></ref><ref name=Tajti1999><pubmed>10412842</pubmed></ref><ref name=Eftekhari2015><pubmed>25463029</pubmed></ref>21, 22, 23脳幹<ref name=Tajti2001><pubmed>11422090</pubmed></ref>24、三叉神経尾核<ref name=Eftekhari2011><pubmed>22074408</pubmed></ref>25、大脳皮質、海馬、小脳<ref name=Eftekhari2011 />25、視床核、視床下核、視床後部<ref name=Sowers2020><pubmed>32750230</pubmed></ref>26、三叉神経脊髄路核<ref name=Walker2015><pubmed>26125036</pubmed></ref>27、扁桃体<ref name=Nguyen1986><pubmed>3488544</pubmed></ref>28、島皮質<ref name=Yasui1989><pubmed>2613940</pubmed></ref>29<br> | |||
=== AMY1受容体 === | |||
:'''構造''':カルシトニン受容体:(calcitonin receptor)とRAMP1の複合体 (CTR/RAMP1複合体)<br> | |||
:'''シグナル伝達経路''':CGRP受容体と類似のcAMP-PKA経路<br> | |||
:'''主な発現部位''': 小径三叉神経ニューロン<ref name=Rees2022><pubmed>35620595</pubmed></ref>30、三叉神経脊髄路<ref name=Hay2017><pubmed>28485843</pubmed></ref>31、 プルキンエ細胞<ref name=Edvinsson2011><pubmed>21040789</pubmed></ref>32 | |||
== 機能== | == 機能== | ||
=== 中枢感作 === | === 中枢感作 === | ||
CGRPは中枢感作(central sensitization)を引き起こし、慢性痛や片頭痛の病態形成に重要な役割を果たす。生理作用は以下の二つに分類される。 | |||
==== 侵害受容伝達 ==== | ==== 侵害受容伝達 ==== | ||
脊髄後角および三叉神経脊髄路核において、CGRPはグルタミン酸の放出を引き起こし、中枢感作を起こす<ref name=Marviz2007><pubmed>17614212</pubmed></ref> | 脊髄後角および三叉神経脊髄路核において、CGRPはグルタミン酸の放出を引き起こし、中枢感作を起こす<ref name=Marviz2007><pubmed>17614212</pubmed></ref>36。さらに、炎症性物質であるサブスタンスPがAMPAおよびNMDA受容体の両方に作用する力を増強する<ref name=Seybold2009><pubmed>19655115</pubmed></ref>37。これにより、CGRPは機械的アロディニアを引き起こす。また、小胞グルタミン酸トランスポーターを介したグルタミン酸伝達は、CGRPによる持続性炎症に関連する熱痛覚過敏の発生に不可欠であり、痛みや痒みの促進に関与する<ref name=Rogoz2014><pubmed>24275230</pubmed></ref>38。 | ||
視床においては、ヒトの網膜と視床後部は関連があることが報告されている<ref name=Maleki2012><pubmed>21337474</pubmed></ref>39。また、マウスの視床後部にCGRPを注入すると、光過敏が誘発され、片頭痛患者の光過敏症に類似した反応が引き起こされることが示されている<ref name=Sowers2020 />26。 | |||
さらに、島皮質<ref name=Liu2020 /> | さらに、島皮質<ref name=Liu2020 />34や前帯状皮質<ref name=Li2019><pubmed>30717631</pubmed></ref>40においてCGRPが増加すると、グルタミン酸作動性シグナル伝達が増強され、痛みの不快感が増強されることが示されている。このように、CGRPは急性の痛みに加え、慢性的疼痛の形成にも関与する。 | ||
=== 嫌悪的行動 === | |||
CGRPは不安や恐怖といった情動行動、ならびに食べ物<ref name=Campos2017><pubmed>28581479</pubmed></ref>41や光に対する嫌悪行動に関与する。これらの行動は、恐怖や不安を引き起こす分界条床核を含む扁桃体のシナプス伝達をCGRPが調節することによって制御されることが知られている<ref name=Sink2011><pubmed>21289190</pubmed></ref>42。さらに分界条床核において遊離されるCGRPはストレスに応答して、不安応答ペプチドである副腎皮質刺激ホルモン放出因子の放出を増加させ、不安行動を惹起することが示されている<ref name=Sink2013><pubmed>23376701</pubmed></ref>43。 | |||
一方、記憶の形成と空間認知を担う海馬においても、CGRPは不安および恐怖記憶に関与する。海馬にCGRPを投与すると、恐怖文脈条件付けによる恐怖記憶の保持が低下し、これは転写調節因子Npas4の増加を介して生じることが報告されている<ref name=Hashikawa-Hobara2021><pubmed>33772088</pubmed></ref>44。さらに、CGRPの海馬投与により不安行動が誘発されるが、これはドパミン代謝酵素であるモノアミン酸化酵素Bのエピジェネティックな調節を介した産生増加により、ドパミンの減少が引き起こされることによると考えられている<ref name=Hashikawa-Hobara2024><pubmed>38503899</pubmed></ref>45。 | |||
=== 細胞保護 === | === 細胞保護 === | ||
CGRPは、その強力な血管拡張作用を有することから推察されるように、心血管系において保護的な役割を果たす。例えば、血管肥大を抑制し<ref name=Argunhan2021><pubmed>33641368</pubmed></ref> | CGRPは、その強力な血管拡張作用を有することから推察されるように、心血管系において保護的な役割を果たす。例えば、血管肥大を抑制し<ref name=Argunhan2021><pubmed>33641368</pubmed></ref>46、酸化ストレスから守る働きを示す<ref name=Smillie2014><pubmed>24516108</pubmed></ref>47。肺においては、肺動脈の血管拡張を引き起こし、低酸素症による障害からの保護作用を持つ<ref name=Tjen-A-Looi1992><pubmed>1357980</pubmed></ref>48。一方で、小児の呼吸器疾患モデルマウスでは、肺においてCGRPが過剰発現し、低酸素症を引き起こすことが報告されており、CGRP受容体拮抗薬の投与によってその症状が抑制されることが示されている<ref name=Xu2022><pubmed>35303432</pubmed></ref>49。 | ||
免疫系においてCGRPは炎症促進作用と抗炎症作用の両方を持つことが明らかになっている<ref name=Assas2014><pubmed>24592205</pubmed></ref><ref name=Shepherd2005><pubmed>16162264</pubmed></ref>50, 51。CGRPは肥満細胞に作用し、炎症性サイトカインやヒスタミンの放出を促進する<ref name=Piotrowski1986><pubmed>2417614</pubmed></ref>52。また、T細胞にも影響を与え、インターロイキン4の産生を増加させる一方で、インターフェロンγとインターロイキン2の産生を減少させる<ref name=Assas2014 />50。 | |||
これらの知見は、CGRPは細胞保護効果を持つ一方で、過剰に遊離されると有害な影響を及ぼす可能性があることを示唆している。すなわち、組織障害時にCGRPの上昇は損傷を引き起こすのではなく、むしろ改善を図る代償的な反応であると考えられる。しかし、その発現量が増えれば増えるほど良いという単純な関係ではなく、CGRPは極めて複雑かつ広範囲な制御機能を有していることが示唆される。 | これらの知見は、CGRPは細胞保護効果を持つ一方で、過剰に遊離されると有害な影響を及ぼす可能性があることを示唆している。すなわち、組織障害時にCGRPの上昇は損傷を引き起こすのではなく、むしろ改善を図る代償的な反応であると考えられる。しかし、その発現量が増えれば増えるほど良いという単純な関係ではなく、CGRPは極めて複雑かつ広範囲な制御機能を有していることが示唆される。 | ||
== 疾患との関わり == | == 疾患との関わり == | ||
9. CGRPが片頭痛に関与しているという最初の報告は、1990年に片頭痛発作中の患者の血液中にCGRPレベルの大幅な上昇が見られたことから始まった<ref name=Goadsby1990><pubmed>1699472</pubmed></ref>53。この発見以後、唾液、涙、発作の間の片頭痛患者の血漿などでもCGRPの上昇が検出され、治療によって抑制されることが明らかとなった<ref name=Bellamy2006><pubmed>16412148</pubmed></ref><ref name=Kamm2019><pubmed>31603037</pubmed></ref><ref name=Cernuda-Moroll2013><pubmed>23975872</pubmed></ref><ref name=Cernuda-Moroll2015><pubmed>25735000</pubmed></ref>54, 55, 56, 57。また、CGRPを静脈注射することにより、片頭痛様の頭痛を引き起こすことが報告されている<ref name=Lassen2002 />6。一方で、CGRPの上昇が全ての片頭痛患者で観察されたわけではなく、CGRPの上昇が片頭痛のバイオマーカーとして機能するかどうかは不明のままである<ref name=Alpuente2022><pubmed>34601944</pubmed></ref>58。しかしCGRPを標的とする薬は臨床的有効性が確立している。最新の研究により、CGRP関連抗体医薬品の有効性が示されている。 | |||
さらに、第二世代の小分子CGRP受容体拮抗薬 (gepant)は急性治療と予防治療の両方に適応があり、片頭痛発作の予防や、進行中の発作の抑制が可能である。米国食品医薬品局により承認されているが、本邦ではまだ未承認である(2025年3月現在)。 | |||
1) モノクローナル抗体 | |||
* Erenumab:CGRP受容体を標的 | |||
* Fremanezumab, Galcanezumab, Eptinezumab: CGRP自体を中和 | |||
* Eptinezumab: 静脈注射薬であり、0.5時間~1時間以内の片頭痛発作にも効果がある<ref name=Ailani2022><pubmed>35659622</pubmed></ref>59 | |||
* | |||
2) Gepant(小分子CGRP受容体拮抗薬) | |||
分子量が小さいため、経口や点鼻による投与が可能<ref name=Tepper2020><pubmed>32337726</pubmed></ref>60 | |||
* Rimegepant, Ubrogepant: 急性片頭痛の治療薬<ref name=Russo2023 />11 | |||
* Atogepant, Rimegepant: 予防治療薬に承認 | |||
* Zavegepant: 鼻腔内製剤。経口薬で効果がない場合や、吐き気・嘔吐により服薬が困難な場合の選択肢となる。 | |||
== 関連語 == | == 関連語 == | ||
2025年8月1日 (金) 00:37時点における版
カルシトニン遺伝子関連ペプチド(CGRP)は1982年に発見され、強力な血管拡張作用を持つ多機能神経ペプチドとして研究が進められてきた。主な作用はGsタンパク質を介したcAMP-PKA経路を主とし、さまざまな生理機能を示す。CREBやERKの活性化、グルタミン酸放出にも関与し、より複雑な神経修飾作用を持つ。CGRPの異常な増加は片頭痛の発症に関与し、これを標的としたモノクローナル抗体や小分子受容体拮抗薬が開発され、片頭痛治療において有効性が示されている。一方で、CGRPはストレス応答の抑制や炎症制御を介して生体を保護する役割も果たす。そのため、生体の恒常性維持には、CGRPの濃度は多すぎず、少なすぎず適切に調節されることが重要である。
カルシトニン遺伝子関連ペプチドとは
1982年にラット甲状腺から発見された[1]1。当初は選択的スプライシングの一例として注目され、カルシトニンをコードするエクソンが除去されることで、CGRPをコードする新たな下流エクソンと、新たなポリアデニル化部位が含まれることが明らかとなった。そのため、この転写物は「カルシトニン遺伝子関連ペプチド」と命名された。その後の研究によりCGRPは多機能性をもつ重要な神経ペプチドとして認識されるに至った。
強力な血管拡張作用を有することから、降圧薬としての応用が期待された。しかし、高血圧におけるCGRPの役割は一定の方向を示さず、CGRPの減少が高血圧の発症に寄与する可能性は示唆されたものの[2]2、正常状態での血圧制御には関与しない可能性も指摘されており[3]3、コンセンサスは得られていない。そのため、降圧薬としての開発には至らなかった。
1980年代にはCGRPが三叉神経で発現していることが明らかとなり[4]4、1990年代には、片頭痛患者の唾液中にCGRPが多く含まれていることが報告された[5]5。2000年代に入ると、CGRPの静脈内投与が片頭痛を誘発することが示され[6]6、片頭痛治療薬の標的として注目された。CGRP受容体拮抗薬(olcegepantやtelcegepant)の開発は、重篤な肝障害の発生により中止されたが、2010年代以降、CGRPまたはその受容体を標的とするモノクローナル抗体医薬品の開発が進展した。2018年には米国で初のCGRP関連抗体医薬品が承認され、片頭痛治療に貢献している。
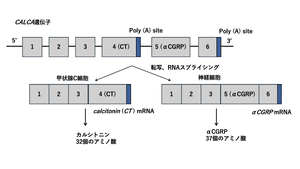
CALCA遺伝子には6つのエクソンが含まれており、第4エクソンはカルシトニン、第5エクソンはCGRPをコードしている。選択的スプライシングによって、それぞれ異なるmRNAが生成され、カルシトニンまたはCGRPが翻訳される。 文献[7]10より改変
構造
37個のアミノ酸からなるペプチドであり、最初の7個のアミノ酸がジスルフィド結合により環状構造を形成する。この環状構造がCGRP受容体であるcalcitonin receptor-like receptor (CRLR)の膜貫通ドメインと相互作用し、受容体を活性化する[8]7。残りのアミノ酸残基、8~37領域も受容体と直接結合するため、ペプチド性受容体拮抗薬としてCGRP (8-37)が用いられる[9]8。
CGRPはカルシトニン、アミリン、アドレノメデュリン、アドレノメデュリン2(インターメディン)とともにファミリーを形成している[10]9。CGRPにはαCGRPとβCGRPの2種類のアイソフォームが存在する。αCGRPは中枢および末梢神経系に多く発現し、血管拡張作用や、神経原性炎症(感覚神経が炎症を促進するメディエーターを放出する)の調節に関与する。一方、βCGRPは主に腸管神経系に発現しており、消化管の運動調節に関与すると考えられている。ヒトにおいてはαCGRPとβCGRPは3アミノ酸の違いがあるが、90%の相同性を有し、両者の生理機能に大きな差異はない[7]10。 CALCA遺伝子は選択的スプライシングを受け、カルシトニンまたはαCGRPのいずれかを産生する。一方、βCGRPはCALCB遺伝子から転写される。CALCA遺伝子からカルシトニンを生成するにはエクソン4が成熟タンパク質として発現される必要があるが、エクソン5とエクソン6が発現するとαCGRPが生成される(図1)。本稿では、特にことわりのない限り「CGRP」はαCGRPを指すものとする。
組織分布
CGRPは中枢神経および末梢神経に広く分布している。中枢神経では扁桃体、傍視床下核、青斑核に主に発現するほか、脊髄後角や血管周囲神経、知覚神経にも存在する[11]11。CGRPの合成は主に三叉神経節細胞および脊髄後根神経節で行われ[12]12、無髄C線維の感覚神経中にサブスタンスPと共存することが知られている[12]12。また、運動神経においてはアセチルコリンの受容体の合成を増加させる栄養因子としての役割が示唆されている[13]13。
脳内におけるCGRPの発現は広範囲に及び、脳幹から大脳皮質にまで広がっている。大脳皮質、小脳、海馬、視床、視床下部、脳幹の核においてほとんどすべてのニューロンがCGRPまたはCGRP受容体を発現している[14]14。
細胞内分布
CGRPは合成後、感覚神経末端内の小胞体に貯蔵され、神経の脱分極に伴いカルシウム依存性エキソサイトーシスを介して放出される[15]15。放出されたCGRPは受容体と結合し、シグナル伝達を活性化する。一方で、余剰のCGRPは膜結合ペプチダーゼである中性エンドペプチダーゼ(ネプリライシン)により分解され、作用を失う[16]16。また、エンドセリン変換酵素によっても分解され、マウスの肺線維症を悪化させる可能性が示されている[17]17。
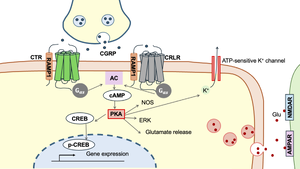
CGRPは神経終末から遊離され、CRLR-RAMP1あるいはCTR-RAMP1二量体を介して細胞内にシグナルを伝達する。CGRPはGタンパク質を介してアデニル酸シクラーゼ(adenylyl cyclase; AC)を活性化し、セカンドメッセンジャーであるcAMPの産生を促進する。cAMPはプロテインキナーゼA (PKA)やcAMP応答配列結合タンパク質(CREB)を活性化し、リン酸化CREB (p-CREB)が核内でmRNA転写を促進する。また、PKAはATP感受性K+チャネルを開口し、細胞外へのK+を促す。さらにCGRPによって活性化されたPKAは、一酸化窒素合成酵素(NOS)や、細胞外シグナル調節キナーゼ(ERK)を活性化し、グルタミン酸の放出を促進する。文献[18][19][20]33, 34, 35より改変
受容体
CGRPは神経修飾因子(neuromodulator)として中枢神経において多彩な機能を果たす。CGRPは以下の2種類の受容体を介して作用する(図2)。
CGRP受容体
- 構造:カルシトニン受容体様受容体(CRLR)と受容体活性修飾タンパク質(receptor activity-modifying protein 1; RAMP1)の複合体(CRLR/RMAP1複合体)
- シグナル伝達経路:Gsタンパク質を介してアデニル酸シクラーゼ(AC)を活性化し、cAMP-PKA経路を活性化する
- 主な発現部位:頭蓋内血管[21][22]18, 19硬膜[21][23]18, 20三叉神経節[24][25][26]21, 22, 23脳幹[27]24、三叉神経尾核[28]25、大脳皮質、海馬、小脳[28]25、視床核、視床下核、視床後部[29]26、三叉神経脊髄路核[30]27、扁桃体[31]28、島皮質[32]29
AMY1受容体
- 構造:カルシトニン受容体:(calcitonin receptor)とRAMP1の複合体 (CTR/RAMP1複合体)
- シグナル伝達経路:CGRP受容体と類似のcAMP-PKA経路
- 主な発現部位: 小径三叉神経ニューロン[33]30、三叉神経脊髄路[34]31、 プルキンエ細胞[35]32
機能
中枢感作
CGRPは中枢感作(central sensitization)を引き起こし、慢性痛や片頭痛の病態形成に重要な役割を果たす。生理作用は以下の二つに分類される。
侵害受容伝達
脊髄後角および三叉神経脊髄路核において、CGRPはグルタミン酸の放出を引き起こし、中枢感作を起こす[36]36。さらに、炎症性物質であるサブスタンスPがAMPAおよびNMDA受容体の両方に作用する力を増強する[37]37。これにより、CGRPは機械的アロディニアを引き起こす。また、小胞グルタミン酸トランスポーターを介したグルタミン酸伝達は、CGRPによる持続性炎症に関連する熱痛覚過敏の発生に不可欠であり、痛みや痒みの促進に関与する[38]38。
視床においては、ヒトの網膜と視床後部は関連があることが報告されている[39]39。また、マウスの視床後部にCGRPを注入すると、光過敏が誘発され、片頭痛患者の光過敏症に類似した反応が引き起こされることが示されている[29]26。
さらに、島皮質[19]34や前帯状皮質[40]40においてCGRPが増加すると、グルタミン酸作動性シグナル伝達が増強され、痛みの不快感が増強されることが示されている。このように、CGRPは急性の痛みに加え、慢性的疼痛の形成にも関与する。
嫌悪的行動
CGRPは不安や恐怖といった情動行動、ならびに食べ物[41]41や光に対する嫌悪行動に関与する。これらの行動は、恐怖や不安を引き起こす分界条床核を含む扁桃体のシナプス伝達をCGRPが調節することによって制御されることが知られている[42]42。さらに分界条床核において遊離されるCGRPはストレスに応答して、不安応答ペプチドである副腎皮質刺激ホルモン放出因子の放出を増加させ、不安行動を惹起することが示されている[43]43。
一方、記憶の形成と空間認知を担う海馬においても、CGRPは不安および恐怖記憶に関与する。海馬にCGRPを投与すると、恐怖文脈条件付けによる恐怖記憶の保持が低下し、これは転写調節因子Npas4の増加を介して生じることが報告されている[44]44。さらに、CGRPの海馬投与により不安行動が誘発されるが、これはドパミン代謝酵素であるモノアミン酸化酵素Bのエピジェネティックな調節を介した産生増加により、ドパミンの減少が引き起こされることによると考えられている[45]45。
細胞保護
CGRPは、その強力な血管拡張作用を有することから推察されるように、心血管系において保護的な役割を果たす。例えば、血管肥大を抑制し[46]46、酸化ストレスから守る働きを示す[47]47。肺においては、肺動脈の血管拡張を引き起こし、低酸素症による障害からの保護作用を持つ[48]48。一方で、小児の呼吸器疾患モデルマウスでは、肺においてCGRPが過剰発現し、低酸素症を引き起こすことが報告されており、CGRP受容体拮抗薬の投与によってその症状が抑制されることが示されている[49]49。
免疫系においてCGRPは炎症促進作用と抗炎症作用の両方を持つことが明らかになっている[50][51]50, 51。CGRPは肥満細胞に作用し、炎症性サイトカインやヒスタミンの放出を促進する[52]52。また、T細胞にも影響を与え、インターロイキン4の産生を増加させる一方で、インターフェロンγとインターロイキン2の産生を減少させる[50]50。
これらの知見は、CGRPは細胞保護効果を持つ一方で、過剰に遊離されると有害な影響を及ぼす可能性があることを示唆している。すなわち、組織障害時にCGRPの上昇は損傷を引き起こすのではなく、むしろ改善を図る代償的な反応であると考えられる。しかし、その発現量が増えれば増えるほど良いという単純な関係ではなく、CGRPは極めて複雑かつ広範囲な制御機能を有していることが示唆される。
疾患との関わり
9. CGRPが片頭痛に関与しているという最初の報告は、1990年に片頭痛発作中の患者の血液中にCGRPレベルの大幅な上昇が見られたことから始まった[53]53。この発見以後、唾液、涙、発作の間の片頭痛患者の血漿などでもCGRPの上昇が検出され、治療によって抑制されることが明らかとなった[54][55][56][57]54, 55, 56, 57。また、CGRPを静脈注射することにより、片頭痛様の頭痛を引き起こすことが報告されている[6]6。一方で、CGRPの上昇が全ての片頭痛患者で観察されたわけではなく、CGRPの上昇が片頭痛のバイオマーカーとして機能するかどうかは不明のままである[58]58。しかしCGRPを標的とする薬は臨床的有効性が確立している。最新の研究により、CGRP関連抗体医薬品の有効性が示されている。 さらに、第二世代の小分子CGRP受容体拮抗薬 (gepant)は急性治療と予防治療の両方に適応があり、片頭痛発作の予防や、進行中の発作の抑制が可能である。米国食品医薬品局により承認されているが、本邦ではまだ未承認である(2025年3月現在)。 1) モノクローナル抗体
- Erenumab:CGRP受容体を標的
- Fremanezumab, Galcanezumab, Eptinezumab: CGRP自体を中和
- Eptinezumab: 静脈注射薬であり、0.5時間~1時間以内の片頭痛発作にも効果がある[59]59
2) Gepant(小分子CGRP受容体拮抗薬) 分子量が小さいため、経口や点鼻による投与が可能[60]60
- Rimegepant, Ubrogepant: 急性片頭痛の治療薬[11]11
- Atogepant, Rimegepant: 予防治療薬に承認
- Zavegepant: 鼻腔内製剤。経口薬で効果がない場合や、吐き気・嘔吐により服薬が困難な場合の選択肢となる。
関連語
参考文献
- ↑
Amara, S.G., Jonas, V., Rosenfeld, M.G., Ong, E.S., & Evans, R.M. (1982).
Alternative RNA processing in calcitonin gene expression generates mRNAs encoding different polypeptide products. Nature, 298(5871), 240-4. [PubMed:6283379] [WorldCat] [DOI] - ↑
Kee, Z., Kodji, X., & Brain, S.D. (2018).
The Role of Calcitonin Gene Related Peptide (CGRP) in Neurogenic Vasodilation and Its Cardioprotective Effects. Frontiers in physiology, 9, 1249. [PubMed:30283343] [PMC] [WorldCat] [DOI] - ↑
Russell, F.A., King, R., Smillie, S.J., Kodji, X., & Brain, S.D. (2014).
Calcitonin gene-related peptide: physiology and pathophysiology. Physiological reviews, 94(4), 1099-142. [PubMed:25287861] [PMC] [WorldCat] [DOI] - ↑
O'Connor, T.P., & van der Kooy, D. (1988).
Enrichment of a vasoactive neuropeptide (calcitonin gene related peptide) in the trigeminal sensory projection to the intracranial arteries. The Journal of neuroscience : the official journal of the Society for Neuroscience, 8(7), 2468-76. [PubMed:2470872] [PMC] [WorldCat] [DOI] - ↑
Nicolodi, M., & Del Bianco, E. (1990).
Sensory neuropeptides (substance P, calcitonin gene-related peptide) and vasoactive intestinal polypeptide in human saliva: their pattern in migraine and cluster headache. Cephalalgia : an international journal of headache, 10(1), 39-50. [PubMed:1690601] [WorldCat] [DOI] - ↑ 6.0 6.1
Lassen, L.H., Haderslev, P.A., Jacobsen, V.B., Iversen, H.K., Sperling, B., & Olesen, J. (2002).
CGRP may play a causative role in migraine. Cephalalgia : an international journal of headache, 22(1), 54-61. [PubMed:11993614] [WorldCat] [DOI] - ↑ 7.0 7.1
Sexton, P.M. (1991).
Central nervous system binding sites for calcitonin and calcitonin gene-related peptide. Molecular neurobiology, 5(2-4), 251-73. [PubMed:1668388] [WorldCat] [DOI] - ↑
Conner, A.C., Hay, D.L., Howitt, S.G., Kilk, K., Langel, U., Wheatley, M., ..., & Poyner, D.R. (2002).
Interaction of calcitonin-gene-related peptide with its receptors. Biochemical Society transactions, 30(4), 451-5. [PubMed:12196113] [WorldCat] [DOI] - ↑
Hughes, S.R., & Brain, S.D. (1991).
A calcitonin gene-related peptide (CGRP) antagonist (CGRP8-37) inhibits microvascular responses induced by CGRP and capsaicin in skin. British journal of pharmacology, 104(3), 738-42. [PubMed:1797334] [PMC] [WorldCat] [DOI] - ↑
Hay, D.L., Garelja, M.L., Poyner, D.R., & Walker, C.S. (2018).
Update on the pharmacology of calcitonin/CGRP family of peptides: IUPHAR Review 25. British journal of pharmacology, 175(1), 3-17. [PubMed:29059473] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Russo, A.F., & Hay, D.L. (2023).
CGRP physiology, pharmacology, and therapeutic targets: migraine and beyond. Physiological reviews, 103(2), 1565-1644. [PubMed:36454715] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Gibson, S.J., Polak, J.M., Bloom, S.R., Sabate, I.M., Mulderry, P.M., Ghatei, M.A., ..., & Evans, R.M. (1984).
Calcitonin gene-related peptide immunoreactivity in the spinal cord of man and of eight other species. The Journal of neuroscience : the official journal of the Society for Neuroscience, 4(12), 3101-11. [PubMed:6209366] [PMC] [WorldCat] [DOI] - ↑
New, H.V., & Mudge, A.W. (1986).
Calcitonin gene-related peptide regulates muscle acetylcholine receptor synthesis. Nature, 323(6091), 809-11. [PubMed:3490625] [WorldCat] [DOI] - ↑
Warfvinge, K., & Edvinsson, L. (2019).
Distribution of CGRP and CGRP receptor components in the rat brain. Cephalalgia : an international journal of headache, 39(3), 342-353. [PubMed:28856910] [WorldCat] [DOI] - ↑
Meng, J., Wang, J., Lawrence, G., & Dolly, J.O. (2007).
Synaptobrevin I mediates exocytosis of CGRP from sensory neurons and inhibition by botulinum toxins reflects their anti-nociceptive potential. Journal of cell science, 120(Pt 16), 2864-74. [PubMed:17666428] [WorldCat] [DOI] - ↑
Katayama, M., Nadel, J.A., Bunnett, N.W., Di Maria, G.U., Haxhiu, M., & Borson, D.B. (1991).
Catabolism of calcitonin gene-related peptide and substance P by neutral endopeptidase. Peptides, 12(3), 563-7. [PubMed:1717955] [WorldCat] [DOI] - ↑
Hartopo, A.B., Emoto, N., Vignon-Zellweger, N., Suzuki, Y., Yagi, K., Nakayama, K., & Hirata, K. (2013).
Endothelin-converting enzyme-1 gene ablation attenuates pulmonary fibrosis via CGRP-cAMP/EPAC1 pathway. American journal of respiratory cell and molecular biology, 48(4), 465-76. [PubMed:23306833] [WorldCat] [DOI] - ↑
Hay, D.L., Garelja, M.L., Poyner, D.R., & Walker, C.S. (2018).
Update on the pharmacology of calcitonin/CGRP family of peptides: IUPHAR Review 25. British journal of pharmacology, 175(1), 3-17. [PubMed:29059473] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Liu, Y., Chen, Q.Y., Lee, J.H., Li, X.H., Yu, S., & Zhuo, M. (2020).
Cortical potentiation induced by calcitonin gene-related peptide (CGRP) in the insular cortex of adult mice. Molecular brain, 13(1), 36. [PubMed:32151282] [PMC] [WorldCat] [DOI] - ↑
Eftekhari, S., Gaspar, R.C., Roberts, R., Chen, T.B., Zeng, Z., Villarreal, S., ..., & Salvatore, C.A. (2016).
Localization of CGRP receptor components and receptor binding sites in rhesus monkey brainstem: A detailed study using in situ hybridization, immunofluorescence, and autoradiography. The Journal of comparative neurology, 524(1), 90-118. [PubMed:26105175] [WorldCat] [DOI] - ↑ 21.0 21.1
Eftekhari, S., Warfvinge, K., Blixt, F.W., & Edvinsson, L. (2013).
Differentiation of nerve fibers storing CGRP and CGRP receptors in the peripheral trigeminovascular system. The journal of pain, 14(11), 1289-303. [PubMed:23958278] [WorldCat] [DOI] - ↑
Edvinsson, L., & Linde, M. (2010).
New drugs in migraine treatment and prophylaxis: telcagepant and topiramate. Lancet (London, England), 376(9741), 645-55. [PubMed:20416945] [WorldCat] [DOI] - ↑
Lennerz, J.K., Rühle, V., Ceppa, E.P., Neuhuber, W.L., Bunnett, N.W., Grady, E.F., & Messlinger, K. (2008).
Calcitonin receptor-like receptor (CLR), receptor activity-modifying protein 1 (RAMP1), and calcitonin gene-related peptide (CGRP) immunoreactivity in the rat trigeminovascular system: differences between peripheral and central CGRP receptor distribution. The Journal of comparative neurology, 507(3), 1277-99. [PubMed:18186028] [WorldCat] [DOI] - ↑
Eftekhari, S., Salvatore, C.A., Calamari, A., Kane, S.A., Tajti, J., & Edvinsson, L. (2010).
Differential distribution of calcitonin gene-related peptide and its receptor components in the human trigeminal ganglion. Neuroscience, 169(2), 683-96. [PubMed:20472035] [WorldCat] [DOI] - ↑
Tajti, J., Uddman, R., Möller, S., Sundler, F., & Edvinsson, L. (1999).
Messenger molecules and receptor mRNA in the human trigeminal ganglion. Journal of the autonomic nervous system, 76(2-3), 176-83. [PubMed:10412842] [WorldCat] [DOI] - ↑
Eftekhari, S., Salvatore, C.A., Johansson, S., Chen, T.B., Zeng, Z., & Edvinsson, L. (2015).
Localization of CGRP, CGRP receptor, PACAP and glutamate in trigeminal ganglion. Relation to the blood-brain barrier. Brain research, 1600, 93-109. [PubMed:25463029] [WorldCat] [DOI] - ↑
Tajti, J., Uddman, R., & Edvinsson, L. (2001).
Neuropeptide localization in the "migraine generator" region of the human brainstem. Cephalalgia : an international journal of headache, 21(2), 96-101. [PubMed:11422090] [WorldCat] [DOI] - ↑ 28.0 28.1
Eftekhari, S., & Edvinsson, L. (2011).
Calcitonin gene-related peptide (CGRP) and its receptor components in human and rat spinal trigeminal nucleus and spinal cord at C1-level. BMC neuroscience, 12, 112. [PubMed:22074408] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Sowers, L.P., Wang, M., Rea, B.J., Taugher, R.J., Kuburas, A., Kim, Y., ..., & Russo, A.F. (2020).
Stimulation of Posterior Thalamic Nuclei Induces Photophobic Behavior in Mice. Headache, 60(9), 1961-1981. [PubMed:32750230] [PMC] [WorldCat] [DOI] - ↑
Walker, C.S., Eftekhari, S., Bower, R.L., Wilderman, A., Insel, P.A., Edvinsson, L., ..., & Hay, D.L. (2015).
A second trigeminal CGRP receptor: function and expression of the AMY1 receptor. Annals of clinical and translational neurology, 2(6), 595-608. [PubMed:26125036] [PMC] [WorldCat] [DOI] - ↑
Nguyen, K.Q., Sills, M.A., & Jacobowitz, D.M. (1986).
Cardiovascular effects produced by microinjection of calcitonin gene-related peptide into the rat central amygdaloid nucleus. Peptides, 7(2), 337-9. [PubMed:3488544] [WorldCat] [DOI] - ↑
Yasui, Y., Saper, C.B., & Cechetto, D.F. (1989).
Calcitonin gene-related peptide immunoreactivity in the visceral sensory cortex, thalamus, and related pathways in the rat. The Journal of comparative neurology, 290(4), 487-501. [PubMed:2613940] [WorldCat] [DOI] - ↑
Rees, T.A., Russo, A.F., O'Carroll, S.J., Hay, D.L., & Walker, C.S. (2022).
CGRP and the Calcitonin Receptor are Co-Expressed in Mouse, Rat and Human Trigeminal Ganglia Neurons. Frontiers in physiology, 13, 860037. [PubMed:35620595] [PMC] [WorldCat] [DOI] - ↑
Hay, D.L. (2017).
Amylin. Headache, 57 Suppl 2, 89-96. [PubMed:28485843] [WorldCat] [DOI] - ↑
Edvinsson, L., Eftekhari, S., Salvatore, C.A., & Warfvinge, K. (2011).
Cerebellar distribution of calcitonin gene-related peptide (CGRP) and its receptor components calcitonin receptor-like receptor (CLR) and receptor activity modifying protein 1 (RAMP1) in rat. Molecular and cellular neurosciences, 46(1), 333-9. [PubMed:21040789] [WorldCat] [DOI] - ↑
Marvizón, J.C., Pérez, O.A., Song, B., Chen, W., Bunnett, N.W., Grady, E.F., & Todd, A.J. (2007).
Calcitonin receptor-like receptor and receptor activity modifying protein 1 in the rat dorsal horn: localization in glutamatergic presynaptic terminals containing opioids and adrenergic alpha2C receptors. Neuroscience, 148(1), 250-65. [PubMed:17614212] [PMC] [WorldCat] [DOI] - ↑
Seybold, V.S. (2009).
The role of peptides in central sensitization. Handbook of experimental pharmacology, (194), 451-91. [PubMed:19655115] [WorldCat] [DOI] - ↑
Rogoz, K., Andersen, H.H., Kullander, K., & Lagerström, M.C. (2014).
Glutamate, substance P, and calcitonin gene-related peptide cooperate in inflammation-induced heat hyperalgesia. Molecular pharmacology, 85(2), 322-34. [PubMed:24275230] [WorldCat] [DOI] - ↑
Maleki, N., Becerra, L., Upadhyay, J., Burstein, R., & Borsook, D. (2012).
Direct optic nerve pulvinar connections defined by diffusion MR tractography in humans: implications for photophobia. Human brain mapping, 33(1), 75-88. [PubMed:21337474] [PMC] [WorldCat] [DOI] - ↑
Li, X.H., Matsuura, T., Liu, R.H., Xue, M., & Zhuo, M. (2019).
Calcitonin gene-related peptide potentiated the excitatory transmission and network propagation in the anterior cingulate cortex of adult mice. Molecular pain, 15, 1744806919832718. [PubMed:30717631] [PMC] [WorldCat] [DOI] - ↑
Campos, C.A., Bowen, A.J., Han, S., Wisse, B.E., Palmiter, R.D., & Schwartz, M.W. (2017).
Cancer-induced anorexia and malaise are mediated by CGRP neurons in the parabrachial nucleus. Nature neuroscience, 20(7), 934-942. [PubMed:28581479] [PMC] [WorldCat] [DOI] - ↑
Sink, K.S., Walker, D.L., Yang, Y., & Davis, M. (2011).
Calcitonin gene-related peptide in the bed nucleus of the stria terminalis produces an anxiety-like pattern of behavior and increases neural activation in anxiety-related structures. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(5), 1802-10. [PubMed:21289190] [PMC] [WorldCat] [DOI] - ↑
Sink, K.S., Chung, A., Ressler, K.J., Davis, M., & Walker, D.L. (2013).
Anxiogenic effects of CGRP within the BNST may be mediated by CRF acting at BNST CRFR1 receptors. Behavioural brain research, 243, 286-93. [PubMed:23376701] [PMC] [WorldCat] [DOI] - ↑
Hashikawa-Hobara, N., Mishima, S., Okujima, C., Shitanishi, Y., & Hashikawa, N. (2021).
Npas4 impairs fear memory via phosphorylated HDAC5 induced by CGRP administration in mice. Scientific reports, 11(1), 7006. [PubMed:33772088] [PMC] [WorldCat] [DOI] - ↑
Hashikawa-Hobara, N., Fujiwara, K., & Hashikawa, N. (2024).
CGRP causes anxiety via HP1γ-KLF11-MAOB pathway and dopamine in the dorsal hippocampus. Communications biology, 7(1), 322. [PubMed:38503899] [PMC] [WorldCat] [DOI] - ↑
Argunhan, F., Thapa, D., Aubdool, A.A., Carlini, E., Arkless, K., Hendrikse, E.R., ..., & Brain, S.D. (2021).
Calcitonin Gene-Related Peptide Protects Against Cardiovascular Dysfunction Independently of Nitric Oxide In Vivo. Hypertension (Dallas, Tex. : 1979), 77(4), 1178-1190. [PubMed:33641368] [WorldCat] [DOI] - ↑
Smillie, S.J., King, R., Kodji, X., Outzen, E., Pozsgai, G., Fernandes, E., ..., & Brain, S.D. (2014).
An ongoing role of α-calcitonin gene-related peptide as part of a protective network against hypertension, vascular hypertrophy, and oxidative stress. Hypertension (Dallas, Tex. : 1979), 63(5), 1056-62. [PubMed:24516108] [WorldCat] [DOI] - ↑
Tjen-A-Looi, S., Ekman, R., Lippton, H., Cary, J., & Keith, I. (1992).
CGRP and somatostatin modulate chronic hypoxic pulmonary hypertension. The American journal of physiology, 263(3 Pt 2), H681-90. [PubMed:1357980] [WorldCat] [DOI] - ↑
Xu, J., Xu, L., Sui, P., Chen, J., Moya, E.A., Hume, P., ..., & Sun, X. (2022).
Excess neuropeptides in lung signal through endothelial cells to impair gas exchange. Developmental cell, 57(7), 839-853.e6. [PubMed:35303432] [PMC] [WorldCat] [DOI] - ↑ 50.0 50.1
Assas, B.M., Pennock, J.I., & Miyan, J.A. (2014).
Calcitonin gene-related peptide is a key neurotransmitter in the neuro-immune axis. Frontiers in neuroscience, 8, 23. [PubMed:24592205] [PMC] [WorldCat] [DOI] - ↑
Shepherd, A.J., Downing, J.E., & Miyan, J.A. (2005).
Without nerves, immunology remains incomplete -in vivo veritas. Immunology, 116(2), 145-63. [PubMed:16162264] [PMC] [WorldCat] [DOI] - ↑
Piotrowski, W., & Foreman, J.C. (1986).
Some effects of calcitonin gene-related peptide in human skin and on histamine release. The British journal of dermatology, 114(1), 37-46. [PubMed:2417614] [WorldCat] [DOI] - ↑
Goadsby, P.J., Edvinsson, L., & Ekman, R. (1990).
Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Annals of neurology, 28(2), 183-7. [PubMed:1699472] [WorldCat] [DOI] - ↑
Bellamy, J.L., Cady, R.K., & Durham, P.L. (2006).
Salivary levels of CGRP and VIP in rhinosinusitis and migraine patients. Headache, 46(1), 24-33. [PubMed:16412148] [WorldCat] [DOI] - ↑
Kamm, K., Straube, A., & Ruscheweyh, R. (2019).
Calcitonin gene-related peptide levels in tear fluid are elevated in migraine patients compared to healthy controls. Cephalalgia : an international journal of headache, 39(12), 1535-1543. [PubMed:31603037] [WorldCat] [DOI] - ↑
Cernuda-Morollón, E., Larrosa, D., Ramón, C., Vega, J., Martínez-Camblor, P., & Pascual, J. (2013).
Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine. Neurology, 81(14), 1191-6. [PubMed:23975872] [WorldCat] [DOI] - ↑
Cernuda-Morollón, E., Ramón, C., Martínez-Camblor, P., Serrano-Pertierra, E., Larrosa, D., & Pascual, J. (2015).
OnabotulinumtoxinA decreases interictal CGRP plasma levels in patients with chronic migraine. Pain, 156(5), 820-824. [PubMed:25735000] [WorldCat] [DOI] - ↑
Alpuente, A., Gallardo, V.J., Asskour, L., Caronna, E., Torres-Ferrus, M., & Pozo-Rosich, P. (2022).
Salivary CGRP can monitor the different migraine phases: CGRP (in)dependent attacks. Cephalalgia : an international journal of headache, 42(3), 186-196. [PubMed:34601944] [WorldCat] [DOI] - ↑
Ailani, J., McAllister, P., Winner, P.K., Chakhava, G., Krog Josiassen, M., Lindsten, A., ..., & Cady, R. (2022).
Rapid resolution of migraine symptoms after initiating the preventive treatment eptinezumab during a migraine attack: results from the randomized RELIEF trial. BMC neurology, 22(1), 205. [PubMed:35659622] [PMC] [WorldCat] [DOI] - ↑
Tepper, D. (2020).
Gepants. Headache, 60(5), 1037-1039. [PubMed:32337726] [WorldCat] [DOI]