「小胞輸送」の版間の差分
細編集の要約なし |
Yasunorimori (トーク | 投稿記録) |
||
| (3人の利用者による、間の18版が非表示) | |||
| 1行目: | 1行目: | ||
英語名:membrane traffic | |||
==要約== | |||
膜トラフィッキング(メンブレントラフィック:membrane traffic)とは、膜の分裂や融合によりオルガネラ同士あるいは細胞膜とオルガネラの間で、小胞(膜)を介してタンパク質や脂質などの輸送や、細胞外へ分泌性因子の放出を行う機構である。この機構は全ての真核細胞に保存されており、神経細胞においては膜タンパク質の軸索・樹状突起への極性輸送、神経突起の伸長や分岐、神経伝達物質の放出、さらには細胞内物質の品質管理(神経変性疾患の原因となるタンパク質凝集塊の除去)など様々な現象に利用されている。 | |||
[[ファイル:図1_メンブレントラフィックの基本原理.jpg|thumb|right|'''メンブレントラフィックの基本原理'''<br>メンブレントラフィックの基本は、まず供給側のオルガネラの膜の一部が出芽して、その根本の部分で切り取られて輸送小胞が形成する。その際、小胞に入るべき内腔成分と膜成分の選別が行われる。輸送小胞は細胞内骨格などに沿って特定の受容側のオルガネラに向かって移動し、受容側のオルガネラ膜と接着し、その後膜融合することで内腔成分および膜成分の輸送が完了する。受容側が細胞膜の場合には、内腔成分(分泌因子)が細胞外へと放出される(特に開口放出あるいはエクソサイトーシスと呼ばれる)。]] | |||
==メンブレントラフィック機構の概要== | |||
真核細胞の細胞内には様々な細胞内小器官(オルガネラ:organelle)が存在しており、これらのオルガネラが機能するためには、それぞれのオルガネラで働く分子が固有のオルガネラへと正しく輸送される必要がある。特に、小胞体(ER, endoplasmic reticulum)、ゴルジ体(Golgi apparatus/body)、エンドソーム(endosome)、リソソーム(lysosome)などのオルガネラ間および細胞表面からのエンドサイトーシスによって細胞内に取り込まれた受容体タンパク質などの輸送は、脂質二重膜からなる小胞(膜)によって制御されており、膜トラフィッキング(メンブレントラフィック、小胞輸送、細胞内膜輸送など)と総称される。なお、日本語で単に「膜輸送」と表記されることもあるが、膜輸送にはmembrane trafficとmembrane transportの二つの意味があり、後者のmembrane transportはチャネルやトランスポーターによる生体膜を貫通した物質輸送を指しmembrane trafficとは全く異なる機構であることから、ここでは混乱を避けるためにメンブレントラフィックという言葉を使用する。また最近では、メンブレントラフィックは細胞内における「原材料の調達から製品消費までのものの流れの総合的なマネジメント」に携わるということで、経済用語にちなんで細胞内ロジスティクス(cellular logistics)と呼ばれることもある。 | |||
メンブレントラフィックは非常に多様性に富む現象であるが、基本的には図1に示す一連のプロセスにより成り立っている。まず、送り手のオルガネラの膜の一部が出芽(budding)して、根本で切り取られて輸送小胞(transport vesicle)となる。その際、輸送小胞に入る内腔成分と膜成分の選別が行われる。輸送小胞は細胞骨格に沿って特定の受け手オルガネラ(あるいは細胞膜)まで運ばれ、受け手のオルガネラと選択的に結合して膜融合が起こり内腔成分と膜成分の輸送が完了する(図1)<ref><pubmed>7969419</pubmed></ref>。従って、メンブレントラフィックは膜融合型輸送とみなすこともできる。 | |||
メンブレントラフィックは様々なオルガネラを経由し、かつ多様なタンパク質が関与する複雑な過程だが、生体膜を透過する輸送形態と異なり輸送分子のコンフォメーション変化を必要とせず、膜の成分である膜タンパク質や脂質をも輸送することが可能で、しかも一度に他種類の分子を大量に運べるという利点を持つ。例えば、小胞体で合成された膜タンパク質が細胞膜へと輸送される過程を例に挙げると、新たに合成された膜タンパク質は小胞体膜へと挿入され、ゴルジ体を経てトランスゴルジ網(TGN, trans-Golgi network)へと輸送される。多くの膜タンパク質の場合、ここまでの過程で正しい高次構造へと折りたたまれ、糖鎖などの翻訳後修飾を受ける。トランスゴルジ網へと輸送された膜タンパク質は、その後、細胞膜、エンドソーム、リソソームあるいは分泌小胞などターゲットされるべき場所へと選別される。一方、細胞外から細胞膜を経てエンドサイトーシスされたタンパク質は初期エンドソームを経た後に、リサイクルされて再び細胞膜へと戻るか、もしくは後期エンドソーム/多胞体(MVB, multivesicular body)を経てリソソームへと運ばれ分解される<ref><pubmed>19696797</pubmed></ref><ref><pubmed>18502633</pubmed></ref>。このように細胞は個々の輸送経路に対して個別の輸送小胞を用意することにより、複雑な輸送経路網の発達を可能にしてきたと考えられる。 | |||
== 神経細胞におけるメンブレントラフィックの役割 == | |||
メンブレントラフィックは酵母からほ乳類まで全ての真核細胞に保存された基本的な仕組みで、タンパク質や脂質を必要に応じて選択し特定の場所に正しく送り届ける役割を担っている<ref><pubmed>8028665</pubmed></ref>。メンブレントラフィックには細胞が生きるためのhousekeeping的な役割を担うもの以外に、神経細胞のように高度に特殊化した細胞の機能を支えているものが数多く知られている。特に神経細胞におけるシナプス小胞の輸送の仕組みは非常に良く解析されており、シナプス小胞のエクソサイトーシスに関わるSNARE分子の発見<ref><pubmed>8402889</pubmed></ref><ref><pubmed>8221884</pubmed></ref>やショウジョウバエのshibire変異体の解析により明らかになったダイナミン分子によるシナプス小胞のエンドサイトーシス制御機構<ref><pubmed>8580706</pubmed></ref>などが良く知られている。これらの発見により普遍的なメンブレントラフィック制御の基本的概念が生まれたと言っても過言ではない。 | |||
この他にも神経細胞においては、軸索あるいは樹状突起への極性輸送、神経突起が伸長・分岐する際の膜の供給、脳由来神経栄養因子(BDNF)などのペプチド性分泌因子の放出、記憶や学習に応じた神経伝達物質受容体の取り込みおよびリサイクリング、神経変性疾患の原因となるタンパク質凝集塊のリソソーム/オートファジー経路による分解(すなわち細胞内物質の品質管理)など様々な現象にメンブレントラフィックが関与している。ここではその一例として、神経突起の伸長における膜の供給および軸索/樹状突起への極性輸送におけるメンブレントラフィックの役割について概説する。 | |||
== | ==神経突起の伸長とメンブレントラフィック== | ||
神経回路網を形成し情報伝達を行うためには、個々の神経細胞が軸索および樹状突起を正しく形成(伸長および分岐)することが不可欠であり、この過程にもメンブレントラフィックが重要な役割を果たしている。例えば、軸索が形成され伸長する際には、細胞内の膜成分が軸索に輸送される現象(vectorial flow)が起こり、軸索の先端にある成長円錐に新たな膜成分が付加される<ref><pubmed>8658598</pubmed></ref><ref><pubmed>9427242</pubmed></ref>。また、TGNからの輸送過程に関与しているプロテインキナーゼD(PKD, protein kinase D)の機能を阻害すると、樹状突起の伸長に異常が生じる<ref><pubmed>16337914</pubmed></ref>。 | |||
軸索の突起伸長過程はシナプス小胞からの放出過程とは別の制御によるものと考えられており、例えば膜融合に関わるエクソシスト複合体の1つであるSec5のショウジョウバエ変異株では、軸索の伸長に異常が生じるがシナプス活動には影響がない<ref><pubmed>12575951</pubmed></ref>。なお、電子顕微鏡による観察から、神経突起の伸長に関わる直径150 nm前後の小胞(PPVs, plasmalemmal precursor vesicles)の存在が明らかになっている。軸索に関してはタンパク質組成の異なる少なくとも3種類のPPVsが存在すると予想されており、これらの小胞は細胞体から軸索に存在する微小管に沿って先端部にある成長円錐へと運ばれている<ref><pubmed>19259102</pubmed></ref>。 | |||
==神経細胞における極性輸送== | |||
神経細胞では軸索あるいは樹状突起にのみ選択的に物質輸送を行ういわゆる「極性輸送」の機構が存在している。例えば、軸索の先端に存在するプレシナプスにはシナプス小胞の構成因子やその輸送に関わる分子などが選択的に運ばれ、樹状突起上に存在するポストシナプスには神経伝達物質の受容体分子(AMPA受容体やNMDA受容体)などが選択的に輸送される<ref><pubmed>14556709</pubmed></ref>。神経突起の先端で機能する分子の多くは膜タンパク質であることから、これらの極性輸送にもメンブレントラフィックは重要な役割を果たしている。 | |||
神経細胞における極性輸送の機構は、上皮細胞の頂端面(apical)や側底面(basolateral)への極性輸送機構とある程度共通している。実際、上皮細胞で頂端面へと選択的に輸送される膜タンパク質は神経細胞でも軸索に選択的に運ばれる傾向にあり、反対に側底面へと選択的に運ばれる膜タンパク質は樹状突起に選択的に運ばれる傾向にある<ref><pubmed>9620691</pubmed></ref>。ただし、上皮細胞と神経細胞の極性輸送機構は全てにおいて共通している訳ではなく、例えば神経細胞の樹状突起に特異的に局在するテレンセファリンの樹状突起ターゲティングシグナルは、上皮細胞においては側底面への輸送シグナルとしては機能しない<ref><pubmed>15689548</pubmed></ref>。 | |||
神経細胞における極性輸送の分子機構に関する詳細は未解明の部分も多いが、近年その一端が解明されつつある。一例を挙げると、輸送小胞の微小管上の移動を司るモータータンパク質・キネシンファミリー分子のうち、軸索特異的な輸送に関与するKIF1Aはシナプトタグミン1、Rab3、シナプトフフィジンといったシナプス小胞の構成因子を輸送する<ref><pubmed>7539720 </pubmed></ref>。一方、KIF17はNMDA受容体のサブユニットであるNR2Bを樹状突起へと輸送する<ref><pubmed>10846156</pubmed></ref>。細胞体との境界に位置する軸索の根元にはアクチン繊維が高密度に存在している軸索小丘(AIS, axon initial segment)と呼ばれる領域があり、ここでキネシン分子依存的に軸索に輸送される分子と樹状突起へ輸送される分子の選択が行われるという説が提唱されている<ref><pubmed>19268344 </pubmed></ref>。また、クラスリン被覆小胞形成のアダプタータンパク質であるAP複合体ファミリーの1つAP-4が、AMPA受容体のサブユニットであるGluR1およびGluR2の樹状突起への選択的輸送に関与することが明らかになっている<ref><pubmed>18341993 </pubmed></ref>。さらに、メンブレントラフィックの普遍的制御因子である低分子量Gタンパク質Rabファミリーの幾つかが、軸索あるいは樹状突起特異的に局在することが最近報告され、これらの分子の極性輸送への関与が示唆されている<ref><pubmed>22291024 </pubmed></ref>。 | |||
==参考文献== | |||
<references/> | |||
(執筆者:森靖典、福田光則(東北大学大学院 生命科学研究科)) | |||
2012年5月13日 (日) 19:07時点における版
英語名:membrane traffic
要約
膜トラフィッキング(メンブレントラフィック:membrane traffic)とは、膜の分裂や融合によりオルガネラ同士あるいは細胞膜とオルガネラの間で、小胞(膜)を介してタンパク質や脂質などの輸送や、細胞外へ分泌性因子の放出を行う機構である。この機構は全ての真核細胞に保存されており、神経細胞においては膜タンパク質の軸索・樹状突起への極性輸送、神経突起の伸長や分岐、神経伝達物質の放出、さらには細胞内物質の品質管理(神経変性疾患の原因となるタンパク質凝集塊の除去)など様々な現象に利用されている。
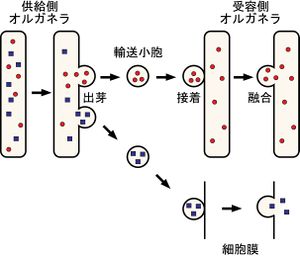
メンブレントラフィックの基本は、まず供給側のオルガネラの膜の一部が出芽して、その根本の部分で切り取られて輸送小胞が形成する。その際、小胞に入るべき内腔成分と膜成分の選別が行われる。輸送小胞は細胞内骨格などに沿って特定の受容側のオルガネラに向かって移動し、受容側のオルガネラ膜と接着し、その後膜融合することで内腔成分および膜成分の輸送が完了する。受容側が細胞膜の場合には、内腔成分(分泌因子)が細胞外へと放出される(特に開口放出あるいはエクソサイトーシスと呼ばれる)。
メンブレントラフィック機構の概要
真核細胞の細胞内には様々な細胞内小器官(オルガネラ:organelle)が存在しており、これらのオルガネラが機能するためには、それぞれのオルガネラで働く分子が固有のオルガネラへと正しく輸送される必要がある。特に、小胞体(ER, endoplasmic reticulum)、ゴルジ体(Golgi apparatus/body)、エンドソーム(endosome)、リソソーム(lysosome)などのオルガネラ間および細胞表面からのエンドサイトーシスによって細胞内に取り込まれた受容体タンパク質などの輸送は、脂質二重膜からなる小胞(膜)によって制御されており、膜トラフィッキング(メンブレントラフィック、小胞輸送、細胞内膜輸送など)と総称される。なお、日本語で単に「膜輸送」と表記されることもあるが、膜輸送にはmembrane trafficとmembrane transportの二つの意味があり、後者のmembrane transportはチャネルやトランスポーターによる生体膜を貫通した物質輸送を指しmembrane trafficとは全く異なる機構であることから、ここでは混乱を避けるためにメンブレントラフィックという言葉を使用する。また最近では、メンブレントラフィックは細胞内における「原材料の調達から製品消費までのものの流れの総合的なマネジメント」に携わるということで、経済用語にちなんで細胞内ロジスティクス(cellular logistics)と呼ばれることもある。
メンブレントラフィックは非常に多様性に富む現象であるが、基本的には図1に示す一連のプロセスにより成り立っている。まず、送り手のオルガネラの膜の一部が出芽(budding)して、根本で切り取られて輸送小胞(transport vesicle)となる。その際、輸送小胞に入る内腔成分と膜成分の選別が行われる。輸送小胞は細胞骨格に沿って特定の受け手オルガネラ(あるいは細胞膜)まで運ばれ、受け手のオルガネラと選択的に結合して膜融合が起こり内腔成分と膜成分の輸送が完了する(図1)[1]。従って、メンブレントラフィックは膜融合型輸送とみなすこともできる。
メンブレントラフィックは様々なオルガネラを経由し、かつ多様なタンパク質が関与する複雑な過程だが、生体膜を透過する輸送形態と異なり輸送分子のコンフォメーション変化を必要とせず、膜の成分である膜タンパク質や脂質をも輸送することが可能で、しかも一度に他種類の分子を大量に運べるという利点を持つ。例えば、小胞体で合成された膜タンパク質が細胞膜へと輸送される過程を例に挙げると、新たに合成された膜タンパク質は小胞体膜へと挿入され、ゴルジ体を経てトランスゴルジ網(TGN, trans-Golgi network)へと輸送される。多くの膜タンパク質の場合、ここまでの過程で正しい高次構造へと折りたたまれ、糖鎖などの翻訳後修飾を受ける。トランスゴルジ網へと輸送された膜タンパク質は、その後、細胞膜、エンドソーム、リソソームあるいは分泌小胞などターゲットされるべき場所へと選別される。一方、細胞外から細胞膜を経てエンドサイトーシスされたタンパク質は初期エンドソームを経た後に、リサイクルされて再び細胞膜へと戻るか、もしくは後期エンドソーム/多胞体(MVB, multivesicular body)を経てリソソームへと運ばれ分解される[2][3]。このように細胞は個々の輸送経路に対して個別の輸送小胞を用意することにより、複雑な輸送経路網の発達を可能にしてきたと考えられる。
神経細胞におけるメンブレントラフィックの役割
メンブレントラフィックは酵母からほ乳類まで全ての真核細胞に保存された基本的な仕組みで、タンパク質や脂質を必要に応じて選択し特定の場所に正しく送り届ける役割を担っている[4]。メンブレントラフィックには細胞が生きるためのhousekeeping的な役割を担うもの以外に、神経細胞のように高度に特殊化した細胞の機能を支えているものが数多く知られている。特に神経細胞におけるシナプス小胞の輸送の仕組みは非常に良く解析されており、シナプス小胞のエクソサイトーシスに関わるSNARE分子の発見[5][6]やショウジョウバエのshibire変異体の解析により明らかになったダイナミン分子によるシナプス小胞のエンドサイトーシス制御機構[7]などが良く知られている。これらの発見により普遍的なメンブレントラフィック制御の基本的概念が生まれたと言っても過言ではない。
この他にも神経細胞においては、軸索あるいは樹状突起への極性輸送、神経突起が伸長・分岐する際の膜の供給、脳由来神経栄養因子(BDNF)などのペプチド性分泌因子の放出、記憶や学習に応じた神経伝達物質受容体の取り込みおよびリサイクリング、神経変性疾患の原因となるタンパク質凝集塊のリソソーム/オートファジー経路による分解(すなわち細胞内物質の品質管理)など様々な現象にメンブレントラフィックが関与している。ここではその一例として、神経突起の伸長における膜の供給および軸索/樹状突起への極性輸送におけるメンブレントラフィックの役割について概説する。
神経突起の伸長とメンブレントラフィック
神経回路網を形成し情報伝達を行うためには、個々の神経細胞が軸索および樹状突起を正しく形成(伸長および分岐)することが不可欠であり、この過程にもメンブレントラフィックが重要な役割を果たしている。例えば、軸索が形成され伸長する際には、細胞内の膜成分が軸索に輸送される現象(vectorial flow)が起こり、軸索の先端にある成長円錐に新たな膜成分が付加される[8][9]。また、TGNからの輸送過程に関与しているプロテインキナーゼD(PKD, protein kinase D)の機能を阻害すると、樹状突起の伸長に異常が生じる[10]。 軸索の突起伸長過程はシナプス小胞からの放出過程とは別の制御によるものと考えられており、例えば膜融合に関わるエクソシスト複合体の1つであるSec5のショウジョウバエ変異株では、軸索の伸長に異常が生じるがシナプス活動には影響がない[11]。なお、電子顕微鏡による観察から、神経突起の伸長に関わる直径150 nm前後の小胞(PPVs, plasmalemmal precursor vesicles)の存在が明らかになっている。軸索に関してはタンパク質組成の異なる少なくとも3種類のPPVsが存在すると予想されており、これらの小胞は細胞体から軸索に存在する微小管に沿って先端部にある成長円錐へと運ばれている[12]。
神経細胞における極性輸送
神経細胞では軸索あるいは樹状突起にのみ選択的に物質輸送を行ういわゆる「極性輸送」の機構が存在している。例えば、軸索の先端に存在するプレシナプスにはシナプス小胞の構成因子やその輸送に関わる分子などが選択的に運ばれ、樹状突起上に存在するポストシナプスには神経伝達物質の受容体分子(AMPA受容体やNMDA受容体)などが選択的に輸送される[13]。神経突起の先端で機能する分子の多くは膜タンパク質であることから、これらの極性輸送にもメンブレントラフィックは重要な役割を果たしている。 神経細胞における極性輸送の機構は、上皮細胞の頂端面(apical)や側底面(basolateral)への極性輸送機構とある程度共通している。実際、上皮細胞で頂端面へと選択的に輸送される膜タンパク質は神経細胞でも軸索に選択的に運ばれる傾向にあり、反対に側底面へと選択的に運ばれる膜タンパク質は樹状突起に選択的に運ばれる傾向にある[14]。ただし、上皮細胞と神経細胞の極性輸送機構は全てにおいて共通している訳ではなく、例えば神経細胞の樹状突起に特異的に局在するテレンセファリンの樹状突起ターゲティングシグナルは、上皮細胞においては側底面への輸送シグナルとしては機能しない[15]。
神経細胞における極性輸送の分子機構に関する詳細は未解明の部分も多いが、近年その一端が解明されつつある。一例を挙げると、輸送小胞の微小管上の移動を司るモータータンパク質・キネシンファミリー分子のうち、軸索特異的な輸送に関与するKIF1Aはシナプトタグミン1、Rab3、シナプトフフィジンといったシナプス小胞の構成因子を輸送する[16]。一方、KIF17はNMDA受容体のサブユニットであるNR2Bを樹状突起へと輸送する[17]。細胞体との境界に位置する軸索の根元にはアクチン繊維が高密度に存在している軸索小丘(AIS, axon initial segment)と呼ばれる領域があり、ここでキネシン分子依存的に軸索に輸送される分子と樹状突起へ輸送される分子の選択が行われるという説が提唱されている[18]。また、クラスリン被覆小胞形成のアダプタータンパク質であるAP複合体ファミリーの1つAP-4が、AMPA受容体のサブユニットであるGluR1およびGluR2の樹状突起への選択的輸送に関与することが明らかになっている[19]。さらに、メンブレントラフィックの普遍的制御因子である低分子量Gタンパク質Rabファミリーの幾つかが、軸索あるいは樹状突起特異的に局在することが最近報告され、これらの分子の極性輸送への関与が示唆されている[20]。
参考文献
- ↑
Rothman, J.E. (1994).
Mechanisms of intracellular protein transport. Nature, 372(6501), 55-63. [PubMed:7969419] [WorldCat] [DOI] - ↑
Grant, B.D., & Donaldson, J.G. (2009).
Pathways and mechanisms of endocytic recycling. Nature reviews. Molecular cell biology, 10(9), 597-608. [PubMed:19696797] [PMC] [WorldCat] [DOI] - ↑
Woodman, P.G., & Futter, C.E. (2008).
Multivesicular bodies: co-ordinated progression to maturity. Current opinion in cell biology, 20(4), 408-14. [PubMed:18502633] [PMC] [WorldCat] [DOI] - ↑
Ferro-Novick, S., & Jahn, R. (1994).
Vesicle fusion from yeast to man. Nature, 370(6486), 191-3. [PubMed:8028665] [WorldCat] [DOI] - ↑
Südhof, T.C., De Camilli, P., Niemann, H., & Jahn, R. (1993).
Membrane fusion machinery: insights from synaptic proteins. Cell, 75(1), 1-4. [PubMed:8402889] [WorldCat] - ↑
Söllner, T., Bennett, M.K., Whiteheart, S.W., Scheller, R.H., & Rothman, J.E. (1993).
A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell, 75(3), 409-18. [PubMed:8221884] [WorldCat] [DOI] - ↑
De Camilli, P., Takei, K., & McPherson, P.S. (1995).
The function of dynamin in endocytosis. Current opinion in neurobiology, 5(5), 559-65. [PubMed:8580706] [WorldCat] [DOI] - ↑
Futerman, A.H., & Banker, G.A. (1996).
The economics of neurite outgrowth--the addition of new membrane to growing axons. Trends in neurosciences, 19(4), 144-9. [PubMed:8658598] [WorldCat] [DOI] - ↑
Bradke, F., & Dotti, C.G. (1997).
Neuronal polarity: vectorial cytoplasmic flow precedes axon formation. Neuron, 19(6), 1175-86. [PubMed:9427242] [WorldCat] [DOI] - ↑
Horton, A.C., Rácz, B., Monson, E.E., Lin, A.L., Weinberg, R.J., & Ehlers, M.D. (2005).
Polarized secretory trafficking directs cargo for asymmetric dendrite growth and morphogenesis. Neuron, 48(5), 757-71. [PubMed:16337914] [WorldCat] [DOI] - ↑
Murthy, M., Garza, D., Scheller, R.H., & Schwarz, T.L. (2003).
Mutations in the exocyst component Sec5 disrupt neuronal membrane traffic, but neurotransmitter release persists. Neuron, 37(3), 433-47. [PubMed:12575951] [WorldCat] [DOI] - ↑
Pfenninger, K.H. (2009).
Plasma membrane expansion: a neuron's Herculean task. Nature reviews. Neuroscience, 10(4), 251-61. [PubMed:19259102] [WorldCat] [DOI] - ↑
Horton, A.C., & Ehlers, M.D. (2003).
Neuronal polarity and trafficking. Neuron, 40(2), 277-95. [PubMed:14556709] [WorldCat] [DOI] - ↑
Jareb, M., & Banker, G. (1998).
The polarized sorting of membrane proteins expressed in cultured hippocampal neurons using viral vectors. Neuron, 20(5), 855-67. [PubMed:9620691] [WorldCat] [DOI] - ↑
Mitsui, S., Saito, M., Hayashi, K., Mori, K., & Yoshihara, Y. (2005).
A novel phenylalanine-based targeting signal directs telencephalin to neuronal dendrites. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(5), 1122-31. [PubMed:15689548] [PMC] [WorldCat] [DOI] - ↑
Okada, Y., Yamazaki, H., Sekine-Aizawa, Y., & Hirokawa, N. (1995).
The neuron-specific kinesin superfamily protein KIF1A is a unique monomeric motor for anterograde axonal transport of synaptic vesicle precursors. Cell, 81(5), 769-80. [PubMed:7539720] [WorldCat] [DOI] - ↑
Setou, M., Nakagawa, T., Seog, D.H., & Hirokawa, N. (2000).
Kinesin superfamily motor protein KIF17 and mLin-10 in NMDA receptor-containing vesicle transport. Science (New York, N.Y.), 288(5472), 1796-802. [PubMed:10846156] [WorldCat] [DOI] - ↑
Song, A.H., Wang, D., Chen, G., Li, Y., Luo, J., Duan, S., & Poo, M.M. (2009).
A selective filter for cytoplasmic transport at the axon initial segment. Cell, 136(6), 1148-60. [PubMed:19268344] [WorldCat] [DOI] - ↑
Matsuda, S., Miura, E., Matsuda, K., Kakegawa, W., Kohda, K., Watanabe, M., & Yuzaki, M. (2008).
Accumulation of AMPA receptors in autophagosomes in neuronal axons lacking adaptor protein AP-4. Neuron, 57(5), 730-45. [PubMed:18341993] [WorldCat] [DOI] - ↑
Mori, Y., Matsui, T., Furutani, Y., Yoshihara, Y., & Fukuda, M. (2012).
Small GTPase Rab17 regulates dendritic morphogenesis and postsynaptic development of hippocampal neurons. The Journal of biological chemistry, 287(12), 8963-73. [PubMed:22291024] [PMC] [WorldCat] [DOI]
(執筆者:森靖典、福田光則(東北大学大学院 生命科学研究科))