「高速液体クロマトグラフィー」の版間の差分
細編集の要約なし |
Hiromasamorishita (トーク | 投稿記録) 細編集の要約なし |
||
| (3人の利用者による、間の79版が非表示) | |||
| 1行目: | 1行目: | ||
英:High Performance Liquid Chromatography、英略語:HPLC | |||
高速液体クロマトグラフィーとは、物質が固定相(カラムの担体)とこれに接して流れる移動相(液体)との親和力の違いから一定の比率で分布し、その比率が物質によって異なる事を利用して分離する方法である。移動相を高圧で流すことで高い分離および感度を得ることができ、固定相、移動相、検出器の組み合わせにより様々な物質の分析を行うことが可能である。神経科学分野においても各種神経伝達物質やタンパク質、ペプチドの分析など、幅広く利用されている。 | |||
==原理== | ==原理== | ||
高速液体クロマトグラフィーとは、物質が固定相(カラムの担体)とこれに接して流れる移動相(液体)との親和力の違いから一定の比率で分布し、その比率が物質によって異なる事を利用して分離する方法である。現在では、物質の精製や分析には欠かせない存在となっている。高速液体クロマトグラフィーには、イオン交換、逆相、順相、サイズ排除(ゲル濾過)、アフィニティーなど様々な方法がある。 | |||
===高速液体クロマトグラフィーの基本構成=== | ===高速液体クロマトグラフィーの基本構成=== | ||
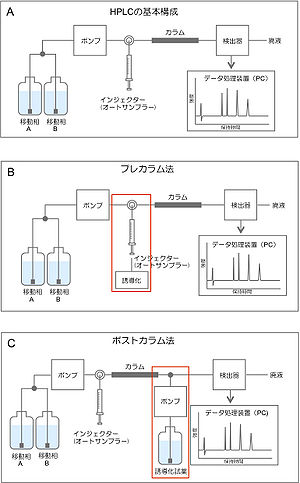
移動相として溶媒や緩衝溶液を送るポンプ、試料を注入するインジェクター(試料導入部)、物質を分離するためのカラム、検出器、データ処理装置(PC)から構成されている(図1-A)。 | 移動相として溶媒や緩衝溶液を送るポンプ、試料を注入するインジェクター(試料導入部)、物質を分離するためのカラム、検出器、データ処理装置(PC)から構成されている(図1-A)。 | ||
[[ファイル:図1 ABC.jpg|thumb|300px|right|図1. (A) HPLCの基本フローチャート. (B) プレカラム法の基本フローチャート. (C) ポストカラム法の基本フローチャート.]] | |||
====ポンプ==== | ====ポンプ==== | ||
移動相の制御に欠かせない装置である。メーカーによって多少異なる形をしているが基本的な構造は同じである。1台のポンプで1つの移動相が基本であるが、2つの電磁弁が付属していると2つの移動相を制御することができる。高速アミノ酸分析計(HITACHI)では電磁弁が5つ付属しており、1台のポンプで5種類の移動相を切り替えて1分析で約40種類のアミノ酸を定量することができる。電磁弁以外では、リザーバ−切り替えバルブがあり同様に6種類の移動相を変えることが可能である。 | |||
====インジェクター==== | ====インジェクター==== | ||
インジェクターには、マイクロシリンジを用いて手動でサンプルを注入するマニュアルインジェクターと、専用バイアル瓶に入れたサンプルをオートサンプラーと呼ばれる装置を用いて自動的に注入するオートインジェクターがある。各メーカーでシステムに合わせたオートサンプラーを開発しており、生体サンプルを取り扱うための冷却機能を備えた装置や誘導化するための反応型オートサンプラーがある。現在では、オートサンプラーを使用して分析する事が多い。 | インジェクターには、マイクロシリンジを用いて手動でサンプルを注入するマニュアルインジェクターと、専用バイアル瓶に入れたサンプルをオートサンプラーと呼ばれる装置を用いて自動的に注入するオートインジェクターがある。各メーカーでシステムに合わせたオートサンプラーを開発しており、生体サンプルを取り扱うための冷却機能を備えた装置や誘導化するための反応型オートサンプラーがある。現在では、オートサンプラーを使用して分析する事が多い。 | ||
====カラム==== | ====カラム==== | ||
カラムは、分析する物質の性質を考慮して種類を選択しなければならない。カラムの種類には、主にイオン交換、逆相、順相、サイズ排除(ゲル濾過)そして光学異性体分離カラムがある。イオン交換カラムには、陽イオン、陰イオン、両イオン型の3つのタイプがある。これらは、金属イオン、無機酸、アミノ酸、ペプチドやタンパク質の分析・分取に用いられる。逆相カラムは、最も種類が多く様々なカラムが開発されている。特に低分子の分析に用いられることが多く神経伝達物質、誘導化したアミノ酸、医薬品、ホルモン、ペプチドの分析などに用いられている。順相カラムは、有機合成した化合物の分離に多く用いられる。サイズ排除カラムは、タンパク質を分子量ごとに分画または会合体としてモノマー、ダイマー、トリマーの分析・分取に用いられる。光学異性体分離カラムはアミノ酸のD体とL体や医薬品などの光学異性体化合物の分析・分取に用いられている。 | |||
====検出器==== | ====検出器==== | ||
様々な検出器が開発されておりUV検出器、蛍光検出器、電気化学検出器、質量分析器、蒸発光散乱検出器などが用いられている。HPLCにおいて、最も汎用的な検出器はUV 検出器であり、次いで蛍光検出器、電気化学検出器の順である。 | |||
====データ処理ソフトウェア==== | |||
==== データ処理ソフトウェア ==== | |||
検出されたデータを取得し、そこからピークの検出・解析をおこなう。各HPLCメーカーから装置の制御機能を合わせ持った製品が出されている。様々なメーカーの装置と接続可能な汎用ソフトウェアには、 EZChrom (Agilent)、 Empower (Waters)、 PowerChrom (eDAQ Pty Ltd)、 Unicorn(GE)などがある。 | 検出されたデータを取得し、そこからピークの検出・解析をおこなう。各HPLCメーカーから装置の制御機能を合わせ持った製品が出されている。様々なメーカーの装置と接続可能な汎用ソフトウェアには、 EZChrom (Agilent)、 Empower (Waters)、 PowerChrom (eDAQ Pty Ltd)、 Unicorn(GE)などがある。 | ||
===測定方法=== | ===測定方法=== | ||
====プレカラム法とポストカラム法==== | ====プレカラム法とポストカラム法==== | ||
HPLCで目的の物質がそのまま分析できない場合、感度を上げるために誘導化を行うことが多い。その誘導化の方法には、プレカラム法(図1-B)と ポストカラム法(図1-C)がある。 | HPLCで目的の物質がそのまま分析できない場合、感度を上げるために誘導化を行うことが多い。その誘導化の方法には、プレカラム法(図1-B)と ポストカラム法(図1-C)がある。 | ||
プレカラム法は成分を分離する前に誘導化する方法であり、ポストカラム法はカラムで成分を分離してから誘導化する方法である。一般に感度を上げるためにプレカラム法で蛍光誘導化が行われる事が多い。蛍光誘導化(ラベル化)とは、蛍光を発しない物質を化学反応で蛍光を発する物質に変換すること、蛍光物質を化学的に結合させることである。測定する物質の種類にもよるが蛍光誘導化するとfmol~pmolまで測定可能になる。ポストカラム法では、分離後誘導化試薬と反応するため別途ポンプが必要となる。また、反応させるための反応コイルや反応カラムを使用することによってサンプルが拡散するため、ポストカラム法はプレカラム法に比べ特に溶出時間が遅くなり物質の感度が悪くなることがある。 | |||
====アイソクラティック法とグラジエント法==== | ====アイソクラティック法とグラジエント法==== | ||
目的物質を移動相の溶媒の性質を変えて分離条件良く分析する方法には、アイソクラティック (Isocratic)法とグラジエント(Gradient)法がある。アイソクラティック法では単一な移動相を用いシンプルな装置で分析する。移動相の組成は複雑で、緩衝溶液のほかに有機溶媒やイオンペア試薬の添加をすることが多い。一方のグラジエント法は、2種類以上の移動相を用いるためHPLCシステムが少々複雑になる。一般的には移動相として水系の緩衝溶液と有機溶媒の2つを用い、徐々に濃度勾配をつけて分離を行う。この方法で良い分離が得られない場合は、移動相の濃度をステップワイズに変えたり、これと直線的に変える方法を組み合わせるとよい。 | |||
====イオンペア試薬==== | ====イオンペア試薬==== | ||
イオンペア試薬は、陽イオンと陰イオンの2種類ある。目的の物質が正に電荷して陽イオン(+)の場合はアルキルスルホン酸塩を、負に電荷して陰イオン(−)の場合は第4級アンモニウム塩を用いる。イオン性物質のサンプルは、イオンペア試薬とイオン結合して電気的に中性となり、さらにイオンペア試薬のアルキル鎖により逆相カラムに保持されて分離できるようになる。数種類のアルキル鎖の長さが異なる試薬があり、分離の度合いを見て選択する。 | |||
HPLCの分析では、検出器の選択、カラムの選択、高感度にするための誘導化、移動相の種類、分離条件(2つの移動相の割合を変えて分離する)、などを組み合わせて目的物質の分析法を確立する。 | |||
HPLCの分析では、検出器の選択、カラムの選択、高感度にするための誘導化、移動相の種類、分離条件( | |||
===応用例(スイッチングバルブ法)=== | ===応用例(スイッチングバルブ法)=== | ||
これまでHPLCの一般的な装置構成について述べてきた。ここでは、装置構成の応用例としてスイッチングバルブ装置を用いたHPLCのシステムについて述べる。 | これまでHPLCの一般的な装置構成について述べてきた。ここでは、装置構成の応用例としてスイッチングバルブ装置を用いたHPLCのシステムについて述べる。 | ||
図2-AのHPLCシステムではアイソクラティック法にスイッチングバルブ装置を組んでいる(構成:移動相2液、ポンプ2台、スイッチングバルブ1台、トラップカラム1本、分離用カラム2本、検出器2台)。スイッチングバルブとは、特定な時間を設定してその時間になると流路を切り替えることができる装置のことである。トラップカラムは、サンプル内の物質を一時的に保持するための長さが短いカラム(1cm程度)である。インジェクション前の流路は、移動相AはポンプA → インジェクター → トラップカラム → カラムA → 検出器Aへ流れている。このとき移動相Bは、ポンプB → カラムB → 検出器Bを流れており、トラップカラムには流れない。インジェクション後スイッチングバルブ設定時間にバルブが作動するとトラップカラムに移動相Bが流れる。このシステムで重要な点は、スイッチングバルブ設定時間である。設定時間を調節することによりカラムBで検出する物質の溶出時間を変えることができる。また目的物質の溶出が移動相の変わり目になると正確な分析ができなくなるため注意が必要である。溶出時間の速いものと遅いものを同時に分析したい場合、スイッチングバルブ法は1本のカラムで分析する場合と比較し約半分の時間でかつ溶出時間の遅い物質を感度良く分析できる利点がある。 | |||
==脳科学への応用== | ==脳科学への応用== | ||
===神経伝達アミノ酸の分析(蛍光誘導化法)=== | ===神経伝達アミノ酸の分析(蛍光誘導化法)=== | ||
蛍光誘導化法で用いられる誘導化試薬は、メーカーから様々な種類が出されている。その中でも本稿では非常に安価なOPA法について述べる。 | 蛍光誘導化法で用いられる誘導化試薬は、メーカーから様々な種類が出されている。その中でも本稿では非常に安価なOPA法について述べる。 | ||
====蛍光検出の原理==== | ====蛍光検出の原理==== | ||
OPA法は、オルトフタルアルデヒド(o-Phthalaldehyde, OPA)、メルカプトエタノール、アミノ酸由来のアミノ基が環化反応し蛍光を発する物質になり、分析を可能にする方法である(図2-A)。OPA誘導体は、励起波長350±10 nm,蛍光波長450±10 nm程度で蛍光検出することができる。 | |||
一般に誘導化する場合は過剰の試薬を加えなければならず、残った蛍光誘導化試薬が蛍光を発して分析する物質の妨害となり分析が困難になることがある。その点OPAは、環化反応しないと蛍光を発しないため残存する誘導化試薬を気にする必要がないのが利点である。一方OPA試薬の欠点として、蛍光の持続時間が短いこと、第2級アミンと反応しないためプロリンやハイドロキシプロリンの検出はできないことがあげられる。 | |||
====測定例1 (グラジエント法)==== | |||
脳組織ホモジネートを用いて、興奮性アミノ酸であるグルタミン酸と抑制性アミノ酸であるGABAを測定した例を述べる。 | |||
図2-Bに示したHPLCの構成で、グラジエント法を用いて分析した。移動相は2種類あり、移動相Aの組成は、100 mM リン酸緩衝液(pH 5.6)、移動相Bの組成は100%アセトニトリルでステップワイズに濃度を変え、25分間で1分析を行った(グラジエントの条件:0 min→1 min 15%, 1 min→4.5 min 16%, 4.5 min→8 min 21%, 8 min→11 min 24%, 11 min→13.5 min 31%, 13.5 min→16.5 min 35%, 16.5 min→25 min 15%)。 | |||
蛍光誘導化試薬は、OPA試薬7.5 mgをメタノール300 μLで溶解した後、2メルカプトエタノールを7.5μLを加え、さらにミリQ水1200 μLを加えた。100 mMホウ酸緩衝液(pH 10.0)は、Na<sub>4</sub>B<sub>4</sub>O<sub>7</sub>・10H<sub>2</sub>O 1.905 gをミリQ水50 mLに溶解し調製した。 | |||
試料の前処理として、摘出した脳組織にすみやかに5〜10倍量の0.2 M PCA(100 μM EDTA・2Na含有)を加え、超音波で30秒間ホモジナイズした。次に、除タンパクを完全にするため氷中で30分間放置した後、4 ℃で10,000 rpm × 15分間遠心し、上清を採取した。上清は20倍に希釈し、15 μLを HPLCサンプルとした。サンプルは、オートサンプラー内にてOPA試薬と反応し、HPLCで分析した。すなわち蛍光誘導化のため反応型のオートサンプラーのサンプルラックを12 ℃に冷却、蛍光誘導化試薬15 μL、サンプル15 μL、100 mM ホウ酸緩衝液(pH 10.0)20 μLを加え30 ℃で2分間インキュベートし、誘導体化されたサンプル35 μLをHPLCにインジェクションした。 | |||
試料の前処理として、摘出した脳組織にすみやかに5〜10倍量の0.2 M | |||
分析例として、図2に0.5~20 pmol/μLのスタンダード(C)と脳組織をホモジネートしたサンプル(D)を分析したクロマトグラフを示した。定量限界は、0.5 pmol/μLであった。このクロマト条件においては、脳内のグルタミン酸と GABAの濃度は充分な測定感度範囲に入り、その他の生体アミノ酸(アスパラギン酸、セリン、アスパラギン、アルギニン、グリシン、アラニン、タウリン)も同時一斉分析を行うことが可能である。 | |||
====測定例2 (スイッチングバルブ法)==== | |||
図3-Aに示したHPLCの構成で、アイソクラティック法を用いて脳組織のホモジネートを分析した。移動相は2種類あり、移動相Aにクエン酸−リン酸緩衝液 pH 5.8, 12%アセトニトリル、移動相Bにクエン酸−リン酸緩衝液 pH 6.2, 25%アセトニトリルを用い15分間で1分析を行った。スイッチングバルブは、インジェクションから1分30秒で切り替わり、12分後に元の流路に戻るセッティングをした。 | |||
蛍光誘導化試薬は、OPA試薬5 mgをメタノール200 μLで溶解した後、2メルカプトエタノール5 μL、0.1 M Na<sub>2</sub>CO<sub>3</sub>溶液800 μL加え、調製した。 | |||
試料の前処理は、測定例(1)と同様に行い、上清を1200倍に希釈して15 μLをHPLCサンプルにした。 | |||
蛍光誘導化のため、オートサンプラーのサンプルラックを12 ℃に冷却、蛍光誘導化試薬15 μL、サンプル15 μLを加え30 ℃で2分間インキュベートし、誘導体化されたサンプル10 μLをインジェクションした。 | |||
===神経伝達モノアミンとその代謝物、およびアセチルコリンの分析(電気化学検出法)=== | |||
====電気化学検出の原理==== | ====電気化学検出の原理==== | ||
酸化還元活性を有する物質を高感度に検出する方法である。一定の電位を印加した電極上で物質が酸化又は還元された時に流れる電流を検出する。電流量は濃度に比例する為、定量分析が可能である。検出器には、電流測定検出器 (Amperometric detector) と電量検出器(Coulometric detector) の2種類があり、一般的にHPLCにおいては電流測定検出器を用いることが多い。これは、電量検出器に比べて電解効率が大幅に低いものの、良いシグナルノイズ比・感度が得られるためである。検出セルは作用電極、参照電極、対極電極からなり、作用電極は測定対象に応じてグラッシーカーボン、グラファイト、白金などを使用する。 | |||
電気化学検出は1950年代にKemuraによって最初にクロマトグラフィーの検出法として用いられ、1960年代後半から1970年代前半にかけてAdamsらによりカテコールアミンおよびアスコルビン酸の分析に応用された。それからさらなる改良が重ねられ、現在神経伝達物質およびその代謝物の定量方法として、一般的な技術となっている。 | |||
詳細な測定原理や方法については、Meffordによる総説3やZapataらのプロトコル4等が参考となる。 | |||
====アセチルコリンおよびコリンの分析==== | |||
アセチルコリンのHPLC-ECDを用いた分析は、1983年にPotterらによって最初に報告された。アセチルコリンは電気化学的に不活性である為、分離用の本カラムの下流にアセチルコリンエステラーゼ (AChE)および コリンオキシダーゼ (ChO) を固定化した酵素カラムを配置し、オンラインで加水分解・酸化することで生成した過酸化水素を白金電極にて検出する (印加電圧 +450 mV vs Ag/AgCl) 。陽イオン交換カラムとともに、移動相にリン酸バッファーを用いることで、アセチルコリンとコリンの分離、そして短時間分析の両立が可能である。 | |||
====モノアミンおよびその代謝物の分析(測定例)==== | |||
グラファイト電極に +700 mV 程度の電位を印加することでカテコールアミン(ドーパミン、ノルアドレナリン、アドレナリン等)や、インドールアミン(セロトニン等)、およびその代謝物の酸化反応をfmolオーダーで検出する。酸化還元電位は物質に固有であり、印加電位を変えることで選択的な検出が可能である。カテコールアミンは特に酸化を受けやすく、印加電位を +500 mV 程度まで下げることで選択的に検出することができる。 | |||
HPLCにおける各成分の分離はアイソクラティック法で行われ、移動相に用いる有機溶媒の種類および濃度、イオンペア試薬の濃度、 pH が大きな影響を及ぼす。有機溶媒には主にメタノールおよびアセトニトリルが用いられるが、濃度を上げることでアミンとその代謝物の溶出時間は早くなり、イオンペア試薬の濃度を上げることでアミンの溶出時間のみ遅くなる。またpH を上げると、DOPAC や HVA など酸性の代謝物の溶出時間は早くなる。 | |||
最適な印加電圧、移動相条件、カラムの種類を選択することで、脳組織中のモノアミンとその代謝物の一斉分析や、脳透析液中のドーパミンおよびセロトニンの短時間での高感度同時分析も可能である。 | |||
[測定例] マウス脳組織中のモノアミンとその代謝物の一斉分析 | |||
マウス線条体片側および小脳を各々摘出し、120 μL の0.2 M過塩素酸(100 μM EDTA・2Na含有)でホモジナイズ後、氷上で15分放置した。次に、遠心分離 (15,000 rpm, 20 分, 4 ℃) を行い、上清をpH3付近に調製後、0.45 μm フィルターでろ過したものを測定試料とした。分析条件はエイコム情報4(エイコム株式会社)に従い、アイソクラティック法で行った。 | |||
その結果、ドーパミン、ノルアドレナリン、セロトニンとその代謝物の合計10成分の同時分析が30分で可能であった(ISO:イソプロテレノール, 内部標準物質)。 | |||
同条件にて、脳組織を用いたサンプルにおいても妨害ピークなく分析ができる。 | |||
HPLCにおける各成分の分離はアイソクラティック法で行われ、移動相に用いる有機溶媒の種類および濃度、イオンペア試薬の濃度、 pH が大きな影響を及ぼす。有機溶媒には主にメタノールおよびアセトニトリルが用いられるが、濃度を上げることでアミンとその代謝物の溶出時間は早くなり、イオンペア試薬の濃度を上げることでアミンの溶出時間のみ遅くなる。またpH | |||
[測定例] | |||
==最近のHPLCの傾向== | ==最近のHPLCの傾向== | ||
===UHPLC (Ultra High Performance Liquid Chromatography)=== | ===UHPLC (Ultra High Performance Liquid Chromatography)=== | ||
UHPLCは、HPLCの最新機種である。原理はHPLCと全く同じであるが、分析時間を比較すると格段に短くなっている。HPLCと大きく異なる点は、カラムと送液圧力である。まずカラムは、カラム担体の粒径が従来より小さくなったため高い分離度がえられるようになった。ただし高圧となるため、高耐圧カラムを用いる。次に送液ポンプは、高耐圧カラムを使用するのに耐えるシステムになっている。さらにUHPLCは,高速分析のためピーク幅は数十秒ときわめて狭いため、検出器のフローセル部分も改良されている。その結果、高感度、高分離、高速分析が可能となった。 | UHPLCは、HPLCの最新機種である。原理はHPLCと全く同じであるが、分析時間を比較すると格段に短くなっている。HPLCと大きく異なる点は、カラムと送液圧力である。まずカラムは、カラム担体の粒径が従来より小さくなったため高い分離度がえられるようになった。ただし高圧となるため、高耐圧カラムを用いる。次に送液ポンプは、高耐圧カラムを使用するのに耐えるシステムになっている。さらにUHPLCは,高速分析のためピーク幅は数十秒ときわめて狭いため、検出器のフローセル部分も改良されている。その結果、高感度、高分離、高速分析が可能となった。 | ||
現在UHPLCは、ペプチドマッピング、メタボローム、アミノ酸分析そして医薬品の分析など様々な分野で活用されているが、カラムの種類はHPLCに比べ、まだ少ない状況である。今後、カラムの種類が豊富になることによりUHPLCの需要が高まることが期待される。 | |||
===LC-MS (Liquid Chromatography-Mass Spectrometry)=== | ===LC-MS (Liquid Chromatography-Mass Spectrometry)=== | ||
Fennらによって質量分析のイオン化法であるエレクトロスプレーイオン化(ESI)法が開発されてから、HPLCの検出器として質量分析計が多様の物質測定に利用できるようになった。このシステムでは、極微量の試料を高感度に検出することが可能であり、同時に多くの物質の分子量・構造情報を得ることができるため、特にプロテオミクスの分野で急速に発展した。しかし、質量分析計を用いた物質の検出は、測定対象がイオン化することが前提であり、試料の調製やHPLC移動相の選択などに制約がある。そこで、他のHPLC検出器で得られた分析条件を用いることが難しく、新たな基礎検討を必要とすることが多い。その中、近年では内径0.075ID &taimes; 0.1 mm のカラムを用い、50~500 nL/min 程度の低流速で送液を行うナノフローHPLCを用いることで、ペプチドやタンパク質消化物においてはamol レベルの検出が可能となっている。脳科学の分野でも、このLC-MSを用いたプロテオーム解析が盛んに行われている。 | |||
本稿で紹介したHPLC検出はごく一部であるが、HPLC分析を行うにあたり、測定対象の物性を理解した上で、それに応じた分析条件、検出器を用いることが重要である。 | 本稿で紹介したHPLC検出はごく一部であるが、HPLC分析を行うにあたり、測定対象の物性を理解した上で、それに応じた分析条件、検出器を用いることが重要である。 | ||
(執筆者:森下泰全、大月香、俣賀宣子 担当編集委員:河西春朗) | |||
2012年5月15日 (火) 16:28時点における版
英:High Performance Liquid Chromatography、英略語:HPLC
高速液体クロマトグラフィーとは、物質が固定相(カラムの担体)とこれに接して流れる移動相(液体)との親和力の違いから一定の比率で分布し、その比率が物質によって異なる事を利用して分離する方法である。移動相を高圧で流すことで高い分離および感度を得ることができ、固定相、移動相、検出器の組み合わせにより様々な物質の分析を行うことが可能である。神経科学分野においても各種神経伝達物質やタンパク質、ペプチドの分析など、幅広く利用されている。
原理
高速液体クロマトグラフィーとは、物質が固定相(カラムの担体)とこれに接して流れる移動相(液体)との親和力の違いから一定の比率で分布し、その比率が物質によって異なる事を利用して分離する方法である。現在では、物質の精製や分析には欠かせない存在となっている。高速液体クロマトグラフィーには、イオン交換、逆相、順相、サイズ排除(ゲル濾過)、アフィニティーなど様々な方法がある。
高速液体クロマトグラフィーの基本構成
移動相として溶媒や緩衝溶液を送るポンプ、試料を注入するインジェクター(試料導入部)、物質を分離するためのカラム、検出器、データ処理装置(PC)から構成されている(図1-A)。
ポンプ
移動相の制御に欠かせない装置である。メーカーによって多少異なる形をしているが基本的な構造は同じである。1台のポンプで1つの移動相が基本であるが、2つの電磁弁が付属していると2つの移動相を制御することができる。高速アミノ酸分析計(HITACHI)では電磁弁が5つ付属しており、1台のポンプで5種類の移動相を切り替えて1分析で約40種類のアミノ酸を定量することができる。電磁弁以外では、リザーバ−切り替えバルブがあり同様に6種類の移動相を変えることが可能である。
インジェクター
インジェクターには、マイクロシリンジを用いて手動でサンプルを注入するマニュアルインジェクターと、専用バイアル瓶に入れたサンプルをオートサンプラーと呼ばれる装置を用いて自動的に注入するオートインジェクターがある。各メーカーでシステムに合わせたオートサンプラーを開発しており、生体サンプルを取り扱うための冷却機能を備えた装置や誘導化するための反応型オートサンプラーがある。現在では、オートサンプラーを使用して分析する事が多い。
カラム
カラムは、分析する物質の性質を考慮して種類を選択しなければならない。カラムの種類には、主にイオン交換、逆相、順相、サイズ排除(ゲル濾過)そして光学異性体分離カラムがある。イオン交換カラムには、陽イオン、陰イオン、両イオン型の3つのタイプがある。これらは、金属イオン、無機酸、アミノ酸、ペプチドやタンパク質の分析・分取に用いられる。逆相カラムは、最も種類が多く様々なカラムが開発されている。特に低分子の分析に用いられることが多く神経伝達物質、誘導化したアミノ酸、医薬品、ホルモン、ペプチドの分析などに用いられている。順相カラムは、有機合成した化合物の分離に多く用いられる。サイズ排除カラムは、タンパク質を分子量ごとに分画または会合体としてモノマー、ダイマー、トリマーの分析・分取に用いられる。光学異性体分離カラムはアミノ酸のD体とL体や医薬品などの光学異性体化合物の分析・分取に用いられている。
検出器
様々な検出器が開発されておりUV検出器、蛍光検出器、電気化学検出器、質量分析器、蒸発光散乱検出器などが用いられている。HPLCにおいて、最も汎用的な検出器はUV 検出器であり、次いで蛍光検出器、電気化学検出器の順である。
データ処理ソフトウェア
検出されたデータを取得し、そこからピークの検出・解析をおこなう。各HPLCメーカーから装置の制御機能を合わせ持った製品が出されている。様々なメーカーの装置と接続可能な汎用ソフトウェアには、 EZChrom (Agilent)、 Empower (Waters)、 PowerChrom (eDAQ Pty Ltd)、 Unicorn(GE)などがある。
測定方法
プレカラム法とポストカラム法
HPLCで目的の物質がそのまま分析できない場合、感度を上げるために誘導化を行うことが多い。その誘導化の方法には、プレカラム法(図1-B)と ポストカラム法(図1-C)がある。 プレカラム法は成分を分離する前に誘導化する方法であり、ポストカラム法はカラムで成分を分離してから誘導化する方法である。一般に感度を上げるためにプレカラム法で蛍光誘導化が行われる事が多い。蛍光誘導化(ラベル化)とは、蛍光を発しない物質を化学反応で蛍光を発する物質に変換すること、蛍光物質を化学的に結合させることである。測定する物質の種類にもよるが蛍光誘導化するとfmol~pmolまで測定可能になる。ポストカラム法では、分離後誘導化試薬と反応するため別途ポンプが必要となる。また、反応させるための反応コイルや反応カラムを使用することによってサンプルが拡散するため、ポストカラム法はプレカラム法に比べ特に溶出時間が遅くなり物質の感度が悪くなることがある。
アイソクラティック法とグラジエント法
目的物質を移動相の溶媒の性質を変えて分離条件良く分析する方法には、アイソクラティック (Isocratic)法とグラジエント(Gradient)法がある。アイソクラティック法では単一な移動相を用いシンプルな装置で分析する。移動相の組成は複雑で、緩衝溶液のほかに有機溶媒やイオンペア試薬の添加をすることが多い。一方のグラジエント法は、2種類以上の移動相を用いるためHPLCシステムが少々複雑になる。一般的には移動相として水系の緩衝溶液と有機溶媒の2つを用い、徐々に濃度勾配をつけて分離を行う。この方法で良い分離が得られない場合は、移動相の濃度をステップワイズに変えたり、これと直線的に変える方法を組み合わせるとよい。
イオンペア試薬
イオンペア試薬は、陽イオンと陰イオンの2種類ある。目的の物質が正に電荷して陽イオン(+)の場合はアルキルスルホン酸塩を、負に電荷して陰イオン(−)の場合は第4級アンモニウム塩を用いる。イオン性物質のサンプルは、イオンペア試薬とイオン結合して電気的に中性となり、さらにイオンペア試薬のアルキル鎖により逆相カラムに保持されて分離できるようになる。数種類のアルキル鎖の長さが異なる試薬があり、分離の度合いを見て選択する。
HPLCの分析では、検出器の選択、カラムの選択、高感度にするための誘導化、移動相の種類、分離条件(2つの移動相の割合を変えて分離する)、などを組み合わせて目的物質の分析法を確立する。
応用例(スイッチングバルブ法)
これまでHPLCの一般的な装置構成について述べてきた。ここでは、装置構成の応用例としてスイッチングバルブ装置を用いたHPLCのシステムについて述べる。 図2-AのHPLCシステムではアイソクラティック法にスイッチングバルブ装置を組んでいる(構成:移動相2液、ポンプ2台、スイッチングバルブ1台、トラップカラム1本、分離用カラム2本、検出器2台)。スイッチングバルブとは、特定な時間を設定してその時間になると流路を切り替えることができる装置のことである。トラップカラムは、サンプル内の物質を一時的に保持するための長さが短いカラム(1cm程度)である。インジェクション前の流路は、移動相AはポンプA → インジェクター → トラップカラム → カラムA → 検出器Aへ流れている。このとき移動相Bは、ポンプB → カラムB → 検出器Bを流れており、トラップカラムには流れない。インジェクション後スイッチングバルブ設定時間にバルブが作動するとトラップカラムに移動相Bが流れる。このシステムで重要な点は、スイッチングバルブ設定時間である。設定時間を調節することによりカラムBで検出する物質の溶出時間を変えることができる。また目的物質の溶出が移動相の変わり目になると正確な分析ができなくなるため注意が必要である。溶出時間の速いものと遅いものを同時に分析したい場合、スイッチングバルブ法は1本のカラムで分析する場合と比較し約半分の時間でかつ溶出時間の遅い物質を感度良く分析できる利点がある。
脳科学への応用
神経伝達アミノ酸の分析(蛍光誘導化法)
蛍光誘導化法で用いられる誘導化試薬は、メーカーから様々な種類が出されている。その中でも本稿では非常に安価なOPA法について述べる。
蛍光検出の原理
OPA法は、オルトフタルアルデヒド(o-Phthalaldehyde, OPA)、メルカプトエタノール、アミノ酸由来のアミノ基が環化反応し蛍光を発する物質になり、分析を可能にする方法である(図2-A)。OPA誘導体は、励起波長350±10 nm,蛍光波長450±10 nm程度で蛍光検出することができる。 一般に誘導化する場合は過剰の試薬を加えなければならず、残った蛍光誘導化試薬が蛍光を発して分析する物質の妨害となり分析が困難になることがある。その点OPAは、環化反応しないと蛍光を発しないため残存する誘導化試薬を気にする必要がないのが利点である。一方OPA試薬の欠点として、蛍光の持続時間が短いこと、第2級アミンと反応しないためプロリンやハイドロキシプロリンの検出はできないことがあげられる。
測定例1 (グラジエント法)
脳組織ホモジネートを用いて、興奮性アミノ酸であるグルタミン酸と抑制性アミノ酸であるGABAを測定した例を述べる。
図2-Bに示したHPLCの構成で、グラジエント法を用いて分析した。移動相は2種類あり、移動相Aの組成は、100 mM リン酸緩衝液(pH 5.6)、移動相Bの組成は100%アセトニトリルでステップワイズに濃度を変え、25分間で1分析を行った(グラジエントの条件:0 min→1 min 15%, 1 min→4.5 min 16%, 4.5 min→8 min 21%, 8 min→11 min 24%, 11 min→13.5 min 31%, 13.5 min→16.5 min 35%, 16.5 min→25 min 15%)。 蛍光誘導化試薬は、OPA試薬7.5 mgをメタノール300 μLで溶解した後、2メルカプトエタノールを7.5μLを加え、さらにミリQ水1200 μLを加えた。100 mMホウ酸緩衝液(pH 10.0)は、Na4B4O7・10H2O 1.905 gをミリQ水50 mLに溶解し調製した。 試料の前処理として、摘出した脳組織にすみやかに5〜10倍量の0.2 M PCA(100 μM EDTA・2Na含有)を加え、超音波で30秒間ホモジナイズした。次に、除タンパクを完全にするため氷中で30分間放置した後、4 ℃で10,000 rpm × 15分間遠心し、上清を採取した。上清は20倍に希釈し、15 μLを HPLCサンプルとした。サンプルは、オートサンプラー内にてOPA試薬と反応し、HPLCで分析した。すなわち蛍光誘導化のため反応型のオートサンプラーのサンプルラックを12 ℃に冷却、蛍光誘導化試薬15 μL、サンプル15 μL、100 mM ホウ酸緩衝液(pH 10.0)20 μLを加え30 ℃で2分間インキュベートし、誘導体化されたサンプル35 μLをHPLCにインジェクションした。
分析例として、図2に0.5~20 pmol/μLのスタンダード(C)と脳組織をホモジネートしたサンプル(D)を分析したクロマトグラフを示した。定量限界は、0.5 pmol/μLであった。このクロマト条件においては、脳内のグルタミン酸と GABAの濃度は充分な測定感度範囲に入り、その他の生体アミノ酸(アスパラギン酸、セリン、アスパラギン、アルギニン、グリシン、アラニン、タウリン)も同時一斉分析を行うことが可能である。
測定例2 (スイッチングバルブ法)
図3-Aに示したHPLCの構成で、アイソクラティック法を用いて脳組織のホモジネートを分析した。移動相は2種類あり、移動相Aにクエン酸−リン酸緩衝液 pH 5.8, 12%アセトニトリル、移動相Bにクエン酸−リン酸緩衝液 pH 6.2, 25%アセトニトリルを用い15分間で1分析を行った。スイッチングバルブは、インジェクションから1分30秒で切り替わり、12分後に元の流路に戻るセッティングをした。 蛍光誘導化試薬は、OPA試薬5 mgをメタノール200 μLで溶解した後、2メルカプトエタノール5 μL、0.1 M Na2CO3溶液800 μL加え、調製した。 試料の前処理は、測定例(1)と同様に行い、上清を1200倍に希釈して15 μLをHPLCサンプルにした。 蛍光誘導化のため、オートサンプラーのサンプルラックを12 ℃に冷却、蛍光誘導化試薬15 μL、サンプル15 μLを加え30 ℃で2分間インキュベートし、誘導体化されたサンプル10 μLをインジェクションした。
神経伝達モノアミンとその代謝物、およびアセチルコリンの分析(電気化学検出法)
電気化学検出の原理
酸化還元活性を有する物質を高感度に検出する方法である。一定の電位を印加した電極上で物質が酸化又は還元された時に流れる電流を検出する。電流量は濃度に比例する為、定量分析が可能である。検出器には、電流測定検出器 (Amperometric detector) と電量検出器(Coulometric detector) の2種類があり、一般的にHPLCにおいては電流測定検出器を用いることが多い。これは、電量検出器に比べて電解効率が大幅に低いものの、良いシグナルノイズ比・感度が得られるためである。検出セルは作用電極、参照電極、対極電極からなり、作用電極は測定対象に応じてグラッシーカーボン、グラファイト、白金などを使用する。 電気化学検出は1950年代にKemuraによって最初にクロマトグラフィーの検出法として用いられ、1960年代後半から1970年代前半にかけてAdamsらによりカテコールアミンおよびアスコルビン酸の分析に応用された。それからさらなる改良が重ねられ、現在神経伝達物質およびその代謝物の定量方法として、一般的な技術となっている。 詳細な測定原理や方法については、Meffordによる総説3やZapataらのプロトコル4等が参考となる。
アセチルコリンおよびコリンの分析
アセチルコリンのHPLC-ECDを用いた分析は、1983年にPotterらによって最初に報告された。アセチルコリンは電気化学的に不活性である為、分離用の本カラムの下流にアセチルコリンエステラーゼ (AChE)および コリンオキシダーゼ (ChO) を固定化した酵素カラムを配置し、オンラインで加水分解・酸化することで生成した過酸化水素を白金電極にて検出する (印加電圧 +450 mV vs Ag/AgCl) 。陽イオン交換カラムとともに、移動相にリン酸バッファーを用いることで、アセチルコリンとコリンの分離、そして短時間分析の両立が可能である。
モノアミンおよびその代謝物の分析(測定例)
グラファイト電極に +700 mV 程度の電位を印加することでカテコールアミン(ドーパミン、ノルアドレナリン、アドレナリン等)や、インドールアミン(セロトニン等)、およびその代謝物の酸化反応をfmolオーダーで検出する。酸化還元電位は物質に固有であり、印加電位を変えることで選択的な検出が可能である。カテコールアミンは特に酸化を受けやすく、印加電位を +500 mV 程度まで下げることで選択的に検出することができる。
HPLCにおける各成分の分離はアイソクラティック法で行われ、移動相に用いる有機溶媒の種類および濃度、イオンペア試薬の濃度、 pH が大きな影響を及ぼす。有機溶媒には主にメタノールおよびアセトニトリルが用いられるが、濃度を上げることでアミンとその代謝物の溶出時間は早くなり、イオンペア試薬の濃度を上げることでアミンの溶出時間のみ遅くなる。またpH を上げると、DOPAC や HVA など酸性の代謝物の溶出時間は早くなる。 最適な印加電圧、移動相条件、カラムの種類を選択することで、脳組織中のモノアミンとその代謝物の一斉分析や、脳透析液中のドーパミンおよびセロトニンの短時間での高感度同時分析も可能である。 [測定例] マウス脳組織中のモノアミンとその代謝物の一斉分析 マウス線条体片側および小脳を各々摘出し、120 μL の0.2 M過塩素酸(100 μM EDTA・2Na含有)でホモジナイズ後、氷上で15分放置した。次に、遠心分離 (15,000 rpm, 20 分, 4 ℃) を行い、上清をpH3付近に調製後、0.45 μm フィルターでろ過したものを測定試料とした。分析条件はエイコム情報4(エイコム株式会社)に従い、アイソクラティック法で行った。 その結果、ドーパミン、ノルアドレナリン、セロトニンとその代謝物の合計10成分の同時分析が30分で可能であった(ISO:イソプロテレノール, 内部標準物質)。 同条件にて、脳組織を用いたサンプルにおいても妨害ピークなく分析ができる。
最近のHPLCの傾向
UHPLC (Ultra High Performance Liquid Chromatography)
UHPLCは、HPLCの最新機種である。原理はHPLCと全く同じであるが、分析時間を比較すると格段に短くなっている。HPLCと大きく異なる点は、カラムと送液圧力である。まずカラムは、カラム担体の粒径が従来より小さくなったため高い分離度がえられるようになった。ただし高圧となるため、高耐圧カラムを用いる。次に送液ポンプは、高耐圧カラムを使用するのに耐えるシステムになっている。さらにUHPLCは,高速分析のためピーク幅は数十秒ときわめて狭いため、検出器のフローセル部分も改良されている。その結果、高感度、高分離、高速分析が可能となった。 現在UHPLCは、ペプチドマッピング、メタボローム、アミノ酸分析そして医薬品の分析など様々な分野で活用されているが、カラムの種類はHPLCに比べ、まだ少ない状況である。今後、カラムの種類が豊富になることによりUHPLCの需要が高まることが期待される。
LC-MS (Liquid Chromatography-Mass Spectrometry)
Fennらによって質量分析のイオン化法であるエレクトロスプレーイオン化(ESI)法が開発されてから、HPLCの検出器として質量分析計が多様の物質測定に利用できるようになった。このシステムでは、極微量の試料を高感度に検出することが可能であり、同時に多くの物質の分子量・構造情報を得ることができるため、特にプロテオミクスの分野で急速に発展した。しかし、質量分析計を用いた物質の検出は、測定対象がイオン化することが前提であり、試料の調製やHPLC移動相の選択などに制約がある。そこで、他のHPLC検出器で得られた分析条件を用いることが難しく、新たな基礎検討を必要とすることが多い。その中、近年では内径0.075ID &taimes; 0.1 mm のカラムを用い、50~500 nL/min 程度の低流速で送液を行うナノフローHPLCを用いることで、ペプチドやタンパク質消化物においてはamol レベルの検出が可能となっている。脳科学の分野でも、このLC-MSを用いたプロテオーム解析が盛んに行われている。
本稿で紹介したHPLC検出はごく一部であるが、HPLC分析を行うにあたり、測定対象の物性を理解した上で、それに応じた分析条件、検出器を用いることが重要である。 (執筆者:森下泰全、大月香、俣賀宣子 担当編集委員:河西春朗)