「フグ毒」の版間の差分
細 →その他 |
|||
| (2人の利用者による、間の24版が非表示) | |||
| 1行目: | 1行目: | ||
{{chembox | {{chembox | ||
| 化合物名 = (−)-テトロドトキシン | | 化合物名 = (−)-テトロドトキシン | ||
| | |画像ファイル=Tetrodotoxin.svg | ||
|画像サイズ= | |||
|画像1=Tetrodotoxin-3D-balls.png | |||
|IUPAC名= Octahydro-12-(hydroxymethyl)-2-imino-5,9:7,10a-dimethano-10aH-[1,3]dioxocino[6,5-d]pyrimidine-4,7,10,11,12-pentol | |||
| | |別称=anhydrotetrodotoxin, 4-epitetrodotoxin, tetrodonic acid, TTX、タリカトキシン、スフェロイジン、テトロドキシン、テトロドントキシン | ||
| | |Section1= {{Chembox Identifiers | ||
| | | CAS番号=4368-28-9 | ||
| | | 日化辞番号 = J76.209A | ||
|Section1={{Chembox Identifiers | | EINECS = 2244588 | ||
| | | PubChem=20382 | ||
| | | SMILES=C([C@@]1([C@@H]2[C@@H]3[C@H](N=C(N[C@@]<br />34C([C@@H]1O[C@@]([C@H]4O)(O2)O)O)N)O)O)O | ||
| | }} | ||
| SMILES = | |Section2= {{Chembox Properties| | ||
| C =11 | H = 17| N =3 | O =8 | |||
| MolarMass= | |||
| 外観=白色固体 | |||
| Density= | |||
| 融点=220 ºC | |||
| BoilingPt= | |||
| Solubility= | |||
}} | |||
|Section2={{Chembox Properties| | |||
| MolarMass= | |||
| | |||
| Density= | |||
| | |||
| BoilingPt= | |||
| Solubility= | |||
}} | }} | ||
|Section3= {{Chembox Hazards | |Section3= {{Chembox Hazards | ||
| 57行目: | 32行目: | ||
| 皮膚への危険性 = | | 皮膚への危険性 = | ||
| Rフレーズ = {{R26/27/28}} | | Rフレーズ = {{R26/27/28}} | ||
| LD50 = 334 μg/kg([[マウス]]、経口) | | LD50 = 334 μg/kg([[ハツカネズミ属|マウス]]、経口)}} | ||
}} | }} | ||
英:tetrodotoxin、英略語:TTX、独:Tetrodotoxin、仏:tétrodotoxine | |||
フグ毒tetrodotoxin (TTX) は1960年の初めに、[[wikipedia:jp:神経|神経]]、[[wikipedia:jp:筋肉|筋肉]]の興奮をつかさどる[[電位依存性ナトリウムチャネル]](Na<sup>+</sup>チャネル)を低濃度でしかも選択的に阻害することが証明されて以来、[[チャネル]]の実験に欠かせないchemical toolとして世界中で広く使われてきている。TTXがきっかけとなって他の毒物や治療薬のチャネルに対する作用機構の研究が重要視され、channelopathyは医学生物学のホットなトピックになった。現在ではTTX抵抗性Na<sup>+</sup>チャネルの存在も知られている。TTXは[[wikipedia:jp:フグ|フグ]]が作るのではなく、海産の[[wikipedia:jp:細菌|細菌]]によって作られ、[[wikipedia:jp:食物連鎖|食物連鎖]]を経てフグの主に[[wikipedia:jp:卵巣|卵巣]]や[[wikipedia:jp:肝臓|肝臓]]に蓄えられる。フグの種類によってはほとんどTTXを持たないものもある。この様な機構を反映して、TTXはフグ以外の[[wikipedia:jp:海産動物|海産動物]]、例外的には[[wikipedia:jp:陸生動物|陸生動物]]にも見出されている。TTXをもった動物はTTX に対する[[wikipedia:jp:LD50|LD50]]が非常に高い。フグ中毒は主に神経、筋肉系の麻痺によるものであるが、[[wikipedia:jp:解毒剤|解毒剤]]は見つかっておらず、[[wikipedia:jp:人工呼吸|人工呼吸]]が対症療法的に有効である。臨床へのTTXの利用もいろいろ試みられているが、まだ試験段階である。 | |||
== 歴史的背景 == | == 歴史的背景 == | ||
フグには強力な毒があるということは5000年も前から[[wikipedia:jp:エジプト|エジプト]]その他で知られていた。特に日本ではフグは最もおいしい[[wikipedia:jp:魚|魚]]として長い間賞玩されてきた。しかしその毒のために中毒死が絶えず、薬理学的な対象として広く研究されてきたとはいえ、以前は[[wikipedia:Kymograph|キモグラフ]]を使うような非常に古典的な手法によっていたので、[[wikipedia:jp:神経毒|神経毒]] | フグには強力な毒があるということは5000年も前から[[wikipedia:jp:エジプト|エジプト]]その他で知られていた。特に日本ではフグは最もおいしい[[wikipedia:jp:魚|魚]]として長い間賞玩されてきた。しかしその毒のために中毒死が絶えず、薬理学的な対象として広く研究されてきたとはいえ、以前は[[wikipedia:Kymograph|キモグラフ]]を使うような非常に古典的な手法によっていたので、[[wikipedia:jp:神経毒|神経毒]]であるこことは知られていても詳しい作用機構はわからなかった。1960年の初めにTTXの[[wikipedia:jp:化学構造|化学構造]]が決定され、また神経、筋肉などで興奮をつかさどるNa<sup>+</sup>チャネルを低濃度でしかも選択的に阻害することが証明されて以来、実験室でのchemical tool として世界中で広く使われ、一躍神経生理、薬理のチャンピオンとしてデビューするようになった。これをきっかけにして、いろいろな化合物がchemical tool として使われる様になり、またさまざまな治療薬のチャネルに対する影響の研究が盛んになり、channelopathy が重要な医学生物学の分野として発展するようになった。 | ||
== 化学構造 == | == 化学構造 == | ||
1964年に京都で開かれたFourth International Conference on the Natural Productsで3つのグループ(日本「2」、アメリカ「1」)によって発表された(C11H17N3O8, 分子量319 | 1964年に京都で開かれたFourth International Conference on the Natural Productsで3つのグループ(日本「2」、アメリカ「1」)によって発表された(C11H17N3O8, 分子量319 )。TTX分子は[[wikipedia:jp:グアニジン|グアニジウム基]]を含み、またhemilactal結合を持っていることが特徴である。TTXは[[wikipedia:jp:双性イオン|双性イオン]](zwitterion)の形をとり2種類のカチオンにイオン化される。水には直接溶けず、[[wikipedia:jp:細胞膜|細胞膜]]は通れない。しかし酸性の溶液には溶解し、比較的安定である。pH 4.8、4 の条件下での分解時定数は14ヶ月と測定されている。アルカリ性の溶液中では不安定である。 | ||
== イオンチャネルに対する作用機構 == | == イオンチャネルに対する作用機構 == | ||
TTXが神経や筋肉を麻痺させることは、特に日本では長い間[[wikipedia:jp:薬理学|薬理学]]者の間で知られていたが、1960年になって[[細胞内微小電極法]]を[[wikipedia:jp:カエル|カエル]]の筋肉に適用した実験から、TTXがNa<sup>+</sup>チャネルを選択的に阻害して麻痺をもたらすという仮説が発表された<ref><pubmed> 14426011 </pubmed></ref>。この仮説は4年後に[[wikipedia:jp:エビ|エビ]]の巨大神経線維に[[電位固定法]]を適用した実験で確実に証明された<ref><pubmed> 14155438 </pubmed></ref>。当時としては毒物をchemical tool として使うということは全く考えられなかった上、また特定のチャネル特にNa<sup>+</sup>チャネルを選択的に阻害する化合物はまったく知られていなかったので、TTXは一躍ユニークなchemical tool として世界中で広く使われるようになった。 | |||
TTXのNa<sup>+</sup> チャネル阻害作用はいろいろな面でユニークである。まず第一にTTXは細胞の外から与えたときにのみ有効で、細胞内に直接与えても阻害しない。大部分の非選択的Na<sup>+</sup>チャネル阻害剤は、外から有効であっても実際は膜を通過してチャネルの内側から働いていることが知られている(たとえば[[局所麻酔薬]])。第二にTTX 分子のグアニジウム基 はNa<sup>+</sup>チャネルを通れる大きさを持っているが、他の部分は大きすぎて通れない。つまりTTX がチャネルを外から塞いで阻害する訳である。第三にTTXがチャネルを阻害しても、チャネルのゲート機構は刺激によって正常に開閉する。このようなユニークな機構を反映して、個々のNa<sup>+</sup>チャネルはTTXによってall-or-noneに阻害される。 | |||
Na<sup>+</sup>チャネルは260 kDaのα サブユニットとβ1 (36 kDa) あよびβ2 (33 kDa) サブユニットから構成されている。α サブユニット が主要な部分で、それだけでもチャネルとして働くがkineticsがおそい。β サブユニットを加えるとkineticsが正常に戻る。各々のα サブユニットは4つの相同ドメイン(I-IV)を含み、各々のドメインは6つの膜貫通領域 (S1-S6)からなっている。各ドメインのS5とS6 | Na<sup>+</sup>チャネルは260 kDaのα サブユニットとβ1 (36 kDa) あよびβ2 (33 kDa) サブユニットから構成されている。α サブユニット が主要な部分で、それだけでもチャネルとして働くがkineticsがおそい。β サブユニットを加えるとkineticsが正常に戻る。各々のα サブユニットは4つの相同ドメイン(I-IV)を含み、各々のドメインは6つの膜貫通領域 (S1-S6)からなっている。各ドメインのS5とS6 をつなぐループにTTX が結合してNa<sup>+</sup>チャネルを阻害すると考えられている。 | ||
== Chemical toolとしての利用 == | == Chemical toolとしての利用 == | ||
TTXは実験室で広く利用されている。2、3の例を次に挙げる。神経や筋肉では通常Na<sup>+</sup>チャネルとK+チャネルが共存しているので、K+チャネルの由来の電流を測定するためにはNa<sup>+</sup>チャネルをTTXで完全に阻害すればよい。シナプス後電位膜のチャネル、例えば[[アセチルコリン受容体]]チャネルや[[グルタミン酸受容体]]チャネルはTTXによって阻害されないので、[[節前繊維]]の興奮をTTXでとめて受容体の働きを調べることができる。その他[[神経興奮]]や[[活動電位]]を止めて実験することが多々あるが、このような場合にはTTXが広く使われている。Na<sup>+</sup>チャネルの密度もTTX あるいは同様なNa<sup>+</sup>チャネル阻害作用のある[[wikipedia:jp:サキシトキシン|サキシトキシン]](saxitoxin、STX)の結合によって測定された。[[無髄神経線維]]では通常1 µm<sup>2</sup>あたり100-300個のNa<sup>+</sup>チャネルが存在する。[[有髄神経線維]]の[[ランヴィエ絞輪]]では[[跳躍伝導]]のために密度が高く、1 µm<sup>2</sup>あたり12000個と測定されている。 | |||
== | == TTX抵抗性Na<sup>+</sup>チャネル == | ||
神経や筋肉のNa<sup>+</sup> | 神経や筋肉のNa<sup>+</sup>チャネルの中には高濃度のTTXではじめて阻害されるものがある。例えば[[後根神経節]]から[[脳]]に向かって痛みを伝える[[C繊維]]は、[[IC50]]が100 µM前後のTTX抵抗性Na<sup>+</sup>チャネルを含んでいる。[[痛み]]は非常に重要なテーマなので、TTX抵抗性Na<sup>+</sup>チャネルの研究は盛んになった。TTX抵抗性Na<sup>+</sup> チャネルも含めて、数種類のNa<sup>+</sup>チャネルが知られている。現在では命名法が統一されて、[[中枢神経|中枢]]、[[末梢神経]]および[[骨格筋]]にあるTTX感受性Na<sup>+</sup>チャネル(IC50=2-10 nM) はNav 1.1、1.2、1.3、1.4、および1.7、心筋と神経を除去された骨格筋にあるTTX抵抗性Na<sup>+</sup>チャネル(IC50=2 µM) はNav1.5、中枢、末梢神経にあるTTX 抵抗性Na<sup>+</sup>チャネル(IC50=1-100 µM) はNav1.8と1.9 と呼ばれている。 | ||
== フグ毒の分布 == | == フグ毒の分布 == | ||
TTXはフグに含まれていることは昔から知られていたが、現在では種々な動物(主に海産動物)に発見されている。たとえば[[wikipedia:jp:ヒモムシ|ヒモムシ]]''Lineus fuscoviridis''、[[wikipedia:jp:軟体動物|軟体動物]]''[[wikipedia:Charonia|Charonia]] lampus sauliae''、''[[wikipedia:Nassarius_siquijorensis|Nassarius (Zeuxis) siquijorensis]]''、''Niotha lineate''、イモリ''[[wikipedia:Taricha|Taricha]] spp.''およびカエル''[[wikipedia:Atelopus|Atelopus]] spp.''などである。TTXはフグによって生産されるのではなく、海産の細菌''[[wikipedia:Vibrio alginolyticus|Vibrio alginolyticus]]''およびその他の''Vibrio spp.''によって作られ、食物連鎖を経てフグに達することが証明された。ゆえにフグをそれらの細菌のない条件下で養殖すれば、TTXを持たないフグが出来るはずである。実際にこれが可能であることが証明された。TTXは主にフグの肝臓や卵巣に含まれているが、フグの種類によっては[[wikipedia:jp:皮膚|皮膚]]や[[wikipedia:jp:腸|腸]]にも含まれている。これらの臓器に含まれているTTXの量はフグの種類によって非常に異なり、ほとんどTTXを持たないフグも知られている。 | |||
TTXを持っている動物はTTXに対して著しい抵抗性を持っている。たとえば[[wikipedia:Xanthidae|オウギガニ]]、ある種の熱帯魚、およびある種のサンショウウオのTTXに対する[[wikipedia:LD50|LD50]]はそれぞれ1000、>300、>10000 mouse unit (MU) と測定されている。1 MUは体重20 gの[[wikipedia:jp:マウス|マウス]]を30分で殺すTTXの量である。TTXを持った3種類のフグでのTTX LD50 は700-750、500-550、300-500 MU であった。一方、TTXを持たない4種類のフグでは、LD50は15-18、19-20、13-15、0.9-1.3 と測定された。 | |||
== | == TTXによる中毒 == | ||
TTX LD50はマウスでは10 ng/g、ヒトでは2 mg/human といわれている。中毒の第1期は神経筋で起こり、唇や舌の[[wikipedia:jp:痺れ|痺れ]]、流涎や腹痛からなる。第2期には痺れが広がり手足(extremity)の麻痺が起こる。第3期には麻痺が神経筋肉系および呼吸器系にひろがって、[[構音障害]](dysarthria)、[[筋線維性攣縮]]、[[wikipedia:jp:低血圧|低血圧]] (hypotension)、血管運動ブロック、[[wikipedia:jp:不整脈|不整脈]] を伴う。第4期の末期には呼吸麻痺、極度の低血圧、[[痙攣]]、[[脊髄反射]]の消失を経て死にいたる。 | |||
解毒剤は知られていない。[[wikipedia:jp:対症療法|対症療法]]としては[[wikipedia:jp:人工呼吸|人工呼吸]]が有効である。心筋のNa<sup>+</sup> | 解毒剤は知られていない。[[wikipedia:jp:対症療法|対症療法]]としては[[wikipedia:jp:人工呼吸|人工呼吸]]が有効である。心筋のNa<sup>+</sup>チャネルはTTXに対する感受性が低く中毒中も働いているので、人工呼吸を施せばTTXが徐々に解毒されて患者は回復に向かう。[[wikipedia:jp:胃洗浄|胃洗浄]]は有効で、[[アトロピン]]も低血圧や徐脈に対症療法的に使われる。 | ||
しかしTTXによる中毒死は絶えない。日本国内での中毒例/死亡例は1965年が152/88、1970年が73/33、1980年が90/15、1990年が55/1、2000年が40/0、2007年が38/2と報告されている。最近の死亡例の低下は医療技術の改良を反映している。にもかかわらず中毒例が多いのは、少量の卵巣や肝臓をたべていわゆるnumb feeling を味わおうとする人が絶えないからである。 | |||
== 臨床への応用 == | == 臨床への応用 == | ||
TTXを臨床に応用すべく、いろいろ試みられているが、まだ試験段階で臨床に使われるまでには至っていない。大部分の試みはTTXの強力かつ選択的なNa<sup>+</sup>チャネル阻害作用を利用するものである。ひとつの大きな障害は副作用、特に低血圧である。臨床への応用の数例を次に述べる。 | |||
TTX抵抗性Na<sup>+</sup>チャネルは痛みを中枢に伝えるC繊維に分布しているので、TTX抵抗性Na<sup>+</sup>チャネルを阻害してTTX感受性Na<sup>+</sup>チャネルを阻害しない[[wikipedia:jp:化合物|化合物]]が見つかれば、[[wikipedia:jp:副作用|副作用]]を伴わずに痛みを抑制することが出来ると考えられる。In vitroの実験では見つかっているものもあるが、まだ臨床的には成功していない。[[脳梗塞]]に伴う[[虚血]]にも[[神経保護薬]]として試みられている。TTXが[[神経末端]]を阻害して虚血に伴う[[グルタミン酸]]の神経末端からの放出を抑制するというのがそのアイデアである。TTXに対する[[wikipedia:ja:モノクローナル抗体|モノクローナル抗体]]の作成も試みられて、ある程度の成功が報告されている。[[wikipedia:jp:癌|癌]]に伴う痛みに対して、非常な低濃度のTTXの筋肉内注射が長い間有効であるという報告もある。 | |||
== 参考文献 == | == 参考文献 == | ||
| 110行目: | 87行目: | ||
<references/> | <references/> | ||
===その他=== | ===その他=== | ||
<pubmed> 17425946</pubmed> | |||
<pubmed> 18941294 </pubmed> | |||
<pubmed> 18728726 </pubmed> | |||
'''Toshi Narahashi'''<br> | |||
Pharmacology of tetrodotoxin.<br> | |||
''Journal of Toxicology - Toxin Reviews'': 2001, 20, 67-84. <br> | |||
'''Mari Yotsu-Yamashita'''<br> | |||
Chemistry of puffer fish toxin.<br> | |||
''Journal of Toxicology – Toxin Reviews'': 2001, 20, 51-66. | |||
(執筆者:楢橋敏夫、編集委員:林 康紀) | |||
2011年12月6日 (火) 18:34時点における版
| (−)-テトロドトキシン | |
|---|---|
| |
| |
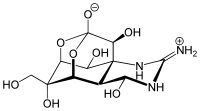
Octahydro-12-(hydroxymethyl)-2-imino-5,9:7,10a-dimethano-10aH-[1,3]dioxocino[6,5-d]pyrimidine-4,7,10,11,12-pentol | |
別称 anhydrotetrodotoxin, 4-epitetrodotoxin, tetrodonic acid, TTX、タリカトキシン、スフェロイジン、テトロドキシン、テトロドントキシン | |
| Identifiers | |
| EC-number | [1] |
| Jmol-3D images | Image |
| PubChem | 20382 |
| |
| Properties | |
| C11H17N3O8 | |
| Molar mass | 319.270 g·mol−1 |
| 危険性 | |
| MSDS | Fisher Scientific |
| EU分類 | |
| Rフレーズ | R26/27/28 |
| 半数致死量 LD50 | 334 μg/kg(マウス、経口) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
英:tetrodotoxin、英略語:TTX、独:Tetrodotoxin、仏:tétrodotoxine
フグ毒tetrodotoxin (TTX) は1960年の初めに、神経、筋肉の興奮をつかさどる電位依存性ナトリウムチャネル(Na+チャネル)を低濃度でしかも選択的に阻害することが証明されて以来、チャネルの実験に欠かせないchemical toolとして世界中で広く使われてきている。TTXがきっかけとなって他の毒物や治療薬のチャネルに対する作用機構の研究が重要視され、channelopathyは医学生物学のホットなトピックになった。現在ではTTX抵抗性Na+チャネルの存在も知られている。TTXはフグが作るのではなく、海産の細菌によって作られ、食物連鎖を経てフグの主に卵巣や肝臓に蓄えられる。フグの種類によってはほとんどTTXを持たないものもある。この様な機構を反映して、TTXはフグ以外の海産動物、例外的には陸生動物にも見出されている。TTXをもった動物はTTX に対するLD50が非常に高い。フグ中毒は主に神経、筋肉系の麻痺によるものであるが、解毒剤は見つかっておらず、人工呼吸が対症療法的に有効である。臨床へのTTXの利用もいろいろ試みられているが、まだ試験段階である。
歴史的背景
フグには強力な毒があるということは5000年も前からエジプトその他で知られていた。特に日本ではフグは最もおいしい魚として長い間賞玩されてきた。しかしその毒のために中毒死が絶えず、薬理学的な対象として広く研究されてきたとはいえ、以前はキモグラフを使うような非常に古典的な手法によっていたので、神経毒であるこことは知られていても詳しい作用機構はわからなかった。1960年の初めにTTXの化学構造が決定され、また神経、筋肉などで興奮をつかさどるNa+チャネルを低濃度でしかも選択的に阻害することが証明されて以来、実験室でのchemical tool として世界中で広く使われ、一躍神経生理、薬理のチャンピオンとしてデビューするようになった。これをきっかけにして、いろいろな化合物がchemical tool として使われる様になり、またさまざまな治療薬のチャネルに対する影響の研究が盛んになり、channelopathy が重要な医学生物学の分野として発展するようになった。
化学構造
1964年に京都で開かれたFourth International Conference on the Natural Productsで3つのグループ(日本「2」、アメリカ「1」)によって発表された(C11H17N3O8, 分子量319 )。TTX分子はグアニジウム基を含み、またhemilactal結合を持っていることが特徴である。TTXは双性イオン(zwitterion)の形をとり2種類のカチオンにイオン化される。水には直接溶けず、細胞膜は通れない。しかし酸性の溶液には溶解し、比較的安定である。pH 4.8、4 の条件下での分解時定数は14ヶ月と測定されている。アルカリ性の溶液中では不安定である。
イオンチャネルに対する作用機構
TTXが神経や筋肉を麻痺させることは、特に日本では長い間薬理学者の間で知られていたが、1960年になって細胞内微小電極法をカエルの筋肉に適用した実験から、TTXがNa+チャネルを選択的に阻害して麻痺をもたらすという仮説が発表された[1]。この仮説は4年後にエビの巨大神経線維に電位固定法を適用した実験で確実に証明された[2]。当時としては毒物をchemical tool として使うということは全く考えられなかった上、また特定のチャネル特にNa+チャネルを選択的に阻害する化合物はまったく知られていなかったので、TTXは一躍ユニークなchemical tool として世界中で広く使われるようになった。
TTXのNa+ チャネル阻害作用はいろいろな面でユニークである。まず第一にTTXは細胞の外から与えたときにのみ有効で、細胞内に直接与えても阻害しない。大部分の非選択的Na+チャネル阻害剤は、外から有効であっても実際は膜を通過してチャネルの内側から働いていることが知られている(たとえば局所麻酔薬)。第二にTTX 分子のグアニジウム基 はNa+チャネルを通れる大きさを持っているが、他の部分は大きすぎて通れない。つまりTTX がチャネルを外から塞いで阻害する訳である。第三にTTXがチャネルを阻害しても、チャネルのゲート機構は刺激によって正常に開閉する。このようなユニークな機構を反映して、個々のNa+チャネルはTTXによってall-or-noneに阻害される。
Na+チャネルは260 kDaのα サブユニットとβ1 (36 kDa) あよびβ2 (33 kDa) サブユニットから構成されている。α サブユニット が主要な部分で、それだけでもチャネルとして働くがkineticsがおそい。β サブユニットを加えるとkineticsが正常に戻る。各々のα サブユニットは4つの相同ドメイン(I-IV)を含み、各々のドメインは6つの膜貫通領域 (S1-S6)からなっている。各ドメインのS5とS6 をつなぐループにTTX が結合してNa+チャネルを阻害すると考えられている。
Chemical toolとしての利用
TTXは実験室で広く利用されている。2、3の例を次に挙げる。神経や筋肉では通常Na+チャネルとK+チャネルが共存しているので、K+チャネルの由来の電流を測定するためにはNa+チャネルをTTXで完全に阻害すればよい。シナプス後電位膜のチャネル、例えばアセチルコリン受容体チャネルやグルタミン酸受容体チャネルはTTXによって阻害されないので、節前繊維の興奮をTTXでとめて受容体の働きを調べることができる。その他神経興奮や活動電位を止めて実験することが多々あるが、このような場合にはTTXが広く使われている。Na+チャネルの密度もTTX あるいは同様なNa+チャネル阻害作用のあるサキシトキシン(saxitoxin、STX)の結合によって測定された。無髄神経線維では通常1 µm2あたり100-300個のNa+チャネルが存在する。有髄神経線維のランヴィエ絞輪では跳躍伝導のために密度が高く、1 µm2あたり12000個と測定されている。
TTX抵抗性Na+チャネル
神経や筋肉のNa+チャネルの中には高濃度のTTXではじめて阻害されるものがある。例えば後根神経節から脳に向かって痛みを伝えるC繊維は、IC50が100 µM前後のTTX抵抗性Na+チャネルを含んでいる。痛みは非常に重要なテーマなので、TTX抵抗性Na+チャネルの研究は盛んになった。TTX抵抗性Na+ チャネルも含めて、数種類のNa+チャネルが知られている。現在では命名法が統一されて、中枢、末梢神経および骨格筋にあるTTX感受性Na+チャネル(IC50=2-10 nM) はNav 1.1、1.2、1.3、1.4、および1.7、心筋と神経を除去された骨格筋にあるTTX抵抗性Na+チャネル(IC50=2 µM) はNav1.5、中枢、末梢神経にあるTTX 抵抗性Na+チャネル(IC50=1-100 µM) はNav1.8と1.9 と呼ばれている。
フグ毒の分布
TTXはフグに含まれていることは昔から知られていたが、現在では種々な動物(主に海産動物)に発見されている。たとえばヒモムシLineus fuscoviridis、軟体動物Charonia lampus sauliae、Nassarius (Zeuxis) siquijorensis、Niotha lineate、イモリTaricha spp.およびカエルAtelopus spp.などである。TTXはフグによって生産されるのではなく、海産の細菌Vibrio alginolyticusおよびその他のVibrio spp.によって作られ、食物連鎖を経てフグに達することが証明された。ゆえにフグをそれらの細菌のない条件下で養殖すれば、TTXを持たないフグが出来るはずである。実際にこれが可能であることが証明された。TTXは主にフグの肝臓や卵巣に含まれているが、フグの種類によっては皮膚や腸にも含まれている。これらの臓器に含まれているTTXの量はフグの種類によって非常に異なり、ほとんどTTXを持たないフグも知られている。
TTXを持っている動物はTTXに対して著しい抵抗性を持っている。たとえばオウギガニ、ある種の熱帯魚、およびある種のサンショウウオのTTXに対するLD50はそれぞれ1000、>300、>10000 mouse unit (MU) と測定されている。1 MUは体重20 gのマウスを30分で殺すTTXの量である。TTXを持った3種類のフグでのTTX LD50 は700-750、500-550、300-500 MU であった。一方、TTXを持たない4種類のフグでは、LD50は15-18、19-20、13-15、0.9-1.3 と測定された。
TTXによる中毒
TTX LD50はマウスでは10 ng/g、ヒトでは2 mg/human といわれている。中毒の第1期は神経筋で起こり、唇や舌の痺れ、流涎や腹痛からなる。第2期には痺れが広がり手足(extremity)の麻痺が起こる。第3期には麻痺が神経筋肉系および呼吸器系にひろがって、構音障害(dysarthria)、筋線維性攣縮、低血圧 (hypotension)、血管運動ブロック、不整脈 を伴う。第4期の末期には呼吸麻痺、極度の低血圧、痙攣、脊髄反射の消失を経て死にいたる。
解毒剤は知られていない。対症療法としては人工呼吸が有効である。心筋のNa+チャネルはTTXに対する感受性が低く中毒中も働いているので、人工呼吸を施せばTTXが徐々に解毒されて患者は回復に向かう。胃洗浄は有効で、アトロピンも低血圧や徐脈に対症療法的に使われる。
しかしTTXによる中毒死は絶えない。日本国内での中毒例/死亡例は1965年が152/88、1970年が73/33、1980年が90/15、1990年が55/1、2000年が40/0、2007年が38/2と報告されている。最近の死亡例の低下は医療技術の改良を反映している。にもかかわらず中毒例が多いのは、少量の卵巣や肝臓をたべていわゆるnumb feeling を味わおうとする人が絶えないからである。
臨床への応用
TTXを臨床に応用すべく、いろいろ試みられているが、まだ試験段階で臨床に使われるまでには至っていない。大部分の試みはTTXの強力かつ選択的なNa+チャネル阻害作用を利用するものである。ひとつの大きな障害は副作用、特に低血圧である。臨床への応用の数例を次に述べる。
TTX抵抗性Na+チャネルは痛みを中枢に伝えるC繊維に分布しているので、TTX抵抗性Na+チャネルを阻害してTTX感受性Na+チャネルを阻害しない化合物が見つかれば、副作用を伴わずに痛みを抑制することが出来ると考えられる。In vitroの実験では見つかっているものもあるが、まだ臨床的には成功していない。脳梗塞に伴う虚血にも神経保護薬として試みられている。TTXが神経末端を阻害して虚血に伴うグルタミン酸の神経末端からの放出を抑制するというのがそのアイデアである。TTXに対するモノクローナル抗体の作成も試みられて、ある程度の成功が報告されている。癌に伴う痛みに対して、非常な低濃度のTTXの筋肉内注射が長い間有効であるという報告もある。
参考文献
引用文献
- ↑
NARAHASHI, T., DEGUCHI, T., URAKAWA, N., & OHKUBO, Y. (1960).
Stabilization and rectification of muscle fiber membrane by tetrodotoxin. The American journal of physiology, 198, 934-8. [PubMed:14426011] [WorldCat] [DOI] - ↑
NARAHASHI, T., MOORE, J.W., & SCOTT, W.R. (1964).
TETRODOTOXIN BLOCKAGE OF SODIUM CONDUCTANCE INCREASE IN LOBSTER GIANT AXONS. The Journal of general physiology, 47, 965-74. [PubMed:14155438] [PMC] [WorldCat] [DOI]
その他
Hwang, D.F., & Noguchi, T. (2007).
Tetrodotoxin poisoning. Advances in food and nutrition research, 52, 141-236.
[PubMed:17425946]
[WorldCat]
[DOI]
Narahashi, T. (2008).
Tetrodotoxin: a brief history. Proceedings of the Japan Academy. Series B, Physical and biological sciences, 84(5), 147-54.
[PubMed:18941294]
[PMC]
[WorldCat]
[DOI]
Noguchi, T., & Arakawa, O. (2008).
Tetrodotoxin--distribution and accumulation in aquatic organisms, and cases of human intoxication. Marine drugs, 6(2), 220-42.
[PubMed:18728726]
[PMC]
[WorldCat]
[DOI]
Toshi Narahashi
Pharmacology of tetrodotoxin.
Journal of Toxicology - Toxin Reviews: 2001, 20, 67-84.
Mari Yotsu-Yamashita
Chemistry of puffer fish toxin.
Journal of Toxicology – Toxin Reviews: 2001, 20, 51-66.
(執筆者:楢橋敏夫、編集委員:林 康紀)
- テンプレート呼び出しで引数が重複しているページ
- Chemical pages without CAS Registry Number
- Articles without EBI source
- Chemical pages without ChemSpiderID
- Chemical pages without DrugBank identifier
- Articles without KEGG source
- Articles without InChI source
- Articles without UNII source
- Pages using Chem molar mass with unsupported parameters