「ミエリン関連糖タンパク質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の17版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/sakurai-2-takeshi/ 櫻井 武]</font><br> | |||
''京都大学大学院医学研究科 メディカルイノベーションセンター''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年2月24日 原稿完成日:2015年1月16日<br> | |||
担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | |||
</div> | |||
{{PBB|geneid=4099}} | {{PBB|geneid=4099}} | ||
英語名:Myelin associated | 英語名:Myelin associated glycoprotein 略語:MAG 別名:Siglec-4 | ||
{{box|text= | |||
分子量約100kDaの[[ミエリン]]画分に存在する膜糖タンパク質で、[[免疫グロブリンドメイン]]をもつ細胞接着因子である。ミエリン形成における[[軸索]]ー[[グリア]]相互作用に関与する分子であるが、最近、中枢神経における神経再生の阻害に関わるミエリンインヒビターの一つとしても注目されている。 | |||
}} | |||
==研究の歴史== | |||
ミエリン画分に存在するタンパク質の一つとして生化学的に研究された。1987年に3つのグループがミエリン関連糖タンパク質の[[wikipedia:JA:cDNA|cDNA]]クローニングを行った。少し遅れて日本でも宮武らのグループがヒトのcDNAのクローニングを報告した。 1994年に[[wikipedia:JA:ノックアウトマウス|ノックアウトマウス]]が2つのグループによって報告され<ref><pubmed>7519026</pubmed></ref><ref><pubmed>7516497</pubmed></ref>、その結果よりミエリン関連糖タンパク質はミエリン化された神経の構造の維持に重要であると考えられている<ref><pubmed>11827985</pubmed></ref>(後述)。 | |||
1994年に2つのグループからミエリン関連糖タンパク質がミエリンインヒビターではないかという報告がなされ<ref><pubmed>7524558</pubmed></ref><ref><pubmed>7522484</pubmed></ref>、その後、2つのグループがミエリン関連糖タンパク質がミエリンインヒビターのNogoに対するNogo受容体のリガンドであることを明らかにした<ref><pubmed>12160746</pubmed></ref><ref><pubmed>12089450</pubmed></ref>(後述)。 | |||
== | ==構造== | ||
分子量約100kDaの[[中枢神経系]]、[[末梢神経系]]の両方の[[ミエリン]]画分に存在する膜糖タンパク質である。ミエリンタンパク質の中では比較的マイナーなタンパク質であるが、ミエリンに存在する糖画分の約30%がミエリン関連糖タンパク質上の糖鎖に由来する。L2/HNK-1抗体で認識される[[wikipedia:JA:抗原|抗原]]構造を有する糖鎖を持つ。細胞外領域は5つの免疫グロブリンドメインからなり、膜貫通領域そして細胞内領域を持つ。 | |||
[[wikipedia:JA:選択的スプライシング|選択的スプライシング]]による細胞内領域の異なるアイソフォームが存在し、主にL(Large)型とS(Small)型からなるが、糖付加の違いによる更なるアイソフォームも存在する。発生段階では中枢ではL型が主であるが、末梢ではS型が主である。成体においてはS型が中枢、末梢の両者で主である<ref><pubmed>1716323</pubmed></ref>。 | |||
==ファミリー== | |||
ミエリン関連糖タンパク質は別名Siglec-4とも呼ばれSIGLECファミリーに属する[[wikipedia:JA:シアル酸|シアル酸]]に結合する活性を有するタンパク質である事も明らかにされた<ref><pubmed>12464312</pubmed></ref>。 | |||
[[ | |||
==発現== | |||
中枢神経系ではオリゴデンドロサイト、末梢神経系ではシュワン細胞に発現している。 | |||
==機能== | |||
In vitroの活性からミエリン関連糖タンパク質は細胞接着因子であることが明らかにされ、また、ミエリン関連糖タンパク質がシュワン細胞がミエリン形成を開始する際の神経の軸索に接する部分の突起の所に局在することから、ミエリン形成における[[軸索]]ー[[グリア]]相互作用に関与する重要な分子であることが予想されていた<ref><pubmed>10625334</pubmed></ref><ref><pubmed>17241126</pubmed></ref>。 梅森らは、[[チロシンキナーゼ]]のc−fynがL-MAGに結合していて、ミエリン形成の初期に[[チロシンリン酸化]]がみられること及び、L-MAGをクロスリンクすることによってc-fynが活性化されることを報告し、ミエリン関連糖タンパク質とfynがミエリン形成に重要であることを示唆していた<ref><pubmed>7509042</pubmed></ref>。 | |||
[[Image:mag1.png|thumb|right||350px|'''図1.ミエリン形成された神経軸索の模式図''']] | |||
1994年に[[wikipedia:JA:ノックアウトマウス|ノックアウトマウス]]が2つのグループによって報告され、in vitroの結果から予測されたようなドラスティックな異常はみられず、ミエリン形成がほとんど正常におこっていたことから、研究者を非常にがっかりさせた。しかしながら、そのマウスでは[[脱髄]]のあとの回復が遅れていたことから、ミエリン関連糖タンパク質はおそらく[[神経再生]]においてのミエリン形成には重要なのではないかと考えられた<ref><pubmed>7519026</pubmed></ref><ref><pubmed>7516497</pubmed></ref>。また、ミエリン関連糖タンパク質ノックアウトマウスにおいては別の分子がその機能を代償しているのではないかと考えられた。事実、ミエリン関連糖タンパク質と[[wikipedia:JA:ガラクト脂質合成酵素|ガラクト脂質合成酵素]](ミエリン関連糖タンパク質に結合するシアル酸の合成酵素)のダブルノックアウトマウスでは[[ランビェ絞輪|ノード]]とパラノードの形成はおこるものの、その構造の維持がおこらないことから、ミエリン関連糖タンパク質はこのようなミエリン化された神経の構造の維持に重要であると考えられている(図1)<ref><pubmed>11827985</pubmed></ref>。 | |||
== | === ミエリンインヒビターとしての論争 === | ||
Martin Schwabらは彼らの長年の研究からミエリンに神経の成長を抑制する分子が存在すると考え、ミエリンアソシエイティドインヒビターとしてその単離を試みていた。1994年に2つのグループから実はミエリン関連糖タンパク質がそのミエリンインヒビターではないかという報告がされた<ref><pubmed>7524558</pubmed></ref><ref><pubmed>7522484</pubmed></ref>。一つはモントリオールのAlbert Aguayoの流れを汲むSam Davidのグループとミエリン研究グループの共同研究であり、もう一つはニューヨークのMarie Filbinのグループである。どちらも、データとしては確固たるものであったが、in vitroのデータをもとにしたものであった。それに対して、Schwabのグループはミエリン関連糖タンパク質ノックアウトマウスを作ったグループと共同で、ノックアウトマウスのミエリンでもまだインヒビターの活性があることから、ミエリンインヒビターはミエリン関連糖タンパク質ではないという反論の論文をすぐさまだした<ref><pubmed>8845160</pubmed></ref>。 それに対して、Sam Davidのグループは地道にそれに対する反論の論文をだしていき、また、Marie Filbinのグループもミエリン関連糖タンパク質の神経成長抑制の活性についての解析の論文をだしていった。そうこうしているうちに、Schwabと一緒に論文を書いていたミエリン関連糖タンパク質ノックアウトマウスを作製したグループもSchwabを抜きに、ミエリン関連糖タンパク質ノックアウトマウスでは神経再生の促進がみられるという論文をだし、実はミエリン関連糖タンパク質もミエリンインヒビターの一つではないかということを示唆していた<ref><pubmed>8663987</pubmed></ref>。 | |||
=== 実はNogo受容体のリガンドだった === | |||
[[Image:mag2.png|thumb|right|350px|'''図2.ミエリン関連糖タンパク質とその受容体によるシグナル系路''']] | |||
Schwabのグループはその後も生化学的に彼らのミエリンインヒビターの精製と同定を進めていた。その彼らの発表した部分アミノ酸配列をもとに2000年に3つのグループがこの分子の同定を発表し、Nogoと呼ばれたこの分子はミエリン関連糖タンパク質とは構造的に異なるものであった。その後、2001年に[[Nogo]]のクローニングを行った3つのグループの1つであるSteven StrittmatterのグループによってNogo受容体が同定された。その後、2002年にStrittmatterのグループとFilbinのグループが実はミエリン関連糖タンパク質もNogo受容体のリガンドであることを明らかにした<ref><pubmed>12160746</pubmed></ref><ref><pubmed>12089450</pubmed></ref>。 また、山下らはミエリン関連糖タンパク質の神経成長阻害の活性はp75を介しておこることを示していたが、その数ヶ月後に実はNogo受容体は[[p75]]と結合しミエリン関連糖タンパク質を含むNogoリガンドはp75を通じて神経成長阻害を示すことが別の2つのグループによって明らかにされた<ref><pubmed>12426574</pubmed></ref><ref><pubmed>12422217</pubmed></ref>。つまり、ミエリンインヒビターには幾つかのものがあり、ミエリン関連糖タンパク質もその一つで、Nogo受容体とp75を介して神経成長を抑制するということである(図2)。このミエリン関連糖タンパク質の活性と[[シグナル]]系路が正常のミエリン形成等においてどのような機能を果たしているかについてははっきりしていない。Nogoを含むミエリンインヒビターについてはその項を参照されたい。 | |||
== 疾患との関係 == | == 疾患との関係 == | ||
ミエリン関連糖タンパク質に対する抗体(特にIgM)は末梢性の[[ニューロパチー]]に関与していることが知られている<ref><pubmed>20842571</pubmed></ref>。これはミエリン関連糖タンパク質に抗原性の高い糖鎖が付着していることによるのかもしれない。抗体の存在は病態のマーカーともなりうるし、また、治療の対象ともなると考えられる。 | |||
| 38行目: | 61行目: | ||
* [[Nogo]] | * [[Nogo]] | ||
* [[ミエリンインヒビター]] | * [[ミエリンインヒビター]] | ||
* [[ | * [[ミエリン塩基タンパク質]] | ||
* [[PLP]] | * [[PLP]] | ||
* [[P0]] | * [[P0]] | ||
| 44行目: | 67行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2015年1月16日 (金) 13:00時点における最新版
櫻井 武
京都大学大学院医学研究科 メディカルイノベーションセンター
DOI:10.14931/bsd.572 原稿受付日:2012年2月24日 原稿完成日:2015年1月16日
担当編集委員:上口 裕之(独立行政法人理化学研究所 脳科学総合研究センター)
| Myelin associated glycoprotein | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | MAG; GMA; S-MAG; SIGLEC-4A; SIGLEC4A | ||||||||||||
| External IDs | OMIM: 159460 HomoloGene: 1771 GeneCards: MAG Gene | ||||||||||||
| |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 4099 | 17136 | |||||||||||
| Ensembl | ENSG00000105695 | ENSMUSG00000036634 | |||||||||||
| UniProt | P20916 | P20917 | |||||||||||
| RefSeq (mRNA) | n/a | NM_010758.2 | |||||||||||
| RefSeq (protein) | n/a | NP_034888.1 | |||||||||||
| Location (UCSC) |
Chr 19: 35.78 – 35.8 Mb |
Chr 7: 31.68 – 31.7 Mb | |||||||||||
| PubMed search | [1] | [2] | |||||||||||
英語名:Myelin associated glycoprotein 略語:MAG 別名:Siglec-4
分子量約100kDaのミエリン画分に存在する膜糖タンパク質で、免疫グロブリンドメインをもつ細胞接着因子である。ミエリン形成における軸索ーグリア相互作用に関与する分子であるが、最近、中枢神経における神経再生の阻害に関わるミエリンインヒビターの一つとしても注目されている。
研究の歴史
ミエリン画分に存在するタンパク質の一つとして生化学的に研究された。1987年に3つのグループがミエリン関連糖タンパク質のcDNAクローニングを行った。少し遅れて日本でも宮武らのグループがヒトのcDNAのクローニングを報告した。 1994年にノックアウトマウスが2つのグループによって報告され[1][2]、その結果よりミエリン関連糖タンパク質はミエリン化された神経の構造の維持に重要であると考えられている[3](後述)。
1994年に2つのグループからミエリン関連糖タンパク質がミエリンインヒビターではないかという報告がなされ[4][5]、その後、2つのグループがミエリン関連糖タンパク質がミエリンインヒビターのNogoに対するNogo受容体のリガンドであることを明らかにした[6][7](後述)。
構造
分子量約100kDaの中枢神経系、末梢神経系の両方のミエリン画分に存在する膜糖タンパク質である。ミエリンタンパク質の中では比較的マイナーなタンパク質であるが、ミエリンに存在する糖画分の約30%がミエリン関連糖タンパク質上の糖鎖に由来する。L2/HNK-1抗体で認識される抗原構造を有する糖鎖を持つ。細胞外領域は5つの免疫グロブリンドメインからなり、膜貫通領域そして細胞内領域を持つ。
選択的スプライシングによる細胞内領域の異なるアイソフォームが存在し、主にL(Large)型とS(Small)型からなるが、糖付加の違いによる更なるアイソフォームも存在する。発生段階では中枢ではL型が主であるが、末梢ではS型が主である。成体においてはS型が中枢、末梢の両者で主である[8]。
ファミリー
ミエリン関連糖タンパク質は別名Siglec-4とも呼ばれSIGLECファミリーに属するシアル酸に結合する活性を有するタンパク質である事も明らかにされた[9]。
発現
中枢神経系ではオリゴデンドロサイト、末梢神経系ではシュワン細胞に発現している。
機能
In vitroの活性からミエリン関連糖タンパク質は細胞接着因子であることが明らかにされ、また、ミエリン関連糖タンパク質がシュワン細胞がミエリン形成を開始する際の神経の軸索に接する部分の突起の所に局在することから、ミエリン形成における軸索ーグリア相互作用に関与する重要な分子であることが予想されていた[10][11]。 梅森らは、チロシンキナーゼのc−fynがL-MAGに結合していて、ミエリン形成の初期にチロシンリン酸化がみられること及び、L-MAGをクロスリンクすることによってc-fynが活性化されることを報告し、ミエリン関連糖タンパク質とfynがミエリン形成に重要であることを示唆していた[12]。
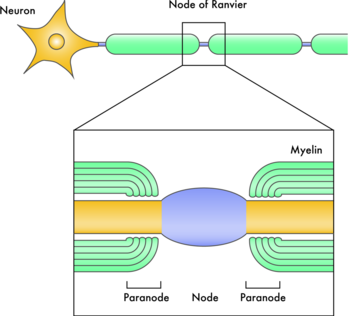
1994年にノックアウトマウスが2つのグループによって報告され、in vitroの結果から予測されたようなドラスティックな異常はみられず、ミエリン形成がほとんど正常におこっていたことから、研究者を非常にがっかりさせた。しかしながら、そのマウスでは脱髄のあとの回復が遅れていたことから、ミエリン関連糖タンパク質はおそらく神経再生においてのミエリン形成には重要なのではないかと考えられた[13][14]。また、ミエリン関連糖タンパク質ノックアウトマウスにおいては別の分子がその機能を代償しているのではないかと考えられた。事実、ミエリン関連糖タンパク質とガラクト脂質合成酵素(ミエリン関連糖タンパク質に結合するシアル酸の合成酵素)のダブルノックアウトマウスではノードとパラノードの形成はおこるものの、その構造の維持がおこらないことから、ミエリン関連糖タンパク質はこのようなミエリン化された神経の構造の維持に重要であると考えられている(図1)[15]。
ミエリンインヒビターとしての論争
Martin Schwabらは彼らの長年の研究からミエリンに神経の成長を抑制する分子が存在すると考え、ミエリンアソシエイティドインヒビターとしてその単離を試みていた。1994年に2つのグループから実はミエリン関連糖タンパク質がそのミエリンインヒビターではないかという報告がされた[16][17]。一つはモントリオールのAlbert Aguayoの流れを汲むSam Davidのグループとミエリン研究グループの共同研究であり、もう一つはニューヨークのMarie Filbinのグループである。どちらも、データとしては確固たるものであったが、in vitroのデータをもとにしたものであった。それに対して、Schwabのグループはミエリン関連糖タンパク質ノックアウトマウスを作ったグループと共同で、ノックアウトマウスのミエリンでもまだインヒビターの活性があることから、ミエリンインヒビターはミエリン関連糖タンパク質ではないという反論の論文をすぐさまだした[18]。 それに対して、Sam Davidのグループは地道にそれに対する反論の論文をだしていき、また、Marie Filbinのグループもミエリン関連糖タンパク質の神経成長抑制の活性についての解析の論文をだしていった。そうこうしているうちに、Schwabと一緒に論文を書いていたミエリン関連糖タンパク質ノックアウトマウスを作製したグループもSchwabを抜きに、ミエリン関連糖タンパク質ノックアウトマウスでは神経再生の促進がみられるという論文をだし、実はミエリン関連糖タンパク質もミエリンインヒビターの一つではないかということを示唆していた[19]。
実はNogo受容体のリガンドだった
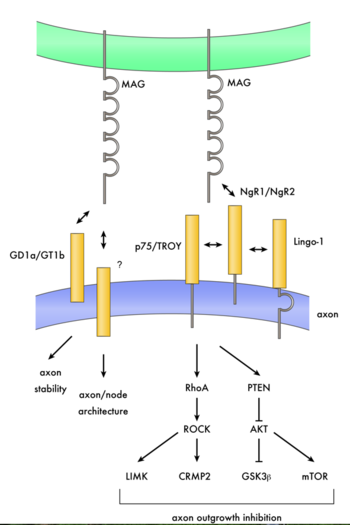
Schwabのグループはその後も生化学的に彼らのミエリンインヒビターの精製と同定を進めていた。その彼らの発表した部分アミノ酸配列をもとに2000年に3つのグループがこの分子の同定を発表し、Nogoと呼ばれたこの分子はミエリン関連糖タンパク質とは構造的に異なるものであった。その後、2001年にNogoのクローニングを行った3つのグループの1つであるSteven StrittmatterのグループによってNogo受容体が同定された。その後、2002年にStrittmatterのグループとFilbinのグループが実はミエリン関連糖タンパク質もNogo受容体のリガンドであることを明らかにした[20][21]。 また、山下らはミエリン関連糖タンパク質の神経成長阻害の活性はp75を介しておこることを示していたが、その数ヶ月後に実はNogo受容体はp75と結合しミエリン関連糖タンパク質を含むNogoリガンドはp75を通じて神経成長阻害を示すことが別の2つのグループによって明らかにされた[22][23]。つまり、ミエリンインヒビターには幾つかのものがあり、ミエリン関連糖タンパク質もその一つで、Nogo受容体とp75を介して神経成長を抑制するということである(図2)。このミエリン関連糖タンパク質の活性とシグナル系路が正常のミエリン形成等においてどのような機能を果たしているかについてははっきりしていない。Nogoを含むミエリンインヒビターについてはその項を参照されたい。
疾患との関係
ミエリン関連糖タンパク質に対する抗体(特にIgM)は末梢性のニューロパチーに関与していることが知られている[24]。これはミエリン関連糖タンパク質に抗原性の高い糖鎖が付着していることによるのかもしれない。抗体の存在は病態のマーカーともなりうるし、また、治療の対象ともなると考えられる。
関連項目
参考文献
- ↑
Montag, D., Giese, K.P., Bartsch, U., Martini, R., Lang, Y., Blüthmann, H., ..., & Nave, K.A. (1994).
Mice deficient for the myelin-associated glycoprotein show subtle abnormalities in myelin. Neuron, 13(1), 229-46. [PubMed:7519026] [WorldCat] [DOI] - ↑
Li, C., Tropak, M.B., Gerlai, R., Clapoff, S., Abramow-Newerly, W., Trapp, B., ..., & Roder, J. (1994).
Myelination in the absence of myelin-associated glycoprotein. Nature, 369(6483), 747-50. [PubMed:7516497] [WorldCat] [DOI] - ↑
Marcus, J., Dupree, J.L., & Popko, B. (2002).
Myelin-associated glycoprotein and myelin galactolipids stabilize developing axo-glial interactions. The Journal of cell biology, 156(3), 567-77. [PubMed:11827985] [PMC] [WorldCat] [DOI] - ↑
McKerracher, L., David, S., Jackson, D.L., Kottis, V., Dunn, R.J., & Braun, P.E. (1994).
Identification of myelin-associated glycoprotein as a major myelin-derived inhibitor of neurite growth. Neuron, 13(4), 805-11. [PubMed:7524558] [WorldCat] [DOI] - ↑
Mukhopadhyay, G., Doherty, P., Walsh, F.S., Crocker, P.R., & Filbin, M.T. (1994).
A novel role for myelin-associated glycoprotein as an inhibitor of axonal regeneration. Neuron, 13(3), 757-67. [PubMed:7522484] [WorldCat] [DOI] - ↑
Domeniconi, M., Cao, Z., Spencer, T., Sivasankaran, R., Wang, K., Nikulina, E., ..., & Filbin, M. (2002).
Myelin-associated glycoprotein interacts with the Nogo66 receptor to inhibit neurite outgrowth. Neuron, 35(2), 283-90. [PubMed:12160746] [WorldCat] [DOI] - ↑
Liu, B.P., Fournier, A., GrandPré, T., & Strittmatter, S.M. (2002).
Myelin-associated glycoprotein as a functional ligand for the Nogo-66 receptor. Science (New York, N.Y.), 297(5584), 1190-3. [PubMed:12089450] [WorldCat] [DOI] - ↑
Pedraza, L., Frey, A.B., Hempstead, B.L., Colman, D.R., & Salzer, J.L. (1991).
Differential expression of MAG isoforms during development. Journal of neuroscience research, 29(2), 141-8. [PubMed:1716323] [WorldCat] [DOI] - ↑
Crocker, P.R. (2002).
Siglecs: sialic-acid-binding immunoglobulin-like lectins in cell-cell interactions and signalling. Current opinion in structural biology, 12(5), 609-15. [PubMed:12464312] [WorldCat] - ↑
Schachner, M., & Bartsch, U. (2000).
Multiple functions of the myelin-associated glycoprotein MAG (siglec-4a) in formation and maintenance of myelin. Glia, 29(2), 154-65. [PubMed:10625334] [WorldCat] - ↑
Quarles, R.H. (2007).
Myelin-associated glycoprotein (MAG): past, present and beyond. Journal of neurochemistry, 100(6), 1431-48. [PubMed:17241126] [WorldCat] [DOI] - ↑
Umemori, H., Sato, S., Yagi, T., Aizawa, S., & Yamamoto, T. (1994).
Initial events of myelination involve Fyn tyrosine kinase signalling. Nature, 367(6463), 572-6. [PubMed:7509042] [WorldCat] [DOI] - ↑
Montag, D., Giese, K.P., Bartsch, U., Martini, R., Lang, Y., Blüthmann, H., ..., & Nave, K.A. (1994).
Mice deficient for the myelin-associated glycoprotein show subtle abnormalities in myelin. Neuron, 13(1), 229-46. [PubMed:7519026] [WorldCat] [DOI] - ↑
Li, C., Tropak, M.B., Gerlai, R., Clapoff, S., Abramow-Newerly, W., Trapp, B., ..., & Roder, J. (1994).
Myelination in the absence of myelin-associated glycoprotein. Nature, 369(6483), 747-50. [PubMed:7516497] [WorldCat] [DOI] - ↑
Marcus, J., Dupree, J.L., & Popko, B. (2002).
Myelin-associated glycoprotein and myelin galactolipids stabilize developing axo-glial interactions. The Journal of cell biology, 156(3), 567-77. [PubMed:11827985] [PMC] [WorldCat] [DOI] - ↑
McKerracher, L., David, S., Jackson, D.L., Kottis, V., Dunn, R.J., & Braun, P.E. (1994).
Identification of myelin-associated glycoprotein as a major myelin-derived inhibitor of neurite growth. Neuron, 13(4), 805-11. [PubMed:7524558] [WorldCat] [DOI] - ↑
Mukhopadhyay, G., Doherty, P., Walsh, F.S., Crocker, P.R., & Filbin, M.T. (1994).
A novel role for myelin-associated glycoprotein as an inhibitor of axonal regeneration. Neuron, 13(3), 757-67. [PubMed:7522484] [WorldCat] [DOI] - ↑
Bartsch, U., Bandtlow, C.E., Schnell, L., Bartsch, S., Spillmann, A.A., Rubin, B.P., ..., & Schachner, M. (1995).
Lack of evidence that myelin-associated glycoprotein is a major inhibitor of axonal regeneration in the CNS. Neuron, 15(6), 1375-81. [PubMed:8845160] [WorldCat] [DOI] - ↑
Schäfer, M., Fruttiger, M., Montag, D., Schachner, M., & Martini, R. (1996).
Disruption of the gene for the myelin-associated glycoprotein improves axonal regrowth along myelin in C57BL/Wlds mice. Neuron, 16(6), 1107-13. [PubMed:8663987] [WorldCat] [DOI] - ↑
Domeniconi, M., Cao, Z., Spencer, T., Sivasankaran, R., Wang, K., Nikulina, E., ..., & Filbin, M. (2002).
Myelin-associated glycoprotein interacts with the Nogo66 receptor to inhibit neurite outgrowth. Neuron, 35(2), 283-90. [PubMed:12160746] [WorldCat] [DOI] - ↑
Liu, B.P., Fournier, A., GrandPré, T., & Strittmatter, S.M. (2002).
Myelin-associated glycoprotein as a functional ligand for the Nogo-66 receptor. Science (New York, N.Y.), 297(5584), 1190-3. [PubMed:12089450] [WorldCat] [DOI] - ↑
Wong, S.T., Henley, J.R., Kanning, K.C., Huang, K.H., Bothwell, M., & Poo, M.M. (2002).
A p75(NTR) and Nogo receptor complex mediates repulsive signaling by myelin-associated glycoprotein. Nature neuroscience, 5(12), 1302-8. [PubMed:12426574] [WorldCat] [DOI] - ↑
Wang, K.C., Kim, J.A., Sivasankaran, R., Segal, R., & He, Z. (2002).
P75 interacts with the Nogo receptor as a co-receptor for Nogo, MAG and OMgp. Nature, 420(6911), 74-8. [PubMed:12422217] [WorldCat] [DOI] - ↑
Dalakas, M.C. (2010).
Pathogenesis and Treatment of Anti-MAG Neuropathy. Current treatment options in neurology, 12(2), 71-83. [PubMed:20842571] [WorldCat] [DOI]