「Dab1」の版間の差分
Takaohonda (トーク | 投稿記録) 細編集の要約なし |
Takaohonda (トーク | 投稿記録) 細編集の要約なし |
||
| 7行目: | 7行目: | ||
| MGIid = | | MGIid = | ||
| Symbol = DAB1 | | Symbol = DAB1 | ||
| AltSymbols = | | AltSymbols = | ||
| IUPHAR = | | IUPHAR = | ||
| ChEMBL = | | ChEMBL = | ||
| 40行目: | 40行目: | ||
| path = PBB/1600 | | path = PBB/1600 | ||
}} | }} | ||
英語名:Disabled-1、英略語:Dab1 | 英語名:Disabled-1、英略語:Dab1 | ||
==要約== | == 要約 == | ||
イントロダクション(背景、歴史的推移など)<br> HowellらはSrcに結合するタンパク質を酵母two-hybrid法で探索し、それまで未知でたった遺伝子がsrcと結合する事を見いだし、Drosophilaで同定されていたdisabled-1遺伝子と相同性があった為、mouse disabled-1 (mDab1)と命名した。mDab1は | イントロダクション(背景、歴史的推移など)<br> HowellらはSrcに結合するタンパク質を酵母two-hybrid法で探索し、それまで未知でたった遺伝子がsrcと結合する事を見いだし、Drosophilaで同定されていたdisabled-1遺伝子と相同性があった為、mouse disabled-1 (mDab1)と命名した。mDab1は | ||
<br> | |||
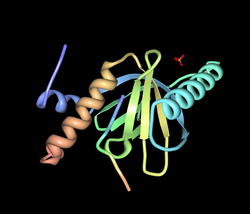
== 分子構造 == | |||
マウスではオルタナティブスプライシングにより13種のバリアントが存在することが報告されているが、発達過程の中枢神経系では555アミノ酸を持つバリアント、Dab1 555が最も多く発現している。Dab1 (Dab1 555)はN末端側からPhosphotyrosine-binding (PTB) domain、チロシンリン酸化部位を持つ細胞内タンパク質である。PTBドメインは、細胞内ドメインにNPxYモチーフを持つ膜タンパク質と結合する。この結合にはNPxYモチーフのチロシン残基のリン酸化は必要としない。PTBドメインにはplekstrin homology (PH)ドメイン様構造が含まれており、細胞膜のリン脂質(PtdIns4P and PtdIns4,5P2)に結合し、Dab1を細胞膜にアンカリングする。また、PTBドメインのN末端側には核移行シグナル(Nuclear localization Signal: NLS)、PTBドメインのC末端側に二つの核外移行シグナル(Nuclear Export Signal: NES)を持っており、核と細胞質間を移行する能力を有している。PTBドメインのC末端側、分子の中程にチロシンリン酸化を受ける部位が5カ所同定されており、このうちの4つがシグナルの伝達に重要な役割を果たしている事が明らかにされている。4つのチロシンリン酸化サイトは配列の相同性からYQXI配列を持つ2つとYXVP配列を持つ二つに分けられる。 | マウスではオルタナティブスプライシングにより13種のバリアントが存在することが報告されているが、発達過程の中枢神経系では555アミノ酸を持つバリアント、Dab1 555が最も多く発現している。Dab1 (Dab1 555)はN末端側からPhosphotyrosine-binding (PTB) domain、チロシンリン酸化部位を持つ細胞内タンパク質である。PTBドメインは、細胞内ドメインにNPxYモチーフを持つ膜タンパク質と結合する。この結合にはNPxYモチーフのチロシン残基のリン酸化は必要としない。PTBドメインにはplekstrin homology (PH)ドメイン様構造が含まれており、細胞膜のリン脂質(PtdIns4P and PtdIns4,5P2)に結合し、Dab1を細胞膜にアンカリングする。また、PTBドメインのN末端側には核移行シグナル(Nuclear localization Signal: NLS)、PTBドメインのC末端側に二つの核外移行シグナル(Nuclear Export Signal: NES)を持っており、核と細胞質間を移行する能力を有している。PTBドメインのC末端側、分子の中程にチロシンリン酸化を受ける部位が5カ所同定されており、このうちの4つがシグナルの伝達に重要な役割を果たしている事が明らかにされている。4つのチロシンリン酸化サイトは配列の相同性からYQXI配列を持つ2つとYXVP配列を持つ二つに分けられる。 | ||
<br> | |||
==発現分布== | == 発現分布 == | ||
==機能== | == 機能 == | ||
1997年になり、dab1の変異マウスの作成、及び自然発症変異マウスyotari, scramblerの原因遺伝子がdab1であることが報告され、dab1が大脳新皮質、海馬、小脳、脳幹の神経核等、中枢神経系の発生に必須の遺伝子である事が明らかになった。大脳新皮質のニューロンは、脳室帯で誕生後、脳の表面方向に移動し、プレプレートの間に入り込んで、辺縁帯直下で移動を終了し、最終分化を行なう。誕生時期の早いニューロンは遅生まれのニューロンに追い越され、ニューロンがいわゆる“インサイドアウト”と呼ばれるパターンで配置される。プレプレートのスプリッティングが起こらず、誕生したニューロンは脳表面から順番に深層に積み重なって行き、異常な層構造を形成するようになる。この変異は1951年、Falconarによって最初に報告されたreelerマウスで見られる脳の層構造異常と全く同一な表現型であった(リーラーフェノタイプ)。この事からDab1はReelinシグナルを細胞内で伝達する分子と考えられた。2000年になり、TrommdorfらがApoER2とVLDLRのダブルノックアウトマウスを作成したところ、リーラーフェノタイプになることが明らかになり、さらに生化学的結合実験により、ApoER2とVLDLRがReelinのレセプターであることが示された。またApoER2とVLDLRの細胞内ドメインのNPxYモチーフにはDab1が結合出来る事が示され、Dab1はReelinシグナルをApoER2、VLDLRを介して受け取る事が示唆された。<br> Howellらは活性化型SrcとDab1を培養細胞に発現させ、チロシンリン酸化を受ける可能性のある5つのチロシンを全てフェニルアラニンに変異させた所、チロシンリン酸化がほぼ検出出来なくなる事から、Dab1のチロシンリン酸化部位を同定した。この5つのチロシンリン酸化部位全てをフェニルアラニンに変異させたノックインマウスを作成した所、リーラーフェノタイプになる事から、Dab1のチロシンリン酸化はReelinシグナルにとって必須であることが明らかになった。<br> チロシンリン酸化部位のReelinシグナルにおける重要性から、様々な研究者により、チロシンリン酸化されたDab1への結合タンパク質の同定が試みられ、PI3K、SOCS3、Nckbeta、Lis1、SFKs、Crkファミリータンパク質等、様々なタンパク質が同定された。このうちCrk及び、Srcのノックアウトマウスでリーラフェノタイプが示された。<br> | 1997年になり、dab1の変異マウスの作成、及び自然発症変異マウスyotari, scramblerの原因遺伝子がdab1であることが報告され、dab1が大脳新皮質、海馬、小脳、脳幹の神経核等、中枢神経系の発生に必須の遺伝子である事が明らかになった。大脳新皮質のニューロンは、脳室帯で誕生後、脳の表面方向に移動し、プレプレートの間に入り込んで、辺縁帯直下で移動を終了し、最終分化を行なう。誕生時期の早いニューロンは遅生まれのニューロンに追い越され、ニューロンがいわゆる“インサイドアウト”と呼ばれるパターンで配置される。プレプレートのスプリッティングが起こらず、誕生したニューロンは脳表面から順番に深層に積み重なって行き、異常な層構造を形成するようになる。この変異は1951年、Falconarによって最初に報告されたreelerマウスで見られる脳の層構造異常と全く同一な表現型であった(リーラーフェノタイプ)。この事からDab1はReelinシグナルを細胞内で伝達する分子と考えられた。2000年になり、TrommdorfらがApoER2とVLDLRのダブルノックアウトマウスを作成したところ、リーラーフェノタイプになることが明らかになり、さらに生化学的結合実験により、ApoER2とVLDLRがReelinのレセプターであることが示された。またApoER2とVLDLRの細胞内ドメインのNPxYモチーフにはDab1が結合出来る事が示され、Dab1はReelinシグナルをApoER2、VLDLRを介して受け取る事が示唆された。<br> Howellらは活性化型SrcとDab1を培養細胞に発現させ、チロシンリン酸化を受ける可能性のある5つのチロシンを全てフェニルアラニンに変異させた所、チロシンリン酸化がほぼ検出出来なくなる事から、Dab1のチロシンリン酸化部位を同定した。この5つのチロシンリン酸化部位全てをフェニルアラニンに変異させたノックインマウスを作成した所、リーラーフェノタイプになる事から、Dab1のチロシンリン酸化はReelinシグナルにとって必須であることが明らかになった。<br> チロシンリン酸化部位のReelinシグナルにおける重要性から、様々な研究者により、チロシンリン酸化されたDab1への結合タンパク質の同定が試みられ、PI3K、SOCS3、Nckbeta、Lis1、SFKs、Crkファミリータンパク質等、様々なタンパク質が同定された。このうちCrk及び、Srcのノックアウトマウスでリーラフェノタイプが示された。<br> | ||
| 68行目: | 70行目: | ||
レスキュー | レスキュー | ||
==結合タンパク質== | == 結合タンパク質 == | ||
== 関連事項 == | |||
==参考文献== | Reelin, ApoER2, VLDLR | ||
== 参考文献 == | |||
(執筆者:本田岳夫、仲嶋一範、担当編集委員:大隅典子) | (執筆者:本田岳夫、仲嶋一範、担当編集委員:大隅典子) | ||
2013年1月8日 (火) 22:45時点における版
英語名:Disabled-1、英略語:Dab1
要約
イントロダクション(背景、歴史的推移など)
HowellらはSrcに結合するタンパク質を酵母two-hybrid法で探索し、それまで未知でたった遺伝子がsrcと結合する事を見いだし、Drosophilaで同定されていたdisabled-1遺伝子と相同性があった為、mouse disabled-1 (mDab1)と命名した。mDab1は
分子構造
マウスではオルタナティブスプライシングにより13種のバリアントが存在することが報告されているが、発達過程の中枢神経系では555アミノ酸を持つバリアント、Dab1 555が最も多く発現している。Dab1 (Dab1 555)はN末端側からPhosphotyrosine-binding (PTB) domain、チロシンリン酸化部位を持つ細胞内タンパク質である。PTBドメインは、細胞内ドメインにNPxYモチーフを持つ膜タンパク質と結合する。この結合にはNPxYモチーフのチロシン残基のリン酸化は必要としない。PTBドメインにはplekstrin homology (PH)ドメイン様構造が含まれており、細胞膜のリン脂質(PtdIns4P and PtdIns4,5P2)に結合し、Dab1を細胞膜にアンカリングする。また、PTBドメインのN末端側には核移行シグナル(Nuclear localization Signal: NLS)、PTBドメインのC末端側に二つの核外移行シグナル(Nuclear Export Signal: NES)を持っており、核と細胞質間を移行する能力を有している。PTBドメインのC末端側、分子の中程にチロシンリン酸化を受ける部位が5カ所同定されており、このうちの4つがシグナルの伝達に重要な役割を果たしている事が明らかにされている。4つのチロシンリン酸化サイトは配列の相同性からYQXI配列を持つ2つとYXVP配列を持つ二つに分けられる。
発現分布
機能
1997年になり、dab1の変異マウスの作成、及び自然発症変異マウスyotari, scramblerの原因遺伝子がdab1であることが報告され、dab1が大脳新皮質、海馬、小脳、脳幹の神経核等、中枢神経系の発生に必須の遺伝子である事が明らかになった。大脳新皮質のニューロンは、脳室帯で誕生後、脳の表面方向に移動し、プレプレートの間に入り込んで、辺縁帯直下で移動を終了し、最終分化を行なう。誕生時期の早いニューロンは遅生まれのニューロンに追い越され、ニューロンがいわゆる“インサイドアウト”と呼ばれるパターンで配置される。プレプレートのスプリッティングが起こらず、誕生したニューロンは脳表面から順番に深層に積み重なって行き、異常な層構造を形成するようになる。この変異は1951年、Falconarによって最初に報告されたreelerマウスで見られる脳の層構造異常と全く同一な表現型であった(リーラーフェノタイプ)。この事からDab1はReelinシグナルを細胞内で伝達する分子と考えられた。2000年になり、TrommdorfらがApoER2とVLDLRのダブルノックアウトマウスを作成したところ、リーラーフェノタイプになることが明らかになり、さらに生化学的結合実験により、ApoER2とVLDLRがReelinのレセプターであることが示された。またApoER2とVLDLRの細胞内ドメインのNPxYモチーフにはDab1が結合出来る事が示され、Dab1はReelinシグナルをApoER2、VLDLRを介して受け取る事が示唆された。
Howellらは活性化型SrcとDab1を培養細胞に発現させ、チロシンリン酸化を受ける可能性のある5つのチロシンを全てフェニルアラニンに変異させた所、チロシンリン酸化がほぼ検出出来なくなる事から、Dab1のチロシンリン酸化部位を同定した。この5つのチロシンリン酸化部位全てをフェニルアラニンに変異させたノックインマウスを作成した所、リーラーフェノタイプになる事から、Dab1のチロシンリン酸化はReelinシグナルにとって必須であることが明らかになった。
チロシンリン酸化部位のReelinシグナルにおける重要性から、様々な研究者により、チロシンリン酸化されたDab1への結合タンパク質の同定が試みられ、PI3K、SOCS3、Nckbeta、Lis1、SFKs、Crkファミリータンパク質等、様々なタンパク質が同定された。このうちCrk及び、Srcのノックアウトマウスでリーラフェノタイプが示された。
自然発症変異マウス及び、ノックアウトマウス
5Fノックイン
キメラ
レスキュー
結合タンパク質
関連事項
Reelin, ApoER2, VLDLR
参考文献
(執筆者:本田岳夫、仲嶋一範、担当編集委員:大隅典子)