「塩素チャネル」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 36行目: | 36行目: | ||
=== ClC塩素チャネル === | === ClC塩素チャネル === | ||
[[Image:ClC.JPG|right|623x182px|'''図1 ClCチャネル'''<br> 1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ([8]より転載)。]] | |||
ClCチャネルは、1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質に共通のものと考えられている。チャネルとCl<sup>-</sup>/H<sup>+</sup>-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。 | [[Image:ClC.JPG|right|623x182px|thumb|'''図1 ClCチャネル'''<br> 1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ([8]より転載)。]] ClCチャネルは、1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質に共通のものと考えられている。チャネルとCl<sup>-</sup>/H<sup>+</sup>-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。 | ||
=== カルシウム依存性塩素チャネル === | === カルシウム依存性塩素チャネル === | ||
2013年3月5日 (火) 22:01時点における版
英: chloride channel
同義語/関連語: アニオンチャネル、塩素イオンチャネル、クロライドチャネル、Cl−チャネル
塩素チャネルは細胞膜に組み込まれたイオンチャネルの一種で、主に塩化物イオン(Cl−)を受動的に透過させる。ほとんどの塩素チャネルは、Cl−以外のI−・Br−・F−等の無機陰イオン(アニオン)にも透過性を示し、またNO3−・SCN−・HCO3−やグルタミン酸・アスパラギン酸等のアミノ酸アニオンにも透過性を示すものも多いことから、一般にアニオンチャネルとも呼ばれる。細胞膜電位・細胞内カルシウムイオン濃度・細胞容積の変化や、リガンドの結合あるいはcAMP依存性のリン酸化反応に応答して開口する塩素チャネルがある。神経系において最もよく知られる塩素チャネルは、神経細胞の興奮・抑制調節に関与するリガンド作動性塩素チャネル(GABAA受容体、GABAC受容体、グリシン受容体)であるが、このチャネルについては他項目(グリシン受容体、GABA受容体)を参照されたい。リガンド作動性以外の塩素チャネルについて、現在のところ特異的な阻害薬がほとんど無い。塩素チャネルは神経系を含むあらゆる種類の細胞に発現し、膜電位や細胞容積の調節、細胞の移動・増殖や細胞死(アポトーシス)、分泌などの細胞の基本機能に広く関与しており、チャネル異常による遺伝性疾患も数多く知られている。
種類
哺乳類の神経系に発現している塩素チャネルは以下の5つに大別される。
ClC塩素チャネル
塩素チャネルとして最初にシビレエイ(学名 Torpedo marmorata)の発電器官からクローニングされた遺伝子ファミリーに属するものである[1]。哺乳類では9種類知られており、そのうち神経系に発現が知られているのは主にClC-2・-3・-4・-6・-7である。ClC-2は主に形質膜に分布して電位感受性塩素チャネルとして機能し、その他のClC-3・-4・-6・-7は主に細胞内小胞膜に分布し、チャネルというよりは、むしろCl-/H+-交換輸送体として機能すると考えられている。
カルシウム依存性塩素チャネル(calcium-activated chloride channel; CaCC)
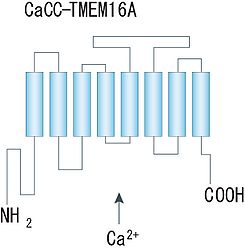
細胞内Ca2+濃度の上昇に応じて活性化される塩素チャネルである。古くから神経系の細胞を含む様々な細胞種で確認されていた最も典型的なCaCCの主な責任分子が、近年Anoctamin/TMEM16ファミリーのAno1/TMEM16A及びAno2/TMEM16Bであることが確定した[2][3]。また、卵黄状黄斑ジストロフィ(ベスト病)の原因遺伝子として主に網膜色素上皮に発現し、神経系全般にも或る程度の発現が認められているBestrophinファミリー(Best1-4)もCaCC活性を持つことが知られている[4]。(なお、かつてCaCCの候補として挙げられていたCLCA及びTTYHファミリーのCaCCとしての機能については、現在否定的な見解が占める。)
細胞容積感受性塩素チャネル (volume-regulated chloride channel)
典型的には細胞容積の増大に伴い開口する塩素チャネルである。神経系の細胞を含むあらゆる細胞種で容積増大により最も多く活性化されるのが、細胞容積感受性外向整流性アニオンチャネル(volume-sensitive outwardly rectifying anion channel; VSOR)と呼ばれるものであるが、その分子実体はまだ解明されていない[5]。その他、マキシアニオンチャネル(maxi-anion channel)[6]と呼ばれるものや、上述のClC-2・Best1も容積感受性があることが知られている。
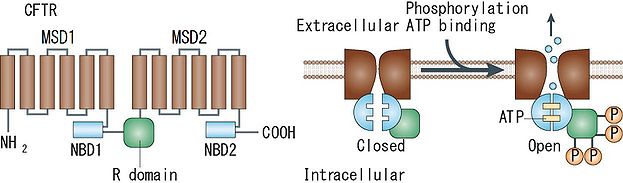
CFTR(cystic fibrosis transmembrane conductance regulator)塩素チャネル
嚢胞性線維症(cystic fibrosis)の原因遺伝子として同定されたCFTRは、神経系でも或る程度の発現が報告されている。cAMP依存性リン酸化酵素(PKA)によるリン酸化を通じて活性化される塩素チャネルである[7]。
リガンド作動性塩素チャネル
他項目(グリシン受容体、GABA受容体)を参照。
構造
ClC塩素チャネル
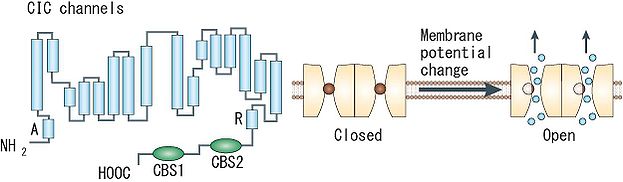
1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ([8]より転載)。
ClCチャネルは、1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質に共通のものと考えられている。チャネルとCl-/H+-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。
カルシウム依存性塩素チャネル
Anoctamin/TMEM16ファミリー
Ano1/TMEM16Aについては、近年二量体を形成していることが示され、アミノ酸疎水性度の解析から、各サブユニットは8回膜貫通領域を持ち、細胞質側に大きなN末端とC末端から成る構造物を持つことが示唆されている。ポア領域やCa2+結合部位及び電位センサー部位は未だ同定されていないが、他のCa2+依存性・電位依存性イオンチャネルでよく知られる構造との類似性は認められていない。
リー === ヒトでは4種類のbestrophinチャネルをコードする遺伝子 (BEST1, BEST2, BEST3, BEST4)が同定されている。C末端側に酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるカルシウム結合部位がある。ヒトBest1はカルシウムイオン結合後にN末とC末領域の相互作用が起こり活性化する。 === anoctamin/TMEM16ファミリー === anoctamin/TMEM16ファミリーは近年カルシウム依存性塩素チャネルの候補として同定された塩素チャネルである。Ano1(TMEM16A)およびAno2 (TMEM16B)はカルシウム
依存的に塩化物イオンを透過させる性質を持つことが証明されている。 === tweetyファミリー === ショウジョウバエ(Drosophila)のflightless遺伝子座に存在するTweety遺伝子のヒトホモログ遺伝子として同定されたtweetyファミリー(ヒト:TTYH1, TTYH2, TTYH3) もカルシウム依存的に塩化物イオンを透過させる性質を持つ。 == CFTR == CFTRは12回膜貫通型糖タンパク質であり、6 個の疎水性膜貫通構造と 2 個の ATP 結合部(nucleotide-binding domain, NBD)および PKA によるリン酸化を受ける調節(R)ドメインの繰り返しモチーフから構成される。Rドメインがリン酸化を受けた状態でNBDの二量体化に伴ってチャネルゲートが開き、NBD二量体の解離によってチャネルゲートが閉じると考
えられている。 =
機能 = 神経系において塩素チャネルは、細胞内外の塩化物イオンを電気化学的な勾配に沿って透過させることにより、細胞容積調節、静止膜電位の形成や安定化、細胞の興奮性を調節する。容積依存性塩素チャネルは、神経細胞やグリア細胞からATPやグルタミン酸、アスパラギン酸、タウリンなどの低分子物質を放出するメカニズムに関与する。塩素チャネルは、これらの調節を介して細胞周期・細胞移動・形態形成(突起伸展など)・細胞死の調節など多様な細胞機能に寄与する。 == 電位依存性塩素チャネル(ClCチャネル) == これまでに神経系で発現しチャネルとして機能することが報告されているClCチャネルの生理機能とその役割について紹介する。 === ClC-2 === ClC-2は、細胞膨張時や膜電位の過分極時、細胞外pHの減少によって活性化される内向き整流性塩素チャネルである。神経細胞の興奮性を調節することが示唆されている。ヒトCLCN-2の遺伝子異常は特発性全般性てんかんの原因となることが報告されている。 === ClC-3 === 外向き整流性塩素チャネルであるClC-3は一般的にはCl-/H+-交換輸送体として機能して(小胞内にH+を蓄積して)、神経伝達物質の放出に関与することが知られる。細胞の種類によっては形質膜で塩素チャネルとして働き、神経細胞の活動を制御する可能性を示唆する報告もある(報告例:海馬神経細胞, Wang et al., 2006, Neuron)。 == カルシウム依存性塩素チャネル == 嗅球の感覚神経の嗅毛ではカルシウム依存性塩素チャネルが、におい物質により惹起される脱分極性の電流の発生に関与することが知られる。このGタンパク質共役型受容体の刺激に伴って活性化される塩素チャネルとしてAno1とAno2が重要な役割を担う(Stephan et al, 2009, PNAS)。 近年小脳バーグマングリアからGABAを放出して小脳顆粒細胞のtonic GABA作用を生じさせる分子もbestrophinファミリーに属する塩素チャネルである
ことが報告された (Lee et al, 2010, Science<ref><pubmed>20929730</pubmed></ref>)。 == CFTR == 脳の神経系においてCFTRの生理的な機能についてはよく分かっていない。 == 容量感受性塩素チャネル == 容積感受性外向整流性(VSOR) 塩素チャネルは、細胞膨張後の調節性容積減少(regulatory volume decrease)に関与する。この塩素チャネルは外向き整流性でI-の方がCl-より高いイオン透過選択性を示すが、この特性を持つ塩素チャネルの分子実体はまだ同定されていない。 = 発現 = 基本的に塩素チャネルは齧歯類の脳でユビキタスに発現する。ClC-2は大脳皮質、海馬、嗅球や小脳における大型ニューロンに強く発現する(Clayton et al, 1998)。ClC-3は海馬、小脳、嗅球に強く発現する(Kawasaki et al, 1994)。マウスClCaファミリーは嗅球に特徴的な強い発現がみられる(Piirsoo et al, 2009) 。 {| border="1" cellspacing="1" cellpadding="1" width="1000" |- | | 遮断薬(阻害剤) | シングルチャネル
コンダクタンス (pS) | イオン選択性 | 関連するヒトの疾患 |- | CFTR | CFTR(inh)-172
グリベンクラミド
ロニダミン
DPC | 5-8 | Br- > Cl- > I- | 嚢胞性線維症 |- | CLCA | タルニフルメート
ジチオスレイトール
DIDS
ニフルミン酸
CLCN2:若年性ミオクロニーてんかん
CLCNKB:バーター症候群
CLCN5:遺伝性腎疾患(Dent病、低リン血症性くる病、X染色体連鎖劣性腎結石症)
CLCN7:大理石骨病 |- | VSOR塩素チャネル | DCPIB
DNDS
DIDS
NPPB
SITS
タモキシフェン | | I- > Cl- | |} ※ 注釈 9AC:9-アントラセンカルボン酸 (9-anthracene-carboxylic acid) CPP:3-(4-クロロフェノキシ)プロパン酸 (p-chlorophenoxy-propionic acid) DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid DIDS:4,4-ジイソチオシアナトスチルベン-2,2-ジスルホン酸, 二ナトリウム塩(4,4′-Diisothiocyanatostilbene-2,2′-disulfonic acid disodium salt hydrate) DNDS:4,4'-ジニトロスチルベン-2,2'-ジスルホン酸二ナトリウム(4,4'-dinitrostilbene-2,2'-disulfonate) NPPB:2-[(3-フェニルプロピル)アミノ]-5-ニトロ安息香 (Nitro-2-(3-phenylpropylamino)benzoic acid) SITS:4-アセチルアミノ-4'-イソチオシアナトスチルベン-2,2'-ジスルホン酸ジナトリウム(4-Acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid disodium salt hydrate) THIP:4,5,6,7-テトラヒドロイソオキサゾロ[5,4-c]ピリジン-3(2H)-オン•塩酸塩(4,5,6,7-Tetrahydroisoxazolo[5,4-c]pyridin-3-ol hydrochloride) TPMPA:(1,2,5,6-テトラヒドロピリジン-4-イル)メチルホスフィン酸((1,2,5,6-Tetrahydropyridin-4-yl)methylphosphinic acid)
参考文献 [1][2][3][4][5][6][7][8][9][10][11]
- ↑ Clayton GH, Staley KJ, Wilcox CL, Owens GC and Smith RL (1998) Developmental expression of ClC-2 in the rat nervous system. Dev Brain Res 108: 307-318
- ↑ Duran C, Thompson CH, Xiao Q and Hartzell HC (2010) Chloride channels: often enigmatic, rarely predictable. Annu Rev Physiol 72: 95-121
- ↑ Jentsch TJ, Steinmeyer K and Schwarz G. (1990) Primary structure of Torpedo marmorata chloride channel isolated by expression cloning in Xenopus oocytes. Nature 348: 510-4
- ↑ Jentsch TJ (2008) CLC chloride channels and transporters: from genes to protein structure, pathology and physiology. Crit Rev Biochem Mol Biol 43: 3-36
- ↑ Kawasaki M, Uchida S, Monkawa T, Miyawaki A, Mikoshiba K, Marumo F and Sasaki S (1994) Cloning and expression of a protein kinase C-regulated chloride channel abundantly expressed in rat brain neuronal cells. Neuron 12: 597-604.
- ↑ Lee S, Yoon BE, Berglund K, Oh SJ, Park H, Shin HS, Augustine GJ and Lee CJ. (2010) Channel-mediated tonic GABA release from glia. Science 330: 790-6
- ↑ Okada Y, Sato K, and Numata T (2009) Pathophysiology and puzzles of the volume-sensitive outwardly rectifying anion channel J Physiol 587: 2141-2149
- ↑ Piirsoo M, Meijer D and Timmusk T (2009) Expression analysis of the CLCA gene family in mouse and human with emphasis on the nervous system. BMC Dev Biol 9:10
- ↑ Stephan AB, Shum EY, Hirsh S, Cygnar KD, Reisert J and Zhao H. (2009) ANO2 is the cilial calcium-activated chloride channel that may mediate olfactory amplification. Proc Natl Acad Sci U S A 106: 11776-81
- ↑ Verkman AS and Galietta LJV (2009) Chloride channels as drug targets. Nat Rev Drug Discov 8: 153-171
- ↑ Wang XQ, Deriy LV, Foss S, Huang P, Lamb FS, Kaetzel MA, Bindokas V, Marks JD and Nelson DJ. (2006) CLC-3 channels modulate excitatory synaptic transmission in hippocampal neurons. Neuron 52: 321-33
(執筆者:秋田天平、熊田竜郎、福田敦夫 担当編集委員:林康紀)