「島」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 12行目: | 12行目: | ||
}} | }} | ||
[[image:insula.jpg|thumb|350px| | [[image:insula.jpg|thumb|350px|'''図.右大脳半球のシルビウス裂に沿って、頭頂・前頭弁蓋と側頭弁蓋を切り開いたところ'''<BR>図の右が前頭部、左が後頭部。ピンクに着色してあるのが島。]] | ||
== 歴史 == | == 歴史 == | ||
2013年11月12日 (火) 11:45時点における版
設楽 宗孝、水挽 貴至
筑波大学医学医療系生命医科学域、大学院人間総合科学研究科感性認知脳科学専攻システム脳科学分野
DOI XXXX/XXXX 原稿受付日:2013年11月1日 原稿完成日:2013年月日
担当編集委員:伊佐 正(自然科学研究機構生理学研究所)
同義語:島皮質 insular cortex
霊長類の島はシルビウス裂内奥に位置し、前頭葉、側頭葉、頭頂葉、基底核に囲まれた領域である。島はBroadmanのarea 13から16に相当する。組織学的には、前腹側部に顆粒細胞層を欠く無顆粒島が、その後背側部に亜顆粒島が、さらにその後背側部に全ての層構造が明瞭な顆粒島が分布する。前部島では行動発現、知覚、内受容、情動など、認知機能に関する活動がみられ、後部島では認知機能への関与は少ないとされる。島の活動は、味覚、嗅覚、触覚、痛覚などに加え、報酬、社会的な痛み、情動、社会的情動、共感、内臓覚、内受容や自己意識にまで関係しているという仮説がある。臨床的には、種々の精神神経疾患との関連が示唆されている。
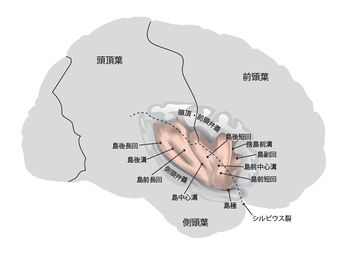
図の右が前頭部、左が後頭部。ピンクに着色してあるのが島。
歴史
Johan Christian Reilは、1796年に Exercitationum anatomicarum fasciculus primus de structura nervorumを発表、その中で第5の葉の存在を指摘した。これが島に関する初の学術的な記述である。しかし記述は本文のみにとどめられ、図示されなかった。Reilの発見した島は、現在も重版中のGray解剖学書で初めて図示され、「Reilの島」という呼称を不朽のものとした[1]。
Reilは島を高次精神機能の責任中枢ととらえた。奇しくも現在、内受容や、情動、共感、自己意識などの高次機能に関わる部位として注目されている。しかしそうした機能に関して、ニューロンレベルでの情報処理過程の解明は進んでいない。
構造
発生
胎生期、島は最も早く発達する皮質である[2]。ヒト胎生6週、始原終脳は尾側下方へと発達し始める。この発達方向は14週から16週に回転を伴って吻側へと転じ、回転先端は側頭葉へと分化する。胎生3-4か月頃、終脳の螺旋状の発達が形成する裂は、シルビウス裂として確認でき[3] [4]、島は内奥に埋没してゆく。この頃、島中心溝があらわとなり、これを境に前部と、前部に比し狭小な後部とに分けられるようになる[3]。
肉眼解剖
霊長類の島はシルビウス裂内奥に位置し、前頭葉、側頭葉、頭頂葉、基底核に囲まれる(図)。ヒトなどの大型霊長類では、島極には前頭島皮質(frontoinsular cortex)が存在し、眼窩前頭葉と接する[5]。脳に占める島の体積の割合はヒトが1.2-1.7%、ゴリラ1.1-1.7%、オランウータン1-1.5%であり、テナガザル0.9-1.1%と比して3割程度大きい[6]。滑脳性の動物(げっ歯類など)の島は大脳半球の表面に露出し、嗅脳溝の上方に位置する。前下方は眼窩皮質と、背尾側は感覚皮質と接している[5]。サルにおいて島中心溝は明らかではなく[7]、便宜的に亜顆粒領域(後述)の中央で前部と後部に二分する[8]。ヒト前部島には3つの短い脳回を、後部島には2つの長い脳回を認めるが、個人差が大きいとされる。またサルにおいてはこれらを認めない[3]。島はBroadmanのarea 13から16に相当する(Brodman 1909)。
組織
霊長類の島の細胞構築学的構成は共通している[9]。前腹側部に顆粒細胞層を欠く無顆粒島(agranular insula)が、その後背側部に亜顆粒島(dysgranular insula)が、さらにその後背側部に全ての層構造が明瞭な顆粒島(granular insula)が分布する[9]。げっ歯類の島では、前方と後方に無顆粒皮質が、背側と腹側に顆粒皮質が分布する[5]。
前部帯状皮質と前頭島皮質の第V層には、単一の基底樹状突起しかもたない紡錘形の大型二極性ニューロンが存在し、spindle cell(紡錘細胞)ないしvon Economo neuron (VEN)と呼ばれる[10]。VENは、自己意識が発達する4歳以降のヒトや、大型類人猿の島に多く存在する[11]。また、自閉症圏の患者やピック病患者、下等な霊長類の島などではVENは少ないとされたこともあり、VENが共感や自己意識を担うという仮説がある[10]。一方、これまではVENが存在しないとされたマカクザルの島でも最近VENが発見されたこと[12]、自己意識の指標とされるマークテスト(鏡に映った動物自身の姿を手掛かりに、事前に体表に書き込まれたマークに注意を向けるかどうかを調べる)に、VENを欠くある種の鳥類がパスすることなどは、上記の仮説に矛盾する[13] [14]。
島の直下には島皮質と並行して前障(claustrum)が広がっている。島の第Ⅶ層とされたこともあったが、発生起源、機能、神経線維連絡は島と異なり、別の神経組織とされる[15]。
神経線維連絡
島は神経管発達の初期に形成された神経線維連絡を保ったままシルビウス裂へと埋没するので、広範囲の脳領域と神経線維連絡を有する[8]。島は傍辺縁系に属し、とりわけ辺縁系の各領域と多くの神経線維連絡を有する。トレーサーを用いた実験[8] [16] [7]によれば、無顆粒島は、眼窩前頭前野 (13a)、正中前頭前野(25、32)、前部帯状皮質(24a、24bの腹側)などと神経線維連絡を有し、これらの領域も無顆粒皮質である。無顆粒島はこのほかに、嗅内皮質、海馬、扁桃体基底核、線条体中央部(背外側領域と正中腹側領域の間)などとも神経線維連絡を有する。亜顆粒島は、眼窩前頭前野(11、12、13m、13l)、帯状皮質(23b、24bの背側、24c下方)などと神経線維連絡を有し、これらの領域も亜顆粒皮質である。亜顆粒島はこのほかに線条体中央部とも神経線維連絡を有する。顆粒島は、帯状皮質のうち顆粒層を認める領域(23c、24c、31)のほかに、体性感覚野、運動野、線条体背外側領域などと神経線維連絡を有する。また島の全ての区画は、前頭前野、傍嗅皮質、前中心弁蓋部、傍島皮質、側頭極、下部側頭葉正中部などと神経線維連絡を有する。
機能
従来、島は、その機能区分に基づき、前部と後部に分けられるとされてきた。メタアナリシス研究によれば、前部島では行動発現、知覚、内受容、情動など、認知機能に関する活動がみられ、後部島では認知機能への関与は少ないという[17]。近年のMRIを用いた研究において、島は運動感覚領野と結合する後部、前部帯状皮質背側部と結合する背側前中部、前部帯状皮質pregenual領域(脳梁より前端付近)と結合する腹側前部の、3つに機能的に分けられるという意見もある[18]。
味覚
前部島皮質は一次味覚野である。前部島皮質は視床後内側腹側核小細胞部(VPMpc)から味覚に関する情報を受けとる[19]。味覚は、有限個の基本味覚の組み合わせからなり、特定の基本味覚に選好性をもつ島ニューロンの活動が、異なる程度で複数組み合わさることで味覚の多様性を表現しているとされる[20] [21]。カニクイザル前部島皮質内の、亜顆粒島前背側部では、嗅覚や視覚、口腔内の触覚などには影響を受けないユニモーダルな活動を示す味覚ニューロンが見つかっている[20]。またアカゲザルの一次味覚野には味覚以外の感覚(舌触り)に反応するニューロンがあるものの[22]、嗅覚などに反応するニューロンは存在せず、嗅覚と味覚との統合は眼窩前頭葉にて行われるという主張がある[21]。一方、ラットを用いた単一ニューロン活動記録実験によれば、味覚野のニューロンが味覚ばかりでなく体性感覚や嗅覚などにも反応していたという報告もある[23]。島の味覚ニューロンがマルチモーダルかユニモーダルかという問題については、検討の余地を残している。
嗅覚
嗅球からもたらされる嗅覚信号は、一次味覚野より前方の眼窩前頭葉後縁に近い無顆粒島に送られる[24]。覚醒ヒトの前部島を電気刺激すると、嗅覚が誘発される[25]。空腹下での嗅覚刺激や、刺激の強さや質の弁別の賦課で、島が活動する[26] [27]。霊長類の島における単一ニューロンレベルの嗅覚情報処理過程は解明されていない。
痛覚、社会的な痛み
サルでは、痛みの伝達に関わる線維は、脊髄後角第Ⅰ層から始まり脊髄視床路を上向し、視床後外側腹側核(VPL)、後内側腹側核(VPM)、下後腹側核(VPI)、内側腹側核の後部(VMpo)に終端する。これらの核は第一次・第二次体性感覚野や島に投射する。島に送られる痛み刺激の大部分は、VMpoを経由する。ヒトでは視床の小細胞性の副尾側核(Vcpc)から前部島への投射も痛みの伝達に関与している[28]。また島は、前部帯状皮質や中脳水道周囲灰白質などと「痛みネットワーク」を組織する[29]。身体的な痛みのみならず、 疎外、死別[30]、不公正な処遇(Harlé et al 2012)などの社会的な痛みでも活動する[29]。社会的な痛みと情動とは分離不可能である。同様に、身体的な痛みもまた、感覚であると同時に情動であり[31]、かつ恐怖や不安とは本質的に異なる情動であるとされる[32]。島は、痛みの感覚・情動両面を担う。両側島が障害されても、痛みの感覚的側面は体性感覚野で代償される。しかし情動的側面は代償されず、感覚と情動の乖離が起こる(疼痛表象不能、後述)。身体に生じた痛みの知覚のみならず、将来の痛み刺激の予測でも、島は活動する[32] [33]。痛みそのものの知覚には後部島が[28]、痛み刺激の予測にはより吻側が関与する[32] [34]。覚醒ヒトの島を電気刺激すると、後部島の刺激で身体的な痛みが、より吻側の刺激では温覚など痛み以外の感覚が誘発される[35]。催眠暗示で誘発された痛みでも島は活動する[34]。他者の身体への侵襲でも島の活動は変化し[36]、これは共感の神経基盤とされる。
情動、社会的情動、共感
情動が生起すると島は活動する[37]。情動の脆弱性(不快感や無力感、不適当感などを自覚しやすいパーソナリティ傾向)が高いと、前部島の活動が誘発されやすい[38]。島は、喜怒哀楽のうち特定の情動に反応するのか、複数の情動に反応するのか(笑い声と泣き声の両方に反応、[39]、諸家の見解は一致しない。また単純な喜怒哀楽に限らず、複雑な情動体験、例えば音楽により生じた感動でも、島が活動する[40]。
古典的定義によれば、情動とは心理状態と身体覚醒度が互いに影響しあう、心身相互作用の産物である(James 1884, Damasio 1999, [41]。身体覚醒度は内受容(後述)を介して知覚され、前部島で表象されるという仮説がある[42] [43]。事実、前部島は情動の生起と内受容の知覚の両方で活動する[44]。前部島は社会的情動(社会的文脈に依存し他人との関わりで生ずる情動)でも活動する[45]。実子の顔を提示すると島中央部[46]や前部島[47]が活動し、恋人の顔を提示すると島中央部が活動する(Bartels and Zeki 2000)。島は共感にも関わり[48]、他者の情動を内的に模倣すると活動する[49]。アカゲザル前部島尾側への電気刺激で社会的情動(威嚇行動が制止され、実験者による威嚇でも、唇をすぼめ小刻みに開閉するなどの仲直り行動)が誘発される[50]。
触覚、その他の体性感覚
亜顆粒島や顆粒島、後島皮質(後部島皮質より尾側) は、第二次体性感覚野と神経線維連絡を有し、触覚に関する情報を受容する[16]。島は手指の皮膚の振動や[51]、物体表面の細かな凹凸の触知[52]、複雑な形状の物体の触知[53]で活動する。島中央部ないしは後部島の活動は手指の冷覚の程度と相関する[54]、前部島の活動は温覚の程度と相関する[55]との報告もある。サル島には、頬部や四肢末端の皮膚への触覚刺激に反応するニューロンがある[56]。
内臓覚と内受容、自己意識
脊髄神経や迷走神経を経由した内臓覚は、孤束核、傍小脳脚核、視床後内側腹側核(VPM)を経由して島へと伝達され[42]、島は口腔より下部の消化管の内臓覚も担う。覚醒下のヒト島を電気刺激すると多様な消化管感覚を生ずる[25]。バルーンを用いた食道刺激や[57] [58]、直腸刺激[59]、肛門括約筋の努力性収縮(Kern et al 2003)でも島が活動する。島は心拍の知覚にも関与し[60] [61] [44]、サル島には心拍数と関係したニューロン活動がある[56]。
20世紀初頭、Charles Sherringtonは、内臓覚、温痛覚、掻痒感、筋固有覚、空腹、口渇などは、自己の身体状態の知覚に必須な感覚であるとした。のちにWilliam Jamesは、身体状態の知覚が自己意識や情動の生起に重要であると唱えた。Sherringtonは内臓覚のみを内受容(interoception)と定義したが、現在この定義は拡張され、身体状態の知覚に関わる感覚全てを包括する[42] [43]。内受容は、視床腹側基底核群を経た後、島に直接ないし体性感覚野を経由して伝達される。このため島は自己意識の座であるという仮説がある[42] [43]。島の損傷に伴う病態失認は自己意識の障害で説明できる[62]。また自分自身の姿か他人の姿かを判断する際に前部島が活動することが知られている[63]。なお自己意識は、前部島と前部帯状皮質の協調産物であるとの説と[64]、前部帯状皮質とは独立した島独自の機能であるとの説がある[42]。
リスク
リスクのいかなる側面に対して島が活動するのかについて、諸家の意見は様々である。損害回避傾向や神経症性などのパーソナリティ指標が高いと、リスク回避行動が顕著となり、これらは島の活動と相関する[65]。また、前部島の活動はリスクの予測やリスクの予測誤差と相関する[66] [48]。一方、リスクを伴わない意思決定やリスク回避行動の直前[67]や、リスクを伴う意思決定や意思決定の結果実際に損害を被らずに済んだ場合[68]などに活動するという報告もある。
報酬
痛みと報酬の独立したネットワークが存在するという主張によれば、島は「痛みネットワーク」に属するという[29]。一方、報酬に関連した活動を認めるという報告がある。ヒト島は、報酬の条件刺激に[69] [70]、金銭報酬と金銭損失の両方に[71]、金銭報酬の期待に[72]対して活動し、活動の強さは金銭報酬の予測額と相関する[73]という。一方金銭報酬の予測額と逆相関するという報告もある(Rolls et al 2007)。島は社会的報酬(褒められるなど)にも反応する[74]。公正でないプレイヤーの処罰[75]、慈善行為[76] [77]、他人への信頼[78] [79]、恋人や実子の顔(情動を参照)でも活動し、これらも社会的報酬への反応とみなせる。マカクザルの後部島[80]や前部島[81]には、報酬に反応する単一ニューロンが存在する。前部島では、ごく近い将来の差し迫った報酬の期待・可能性に関係したニューロン活動が見つかっている[81]。
発語、言語
1861年、Brocaは、左前頭葉に梗塞巣を有する症例から、運動性失語の責任領域を決定したが、その後、運動性言語の中枢はさらに広範に及ぶことが指摘され、現在では左前部島も運動性言語中枢に含むという説がある[82]。
臨床
島の過剰な活動が、肥満患者における旺盛な食欲の原因であるという説がある[83]。一方、島の活動が抑制されると離人症性障害を生ずるという説がある[84] [85]。またごく稀に両側島が障害されると、例えば針で突き刺されたとき、それが鋭い尖ったものによる刺激だと理解はできても、恐怖や嫌悪、自律神経反応、逃避反応などは消失する。こうした痛みにおける感覚と情動の乖離は疼痛表象不能と呼ばれる[86]。染色体17p11.2が欠損し、精神発達遅滞や多動、痛み反応の減弱などを伴うSmith-Magenis症候群では、島の灰白質密度が低下するなどの異常が認められる[87]。島は内受容によって薬物希求を表象するとされる。このためマリファナ[88]やコカイン[89] [90]の濫用患者の島は、薬物希求が高まると活動する。一方、島の損傷によってタバコの濫用が軽快・消失したり[91]、ラットの島を不活化させるとアンフェタミン希求が減弱したりするとされる[92]。パニック障害の病態生理として、島の異常が想定されている。不快刺激の予測信号が増大すると不安を生ずるが、不快刺激の予測には内受容の遠心性コピーが利用されていると考えられる。内受容の変調が身体の変調として知覚されればパニック障害となる[93]。大うつ病性障害では、うつ評価尺度と島の灰白質容量の低下とに相関があるとされる[94]。また、本来は痛みに対して活動する後部に、本来は前部にしか見られない情動に対する活動領域が広がり、機能トポグラフの再構成が生じているとされる[95]。平時における島の過活動がうつ病者の認知や行動の特徴を説明できるという報告もある[96]。一方、幻聴は、音源が自身の思考由来なのか、外部環境由来なのかを判別する能力が低下し、前者を後者に誤帰属するため生ずる。統合失調症では、自己意識の座とされる前部島の灰白質容量が低下し、灰白質容量と臨床症状評価尺度との相関も認められるとされ[97]、幻聴の誤帰属仮説の傍証となっている。
参考文献
- ↑
Binder, D.K., Schaller, K., & Clusmann, H. (2007).
The seminal contributions of Johann-Christian Reil to anatomy, physiology, and psychiatry. Neurosurgery, 61(5), 1091-6; discussion 1096. [PubMed:18091285] [WorldCat] [DOI] - ↑
Wai, M.S., Shi, C., Kwong, W.H., Zhang, L., Lam, W.P., & Yew, D.T. (2008).
Development of the human insular cortex: differentiation, proliferation, cell death, and appearance of 5HT-2A receptors. Histochemistry and cell biology, 130(6), 1199-204. [PubMed:18762964] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2
Türe, U., Yaşargil, D.C., Al-Mefty, O., & Yaşargil, M.G. (1999).
Topographic anatomy of the insular region. Journal of neurosurgery, 90(4), 720-33. [PubMed:10193618] [WorldCat] [DOI] - ↑
Kalani, M.Y., Kalani, M.A., Gwinn, R., Keogh, B., & Tse, V.C. (2009).
Embryological development of the human insula and its implications for the spread and resection of insular gliomas. Neurosurgical focus, 27(2), E2. [PubMed:19645558] [WorldCat] [DOI] - ↑ 5.0 5.1 5.2
Butti, C., & Hof, P.R. (2010).
The insular cortex: a comparative perspective. Brain structure & function, 214(5-6), 477-93. [PubMed:20512368] [WorldCat] [DOI] - ↑
Semendeferi, K., & Damasio, H. (2000).
The brain and its main anatomical subdivisions in living hominoids using magnetic resonance imaging. Journal of human evolution, 38(2), 317-32. [PubMed:10656781] [WorldCat] [DOI] - ↑ 7.0 7.1
Chikama, M., McFarland, N.R., Amaral, D.G., & Haber, S.N. (1997).
Insular cortical projections to functional regions of the striatum correlate with cortical cytoarchitectonic organization in the primate. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(24), 9686-705. [PubMed:9391023] [WorldCat] - ↑ 8.0 8.1 8.2
Mesulam, M.M., & Mufson, E.J. (1982).
Insula of the old world monkey. III: Efferent cortical output and comments on function. The Journal of comparative neurology, 212(1), 38-52. [PubMed:7174907] [WorldCat] [DOI] - ↑ 9.0 9.1
Mesulam, M.M., & Mufson, E.J. (1982).
Insula of the old world monkey. I. Architectonics in the insulo-orbito-temporal component of the paralimbic brain. The Journal of comparative neurology, 212(1), 1-22. [PubMed:7174905] [WorldCat] [DOI] - ↑ 10.0 10.1
Allman, J.M., Watson, K.K., Tetreault, N.A., & Hakeem, A.Y. (2005).
Intuition and autism: a possible role for Von Economo neurons. Trends in cognitive sciences, 9(8), 367-73. [PubMed:16002323] [WorldCat] [DOI] - ↑
Nimchinsky, E.A., Gilissen, E., Allman, J.M., Perl, D.P., Erwin, J.M., & Hof, P.R. (1999).
A neuronal morphologic type unique to humans and great apes. Proceedings of the National Academy of Sciences of the United States of America, 96(9), 5268-73. [PubMed:10220455] [PMC] [WorldCat] [DOI] - ↑
Evrard, H.C., Forro, T., & Logothetis, N.K. (2012).
Von Economo neurons in the anterior insula of the macaque monkey. Neuron, 74(3), 482-9. [PubMed:22578500] [WorldCat] [DOI] - ↑
Prior, H., Schwarz, A., & Güntürkün, O. (2008).
Mirror-induced behavior in the magpie (Pica pica): evidence of self-recognition. PLoS biology, 6(8), e202. [PubMed:18715117] [PMC] [WorldCat] [DOI] - ↑
de Waal, F.B. (2008).
Putting the altruism back into altruism: the evolution of empathy. Annual review of psychology, 59, 279-300. [PubMed:17550343] [WorldCat] [DOI] - ↑
Mufson, E.J., & Mesulam, M.M. (1982).
Insula of the old world monkey. II: Afferent cortical input and comments on the claustrum. The Journal of comparative neurology, 212(1), 23-37. [PubMed:7174906] [WorldCat] [DOI] - ↑ 16.0 16.1
Friedman, D.P., Murray, E.A., O'Neill, J.B., & Mishkin, M. (1986).
Cortical connections of the somatosensory fields of the lateral sulcus of macaques: evidence for a corticolimbic pathway for touch. The Journal of comparative neurology, 252(3), 323-47. [PubMed:3793980] [WorldCat] [DOI] - ↑
Cauda, F., Costa, T., Torta, D.M., Sacco, K., D'Agata, F., Duca, S., ..., & Vercelli, A. (2012).
Meta-analytic clustering of the insular cortex: characterizing the meta-analytic connectivity of the insula when involved in active tasks. NeuroImage, 62(1), 343-55. [PubMed:22521480] [PMC] [WorldCat] [DOI] - ↑
Deen, B., Pitskel, N.B., & Pelphrey, K.A. (2011).
Three systems of insular functional connectivity identified with cluster analysis. Cerebral cortex (New York, N.Y. : 1991), 21(7), 1498-506. [PubMed:21097516] [PMC] [WorldCat] [DOI] - ↑
Pritchard, T.C., Hamilton, R.B., Morse, J.R., & Norgren, R. (1986).
Projections of thalamic gustatory and lingual areas in the monkey, Macaca fascicularis. The Journal of comparative neurology, 244(2), 213-28. [PubMed:3950095] [WorldCat] [DOI] - ↑ 20.0 20.1
Yaxley, S., Rolls, E.T., & Sienkiewicz, Z.J. (1990).
Gustatory responses of single neurons in the insula of the macaque monkey. Journal of neurophysiology, 63(4), 689-700. [PubMed:2341869] [WorldCat] [DOI] - ↑ 21.0 21.1
Kadohisa, M., Rolls, E.T., & Verhagen, J.V. (2005).
Neuronal representations of stimuli in the mouth: the primate insular taste cortex, orbitofrontal cortex and amygdala. Chemical senses, 30(5), 401-19. [PubMed:15829609] [WorldCat] [DOI] - ↑
Verhagen, J.V., Kadohisa, M., & Rolls, E.T. (2004).
Primate insular/opercular taste cortex: neuronal representations of the viscosity, fat texture, grittiness, temperature, and taste of foods. Journal of neurophysiology, 92(3), 1685-99. [PubMed:15331650] [WorldCat] [DOI] - ↑
Simon, S.A., de Araujo, I.E., Gutierrez, R., & Nicolelis, M.A. (2006).
The neural mechanisms of gustation: a distributed processing code. Nature reviews. Neuroscience, 7(11), 890-901. [PubMed:17053812] [WorldCat] [DOI] - ↑
de Araujo, I.E., Rolls, E.T., Kringelbach, M.L., McGlone, F., & Phillips, N. (2003).
Taste-olfactory convergence, and the representation of the pleasantness of flavour, in the human brain. The European journal of neuroscience, 18(7), 2059-68. [PubMed:14622239] [WorldCat] [DOI] - ↑ 25.0 25.1
PENFIELD, W., & FAULK, M.E. (1955).
The insula; further observations on its function. Brain : a journal of neurology, 78(4), 445-70. [PubMed:13293263] [WorldCat] [DOI] - ↑
Savic, I., Gulyas, B., Larsson, M., & Roland, P. (2000).
Olfactory functions are mediated by parallel and hierarchical processing. Neuron, 26(3), 735-45. [PubMed:10896168] [WorldCat] [DOI] - ↑
Gottfried, J.A., & Dolan, R.J. (2003).
The nose smells what the eye sees: crossmodal visual facilitation of human olfactory perception. Neuron, 39(2), 375-86. [PubMed:12873392] [WorldCat] [DOI] - ↑ 28.0 28.1
Treede, R.D., Apkarian, A.V., Bromm, B., Greenspan, J.D., & Lenz, F.A. (2000).
Cortical representation of pain: functional characterization of nociceptive areas near the lateral sulcus. Pain, 87(2), 113-9. [PubMed:10924804] [WorldCat] [DOI] - ↑ 29.0 29.1 29.2
Lieberman, M.D., & Eisenberger, N.I. (2009).
Neuroscience. Pains and pleasures of social life. Science (New York, N.Y.), 323(5916), 890-1. [PubMed:19213907] [WorldCat] [DOI] - ↑
Kersting, A., Ohrmann, P., Pedersen, A., Kroker, K., Samberg, D., Bauer, J., ..., & Suslow, T. (2009).
Neural activation underlying acute grief in women after the loss of an unborn child. The American journal of psychiatry, 166(12), 1402-10. [PubMed:19884226] [WorldCat] [DOI] - ↑
Price, D.D. (2000).
Psychological and neural mechanisms of the affective dimension of pain. Science (New York, N.Y.), 288(5472), 1769-72. [PubMed:10846154] [WorldCat] [DOI] - ↑ 32.0 32.1 32.2
Ploghaus, A., Tracey, I., Gati, J.S., Clare, S., Menon, R.S., Matthews, P.M., & Rawlins, J.N. (1999).
Dissociating pain from its anticipation in the human brain. Science (New York, N.Y.), 284(5422), 1979-81. [PubMed:10373114] [WorldCat] [DOI] - ↑
Porro, C.A., Baraldi, P., Pagnoni, G., Serafini, M., Facchin, P., Maieron, M., & Nichelli, P. (2002).
Does anticipation of pain affect cortical nociceptive systems? The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(8), 3206-14. [PubMed:11943821] [PMC] [WorldCat] [DOI] - ↑ 34.0 34.1
Raij, T.T., Numminen, J., Närvänen, S., Hiltunen, J., & Hari, R. (2009).
Strength of prefrontal activation predicts intensity of suggestion-induced pain. Human brain mapping, 30(9), 2890-7. [PubMed:19184995] [WorldCat] [DOI] - ↑
Ostrowsky, K., Magnin, M., Ryvlin, P., Isnard, J., Guenot, M., & Mauguière, F. (2002).
Representation of pain and somatic sensation in the human insula: a study of responses to direct electrical cortical stimulation. Cerebral cortex (New York, N.Y. : 1991), 12(4), 376-85. [PubMed:11884353] [WorldCat] [DOI] - ↑
Corradi-Dell'Acqua, C., Hofstetter, C., & Vuilleumier, P. (2011).
Felt and seen pain evoke the same local patterns of cortical activity in insular and cingulate cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(49), 17996-8006. [PubMed:22159113] [PMC] [WorldCat] [DOI] - ↑
Bermpohl, F., Pascual-Leone, A., Amedi, A., Merabet, L.B., Fregni, F., Gaab, N., ..., & Northoff, G. (2006).
Dissociable networks for the expectancy and perception of emotional stimuli in the human brain. NeuroImage, 30(2), 588-600. [PubMed:16275018] [WorldCat] [DOI] - ↑
Iaria, G., Committeri, G., Pastorelli, C., Pizzamiglio, L., Watkins, K.E., & Carota, A. (2008).
Neural activity of the anterior insula in emotional processing depends on the individuals' emotional susceptibility. Human brain mapping, 29(3), 363-73. [PubMed:17415777] [WorldCat] [DOI] - ↑
Sander, K., & Scheich, H. (2005).
Left auditory cortex and amygdala, but right insula dominance for human laughing and crying. Journal of cognitive neuroscience, 17(10), 1519-31. [PubMed:16269094] [WorldCat] [DOI] - ↑
Blood, A.J., & Zatorre, R.J. (2001).
Intensely pleasurable responses to music correlate with activity in brain regions implicated in reward and emotion. Proceedings of the National Academy of Sciences of the United States of America, 98(20), 11818-23. [PubMed:11573015] [PMC] [WorldCat] [DOI] - ↑
SCHACHTER, S., & SINGER, J.E. (1962).
Cognitive, social, and physiological determinants of emotional state. Psychological review, 69, 379-99. [PubMed:14497895] [WorldCat] [DOI] - ↑ 42.0 42.1 42.2 42.3 42.4
Craig, A.D. (2009).
How do you feel--now? The anterior insula and human awareness. Nature reviews. Neuroscience, 10(1), 59-70. [PubMed:19096369] [WorldCat] [DOI] - ↑ 43.0 43.1 43.2
Craig, A.D. (2009).
A rat is not a monkey is not a human: comment on Mogil (Nature Rev. Neurosci. 10, 283-294 (2009)). Nature reviews. Neuroscience, 10(6), 466. [PubMed:19455175] [WorldCat] [DOI] - ↑ 44.0 44.1
Zaki, J., Davis, J.I., & Ochsner, K.N. (2012).
Overlapping activity in anterior insula during interoception and emotional experience. NeuroImage, 62(1), 493-9. [PubMed:22587900] [PMC] [WorldCat] [DOI] - ↑
Lamm, C., & Singer, T. (2010).
The role of anterior insular cortex in social emotions. Brain structure & function, 214(5-6), 579-91. [PubMed:20428887] [WorldCat] [DOI] - ↑
Bartels, A., & Zeki, S. (2000).
The neural basis of romantic love. Neuroreport, 11(17), 3829-34. [PubMed:11117499] [WorldCat] [DOI] - ↑
Leibenluft, E., Gobbini, M.I., Harrison, T., & Haxby, J.V. (2004).
Mothers' neural activation in response to pictures of their children and other children. Biological psychiatry, 56(4), 225-32. [PubMed:15312809] [WorldCat] [DOI] - ↑ 48.0 48.1
Singer, T., Critchley, H.D., & Preuschoff, K. (2009).
A common role of insula in feelings, empathy and uncertainty. Trends in cognitive sciences, 13(8), 334-40. [PubMed:19643659] [WorldCat] [DOI] - ↑
Carr, L., Iacoboni, M., Dubeau, M.C., Mazziotta, J.C., & Lenzi, G.L. (2003).
Neural mechanisms of empathy in humans: a relay from neural systems for imitation to limbic areas. Proceedings of the National Academy of Sciences of the United States of America, 100(9), 5497-502. [PubMed:12682281] [PMC] [WorldCat] [DOI] - ↑
Caruana, F., Jezzini, A., Sbriscia-Fioretti, B., Rizzolatti, G., & Gallese, V. (2011).
Emotional and social behaviors elicited by electrical stimulation of the insula in the macaque monkey. Current biology : CB, 21(3), 195-9. [PubMed:21256020] [WorldCat] [DOI] - ↑
Gelnar, P.A., Krauss, B.R., Szeverenyi, N.M., & Apkarian, A.V. (1998).
Fingertip representation in the human somatosensory cortex: an fMRI study. NeuroImage, 7(4 Pt 1), 261-83. [PubMed:9626668] [WorldCat] [DOI] - ↑
Kitada, R., Hashimoto, T., Kochiyama, T., Kito, T., Okada, T., Matsumura, M., ..., & Sadato, N. (2005).
Tactile estimation of the roughness of gratings yields a graded response in the human brain: an fMRI study. NeuroImage, 25(1), 90-100. [PubMed:15734346] [WorldCat] [DOI] - ↑
Milner, T.E., Franklin, D.W., Imamizu, H., & Kawato, M. (2007).
Central control of grasp: manipulation of objects with complex and simple dynamics. NeuroImage, 36(2), 388-95. [PubMed:17451973] [WorldCat] [DOI] - ↑
Craig, A.D., Chen, K., Bandy, D., & Reiman, E.M. (2000).
Thermosensory activation of insular cortex. Nature neuroscience, 3(2), 184-90. [PubMed:10649575] [WorldCat] [DOI] - ↑
Olausson, H., Charron, J., Marchand, S., Villemure, C., Strigo, I.A., & Bushnell, M.C. (2005).
Feelings of warmth correlate with neural activity in right anterior insular cortex. Neuroscience letters, 389(1), 1-5. [PubMed:16051437] [WorldCat] [DOI] - ↑ 56.0 56.1
Zhang, Z.H., Dougherty, P.M., & Oppenheimer, S.M. (1999).
Monkey insular cortex neurons respond to baroreceptive and somatosensory convergent inputs. Neuroscience, 94(2), 351-60. [PubMed:10579199] [WorldCat] [DOI] - ↑
Aziz, Q., Thompson, D.G., Ng, V.W., Hamdy, S., Sarkar, S., Brammer, M.J., ..., & Williams, S.C. (2000).
Cortical processing of human somatic and visceral sensation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(7), 2657-63. [PubMed:10729346] [PMC] [WorldCat] - ↑
Coen, S.J., Gregory, L.J., Yágüez, L., Amaro, E., Brammer, M., Williams, S.C., & Aziz, Q. (2007).
Reproducibility of human brain activity evoked by esophageal stimulation using functional magnetic resonance imaging. American journal of physiology. Gastrointestinal and liver physiology, 293(1), G188-97. [PubMed:17395900] [WorldCat] [DOI] - ↑
Lotze, M., Wietek, B., Birbaumer, N., Ehrhardt, J., Grodd, W., & Enck, P. (2001).
Cerebral activation during anal and rectal stimulation. NeuroImage, 14(5), 1027-34. [PubMed:11697934] [WorldCat] [DOI] - ↑
Critchley, H.D., Wiens, S., Rotshtein, P., Ohman, A., & Dolan, R.J. (2004).
Neural systems supporting interoceptive awareness. Nature neuroscience, 7(2), 189-95. [PubMed:14730305] [WorldCat] [DOI] - ↑
Pollatos, O., Schandry, R., Auer, D.P., & Kaufmann, C. (2007).
Brain structures mediating cardiovascular arousal and interoceptive awareness. Brain research, 1141, 178-87. [PubMed:17296169] [WorldCat] [DOI] - ↑
Karnath, H.O., & Baier, B. (2010).
Right insula for our sense of limb ownership and self-awareness of actions. Brain structure & function, 214(5-6), 411-7. [PubMed:20512380] [WorldCat] [DOI] - ↑
Devue, C., Collette, F., Balteau, E., Degueldre, C., Luxen, A., Maquet, P., & Brédart, S. (2007).
Here I am: the cortical correlates of visual self-recognition. Brain research, 1143, 169-82. [PubMed:17306235] [WorldCat] [DOI] - ↑
Medford, N., & Critchley, H.D. (2010).
Conjoint activity of anterior insular and anterior cingulate cortex: awareness and response. Brain structure & function, 214(5-6), 535-49. [PubMed:20512367] [PMC] [WorldCat] [DOI] - ↑
Paulus, M.P., Rogalsky, C., Simmons, A., Feinstein, J.S., & Stein, M.B. (2003).
Increased activation in the right insula during risk-taking decision making is related to harm avoidance and neuroticism. NeuroImage, 19(4), 1439-48. [PubMed:12948701] [WorldCat] - ↑
Preuschoff, K., Quartz, S.R., & Bossaerts, P. (2008).
Human insula activation reflects risk prediction errors as well as risk. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(11), 2745-52. [PubMed:18337404] [PMC] [WorldCat] [DOI] - ↑
Kuhnen, C.M., & Knutson, B. (2005).
The neural basis of financial risk taking. Neuron, 47(5), 763-70. [PubMed:16129404] [WorldCat] [DOI] - ↑
Xue, G., Lu, Z., Levin, I.P., & Bechara, A. (2010).
The impact of prior risk experiences on subsequent risky decision-making: the role of the insula. NeuroImage, 50(2), 709-16. [PubMed:20045470] [PMC] [WorldCat] [DOI] - ↑
Büchel, C., Dolan, R.J., Armony, J.L., & Friston, K.J. (1999).
Amygdala-hippocampal involvement in human aversive trace conditioning revealed through event-related functional magnetic resonance imaging. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(24), 10869-76. [PubMed:10594068] [PMC] [WorldCat] - ↑
Kirsch, P., Schienle, A., Stark, R., Sammer, G., Blecker, C., Walter, B., ..., & Vaitl, D. (2003).
Anticipation of reward in a nonaversive differential conditioning paradigm and the brain reward system: an event-related fMRI study. NeuroImage, 20(2), 1086-95. [PubMed:14568478] [WorldCat] [DOI] - ↑
Elliott, R., Friston, K.J., & Dolan, R.J. (2000).
Dissociable neural responses in human reward systems. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(16), 6159-65. [PubMed:10934265] [PMC] [WorldCat] - ↑
Knutson, B., Fong, G.W., Bennett, S.M., Adams, C.M., & Hommer, D. (2003).
A region of mesial prefrontal cortex tracks monetarily rewarding outcomes: characterization with rapid event-related fMRI. NeuroImage, 18(2), 263-72. [PubMed:12595181] [WorldCat] - ↑
Knutson, B., Taylor, J., Kaufman, M., Peterson, R., & Glover, G. (2005).
Distributed neural representation of expected value. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(19), 4806-12. [PubMed:15888656] [PMC] [WorldCat] [DOI] - ↑
Izuma, K., Saito, D.N., & Sadato, N. (2008).
Processing of social and monetary rewards in the human striatum. Neuron, 58(2), 284-94. [PubMed:18439412] [WorldCat] [DOI] - ↑
de Quervain, D.J., Fischbacher, U., Treyer, V., Schellhammer, M., Schnyder, U., Buck, A., & Fehr, E. (2004).
The neural basis of altruistic punishment. Science (New York, N.Y.), 305(5688), 1254-8. [PubMed:15333831] [WorldCat] [DOI] - ↑
Moll, J., Krueger, F., Zahn, R., Pardini, M., de Oliveira-Souza, R., & Grafman, J. (2006).
Human fronto-mesolimbic networks guide decisions about charitable donation. Proceedings of the National Academy of Sciences of the United States of America, 103(42), 15623-8. [PubMed:17030808] [PMC] [WorldCat] [DOI] - ↑
Tankersley, D., Stowe, C.J., & Huettel, S.A. (2007).
Altruism is associated with an increased neural response to agency. Nature neuroscience, 10(2), 150-1. [PubMed:17237779] [WorldCat] [DOI] - ↑
Rilling, J., Gutman, D., Zeh, T., Pagnoni, G., Berns, G., & Kilts, C. (2002).
A neural basis for social cooperation. Neuron, 35(2), 395-405. [PubMed:12160756] [WorldCat] [DOI] - ↑
Harbaugh, W.T., Mayr, U., & Burghart, D.R. (2007).
Neural responses to taxation and voluntary giving reveal motives for charitable donations. Science (New York, N.Y.), 316(5831), 1622-5. [PubMed:17569866] [WorldCat] [DOI] - ↑
Asahi, T., Uwano, T., Eifuku, S., Tamura, R., Endo, S., Ono, T., & Nishijo, H. (2006).
Neuronal responses to a delayed-response delayed-reward go/nogo task in the monkey posterior insular cortex. Neuroscience, 143(2), 627-39. [PubMed:16979828] [WorldCat] [DOI] - ↑ 81.0 81.1
Mizuhiki, T., Richmond, B.J., & Shidara, M. (2007).
Mode changes in activity of single neurons in anterior insular cortex across trials during multi-trial reward schedules. Neuroscience research, 57(4), 587-91. [PubMed:17257703] [PMC] [WorldCat] [DOI] - ↑
Ackermann, H., & Riecker, A. (2010).
The contribution(s) of the insula to speech production: a review of the clinical and functional imaging literature. Brain structure & function, 214(5-6), 419-33. [PubMed:20512374] [WorldCat] [DOI] - ↑
Frank, S., Kullmann, S., & Veit, R. (2013).
Food related processes in the insular cortex. Frontiers in human neuroscience, 7, 499. [PubMed:23986683] [PMC] [WorldCat] [DOI] - ↑
Phillips, M.L., Medford, N., Senior, C., Bullmore, E.T., Suckling, J., Brammer, M.J., ..., & David, A.S. (2001).
Depersonalization disorder: thinking without feeling. Psychiatry research, 108(3), 145-60. [PubMed:11756013] [WorldCat] [DOI] - ↑
Sierra, M., & David, A.S. (2011).
Depersonalization: a selective impairment of self-awareness. Consciousness and cognition, 20(1), 99-108. [PubMed:21087873] [WorldCat] [DOI] - ↑
Berthier, M., Starkstein, S., & Leiguarda, R. (1988).
Asymbolia for pain: a sensory-limbic disconnection syndrome. Annals of neurology, 24(1), 41-9. [PubMed:3415199] [WorldCat] [DOI] - ↑
Boddaert, N., De Leersnyder, H., Bourgeois, M., Munnich, A., Brunelle, F., & Zilbovicius, M. (2004).
Anatomical and functional brain imaging evidence of lenticulo-insular anomalies in Smith Magenis syndrome. NeuroImage, 21(3), 1021-5. [PubMed:15006669] [WorldCat] [DOI] - ↑
Filbey, F.M., Schacht, J.P., Myers, U.S., Chavez, R.S., & Hutchison, K.E. (2009).
Marijuana craving in the brain. Proceedings of the National Academy of Sciences of the United States of America, 106(31), 13016-21. [PubMed:19651613] [PMC] [WorldCat] [DOI] - ↑
Kilts, C.D., Schweitzer, J.B., Quinn, C.K., Gross, R.E., Faber, T.L., Muhammad, F., ..., & Drexler, K.P. (2001).
Neural activity related to drug craving in cocaine addiction. Archives of general psychiatry, 58(4), 334-41. [PubMed:11296093] [WorldCat] [DOI] - ↑
Bonson, K.R., Grant, S.J., Contoreggi, C.S., Links, J.M., Metcalfe, J., Weyl, H.L., ..., & London, E.D. (2002).
Neural systems and cue-induced cocaine craving. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 26(3), 376-86. [PubMed:11850152] [WorldCat] [DOI] - ↑
Naqvi, N.H., Rudrauf, D., Damasio, H., & Bechara, A. (2007).
Damage to the insula disrupts addiction to cigarette smoking. Science (New York, N.Y.), 315(5811), 531-4. [PubMed:17255515] [PMC] [WorldCat] [DOI] - ↑
Contreras, M., Ceric, F., & Torrealba, F. (2007).
Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science (New York, N.Y.), 318(5850), 655-8. [PubMed:17962567] [WorldCat] [DOI] - ↑
Paulus, M.P., & Stein, M.B. (2006).
An insular view of anxiety. Biological psychiatry, 60(4), 383-7. [PubMed:16780813] [WorldCat] [DOI] - ↑
Sprengelmeyer, R., Steele, J.D., Mwangi, B., Kumar, P., Christmas, D., Milders, M., & Matthews, K. (2011).
The insular cortex and the neuroanatomy of major depression. Journal of affective disorders, 133(1-2), 120-7. [PubMed:21531027] [WorldCat] [DOI] - ↑
Mutschler, I., Ball, T., Wankerl, J., & Strigo, I.A. (2012).
Pain and emotion in the insular cortex: evidence for functional reorganization in major depression. Neuroscience letters, 520(2), 204-9. [PubMed:22503725] [WorldCat] [DOI] - ↑
Sliz, D., & Hayley, S. (2012).
Major depressive disorder and alterations in insular cortical activity: a review of current functional magnetic imaging research. Frontiers in human neuroscience, 6, 323. [PubMed:23227005] [PMC] [WorldCat] [DOI] - ↑
Wylie, K.P., & Tregellas, J.R. (2010).
The role of the insula in schizophrenia. Schizophrenia research, 123(2-3), 93-104. [PubMed:20832997] [PMC] [WorldCat] [DOI]