「パッチクランプ法」の版間の差分
細編集の要約なし |
|||
| 9行目: | 9行目: | ||
==パッチクランプ法とは== | ==パッチクランプ法とは== | ||
パッチクランプ法は[[電位固定法]]を基に、[[wikipedia:Erwin Neher|Erwin Neher]]と[[wikipedia:Bert Sakmann|Bert Sakmann]]によって開発された電気生理学的記録方法である<ref name=ref1><pubmed>1083489</pubmed></ref><ref name=okada>'''岡田泰伸'''<br> | パッチクランプ法は[[電位固定法]]を基に、[[wikipedia:Erwin Neher|Erwin Neher]]と[[wikipedia:Bert Sakmann|Bert Sakmann]]によって開発された電気生理学的記録方法である<ref name=ref1><pubmed>1083489</pubmed></ref><ref name=okada>'''岡田泰伸'''<br>新パッチクランプ実験技術法<br>''吉岡書店'' (2001) ISBN 4-8427-0296-6</ref><ref name=mikoshiba>''Tritsch D. Chesnoy-Marchais D. Feltz A.'''(translation supervised by Mikoshiba K.)<br>ニューロンの生理学<br>''京都大学学術出版会'' ISBN 978-4-87698-773-3</ref>。 | ||
パッチクランプ法が開発される以前は、パッチクランプ法で使用される電極よりも先端が細い電極([[微小電極]] | パッチクランプ法が開発される以前は、パッチクランプ法で使用される電極よりも先端が細い電極([[微小電極]]、sharp glass electrode)を細胞内に刺入して電流を記録する[[細胞内記録法]]が用いられていた。この方法では、電極刺入口において絶縁性が得られ、正確な[[膜電位]]測定が可能であったが、電極と細胞膜間のシール抵抗が細胞膜の抵抗([[入力抵抗]])よりも十分に大きくないと正確な測定は行えず、小さな細胞には不向きであった。 | ||
一方、パッチクランプ法はガラス電極と細胞膜の間に非常に抵抗の高い(1GΩ以上)シール(gigaohm seal:ギガシール)を形成させることにより、電極先端と同程度の大きさの小さな細胞からの電位測定が可能となった。これにより、細胞膜上のイオンチャネルによる微小電流を測定することが可能となった。 | |||
Erwin NeherとBert Sakmannはこの方法により[[筋]]線維における単一[[アセチルコリン]]電流を直接的に検出し、イオン通過路としてのチャネルの存在を初めて証明した。その後、パッチクランプ法を応用した様々な方法の追加開発により、多くの細胞系に用いられるようになった。この技法を発明し、発展させたことにより、1991年にErwin NeherとBert Sakmannは[[wikipedia:ja:ノーベル生理学・医学賞|ノーベル生理学・医学賞]]を受賞した。 | Erwin NeherとBert Sakmannはこの方法により[[筋]]線維における単一[[アセチルコリン]]電流を直接的に検出し、イオン通過路としてのチャネルの存在を初めて証明した。その後、パッチクランプ法を応用した様々な方法の追加開発により、多くの細胞系に用いられるようになった。この技法を発明し、発展させたことにより、1991年にErwin NeherとBert Sakmannは[[wikipedia:ja:ノーベル生理学・医学賞|ノーベル生理学・医学賞]]を受賞した。 | ||
2013年8月17日 (土) 14:30時点における版
渡辺 拓也、二井 健介
マサチューセッツ州立大学 メディカルスクール
DOI XXXX/XXXX 原稿受付日:2013年6月4日 原稿完成日:2013年8月xx日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
パッチクランプ法は、イオンチャネルやトランプポーターを介したイオンの挙動を記録することで、細胞膜上の単一または複数のイオンチャネルならびにトランスポーターの活動を直接的に測定する方法である。培養細胞や急性単離標本、組織標本(スライス切片)、さらに行動下にある個体においても適用可能であり、主に神経、心筋、平滑筋、感覚器細胞などを対象とした研究に用いられている。
パッチクランプ法とは
パッチクランプ法は電位固定法を基に、Erwin NeherとBert Sakmannによって開発された電気生理学的記録方法である[1][2][3]。
パッチクランプ法が開発される以前は、パッチクランプ法で使用される電極よりも先端が細い電極(微小電極、sharp glass electrode)を細胞内に刺入して電流を記録する細胞内記録法が用いられていた。この方法では、電極刺入口において絶縁性が得られ、正確な膜電位測定が可能であったが、電極と細胞膜間のシール抵抗が細胞膜の抵抗(入力抵抗)よりも十分に大きくないと正確な測定は行えず、小さな細胞には不向きであった。
一方、パッチクランプ法はガラス電極と細胞膜の間に非常に抵抗の高い(1GΩ以上)シール(gigaohm seal:ギガシール)を形成させることにより、電極先端と同程度の大きさの小さな細胞からの電位測定が可能となった。これにより、細胞膜上のイオンチャネルによる微小電流を測定することが可能となった。
Erwin NeherとBert Sakmannはこの方法により筋線維における単一アセチルコリン電流を直接的に検出し、イオン通過路としてのチャネルの存在を初めて証明した。その後、パッチクランプ法を応用した様々な方法の追加開発により、多くの細胞系に用いられるようになった。この技法を発明し、発展させたことにより、1991年にErwin NeherとBert Sakmannはノーベル生理学・医学賞を受賞した。
微小電極による細胞内記録法と比較して、ホールセル法はギガシールの結果によりリーク電流が非常に少なく安定して記録することができる。また、ホールセル法に用いる電極先端は、微小電極よりも大きいため、細胞内への化合物の添加を短時間でできる。しかし、細胞内が潅流されてしまう短所もある。
一方、微小電極による細胞内記録では電極が鋭利なため、細胞内環境を比較的安定に保つことができる。しかし、顕微鏡下で電極先端を同定することは困難であるため、オシロスコープ上で矩形波電流の変化をモニターすることにより、電極を細胞に刺し入れる。そのため、ホールセル法に比べ技術を要する。
基本的技術
顕微鏡
スライス標本ではスライスの上層にある細胞から測定することが多い為、正立型微分干渉顕微鏡を用いる。赤外線微分干渉(IR-DIC)カメラを通したビデオ映像を利用することにより、厚いスライスの深部の細胞を捉えることができる。ブラインドパッチ法では細胞を捉える必要が無い為、実体顕微鏡を利用する。単層の培養細胞では、位相差顕微鏡を使用する。
電極
先端が開口しているガラス微小ピペットを電極として用いる。材質は軟質ソーダガラス、誘電率が低くてノイズの少ない硬質のホウケイ酸ガラスが用いられる。これらのガラス管を、プラーにより電極先端の径が1-5μm、電極抵抗(Rp)2-10MΩ程度の電極を作製する。より高いギガシールの形成には、電極先端をマイクロフォージにより更に熱加工し(ファイアーポリッシュ)、電極先端表面を滑らかにする。ノイズを軽減するために、ファイアーポリッシュした電極先端をシルガードや、シリコンでコーティングする場合もある。
電極内液
基本的な電極内液は等張の塩化カリウム溶液であり、解析する項目に応じて、電極内液の組成を選択する必要がある。
- 陽イオン:生体に近い条件で膜電位・電流変化を記録する時は、細胞内の主な陽イオンであるカリウム(K+)が主組成の内液を用いる。細胞を脱分極させた状態で電流を記録する際は、K+をK+チャネルブロッカーであるCs+に置換することによりK+電流の混入を排除する。
- 陰イオン:細胞内には膜非透過性の陰イオンが多く存在し、これにより細胞膜の内側がマイナスに荷電されることにより、濃度勾配によるK+の細胞外への流出を抑制している。そのため、膜非透過性の陰イオンであるメタンスルホン酸(methanesulfonate)やグルコン酸(gluconate)を電極内液に加える。しかし、上記の陰イオン使用時にはCl-使用時に比べ、液間電位が大きくなるため、液間電位補正が必要となる。
- キレーター:細胞内Ca2+濃度緩衝能は10mMのEGTAによるものと同等である為、細胞内Ca2+濃度を変化させたくない場合は10mMのEGTAを加える。一方、細胞内に流入したCa2+による電流の測定や開口分泌などのCa2+の細胞内流入による生理機能を解析する際は、キレーターの濃度を低く調節する必要がある。細胞内に流入したCa2+の影響を取り除きたい場合は、EGTAの代わりにBAPTAを用いることにより、細胞内Ca2+を素早くキレートすることができる。
- ATP、GTP:細胞内液が電極内液に潅流されることにより、細胞機能維持に必要な細胞内成分が失われ、細胞機能のrundownが起きる。このrundownを防ぐ目的として、ATPならびにGTPを電極内液に加える。例えば、ATPはCa2+チャネルのリン酸化を補うことにより、Ca2+チャネルの機能を維持し、Ca2+電流のrundownを防ぐ。GTPはGTP結合タンパク質の機能維持の為に添加する。
- その他:細胞内因子に対する阻害剤や抗体を電極内液に加えることで、機能を担っている分子の同定ができる。また、RNaseを除去した電極内液を使用することで、ホールセル記録後の細胞から、mRNAを回収し、RT-PCRにより記録細胞に発現している遺伝子を解析することが可能である。
手技
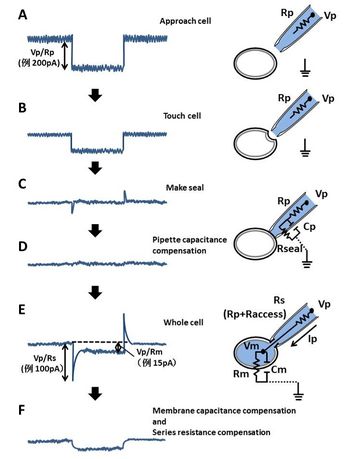
Rp: 電極抵抗、Rs: 直列抵抗、Rseal: シール抵抗、Rm: 膜抵抗(入力抵抗)、Raccess: アクセス抵抗、Cm: 膜容量、Cp: 電極による浮遊容量、Vp: ピペット電位、Vm: 膜電位、Ip: ピペット電流
例:矩形波パルス-1mVを与えた際、図に表記した電流応答が得られたとする。オームの法則(V=IR)により、Rpは5MΩ、Rsは10MΩ、Rmは66MΩとなる。
先端が開口しているガラス電極に実験目的に応じて選択された電極内液を満たす。電極内液を満たす際は、フィルターを介して行い、電極内部へのゴミの侵入を防ぐ。また、電極内部に気泡が入った場合は電極を軽く叩いて、気泡を取り除く。塩化銀の金属線が付いた電極ホルダーへ電極を装着する。電極内液と接触している塩化銀の金属線により、プレアンプへ電流・電圧が伝えられる。電極内部へ繋がっているチューブを介し陽圧をかけることで、電極先端へのゴミや組織の付着を防ぎ、ギガシールを形成し易くする。
矩形波電位パルス(通常数mV)を繰り返し与え、矩形波電流をオシロスコープ上でモニターする事で電極先端の抵抗を測定し、その状態を把握しつつ実験を進めていく(図1A)[2]。
- 細胞へのアプローチと接触
- 顕微鏡とマニュピレーターを操作し、標的細胞へ電極先端を近づける。細胞に電極先端が近づくと矩形波電流が小さくなる(図1B)。また、陽圧によって細胞表面にくぼみ(dimple)が観察される。
- ギガシール形成
- 陽圧の解除により、細胞膜が電極先端へ接着させる。吸引により内部に軽い陰圧をかけることで、細胞膜とピペット先端を密着させ、ギガシール(1GΩ以上の抵抗)を形成する。矩形波電流はゼロに近くなり、電流ノイズも小さくさる(図1C)。このギガシールにより、漏れ電流(leak current)が非常に小さくなり、イオンチャネルの開閉による小さな電流を測定することが可能となる。
ギガシール形成後、電極による浮遊容量Cpをアンプを介して補正する(図1D)。 - ホールセル形成
- さらに陰圧をかけることで、細胞膜を穿孔し、ホールセルの状態にする(図1E)。矩形波電流は直列抵抗に応じた容量性サージ電流(capatitative surge current)としてモニターされる。この振幅値は直列抵抗に反比例することから、容量性サージ電流とピペット電位Vpから直列抵抗 (series resistance, Rs)の値を算出することができる(図1E)。また、膜抵抗Rm(入力抵抗)も算出することができる。
Rsは膜容量に対して直列に配置される抵抗成分であり、電極抵抗Rpとアクセス抵抗Raccess(電極と細胞の間の抵抗成分)の和である。Rsは電極の形状に依存しており、電極の先端径が大きく、テーパーが短い(電極先端まで太く、急に細くなる)ものは、Rsは小さくなる。
膜電位Vmはピペット電位Vpよりも直列抵抗によってIp・Rs分の電圧降下が見られる。膜電位固定下で、細胞が小さい場合、電流Ipは小さいため大きな電圧降下は認められないが、細胞が大きい場合は、ピペット電流Ipは大きくなる為、膜電位Vmとピペット電位Vpの差が大きくなり、膜電位の制御が正しく行われなくなる。その為、大きな細胞の膜電位を制御するには、直列抵抗Rsを小さくする必要がある。あるいは電気的に直列抵抗Rsの補正(Series resistance compensation)をアンプを介して行う(図1F)。
また、膜容量Cmに荷電する電流が大きくなり、時定数の早いイオンチャネルなどの電流応答を正確に記録できないため、膜容量Cmの補正(membrane capacitance compensation)を行う。
種々の方法
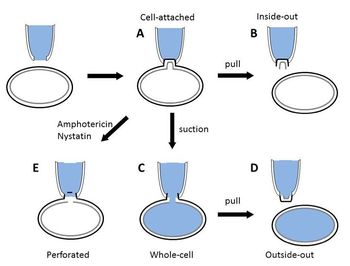
研究目的によって以下のパッチクランプ法が使い分けられる(図2)。セルアタッチ法とインサイド−アウト法、アウトサイド−アウト法は、電極で取り囲んだ領域のイオンチャネルの挙動を記録するために用いられる(単一チャネル記録法)。ホールセル法とパーフォレイテッド法は単一チャネル電流ではなく、細胞膜全体の電気現象を記録することができる(全細胞電流記録法)。
研究目的によって以下のパッチクランプ法が使い分けられる(図2)[2]。セルアタッチ法とインサイド-アウト法、アウトサイド-アウト法は、電極で取り囲んだ領域のイオンチャネルの挙動を記録するために用いられる(単一チャネル記録法)。ホールセル法とパーフォレイテッド法は単一チャネル電流ではなく、細胞膜全体の電気現象を記録することができる(全細胞電流記録法)。
セルアタッチ法
電極を細胞膜上に密着させたまま記録する方法である(図2A)。この方法は細胞内液と電極内液が混ざらないため、細胞内環境を変化させることなく、単一イオンチャネル電流や神経細胞の発火頻度を記録することができる。リガンド依存性イオンチャネルや代謝型受容体に調節されるチャネルに関する研究では、細胞膜の外部表面に神経伝達物質や薬物が接触できるように、それらを電極内液に含ませて使用する。
インサイド-アウト法
セルアタッチ法の状態からギガシールした電極を引き上げると、細胞からパッチ膜が切り離され、細胞膜の内側が細胞外液中に露出した状態がインサイドーアウト法である(図2B)。これをインサイドーアウト法と呼ぶ。この方法ではイオンチャネルの細胞膜内側の条件を調節することが可能であり、細胞内リガンドによって影響されるイオンチャネルの解析に有用である。
ホールセル法
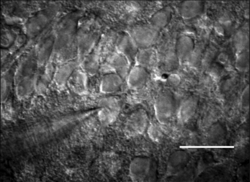
海馬スライス培養細胞のノマルスキー型微分干渉像。左下から電極がアプローチしている。スケールバー:30 µm。
下記の穿孔パッチ法と区別する時にはコンベンショナルホールセル法ともいう。セルアタッチ法から電極の陰圧をさらに強くすることでパッチ膜を破って穴を開け、電極内と細胞内が繋がる状態がホールセル法である(図2C)。ホールセル法では、全細胞膜の複数のイオンチャネルを介した電流を記録することが可能である。パッチ膜を介した電流応答を記録するセルアタッチ法やインサイド-アウト法、アウトサイド-アウト法では、イオン透過効率の低いキャリアやポンプを介した電流を記録することはできないが、ホールセル法では全細胞膜におけるそれら電流の総和を記録することができる。ホールセル法では通常細胞体から記録されるが、細胞体と樹状突起ではチャネルの分布や特性が違うため、電流電位応答が異なる。樹状突起での微細な電流電位応答を記録するため、樹状突起に電極を当てて記録するdendritic パッチクランプ法もある[4]。
アウトサイド-アウト法
ホールセル法の状態から電極をゆっくりと細胞から引き離し、細胞膜の小胞を形成させ、細胞から切り取る(図2D)。これにより細胞膜の外側が電極の外側を向くようになる。細胞外液組成を調節して記録することができるため、神経伝達物質のような細胞膜の外側に作用するような物質の研究に用いられる。
パーフォレイテッド法
穿孔パッチ法ともいう(図2E)。ホールセル法の代替法であり、HornとMartyによって開発された[5]。ギガシールを形成後、陰圧によって膜を破るのではなく、パッチ電極内液に含まれたニスタチン、アンホテリシンBやグラミシジンのような抗生物質によって細胞膜に小さな穴をあける方法である。これらの抗生物質が、ほとんどの細胞膜に一価イオンや10Å以下の径を持つ分子を通過させる孔をあけることを利用している。そのため、膜を破らずに全細胞膜での電流を記録することができる。また、細胞の内容成分の漏出を軽減し、細胞内環境を保持することが可能となる。
ニスタチン、アンホテリシンBは一価の陽イオン(Na+、K+、Cs+、Li+など)に加え、一価の陰イオン(Cl-)に対して透過性を有しているが、グラミシジンは陰イオンに対する透過性が無く、グラミシジンによるパーフォレイテッドパッチは細胞内のCl-濃度を保持したまま記録することが可能である。ホールセル法では電極内液のCl-により、細胞内Cl-濃度が上昇するため、ホールセル法とグラミシジンによるパーフォレイテッドパッチ法では、固定電位によってCl-チャネルを介した電流応答の向きが異なる。
しかし、いくつかの欠点がある。まず、ホールセル法と比較して、Rsが高くなり、電気的解像能が低下する。また、抗生物質による細胞膜の穿孔には時間がかかる(10-30分間)。さらに、抗生物質により形成された孔によって電極先端の膜は弱くなっているため、その膜が破れて、ホールセル法に移行する危険性がある。
ルーズパッチ法
非侵襲的に細胞から記録を行うため、ギガシールよりも緩いシールを形成して記録を行う方法をルーズパッチ法と呼ぶ。シールが緩いので、記録後に電極を細胞膜から取り去っても細胞膜は無傷であり、細胞膜を壊すことなく、同じ細胞の異なる場所で繰り返し記録することが可能である。しかし、電極と細胞膜間の抵抗が低いため、電流が漏れやすいという欠点がある。この漏れ電流は、細胞の異なる場所での記録と比較することで補正することができる。
ブラインドパッチ法
顕微鏡下で観察できない組織深部にある細胞から記録を行うために、オシロスコープ上で矩形波電流の変化を観察しながら、細胞に電極を接触させ、記録を行う方法をブラインドパッチ法と呼ぶ。
成熟した動物のスライス標本では組織の構造が複雑であり、顕微鏡下で細胞への電極のアプローチを観察することが困難である。ブラインドパッチ法は顕微鏡での細胞観察の必要が無い為、動物の週齢を気にせず記録することができる。また、視覚的に標的細胞を選別しないため、無作為的に細胞から記録することができる。
しかし、様々な種類の細胞が存在する場所では、どの種類の細胞から記録したのかわからないため、電極内液に標識物質等を添加し、記録後に細胞を同定する必要がある。この手法は、スライス標本のみならずin vivo パッチクランプにも応用されている。
オートパッチクランプ法
ロボットによるブラインドパッチ法
ブラインドパッチ法をロボットに応用させたin vivoでのパッチクランプ法が開発されている[6]。
プレート上でのパッチクランプ法
複数のパッチ穴のあるプレートやチップ上の培養細胞でのパッチクランプ法が開発されている[7] [8]。短時間に大量のデータを取得することが可能であり、薬物のスクリーニングに有用である。
In vivoパッチクランプ法
ネコの皮質においてin vivoパッチクランプ法が最初に行われた[9]。その後、ラットならびにマウス[10]においても行われ、ショウジョウバエの脳神経細胞からの記録も行われている[11]。In vivoパッチクランプ法ではブラインドパッチ法が用いられていたが、二光子励起顕微鏡を用いることで、標的細胞を観察しながらパッチクランプ法を行うことが可能である[12]。この場合、細胞外に蛍光色素を放出すると、細胞が影として観察されるので、それを標的として記録する(shadow patch)。
関連項目
参考文献
- ↑
Neher, E., & Sakmann, B. (1976).
Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature, 260(5554), 799-802. [PubMed:1083489] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 岡田泰伸
新パッチクランプ実験技術法
吉岡書店 (2001) ISBN 4-8427-0296-6 - ↑ Tritsch D. Chesnoy-Marchais D. Feltz A.'(translation supervised by Mikoshiba K.)
ニューロンの生理学
京都大学学術出版会 ISBN 978-4-87698-773-3 - ↑
Davie, J.T., Kole, M.H., Letzkus, J.J., Rancz, E.A., Spruston, N., Stuart, G.J., & Häusser, M. (2006).
Dendritic patch-clamp recording. Nature protocols, 1(3), 1235-47. [PubMed:17406407] [WorldCat] [DOI] - ↑
Horn, R., & Marty, A. (1988).
Muscarinic activation of ionic currents measured by a new whole-cell recording method. The Journal of general physiology, 92(2), 145-59. [PubMed:2459299] [PMC] [WorldCat] [DOI] - ↑
Kodandaramaiah, S.B., Franzesi, G.T., Chow, B.Y., Boyden, E.S., & Forest, C.R. (2012).
Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nature methods, 9(6), 585-7. [PubMed:22561988] [PMC] [WorldCat] [DOI] - ↑
Schroeder, K., Neagle, B., Trezise, D.J., & Worley, J. (2003).
Ionworks HT: a new high-throughput electrophysiology measurement platform. Journal of biomolecular screening, 8(1), 50-64. [PubMed:12854998] [WorldCat] [DOI] - ↑
Korsgaard, M.P., Strøbaek, D., & Christophersen, P. (2009).
Automated planar electrode electrophysiology in drug discovery: examples of the use of QPatch in basic characterization and high content screening on Na(v), K(Ca)2.3, and K(v)11.1 channels. Combinatorial chemistry & high throughput screening, 12(1), 51-63. [PubMed:19149491] [WorldCat] [DOI] - ↑
Pei, X., Volgushev, M., Vidyasagar, T.R., & Creutzfeldt, O.D. (1991).
Whole cell recording and conductance measurements in cat visual cortex in-vivo. Neuroreport, 2(8), 485-8. [PubMed:1912484] [WorldCat] [DOI] - ↑
Margrie, T.W., Brecht, M., & Sakmann, B. (2002).
In vivo, low-resistance, whole-cell recordings from neurons in the anaesthetized and awake mammalian brain. Pflugers Archiv : European journal of physiology, 444(4), 491-8. [PubMed:12136268] [WorldCat] [DOI] - ↑
Murthy, M., & Turner, G. (2013).
Whole-cell in vivo patch-clamp recordings in the Drosophila brain. Cold Spring Harbor protocols, 2013(2), 140-8. [PubMed:23378646] [WorldCat] [DOI] - ↑
Kitamura, K., Judkewitz, B., Kano, M., Denk, W., & Häusser, M. (2008).
Targeted patch-clamp recordings and single-cell electroporation of unlabeled neurons in vivo. Nature methods, 5(1), 61-7. [PubMed:18157136] [WorldCat] [DOI]