英:postsynaptic density 英略称:PSD、独:postsynaptische Dichte 仏:densité post-synaptique シナプス後肥厚とはシナプス膜直下、細胞質側に存在する多数の蛋白質を含む複合体である。当初、電子顕微鏡によるシナプスの観察から、シナプス直下のみ電子線を通しにくい細胞膜が肥厚してみれるからこのように名付けられた。シナプスの膜直下に有ることから、シナプスの構造や機能に密接な関わりがあることが推定され、多くの研究がなされてきた。生化学的に単離する事も可能で、シナプスの構造蛋白質、調節蛋白質など数百種類に及ぶ分子を含む事が判っている。
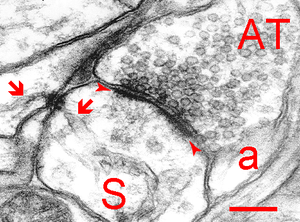
この例は穿孔PSDである。矢頭間:PSD、S:樹状突起棘、AT:軸索終止、a:星状膠細胞、矢印:小胞体、スケールバー:200 nm。ヒト大脳皮質。SpacekとHarrisによる。許可を得て転載。
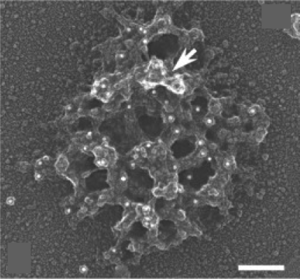
スケールバー:100 nm。LismanとReeseによる。
電子顕微鏡像
T - 細型棘、 M - 茸状棘と穿孔シナプス(ラット、海馬)SpacekとHarrisによる。許可を得て転載。
Palayは、シナプスを電子顕微鏡で観察する事で、シナプスの直下の膜が他の部分に比べて電子密度が高い事に気づいた[1]。その後、この構造はAkertら(1969)、Bloomら(1970)によりpostsynaptic density(PSD)と名付けられた[2]。シナプスの膜直下に有ることから、シナプスの構造や機能に密接な関わりがあることが容易に推定され、多くの研究がなされてきた。
GrayはPSDがシナプスの後部にのみ認められる非対称シナプス(Gray I型シナプス)に加え、シナプス前部にも認められる対称 シナプス(Gray II型シナプス)が有ることを見いだした[3]。I型シナプスは円形のシナプス顆粒を持つのに対し、II型は楕円形のシナプス顆粒を持つ。現在では、I型シナプスが、グルタミン酸性興奮性シナプス、II型シナプスがGABA性抑制性シナプスであるとされており、電子顕微鏡的に観察されたシナプスの機能を推定する手がかりとなっている。
海馬CA1錐体細胞の場合では、PSDの大きさは平均直径XXXX nm、厚さXXXX nm程度である。また、場合によってはシナプス直下で連続した構造ではなく、切れ目が有りそのようなPSDは穿孔PSD(perforated PSD)と呼ばれている。そのようなPSDは茸状(mushroom)樹状突起蕀に形成された一般に大きなシナプスに認められるが、穿孔をなす成因と生理学的意義はよく判っていない。しかし、一般にPSDが大きなシナプスは、シナプス前終末も大きく、ドックしているシナプス顆粒の数も多いため、より効率の良いシナプス伝達に関与していると思われる。
ReeseらはPSDを電子顕微鏡断層撮影で観察し、PSD中に様々な形状の蛋白質粒子を見いだし分類した上、それぞれを既知のPSD分子種に分類しているが、実際にはその主張を確認することは難しい。
生化学的性質
CotmanらはPSDが界面活性剤に耐性があることを利用し、PSDを生化学的に単離することに成功した。 今日では、Siekevitzらによる界面活性剤に非連続蔗糖密度勾配遠心法を組み合わせた方法がよく用いられている[4]。単離したPSDの電子顕微鏡像は組織中のPSDと大きさや形状がよく似ており、大きさが平均360 nm、分子量が1.10±0.36 GDaであった。走査型電子顕微鏡観察では、不定形の網目状の構造が認められおり、その構造がPSDを形作る構成基盤である可能性がある。
これによりPSDを構成する分子を同定することが可能となった。 さらに順により強い界面活性剤処理を行うことにより、PSD I、II、IIIとしてPSDに強固に結合している分子を分別していくことも可能である。 ただし、この方法では、通常シナプス後部にはあまり存在しない分子(例えば塩基性ミエリン蛋白質)も混入することも知られており、取れてきた標品の中に含まれている分子が本当にPSD由来であるかは、別に免疫染色などで確認する必要が有る。
Major 51000はCaMKIIである事が後に判明する。Siekevitzらによる[4]。
| Shengら[5] | 杉山ら[6] | |
|---|---|---|
| AKAP79/150 | 20 | N.D. |
| CaMKIIα/β | 5600 | N.D. |
| GluR1/2/3 | 60 | N.D. |
| Homer1/2/3 | 60 | 343 |
| IRSp53 | 80 | N.D. |
| mGluR1/5 | 20 | N.D. |
| NR1/NR2A/NR2B | 20 | N.D. |
| PSD-95 | 300 | 273* |
| SAP97 | 10 | * |
| SAPAP1-4/GKAP | 150 | 171 |
| Shank1/2/3 | 150 | 310 |
Pengらは、質量分析系を用い、数百種に及ぶ分子を同定している。その構成要素はシナプ伝達に関与する分子(受容体など)のほか、細胞内情報伝達分子(蛋白質リン酸化酵素、小分子GTP結合蛋白質など)、細胞骨格系分子(アクチン、スペクトリンなど)、足場蛋白質(PSD-95、Shank、Homerなど)、細胞接着分子(カドヘリン、ニューロリギンなど)が見いだされている。定量的な解析もなされ、major PSD proteinとしてかねてから知られていたCaMKIIが最も多く、次いでアクチンなど細胞骨格系の蛋白質が多い。
彼らはまた、一個のPSDの分子量、そして、その要素の構成比から、一個のPSDの中にある分子の数を推定した。それによると、表のように、多い蛋白質で数百個の単位で存在することが判った。 この数値は、杉山らがGFP融合蛋白質、免疫染色と蛍光標準ビーズを組み合わせた実験から得られた数字と驚くほど一致している。また、電気生理学的な雑音解析によっても一つのシナプスに存在する受容体数は数十から数百個であり、妥当な数字である。
CaMKIIが桁違いに多いが、これはサンプル調整時の虚血によりPSDに移行することが知られており、それによる影響で過大に計量されている可能性があるが、それでもなお最も多い蛋白質の一つであることには間違えがない。その他のシグナル伝達分子に比べ、これは数十倍以上多く、これはCaMKIIが単にシグナル伝達分子であるだけではなく、PSDに於ける構造因子であることも示唆する。実際に岡本らはCaMKIIβがアクチンを束化する活性があることを見いだしている。
これらのPSD分子は、蛋白質ドメイン間相互作用により、お互い結合し合っている。どの蛋白質が、PSDの最も中心に存在するかは判っていないが、一つの候補としてHomerとShankがある。この両者を精製し、混合することにより、PSDと同様な、網目状構造が再構築できるのに加え、そこにアダプター蛋白質であるGKAPを加えると組み込まれる。GKAPはさらにPSD-95を介しシナプス膜表面のグルタミン酸受容体に結合するので、ShankとHomerを基盤としてその他の蛋白質が次々に結合していくことで、PSDが形成されている可能性がある。実際にPSDとShankをニューロンに過剰発現することによりPSDが大きくなることが知られている。
免疫電子顕微鏡による観察からは、様々なPSD蛋白質が膜直下から鉛直方向に層構造を作っていること、また、シナプス中心から水平方向に周辺部に向かっても蛋白質それぞれの分布をしていることが知られている。
分子構造のダイナミクス
岡部らはPSDのコア蛋白質であるPSD-95をGFP融合蛋白とし、神経細胞に導入した上で、継時観察を行った。それによると、PSDは常に形態的に変化していることが判った。さらに、一個のPSDに存在するPSD-95-GFPの蛍光を褪色させて、その回復を測定することによりPSD-95のturnoverを観察した。その結果、PSDに存在するPSD-95は早いturnoverを示す成分(数十分の単位)と1時間程度の観察ではほとんどturnoverが認められない2つの成分が有ることが判った。様々な蛋白質についてさらに検討を加えた所、蛋白質によってアクチンのように殆どの分子が数分以内に入れ替わる分子もある一方で、PSD-95のように遅い分子も有ることが判った。PSDの蛋白質は樹状突起から供給されるのに加え、隣りのシナプスからも供給される。
分子のturnoverの速度を規定しているのは、その蛋白質の分子量と形状により影響される拡散速度に加え、結合部位の存在や蛋白質の修飾などが深く関わっているものと考えられる。また、この移行が、拡散による能動的な過程か、あるいはモーター蛋白質を利用した受動的過程は判っていないが、おそらく両者が有るものと考えられる。
同じ蛋白質で早い成分と遅い成分が有るとき、それらがPSDでいかに配置されているかは興味深い問題であるが、これもまだ明らかにされていない。
神経活動依存的なAMPA型グルタミン酸受容体のシナプスへの移行がシナプス可塑性の主要な機構であり、その裏打ち構造であるPSDがいかに変化するかはシナプス可塑性の分子機構を理解するのに重要である。神経活動依存的なシナプスへの移行はCaMKIIで初めて見いだされ、これはCa2+/calmodulinによるキナーゼ活性の活性化による。しかし、数百に及ぶPSD構成要素がいかにシナプス可塑性で変化していくかの全体像はまだ得られていない。
将来展望
当初、PSDの観察に用いられてきた電子顕微鏡は、生組織に用いることが出来ないと言う大きな欠点が有った。一方で、光学顕微鏡は生組織を観察できるが、分解能に限度が有り、PSDの詳しい構造はみることが出来ない。最近、超高解像度顕微鏡と呼ばれる技術が開発され、100 nm以下の分解能で構造を観察することが出来るようになりつつ有る。まだ、光褪色などの問題を抱えるが、将来的には生細胞でのPSD動態観察に応用可能であると期待される。
参考文献
- ↑
PALAY, S.L. (1956).
Synapses in the central nervous system. The Journal of biophysical and biochemical cytology, 2(4 Suppl), 193-202. [PubMed:13357542] [PMC] [WorldCat] [DOI] - ↑
Akert, K., Moor, H., Pfenninger, K., & Sandri, C. (1969).
Contributions of new impregnation methods and freeze etching to the problems of synaptic fine structure. Progress in brain research, 31, 223-40. [PubMed:4186645] [WorldCat] [DOI] - ↑
GRAY, E.G. (1959).
Axo-somatic and axo-dendritic synapses of the cerebral cortex: an electron microscope study. Journal of anatomy, 93, 420-33. [PubMed:13829103] [PMC] [WorldCat] - ↑ 4.0 4.1
Carlin, R.K., Grab, D.J., Cohen, R.S., & Siekevitz, P. (1980).
Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of cell biology, 86(3), 831-45. [PubMed:7410481] [PMC] [WorldCat] [DOI] - ↑
Sheng, M., & Hoogenraad, C.C. (2007).
The postsynaptic architecture of excitatory synapses: a more quantitative view. Annual review of biochemistry, 76, 823-47. [PubMed:17243894] [WorldCat] [DOI] - ↑
Sugiyama, Y., Kawabata, I., Sobue, K., & Okabe, S. (2005).
Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature methods, 2(9), 677-84. [PubMed:16118638] [WorldCat] [DOI]
(執筆者:林 康紀、担当編集委員:)