蛍光共鳴エネルギー移動(FRET) 英:fluorescence resonance energy transfer 英略称:FRET、独:仏: FRETは、1946年、Theodor Försterによって初めて報告された現象である。Donor となる蛍光体の蛍光スペクトルとAcceptorとなる蛍光体の励起スペクトルに重なりがあるときに、DonorからAcceptorへのエネルギー移動が起きる。GFPおよびバイオイメージングの発展によって、FRETを基にした細胞内シグナル伝達分子の可視化検出などに用いられ、神経分野においても、個体の脳のにおいて応用されている。 目次 1. 原理 2.検出 蛍光強度比 蛍光寿命 2. 細胞生物学および神経科学への応用 cAMP, カルシウムイメージング, リン酸化 スパインイメージング Actin, CaMkII, Ras 3. 将来展望 In vivo イメージング 超高解像度イメージング マルチカラーイメージング 4. 参考文献
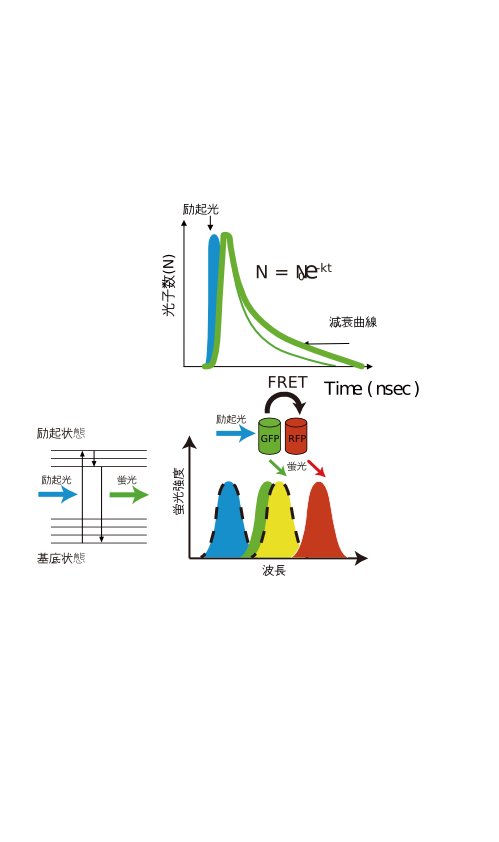
原理) 図1のヤブロンスキーダイヤグラムに示すように、励起光により、Donorの蛍光団の電子が基底状態からエネルギー準位が上の励起状態に励起される。励起された電子は、回転エネルギーや振動エネルギーを失いながら、励起状態の底まで行き着く。その後、基底状態に戻る際に、蛍光としてエネルギーを放出する。今、Donorの近くに、Donorの蛍光スペクトルと重なる励起スペクトルを持ったAcceptorが存在するとFRETが起き、Donorの蛍光強度の減少、蛍光寿命の減少、Acceptorの蛍光の増加などが観察される。 FRETは、以下の式で規定される。
実際に、変数となりうるのは以下の性質である。 1.距離。距離の6乗に反比例する。 2.Donorの蛍光の遷移双極子モーメントとAcceptorの遷移励起光のための双極子モーメントの相対配向。フルオレセインなど、等方的に蛍光の放射が起きる場合には、κ=2/3であるが、GFPをはじめとした配向の定まった蛍光タンパク質などは、各々の値を取る。
検出) 1)ドナーとアクセプターの蛍光強度を測定する方法。 FRETが起きると、Donorの蛍光強度が減少し、Acceptorの蛍光強度が減少する。測定の際には、蛍光強度の変化を測定することになるが、細胞などの試料においては、細胞の形状変化に伴う蛍光強度変化などが起きることから、実際には、ドナーとアクセプターの蛍光強度のの変化を取得することによって、これらのファクターを除外する。
2)ドナーの蛍光寿命を測定する方法。 近年、時間相関単一光子計数法とpulsing laserの相性の良さから、時間分解能の向上により、蛍光寿命を比較的短時間で取得することが可能となった。 蛍光寿命は、GFPおよびそのcolor variantタンパクでは、1-5 nsec、希土類錯体などは、1µsec、pyren coronenなどは、400, 200 nsecである。上述のように、FRETが起きると蛍光寿命を表す減衰曲線の傾きが変わる。これを基にFRETを観察する。
神経科学分野への応用 GFPのcolor variant、CFPおよびYFPなどの開発以来、FRETは積極的に細胞内イメージングに取り入れられ始めた。1997年、Miyawakiらによって、Calcium indicator, Cameleonが開発され、さらに、cAMP, cGMP, リン酸化を初めとした細胞内シグナル伝達の重要なターゲット分子のFRETプローブが次々と作製され、細胞内の活性の局在などの解明に大きく貢献してきた。 脳神経分野においては、林らが、2000年初期に記憶の最小単位分子と言われているカルシウムカルモデュリンキナーゼII (CaMKII)の活性、シナプスの構造を制御するactinの重合を可視化するためのFRETプローブが開発された。1990年代後半からの2光子顕微鏡の発達により、神経回路ネットワークを保持したスライスおよびin vivoで神経活動を観察可能になり、脳のスライスにおいては、波長依存的な蛍光の吸収が生じるため、DonorとAcceptorの2波長を測定する蛍光強度比を測定するよりも、蛍光の散乱、吸収によって変化しない蛍光寿命測定法が発達してきている。安田グループは、蛍光寿命測定を基に、神経細胞樹状突起上の微小構造、棘突起(スパイン)において、スパインの構造的変化を誘導するシグナル伝達分子の活性化の変化を観察することに成功している。 マウス個体においては、神経回路ネットワークにおけるシナプスの役割を解明する目的で、フェレットにCaMKII probeを導入し、神経回路ネットワークに変化を起こした時のCaMKIIの活性化の変化を観測している例がある。また、神経活動をモニターする目的で、膜電位プローブVSFP2.3/2.42によって、マウスのヒゲ刺激による入力先であるbarrel cortexでの入力特異的な神経の活性化が観察されている。 神経細胞内のカルシウム濃度を測定するために、オレゴングリーンの蛍光寿命の変化から、カルシウム濃度を測定し、アストロサイトでのカルシウム濃度が、アルツハイマー様マウスと正常マウスで違うことが報告されている。
将来展望 脳研究において、将来、生きたままの状態の脳の活動を明らかにする方向に移るであろう。蛍光タンパク質の蛍光強度、励起および蛍光波長の顕微鏡の性能の改良は日進月歩であり、 応答の低さ、バックグランドの混入などの問題があるが、In vivoにおいては、FLIMなどが発揮するようになるだろう。また、神経活動に必要なシグナル伝達を同時に観察するために、マルチカラーイメージングの試みがなされるであろう。その際には、1つの蛍光の寿命を観察するFLIM測定が適している。