塩素チャネル
英: chloride channel
同義語/関連語: アニオンチャネル、塩素イオンチャネル、クロライドチャネル、Cl−チャネル
塩素チャネルは細胞膜に組み込まれたイオンチャネルの一種で、主に塩化物イオン(Cl−)を受動的に透過させる。ほとんどの塩素チャネルは、Cl−以外のI−・Br−・F−等の無機陰イオン(アニオン)にも透過性を示し、またNO3−・SCN−・HCO3−やグルタミン酸・アスパラギン酸等のアミノ酸アニオンにも透過性を示すものも多いことから、一般にアニオンチャネルとも呼ばれる。細胞膜電位・細胞内カルシウムイオン濃度・細胞容積の変化や、リガンドの結合あるいはcAMP依存性のリン酸化反応に応答して開口する塩素チャネルがある。神経系において最もよく知られる塩素チャネルは、神経細胞の興奮・抑制調節に関与するリガンド作動性塩素チャネル(GABAA受容体、GABAC受容体、グリシン受容体)であるが、このチャネルについては他項目(グリシン受容体、GABA受容体)を参照されたい。リガンド作動性以外の塩素チャネルについて、現在のところ特異的な阻害薬がほとんど無い。塩素チャネルは神経系を含むあらゆる種類の細胞に発現し、膜電位や細胞容積の調節、細胞の移動・増殖や細胞死(アポトーシス)、分泌などの細胞の基本機能に広く関与しており、チャネル異常による遺伝性疾患も数多く知られている。
種類
哺乳類の神経系に発現している塩素チャネルは以下の5つに大別される。
ClC塩素チャネル
塩素チャネルとして最初にシビレエイ(学名 Torpedo marmorata)の発電器官からクローニングされた遺伝子ファミリーに属するものである[1]。哺乳類では9種類知られており、そのうち神経系に発現が知られているのは主にClC-2・-3・-4・-6・-7である。ClC-2は主に形質膜に分布して電位感受性塩素チャネルとして機能し、その他のClC-3・-4・-6・-7は主に細胞内小胞膜に分布し、チャネルというよりは、むしろCl-/H+-交換輸送体として機能すると考えられている。
カルシウム依存性塩素チャネル(calcium-activated chloride channel; CaCC)
細胞内Ca2+濃度の上昇に応じて活性化される塩素チャネルである。古くから神経系の細胞を含む様々な細胞種で確認されていた最も典型的なCaCCの主な責任分子が、近年Anoctamin/TMEM16ファミリーのAno1/TMEM16A及びAno2/TMEM16Bであることが確定した[2][3]。また、卵黄状黄斑ジストロフィ(ベスト病)の原因遺伝子として主に網膜色素上皮に発現し、神経系全般にも或る程度の発現が認められているBestrophinファミリー(Best1-4)もCaCC活性を持つことが知られている[4]。(なお、かつてCaCCの候補として挙げられていたCLCA及びTTYHファミリーのCaCCとしての機能については、現在否定的な見解が占める。)
細胞容積感受性塩素チャネル (volume-regulated chloride channel)
典型的には細胞容積の増大に伴い開口する塩素チャネルである。神経系の細胞を含むあらゆる細胞種で容積増大により最も多く活性化されるのが、細胞容積感受性外向整流性アニオンチャネル(volume-sensitive outwardly rectifying anion channel; VSOR)と呼ばれるものであるが、その分子実体はまだ解明されていない[5]。その他、マキシアニオンチャネル(maxi-anion channel)[6]と呼ばれるものや、上述のClC-2・Best1も容積感受性があることが知られている。
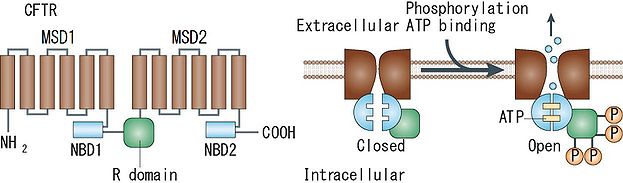
CFTR(cystic fibrosis transmembrane conductance regulator)塩素チャネル
嚢胞性線維症(cystic fibrosis)の原因遺伝子として同定されたCFTRは、神経系でも或る程度の発現が報告されている。cAMP依存性リン酸化酵素(PKA)によるリン酸化を通じて活性化される塩素チャネルである[7]。
リガンド作動性塩素チャネル
他項目(グリシン受容体、GABA受容体)を参照。
構造
ClC塩素チャネル
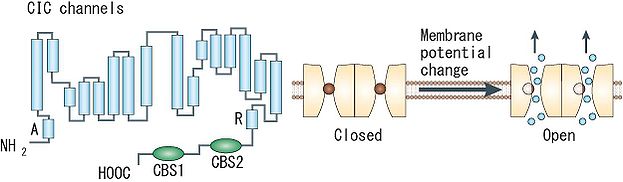
1つのサブユニットはA~Rの18のセグメントに分けられる。細胞質側にN末端とC末端があり、C末端側に2つのCBSドメインを持つ([8]より転載)。
ClCチャネルは、1つのポアを持つサブユニットタンパク質が2つ会合して二量体を形成するため、計2つのポアを有するdouble-barreledチャネルである。各ポアはイオン選択性やコンダクタンスなどの特性を保持しており、各ポアに内在するゲート機構(‘fast gate’)により他方のポアの開閉状態に関わらず独立して開閉しうるが、別の共有するゲート機構(‘slow (common) gate’)を通じて両ポアの開閉が同時にも制御されうる。バクテリアのClCタンパク質については既にX線結晶構造解析が進んでおり、各サブユニットが17の膜内へリックス構造(うち8つは膜を貫通せず途中で折り返す)を含む18のセグメントで構成された複雑なトポロジーが明らかになった。チャネル阻害剤の結合部位の解析やシステイン変異導入の解析から、この構造は全ての種のClCタンパク質に共通のものと考えられている。チャネルとCl-/H+-交換輸送の機能の違いは、細胞質側の或る1つのグルタミン酸残基の有無に起因しており、構造上の大差は無いことが判明している。なお、真核生物のClCタンパク質のC末端には、サブユニット間の相互作用やチャネルの活性に影響を与えうる2つのcystathionine-β-synthase (CBS) ドメインが存在する。
カルシウム依存性塩素チャネル
Anoctamin/TMEM16ファミリー
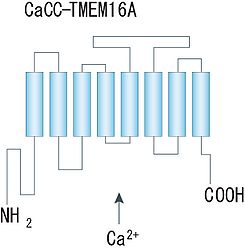
細胞質側にN末端とC末端を持ち、8回膜貫通領域から成る構造が示唆されている。([8]より転載)。
Ano1/TMEM16Aについては、近年二量体を形成していることが示され、アミノ酸疎水性度の解析から、各サブユニットは8回膜貫通領域を持ち、細胞質側に大きなN末端とC末端から成る構造物を持つことが示唆されている。ポア領域やCa2+結合部位及び電位センサー部位は未だ同定されていないが、他のCa2+依存性・電位依存性イオンチャネルでよく知られる構造との類似性は認められていない。
Bestrophinファミリー
Bestrophinチャネルも少なくとも二量体以上の多量体を形成し、各サブユニットは少なくとも4つの膜貫通領域を持つことが示唆されている。各サブユニットのC末端側に、酸性アミノ酸のクラスター領域とEFハンドモチーフで構成されるCa2+結合部位がある。Ca2+結合後にN末端とC末端領域の相互作用が起こり活性化することが、ヒトBest1で示されている。
{| border="1" cellspacing="1" cellpadding="1" width="1000" |- | | 遮断薬(阻害剤) | シングルチャネル
コンダクタンス (pS) | イオン選択性 | 関連するヒトの疾患 |- | CFTR | CFTR(inh)-172
グリベンクラミドロニダミン
ジチオスレイトール
DIDS
ニフルミン酸
クロロトキシン
ジフェニルホスフィン酸クロリド
DIDS
IAA-94
NPPB
ニフルミン酸
タモキシフェン | 1-9 | Cl- > Br- > I- | CLCN1:筋強直症
CLCN2:若年性ミオクロニーてんかん
CLCNKB:バーター症候群
CLCN5:遺伝性腎疾患(Dent病、低リン血症性くる病、X染色体連鎖劣性腎結石症)
CLCN7:大理石骨病 |- | VSOR塩素チャネル | DCPIB
DNDS
DIDS
NPPB
SITS
タモキシフェン | | I- > Cl- | |} ※ 注釈 9AC:9-アントラセンカルボン酸 (9-anthracene-carboxylic acid) CPP:3-(4-クロロフェノキシ)プロパン酸 (p-chlorophenoxy-propionic acid) DCPIB:4-(2-butyl-6,7-dichloro-2-cyclopentylindan-1-on-5-yl)oxybutyric acid DIDS:4,4-ジイソチオシアナトスチルベン-2,2-ジスルホン酸, 二ナトリウム塩(4,4′-Diisothiocyanatostilbene-2,2′-disulfonic acid disodium salt hydrate) DNDS:4,4'-ジニトロスチルベン-2,2'-ジスルホン酸二ナトリウム(4,4'-dinitrostilbene-2,2'-disulfonate) NPPB:2-[(3-フェニルプロピル)アミノ]-5-ニトロ安息香 (Nitro-2-(3-phenylpropylamino)benzoic acid) SITS:4-アセチルアミノ-4'-イソチオシアナトスチルベン-2,2'-ジスルホン酸ジナトリウム(4-Acetamido-4′-isothiocyanato-2,2′-stilbenedisulfonic acid disodium salt hydrate) THIP:4,5,6,7-テトラヒドロイソオキサゾロ[5,4-c]ピリジン-3(2H)-オン•塩酸塩(4,5,6,7-Tetrahydroisoxazolo[5,4-c]pyridin-3-ol hydrochloride) TPMPA:(1,2,5,6-テトラヒドロピリジン-4-イル)メチルホスフィン酸((1,2,5,6-Tetrahydropyridin-4-yl)methylphosphinic acid)
参考文献 [1][2][3][4][5][6][7][8][9][10][11]
- ↑ Clayton GH, Staley KJ, Wilcox CL, Owens GC and Smith RL (1998) Developmental expression of ClC-2 in the rat nervous system. Dev Brain Res 108: 307-318
- ↑ Duran C, Thompson CH, Xiao Q and Hartzell HC (2010) Chloride channels: often enigmatic, rarely predictable. Annu Rev Physiol 72: 95-121
- ↑ Jentsch TJ, Steinmeyer K and Schwarz G. (1990) Primary structure of Torpedo marmorata chloride channel isolated by expression cloning in Xenopus oocytes. Nature 348: 510-4
- ↑ Jentsch TJ (2008) CLC chloride channels and transporters: from genes to protein structure, pathology and physiology. Crit Rev Biochem Mol Biol 43: 3-36
- ↑ Kawasaki M, Uchida S, Monkawa T, Miyawaki A, Mikoshiba K, Marumo F and Sasaki S (1994) Cloning and expression of a protein kinase C-regulated chloride channel abundantly expressed in rat brain neuronal cells. Neuron 12: 597-604.
- ↑ Lee S, Yoon BE, Berglund K, Oh SJ, Park H, Shin HS, Augustine GJ and Lee CJ. (2010) Channel-mediated tonic GABA release from glia. Science 330: 790-6
- ↑ Okada Y, Sato K, and Numata T (2009) Pathophysiology and puzzles of the volume-sensitive outwardly rectifying anion channel J Physiol 587: 2141-2149
- ↑ Piirsoo M, Meijer D and Timmusk T (2009) Expression analysis of the CLCA gene family in mouse and human with emphasis on the nervous system. BMC Dev Biol 9:10
- ↑ Stephan AB, Shum EY, Hirsh S, Cygnar KD, Reisert J and Zhao H. (2009) ANO2 is the cilial calcium-activated chloride channel that may mediate olfactory amplification. Proc Natl Acad Sci U S A 106: 11776-81
- ↑ Verkman AS and Galietta LJV (2009) Chloride channels as drug targets. Nat Rev Drug Discov 8: 153-171
- ↑ Wang XQ, Deriy LV, Foss S, Huang P, Lamb FS, Kaetzel MA, Bindokas V, Marks JD and Nelson DJ. (2006) CLC-3 channels modulate excitatory synaptic transmission in hippocampal neurons. Neuron 52: 321-33
(執筆者:秋田天平、熊田竜郎、福田敦夫 担当編集委員:林康紀)