シングルセルRNAシーケンシング
山形方人<br>
Harvard University
DOI:10.14931/bsd.8038 原稿受付日:年月日 原稿完成日:年月日
担当編集委員:
英:single cell RNA sequencing, scRNA-seq
{{box|text= シングルセルRNAシーケンシング(scRNA-seq)は、次世代シーケンシング (Next Generation Sequencing、NGS)技術を使用して個々の細胞が発現しているmRNA全体、つまりトランスクリプトームを質的、量的に網羅的に調べ、細胞ごとの違いを高解像度で検出、分類することで、細胞の分類を行うことができる技術である。また、刺激、発生など細胞の状況に応じて、個々の細胞のトランスクリプトームの情報を得ることで、病態や細胞系譜などの解析も可能である。特に多様なニューロンが存在する神経系では、この方法により、神経細胞の分類や状態について、深い理解が進んできている。}
トランスクリプトーム
トランスクリプトーム(transcriptome)は、細胞中に存在する全ての転写産物(タンパク質をコードするmRNA、タンパク質をコードしないノンコーディングRNA、マイクロRNAなど)の総体である。トランスクリプトームは、ゲノムとは異なり、同一の個体でも、組織ごとに、更には発生段階や細胞外からの影響によって固有のものである。このようなトランスクリプトームは、同質あるいは異質の多数の細胞集団(例、培養細胞株、組織)からRNAを抽出し、1990年代に開発されたDNAマイクロアレイのように数多くの既知のmRNAを一気に識別する技術によって解析されるようになった。その後、次世代シーケンシング(NGS)の利用により、希少mRNAやノンコーディングRNAを含めた未知の転写産物の高感度検出も可能になるとともに、スプライシングを経て成熟していく過程のmRNAの構造など、転写産物の種類だけでなく、転写産物の構造の理解も進むことになった。また、NGSは、ヒトやモデル実験生物(マウス、センチュウ、ショウジョウバエなど)として広く利用される生物だけでなく、多様な生物のトランスクリプトームの理解も可能にした。
シングルセルトランスクリプトーム研究史の概観
1つの細胞の持つ生体物質を定量しようとする試みは古くからあった。1960年代になると、Fluorescence-activated cell sorting (FACS)が発明され、標識抗体などのプローブと組み合わせることで、多くの細胞の中で1つの細胞が持っている分子の種類や量についての断片的な研究が可能になり、この方法は現在でも利用されている。その後、免疫組織化学やin situ hybridizationなどにより、タンパク質やmRNAの種類や量が観察できるようになり、組織中の1つの細胞の同定などに活用されてきている。 一つの細胞内にある全RNAは細胞種によるが1-50pgである。そのうち、mRNAの占める割合は1-5%程度である。この微量のmRNAをcDNAに変換してから大幅に増幅できるPCRが発明されることで、1つの細胞が発現するmRNAを高感度で検出できるようになった。例えば、1991年、Linda BuckとRichard Axelは、嗅覚受容体がGタンパク質であると仮定し、個々の嗅覚細胞で特異的に観察されるGタンパク質mRNAを比較することで、嗅覚受容体候補の同定に成功した(年、ノーベル生理学・医学賞)。1995年になると、Catherine DulacとRichard Axelは、異なる鋤鼻神経細胞で特異的に発現する遺伝子を単細胞cDNAライブラリーのディファレンシャル・スクリーニングという方法で、フェロモン受容体候補を同定した。同様な手法で異なる種類の網膜神経節細胞で発現している遺伝子も同定されており、このようなアプローチが生理的に重要な機能を持つ遺伝子の発見に効果的であることを示した。 一方で多くの種類のmRNAを1細胞レベルで観察する単細胞トランスクリプトームには技術的なブレークスルーが待たれた。1つ大きな問題はPCRなどの増幅に伴うバイアスなどのアーティファクトが頻繁に観察されること、そしてもう一つの課題は多くの種類のcDNAを簡便に観察することを可能にする方法の開発であった(PMID: 16547197)。これを可能にしたのが、増幅法の改良とマイクロアレイの利用であった。しかしながら、増幅に伴うアーティファクトの解決は依然として不十分で、また1つの細胞ごとに高価なマイクロアレイを利用することは、多数の細胞のトランスクリプトームを観察するのには限界があった。2009年に、これらの問題を解決できる可能性として、High-throughput sequencing (HTS)を利用するscRNA-seqプロトコルがAzim Suraniのグループによって報告されたPMID:19349980。しかしながら、この方法でも一つの細胞ごとに処理を行うという操作が必要で、この論文でもたった8個の細胞の解析に留まっており、非常に多くの細胞についてのトランスクリプームを一挙に理解することはできなかった。
シングルセルRNAシーケンシング(scRNA-seq)の現状
以来、完全長cDNAまたは分子識別子(unique molecular identifiers: UMI)を持つcDNAを生成するためにmRNA転写産物を増幅する方法が異なるscRNA-seqが考案されてきた。2013年には、このような1細胞のシーケンシング技術が、Nature Methods誌のMethod of the Year に選ばれた。たとえば、SMART-seq(Switch mechanism at the 5' End of RNA Templates)( 18 )およびその改良されたプロトコルであるSMART-seq2( 19、20 )は、完全長cDNA合成のためのプロトコルである。また、MARS-seq(並列RNA単一細胞配列決定)( 21 )、STRT(単一細胞タグ付き逆転写)( 22、23 )、CEL-seq(線形増幅および配列決定による細胞発現)( 24 )、CEL-seq2( 25 )などが報告されてきた。特にSMART-seq(SMART-seq2)は、ピペット、限界希釈、レーザー捕獲法などを用いる多穴プレート法、更に半導体集積回路製作技術で作った流体集積回路を利用するFluidigm C1のシステム(https://jp.fluidigm.com)と組み合わせることで利用される機会が多い。このプロトコールの特徴は、全長のトランスクリプトームを得ることができることであり、mRNAのスプライシングバリアントなどのアイソフォーム、SNPs、変異の検出にも利用できる点で次に説明するUMIを用いる方法に比べて利点があるが、そのコストと処理できる細胞数の点で極めて不利である。
最も重要なscRNA-seqの方法論についての進歩は、2015年、Harvard Medical Schoolの独立した2つのグループから、inDropそしてDrop-seqという類似した2つの方法が発表されたことであろう。マイクロ流体力学 (Microfluidics) 、 UMIとしてDNAバーコーディング (DNA barcoding) 、そしてNGSを利用することで、自動化とサンプル調製の容易さから、一つの細胞あたりに要するコストを大幅に低下させることに成功した(Drop-seqはその発表時で、6セント/細胞)。これらの方法では、細胞1つずつをマイクロ流体力学によるエマルジョン技術を利用した装置に流入させ、その1細胞を試薬を封入した1つのDroplet(油滴)に自動的に閉じ込める。そのDroplet中には、DropletごとにUMIとして異なったDNAバーコードを持つゲルビーズが入っており、そこからcDNA合成反応を行うことで、それぞれの同じ細胞に含まれていたmRNAが同じUMIを持つcDNAとして合成され、Dropletを破壊した後も、そのcDNAが由来した細胞が区別できるということを利用している(図1)。このようにして増幅したUMI付きのcDNAをNGSで配列決定することによりscRNA-seqが可能になる。なお、DropSeqはコストが低いが、細胞の取得率と検出感度が低い弱点がある。inDropはDropSeqより細胞取得率が高く、パラメータを調整することで低レベルで発現される遺伝子の検出に有利である。 inDropの方法は、1 Cellbio社(https://1cell-bio.com)から販売されているが、特に重要なのは同様の原理を用いた10xGenomics社(https://www.10xgenomics.com/jp/)がChromiumと命名された市販機器と試薬を発売することで、多くの研究者に利用できることになったことである。Svenssonらのデータベース(www.nxn.se/single-cell-studies/gui)では、scRNA-seqを用いた論文で用いられた方法について調査しているが、この数年、10xGenomics社のChromiumを用いた方法が飛躍的に増加し、ほぼ寡占状態になりつつあることがわかる(現在、10XGenomics社とBioRad社の間で関連特許をめぐる係争がある。)。10X Genomics Chromiumは市販であるので導入が容易であり、inDropやDropSeqに比べ最大数の転写産物の検出に敏感であるが、コストが高い。
シングルセルRNAシーケンシング(scRNA-seq)の実際
ここでは主流になっている10xGenomics社のChromiumを用いた方法とSMART-seqなどを用いた方法に共通する方法の実際について議論する。シングルセルRNAシーケンシングの利用には、4つのステップがある。1)細胞をバラバラに単離すること。2)ライブラリーの作製とNGSシーケンシング。3)前処理(preprocessing、得られた配列の整理)。4)ダウンストリーム分析(生物学的な情報を得る)。これらのうち、2)の段階については、上に記述したように市販の機器や試薬を利用することが多くなっているので、各社のマニュアル等を参考にするのが現実的である。
組織からの細胞の分離=
血液細胞のように浮遊した細胞ではない場合、物理的あるいは酵素処理などによって、生組織から状態の良い細胞をdissociationする必要がある。神経系組織の酵素処理には、パパインを用いる方法が広く用いられている。ただ、しばしば問題となるのが、酵素処理のため短時間加温することで、発現が変化する遺伝子が存在することである。例えば、脳のミクログリアの解析には、低温下で組織をホモゲナイズするなどの工夫が必要であった(Hammond et al., 2019)。また、酵素処理時に転写阻害剤であるアクチノマイシンで処理することで、このような現象を抑制できる(Wu et al., 2017)。更に、ヒマラヤ氷河から得られた細菌Bacillus licheniformisから得られた低温プロテアーゼを用いる方法も報告されている(Adam et al., 2017)。 単離した細胞は、そのまま10xGenomicsのChromiumのプラットフォームに導入することができるが、抗体などを用いたFACS、パニング、磁気ビーズカラムなどによる細胞の単離を行う場合もある。 なお、ヒト組織などから生細胞を得ることは困難なことが多い。この場合、凍結した組織から、核を調製し、これを分析する方法がある()。更に、RNAを分析するscRNA-seqではないが、シングルセルの遺伝子発現を推定する方法として、トランスポゾンを用いることでゲノムのオープンクロマチン領域を選択的に検出し、ライブラリーを作製しシーケンスするATAC-seq (Assay for Transposase-Accessible Chromatin)がある。
scRNA-seqデータの前処理
Seurat, Scanpyなどのソフト。 Transcriptomeとの照合。質のチェック。 視覚化(Visualization。tSNE。
ダウンストリーム分析
Dimensionality Reductionとクラスタリング。 マーカー遺伝子とクラスタリングの同定。 DE遺伝子、の検出、MAST。 組成解析。 Trajectory interference 発生。発現の動態。
神経科学への応用
ニューロンのクラスとタイプ
様々な神経・精神疾患について理解しその診断や治療に役立てるためには、ニューロン、グリア細胞を中心にした神経系にある細胞の「タイプ」を識別し、それぞれの細胞における分子的な変化を観察することが重要である。近年、中枢神経系のグリア細胞にも、多様なアストロサイト、オリゴデンドロサイト、ミクログリアの存在が報告されてきている。一方で、ニューロンは著しく多様であり、このニューロンの多様性こそが、神経系を特徴づけており、その多彩で複雑な機能の発現に必須であることは疑う余地がない。 解剖学的な視点から言えば、すべてのニューロンの存在する位置は異なるので、すべてのニューロンは異なるという見方もできる。しかし、これは極論であり、従来の神経科学では、ニューロンの多様性は、それぞれのニューロンの解剖学的な位置、発現している分子、電気生理学、結合性、形態、神経伝達物質、神経伝達物質受容体とシグナル伝達によって識別されてきた。こうしたニューロンの多様性を便宜的に記述するのに、タイプ(type)、クラス(class)、サブクラス(subclass)、サブタイプ(subtype) というような用語が用いられてきた。しかし、本稿では混乱を防ぐため、Masland(2004)の提唱に従い、「クラス」と「タイプ」という単語を用いることとする。タイプは、これ以上分類することができないとされる階層である。例えば、大脳皮質の錐体細胞、網膜神経節細胞といった大雑把な識別は「クラス」と呼ぶ。大脳皮質の錐体細胞というクラスは、層や領野によって「タイプ」が異なるし、網膜神経節細胞には視覚情報によって応答が異なる「タイプ」が存在する。この分類は、免疫組織化学、形態、電気生理学などの技術により識別可能である暫定的なものに過ぎない。本稿で解説するscRNA-seqの技術は、その網羅性からそれぞれのニューロンについてこれまでにないビッグデータを提供することで、このニューロンのタイプの理解に確実な根拠を与えつつある。
大脳
その他のCNS
疾患
アルツハイマー、Autism
網膜
展望
一般的な方法としては、重鎖抗体を産生する動物を飼育し、それを抗原で免疫することで、重鎖抗体が得られる。比較的小型のリャマのほかに、アルパカ、ヒトコブラクダ、小型のネコザメ(Heterodontus francisci)などが免疫に利用されている。
次に免疫された動物から血液を採集し、その中にあるB細胞から、可変領域を含むcDNAライブラリーをM13ファージを使ったファージディスプレイライブラリーに組み込み、固定化した抗原を使ったスクリーニングすることで、cDNA配列を単離し、抗原に結合するナノボディ配列を知ることができる[1][2]。ラクダ科動物の遺伝子を組み込んだマウスも開発されているが、その利用は一般的ではないようである[3][4]。
このスクリーニングを効果的に行うための工夫が多数開発されてきている[5]。ファージディスプレイの担体の工夫、Staphylococcus carnosusのようなグラム陽性菌表面へのディスプレイ、酵母細胞表面へのディスプレイ、mRNAディスプレイ、リボソームディスプレイ、細胞内での2ハイブリッドスクリーニングなどが用いられてきている。
特に、最近、これらの方法を組み合わせることで、効率的に行う戦略が考案されている。Fridyらは、免疫動物の結合抗体を精製しその質量スペクトルの結果とファージディスプレイのハイスループットな配列決定を組み合わせる方法で、蛍光タンパク質に結合する多数のナノボディを報告した[6]。Zimmermann は、リボソームディスプレイ、ファージディスプレイ、ELISAを組み合わせることで、短期間にナノボディ配列を得る戦略を報告している[7]。また、McMahon らは、酵母ディスプレイを用いて、免疫動物を用いない合成ライブラリーをスクリーニングすることで親和性の高いナノボディ配列を得ることができることを示している[8] 。
ただ、このような非免疫ライブラリーや合成ライブラリーを用いる方法については、まだ適用例が多くなく、標準的な方法とされるものが存在しないというのが実情であろう。また、ある程度の抗原親和性を示すナノボディの配列を調整することで、親和性の成熟(affinity maturation)を行うこともできる[9] 。
将来的には人工知能などを使ったナノボディのデザインなども可能になるのかもしれない[10][11]。
通常、ナノボディは、目的別に発現ベクターにクローニングした後、哺乳類細胞だけなく、細菌、酵母、植物でも産生させることができる。哺乳類細胞では、抗体が本来機能する細胞外だけでなく、細胞内部でも発現させることが可能である(イントラボディ)。ただし、ナノボディの配列はそれぞれ異なり、ジスルフィド結合の生成が抗原との結合力あるコンフォメーションを取るために必要な場合、細胞外とは還元環境の異なる細胞内や細菌などでは活性のあるものが産生できないものもある。ナノボディの中には90℃という高温でも失活しないものもあるように[12][13]、一般に安定性は高いが、これも各ナノボディのアミノ酸配列から生じる特性による。
既知ナノボディ
ナノボディの情報を系統的に収集してきている中国の南京にある東南大学のiCAN (Institute Collection & Analysis of Nanobody)[14]には、2018年8月現在、約2400のナノボディ配列が登録されている。
1つのナノボディは、120アミノ酸(cDNAとして360bp)ほどなので、クローニングなどに利用するための配列を付加しても500bp未満の長さに収めることができる。したがって、利用したい特定ナノボディのアミノ酸配列がわかっていれば、いくつかの民間会社が提供している長鎖DNAを化学合成するサービスなどを利用することで短期間のうちにcDNA配列が入手可能である。
修飾
ナノボディだけでは 通常の抗体と違い定常領域を欠いているため、何らかの修飾が必要である。このことはナノボディが抗体のように簡便に利用できないという不便さになっているが、修飾を実験に合わせて自在に工夫できるという利点にもなっている。また、余分な構造を持たないので、バックグラウンドを低下させ、感度や精度の高い解析が可能になるという長所もある。
化学的カップリング
免疫組織化学に最もよく用いられているのは、ナノボディをタンパク質として精製後、色素分子などを化学的にカップリングするという方法である。このような試薬は既製のナノボディ試薬として市販もされている(例、ChromoTek社[15] )。最近、1次抗体を認識する「2次抗体」の活性を持つナノボディが報告されている[16] 。ナノボディの多くは、大腸菌で活性あるものを大量産生、精製することができるので、一度、配列がわかれば、動物を使用する必要がなくなる。
また、化学的なカップリングなので、カップリングする分子を変化させ工夫することで、目的に合わせて様々な標識ナノボディ(薬剤を結合した武装抗体など)を作製できる可能性がある[17] 。しかし、カップリングによるアミノ酸残基を修飾する反応により抗原結合能を失うことも想定される。この問題については、修飾するアミノ酸残基の位置を制御することで解決は可能である[18] 。
RANbody
化学的カップリング反応は、しばしばナノボディの活性を消失させるが、実験的にも条件決定など必ずしも容易ではない。この問題を克服するために開発されたプラットフォームがRANbody(Receptor-and-Nanobody)である[19]。
RANbodyは、1つのナノボディを酵素(改良型西洋ワサビペルオキシダーゼ HRP)、抗原性のあるニワトリ抗体IgYのFc断片、あるいは多重エピトープタグなどのうち1つと、組み換えDNA技術により融合させることで、検出可能にしたものである。プラスミドを293T細胞などの動物細胞に導入するだけで、培地中に放出されるので多くの生物医学系の実験室で利用できる。HRPは大腸菌の中では活性のある酵素として発現させることができない。その一つの解決策として、アスコルビン酸オキシダーゼ (APEX2)との融合タンパク質を大腸菌で発現させて用いることができるが、APEX2はHRPに比べて活性が弱い[20][21] 。
利用法
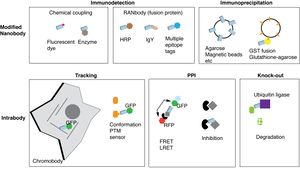
参考文献
- ↑ <pubmed>24577359</pubmed>
- ↑
Flajnik, M.F., & Dooley, H. (2009).
The generation and selection of single-domain, v region libraries from nurse sharks. Methods in molecular biology (Clifton, N.J.), 562, 71-82. [PubMed:19554288] [WorldCat] [DOI] - ↑
Zou, X., Smith, J.A., Nguyen, V.K., Ren, L., Luyten, K., Muyldermans, S., & Brüggemann, M. (2005).
Expression of a dromedary heavy chain-only antibody and B cell development in the mouse. Journal of immunology (Baltimore, Md. : 1950), 175(6), 3769-79. [PubMed:16148123] [WorldCat] [DOI] - ↑
Janssens, R., Dekker, S., Hendriks, R.W., Panayotou, G., van Remoortere, A., San, J.K., ..., & Drabek, D. (2006).
Generation of heavy-chain-only antibodies in mice. Proceedings of the National Academy of Sciences of the United States of America, 103(41), 15130-5. [PubMed:17015837] [PMC] [WorldCat] [DOI] - ↑
Liu, W., Song, H., Chen, Q., Yu, J., Xian, M., Nian, R., & Feng, D. (2018).
Recent advances in the selection and identification of antigen-specific nanobodies. Molecular immunology, 96, 37-47. [PubMed:29477934] [WorldCat] [DOI] - ↑
Fridy, P.C., Li, Y., Keegan, S., Thompson, M.K., Nudelman, I., Scheid, J.F., ..., & Rout, M.P. (2014).
A robust pipeline for rapid production of versatile nanobody repertoires. Nature methods, 11(12), 1253-60. [PubMed:25362362] [PMC] [WorldCat] [DOI] - ↑
Zimmermann, I., Egloff, P., Hutter, C.A., Arnold, F.M., Stohler, P., Bocquet, N., ..., & Seeger, M.A. (2018).
Synthetic single domain antibodies for the conformational trapping of membrane proteins. eLife, 7. [PubMed:29792401] [PMC] [WorldCat] [DOI] - ↑
McMahon, C., Baier, A.S., Pascolutti, R., Wegrecki, M., Zheng, S., Ong, J.X., ..., & Kruse, A.C. (2018).
Yeast surface display platform for rapid discovery of conformationally selective nanobodies. Nature structural & molecular biology, 25(3), 289-296. [PubMed:29434346] [PMC] [WorldCat] [DOI] - ↑
Yau, K.Y., Dubuc, G., Li, S., Hirama, T., Mackenzie, C.R., Jermutus, L., ..., & Tanha, J. (2005).
Affinity maturation of a V(H)H by mutational hotspot randomization. Journal of immunological methods, 297(1-2), 213-24. [PubMed:15777944] [WorldCat] [DOI] - ↑
Liberis, E., Velickovic, P., Sormanni, P., Vendruscolo, M., & Liò, P. (2018).
Parapred: antibody paratope prediction using convolutional and recurrent neural networks. Bioinformatics (Oxford, England), 34(17), 2944-2950. [PubMed:29672675] [WorldCat] [DOI] - ↑
Chevalier, A., Silva, D.A., Rocklin, G.J., Hicks, D.R., Vergara, R., Murapa, P., ..., & Baker, D. (2017).
Massively parallel de novo protein design for targeted therapeutics. Nature, 550(7674), 74-79. [PubMed:28953867] [PMC] [WorldCat] [DOI] - ↑
van der Linden, R.H., Frenken, L.G., de Geus, B., Harmsen, M.M., Ruuls, R.C., Stok, W., ..., & Verrips, C.T. (1999).
Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies. Biochimica et biophysica acta, 1431(1), 37-46. [PubMed:10209277] [WorldCat] [DOI] - ↑
Akazawa-Ogawa, Y., Takashima, M., Lee, Y.H., Ikegami, T., Goto, Y., Uegaki, K., & Hagihara, Y. (2014).
Heat-induced irreversible denaturation of the camelid single domain VHH antibody is governed by chemical modifications. The Journal of biological chemistry, 289(22), 15666-79. [PubMed:24739391] [PMC] [WorldCat] [DOI] - ↑
Zuo, J., Li, J., Zhang, R., Xu, L., Chen, H., Jia, X., ..., & Xie, W. (2017).
Institute collection and analysis of Nanobodies (iCAN): a comprehensive database and analysis platform for nanobodies. BMC genomics, 18(1), 797. [PubMed:29041922] [PMC] [WorldCat] [DOI] - ↑ https://www.chromotek.com/
- ↑
Pleiner, T., Bates, M., & Görlich, D. (2018).
A toolbox of anti-mouse and anti-rabbit IgG secondary nanobodies. The Journal of cell biology, 217(3), 1143-1154. [PubMed:29263082] [PMC] [WorldCat] [DOI] - ↑
Traenkle, B., & Rothbauer, U. (2017).
Under the Microscope: Single-Domain Antibodies for Live-Cell Imaging and Super-Resolution Microscopy. Frontiers in immunology, 8, 1030. [PubMed:28883823] [PMC] [WorldCat] [DOI] - ↑
Pleiner, T., Bates, M., Trakhanov, S., Lee, C.T., Schliep, J.E., Chug, H., ..., & Görlich, D. (2015).
Nanobodies: site-specific labeling for super-resolution imaging, rapid epitope-mapping and native protein complex isolation. eLife, 4, e11349. [PubMed:26633879] [PMC] [WorldCat] [DOI] - ↑
Yamagata, M., & Sanes, J.R. (2018).
Reporter-nanobody fusions (RANbodies) as versatile, small, sensitive immunohistochemical reagents. Proceedings of the National Academy of Sciences of the United States of America, 115(9), 2126-2131. [PubMed:29440485] [PMC] [WorldCat] [DOI] - ↑
Buser, D.P., Schleicher, K.D., Prescianotto-Baschong, C., & Spiess, M. (2018).
A versatile nanobody-based toolkit to analyze retrograde transport from the cell surface. Proceedings of the National Academy of Sciences of the United States of America, 115(27), E6227-E6236. [PubMed:29915061] [PMC] [WorldCat] [DOI] - ↑
Lam, S.S., Martell, J.D., Kamer, K.J., Deerinck, T.J., Ellisman, M.H., Mootha, V.K., & Ting, A.Y. (2015).
Directed evolution of APEX2 for electron microscopy and proximity labeling. Nature methods, 12(1), 51-4. [PubMed:25419960] [PMC] [WorldCat] [DOI]