英語名:Glutamic acid 独:Glutaminsäure 仏:Acide glutamique 略称:Glu, E
| Glutamic acid | |
|---|---|
| |
| |
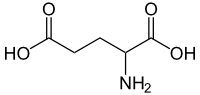
Glutamic acid | |
別称 2-Aminopentanedioic acid 2-Aminoglutaric acid | |
| Identifiers | |
| 617-65-2 | |
| ChEBI | |
| ChEMBL | ChEMBL276389 |
| ChemSpider | 591 |
| |
| Jmol-3D images | Image |
| KEGG | D04341 |
| |
| UNII | 61LJO5I15S |
| Properties | |
| C5H9NO4 | |
| Molar mass | 147.130 g·mol−1 |
| Appearance | white crystalline powder |
| Density | 1.4601 (20 °C) |
| Melting point | 199 °C decomp. |
| 8.64 g/l (25 °C) [1] | |
| Solubility | 0.00035g/100g ethanol 25 degC [2] |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
タンパク質を構成するアミノ酸の一つであり、ヒトを初めとする動物においては非必須アミノ酸、即ち他の有機化合物から合成する事が出来るアミノ酸である。脊椎動物中枢神経系での主要な神経伝達物質である。また、節足動物では、神経筋接合部に於ける神経伝達物質である。イオンチャネル型、代謝活性型の2種類のグルタミン酸受容体を介して作用し、主要な興奮性伝達を担う。一方で、過剰な活性は神経細胞死を引き起こす。またグルタミン酸性シナプスの異常により統合失調症、自閉症が引き起こされるとも考えられている。
発見の歴史
グルタミン酸は、Karl Heinrich Leopold Ritthausenにより1866年、小麦タンパク質であるグルテンの酸加水分解物の中から発見された。一方、池田菊苗は、甘味、塩味、苦味、酸味とは別の味があるのに気づきうまみと名付け、昆布からその成分を抽出してグルタミン酸である事を見出した。
神経組織への影響に初めて気づいたのは林髞であった。彼は、ネコの大脳皮質にグルタミン酸を投与するとネコが興奮する事に気づいた。一方、LucusとNewhouseらはグルタミン酸塩の皮下注射が網膜に損傷を起こす事に気づいた。この神経興奮作用と神経変性作用は現在では密接に関連した現象である事が判っているが、当時はその関係は思いもよらなかった。中枢神経組織内にあまりに多く含まれていたのが一つの原因である。そのため、早期に神経伝達物質として考えられていたカテコールアミン、アセチルコリンなどとと比較して神経伝達物質であると確立されるのは遅れた。
ある物質が神経伝達物質として機能する事の証明には、まずその物質が組織に存在し合成系がある事、その物質を作用させる事でシナプス伝達と同様の現象が起こる事、その物質の拮抗薬を作用させる事でシナプス伝達も抑制される事、刺激に応じて放出される事、不活化過程がある事などがあげられる(篠崎)。したがって、拮抗薬の存在が必須であるが、その開発は遅れていた。
J. C. Watkinsらは系統的に直鎖状のグルタミン酸分子の変異体を作って興奮性アミノ酸として機能するかを検討した。その結果、D-アスパラギン酸のアミノ基にさらにメチル基がついたN-メチル-D-アスパラギン酸(NMDA)が、グルタミン酸と比較して数十倍に上る活性を持つ事を見いだした。さらに、炭素数を一つ増やしたD体のω位(この場合はα位の炭素より最も遠い炭素を指す)のカルボン酸をホスホン酸としたD-(-)-2-アミノ-5-ホスホノペンタン酸(D-(-)-2-amino-5-phosphonopentanoic acid, AP5)がその働きを特異的に抑える事に気づいた。この事から、グルタミン酸受容体にはNMDA型ならびに非NMDA型がある事を提唱した。
竹本常松らは駆虫薬である使君子(Quisqualis indica)の種子ならびに海人草(Digenea simplex)の有効成分がそれぞれ、キスカル酸、カイニン酸であると同定した。篠崎温彦はこれらの物質が、興奮性アミノ酸と類似している事に気づき、非NMDA型グルタミン酸受容体を活性化する事に気づいた。しかもこの両者は別々な受容体を活性化した。これによりイオンチャネル型受容体はNMDA型、キスカル酸型、カイニン酸の3つに分けられる事が示された。
また神経細胞内に取り込み、さらにシナプス顆粒内に貯蔵するためのトランスポーターも分子として同定され、グルタミン酸の中枢神経系における神経伝達物質としての機能は確固たるものとなった。
1. Vickery HB, Schmidt CLA. The history of the discovery of the amino acids. Chem Rev 1931;9:169–318. 2. Fischer E. Einleitung [Introduction]. In: Fischer E, ed. Untersuchungen u ̈ber Aminosa ̈uren, Polypeptide und Prote ̈ıne [Studies on amino acids, polypeptides, and protein] (1899–1906). Berlin: Julius Springer Verlag, 1906:69 (in German). Glutamate: from discovery as a food flavor to role as a basic taste (umami)1–3 Kenzo Kurihara Ritthausen, K. (1913). On a procedure for separating inosinic acid. Journal of Tokyo Chemical Society, 34, 751–757. Glutamate. Its applications in food and contribution to health S. Jinap *, P. Hajeb https://www.jstage.jst.go.jp/article/fpj1944/116/3/116_3_125/_pdf
化学的性質
1個のアミノ基と2個のカルボン酸があるため、水によく溶け、溶液は酸性である。さらに溶解度を上げたいときは、水酸化ナトリウムを加えるか、一ナトリウム塩を用いる。同じ理由により、タンパク質に埋め込まれた場合も、酸性の側鎖となる。比較的安定な物質ではあるが、ピロリドンカルボン酸(pyrrolidonecarboxylic acid)に次第に変化していくため、長期には凍結保存するか、粉末から用時調整する。
生合成
神経伝達物質としての役割
グルタミン酸は脊椎動物中枢神経系の殆どの早い興奮性伝達物質を担っている他、遅いシナプス伝達の一部も担う。そのため、上位中枢から脊髄に至るまで、グルタミン酸性シナプスは広く分布している。また節足動物では神経筋接合部もグルタミン酸によって担われている。
シナプス顆粒への取り込み
シナプス前終末内部のシナプス顆粒に小胞型グルタミン酸輸送体 (vesicular glutamate transporter, VGluT)によって濃縮される。VGluTは1-3のサブタイプが存在し、solute carrier (SLC)ファミリータンパク質に属する(VGluT1=SLC17A7、VGluT2=SLC17A6、VGluT3=SLC17A8)。また、小胞型興奮性アミノ酸輸送体 (vesicular excitatory amino acid transporter, VEAT=SLC17A5)もグルタミン酸並びにアスパラギン酸をシナプス顆粒内に輸送する[3]。
いずれも同じく小胞上にある顆粒型F0F1-ATPaseによって作られるプロトン濃度勾配とそれによって生じた電位勾配をを利用して細胞質側から顆粒内へグルタミン酸を濃縮する。最終的な顆粒内グルタミン酸濃度は100 mMに及ぶ。
イオンチャネル型受容体
グルタミン酸神経伝達のうち、早い成分を担っているのがイオンチャネル型グルタミン酸受容体である。脊椎動物ではカチオンチャネルである興奮性のグルタミン酸受容体のみであるが、無脊椎動物では、塩素チャネルである抑制型のグルタミン酸受容体も知られている。
興奮性グルタミン酸受容体は次の3種に大きく分けられる。いずれも、大きな細胞外ドメインに3つの膜貫通領域(M1、M3、M4)とそれに挟まれた膜にループ状に埋め込まれるM2領域、細胞内ドメインからなる。テトラマーを形成される。
AMPA型グルタミン酸受容体
- 古くはキスカル酸型グルタミン酸受容体といわれたが、キスカル酸は代謝活性型グルタミン酸受容体も刺激する事が判ったため、より特異的なアゴニストである2-amino-3-(3-hydroxy-5-methyl-isoxazol-4-yl)propanoic acid (AMPA)からAMPA型グルタミン酸受容体といわれるようになった。拮抗阻害薬にはNBQXがよく用いられる。
- AMPA型グルタミン酸受容体は、通常の場合、膜電位によらず機能する。そのため、静止膜電位付近のシナプス伝達を担っている。チャネルはNa+、K+に対して透過性が高い。
- GluA1-4(以前はGluR1-4と呼ばれていた)の4つのサブタイプがあり、リガンド結合領域がFLIP型、FLOP型の選択的スプラインシング、またサブタイプによっては細胞内ドメインも選択的スプラインシングを受ける。
- GluA2サブユニットではチャネル壁を構成する一つのアミノ酸がmRNAの編集によりグルタミンからアルギニンに変化する。その他のサブユニットではグルタミンのままである。このため、GluA2を含む受容体と含まない受容体では整流特性、イオン透過性がかわっている。
詳細はAMPA型グルタミン酸受容体の項目参照。
カイニン酸型グルタミン酸受容体
- カイニン酸受容体はGluK1-3 (GluR5-7)、GluK4,5 (KA1-2)からなる。AMPA型受容体、NMDA型受容体と比較して中枢神経系での伝達の寄与は小さい。
NMDA型グルタミン酸受容体
- NMDAにより特異的に活性化される。拮抗的阻害剤としては、D-AP5、D-CPP(D-AP7を環状化したもの)、非拮抗的阻害剤としてはMK801、フェンサイクリジン、ケタミンなどが知られている。また、コアゴニストとしてグリシンまたはD-セリンを必要とする。
- 通常静止膜電位付近では、Mg2+によりチャネルが塞がれており、活性化にはある程度の脱分極が必要である。そのため、ある程度の神経活動がある時にのみ活動する。AMPA型受容体とは異なり、Ca2+透過性が高く、活性化により細胞内Ca2+濃度が上昇する。シナプス可塑性にはこのCa2+が必須である。
- 通常GluN1(NR1)、GluN2A-D(NR2A-D)から構成される。すべての受容体にGluN1は含まれる一方、GluN2は組織により特定のサブユニットが含まれており、電気生理学的特性を規定していると考えられる。また一部はGluN3A,B(NR3A,B)サブユニットも含むと考えられる。GluN3がGluN1、GluN2と複合体に共存すると、ドミナントネガティブ体として働く。また、GluN1とだけ複合体を作ると、グリシン単独で開くチャネルが形成されるが、実際に神経組織で、グリシン受容体として機能しているかは不明である。
詳細はNMDA型グルタミン酸受容体の項目参照
代謝活性型受容体
リガンド結合領域を含む細胞外N末端、7回膜貫通領域、細胞内C末端からなる。Gタンパク質共役受容体の一つであるが、ロドプシンとの相同性はほとんどない。 ホスホリパーゼCを活性化する事によりイノシトール3リン酸/Ca2+/リン脂質依存性タンパク質リン酸化酵素 (Cキナーゼ)経路につながるサブグループI、DCG-IVにより活性化され、cAMP産生を抑制するサブグループII、L−AP4により活性化され、cAMP産生を抑制するサブグループIIIが存在する。遅いシナプス伝達やシナプス前抑制に関与する。
再取り込み
シナプス間隙に放出されたグルタミン酸は細胞膜に存在するグルタミン酸輸送体(Excitatory amino acid transporter, EAAT)によって細胞内へ取り込まれる事で不活化される。EAATはVGluTと同じくSLCタンパク質スーパーファミリーに属し、1-5までのサブタイプが存在する。EAAT1 と2はグリア細胞に存在し、3、4はニューロン、5は網膜に存在する。取り込みに要するエネルギーはEAAT1-3は細胞膜内外のNa+、K+勾配、EAAT4、5はCl−勾配を用いている。
神経細胞膜に存在するEAATにより取り込まれたグルタミン酸は再利用される。グリア細胞の膜に存在する。
疾患との関わり
興奮毒性
自閉症
ゲノム解析の結果より、自閉症関連遺伝子が同定された。それの中にShank、neuroligin、neurexinといった、グルタミン酸性シナプスの構成要素が見いだされている。Shankはシナプス後部でHomerと共にシナプス後膜肥厚のframeworkを形成する。Neuroliginは、GKAPとPSD-95を介し、Shankと結合し、一方、シナプス前部のneurexinと結合する。また、モデル動物においても、社会性の異常などが認められ、それは薬理学的なグルタミン酸伝達の増強によって是正される。この事は、中枢神経系におけるグルタミン酸性シナプス伝達の異常が自閉症を引き起こしている事を示唆する。ただし、これはごく一部の患者でしか認められず、自閉症全体を説明するものではない事に注意を要する。
関連項目
参考文献
- ↑ http://hazard.com/msds/mf/baker/baker/files/g3970.htm
- ↑ http://books.google.ch/books?id=xteiARU46SQC&pg=PA15&lpg=PA15&dq=methionine+solubility+in+ethanol&source=bl&ots=HzHueOPPoB&sig=KjMXxDNgjSvG1CddED9lfaYEhKQ&hl=en&sa=X&ei=2-26T-bZK-mX0QWt3I2ACA&redir_esc=y#v=onepage&q=methionine%20solubility%20in%20ethanol&f=false
- ↑
Omote, H., Miyaji, T., Juge, N., & Moriyama, Y. (2011).
Vesicular neurotransmitter transporter: bioenergetics and regulation of glutamate transport. Biochemistry, 50(25), 5558-65. [PubMed:21612282] [WorldCat] [DOI]
(執筆者:林 康紀 担当編集委員:尾藤晴彦)