江藤 圭、石橋 仁、鍋倉 淳一
自然科学研究機構生理学研究所
DOI:10.14931/bsd.3042 原稿受付日:2012年12月25日 原稿完成日:2014年3月13日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:inhibitory amino acids 独:inhibitorische Aminosäuren, hemmende Aminosäuren 仏:acide aminé inhibiteur
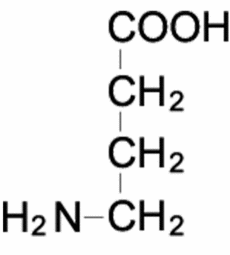
| γ-Aminobutyric acid | |
|---|---|
| |
| |
4-aminobutanoic acid | |
| Identifiers | |
| 56-12-2 | |
| ChEBI | |
| ChEMBL | ChEMBL96 |
| ChemSpider | 116 |
| DrugBank | {{{value}}} |
| |
| 1067 | |
| Jmol-3D images | Image |
| KEGG | D00058 |
| MeSH | gamma-Aminobutyric+Acid |
| PubChem | 119 |
| |
| UNII | 2ACZ6IPC6I |
| Properties | |
| Molar mass | 103.12 g/mol |
| Appearance | white microcrystalline powder |
| Density | 1.11 g/mL |
| Melting point | 203.7 °C (398.7 °F; 476.8 K) |
| Boiling point | |
| soluble | |
| Acidity (pKa) | 4.23 (carboxyl), 10.43 (amino)[1] |
| 危険性 | |
| Main hazards | Irritant, Harmful |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
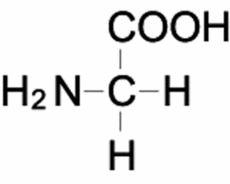
| Glycine[2] | |
|---|---|
| |
| |
Glycine | |
別称 Aminoethanoic acid Aminoacetic acid | |
| Identifiers | |
| 56-40-6 | |
| Abbreviations | Gly, G |
| ATC code | |
| ChEBI | |
| ChEMBL | ChEMBL773 |
| ChemSpider | 730 |
| DrugBank | {{{value}}} |
| EC-number | [1] |
| |
| 727 | |
| Jmol-3D images | Image |
| KEGG | D00011 |
| PubChem | 750 |
| |
| UNII | TE7660XO1C |
| Properties | |
| C2H5NO2 | |
| Molar mass | 75.07 g·mol−1 |
| Appearance | white solid |
| Density | 1.607 g/cm3 |
| Melting point | 233 °C (decomposition) |
| 24.99 g/100 mL (25 °C)[3] | |
| Solubility | soluble in ethanol, pyridine insoluble in ether |
| Acidity (pKa) | 2.34 (carboxyl), 9.6 (amino)[1] |
| 危険性 | |
| 半数致死量 LD50 | 2600 mg/kg (mouse, oral) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
抑制性アミノ酸は、中枢神経系の抑制性シナプス伝達を担うアミノ酸であり、ガンマ-アミノ酪酸(γ-aminobutyric acid; GABA)とグリシンがある。
GABA
GABAは、イモなどの植物に含まれるアミノ酸として古くから知られていたが、1950年代になって、林髞らにより脳にGABAを注入すると抑制作用を示すことが明らかにされ[4]、1966年には大塚正徳らが、ザリガニの神経筋接合部においてGABAが刺激に応じて放出されることを証明し、GABAの抑制性伝達物質としての同定に寄与した[5]。その後、1967年にKrnjevicとSchwartzがGABAが抑制性神経伝達物質であると証明し[6]、今日では、哺乳動物の中枢神経系において、GABAが抑制性伝達物質であることは広く認識されている。もちろん、GABAは中枢神経系以外にも、さまざまな非神経組織に存在して、その組織特有の生理機能を有していると考えられている。
生合成
GABAの生合成に関しては、脳内では主に、グルタミン酸デカルボキシラーゼ(glutamic acid decarboxylase; GAD)による脱炭酸によって、グルタミン酸から産生される[7]。このGADには、 分子量が 65300と66600の2つのアイソフォーム(GAD65とGAD67)が知られており、どちらも同一の抑制性神経細胞に存在するが、GAD67が細胞質全体に存在するのに対してGAD65は神経終末部に豊富に存在することから[8]、GAD65が抑制性シナプス伝達を担うGABA合成に関与すると考えられている[9]。
GABAの合成に関しては、TCAサイクルのα-ケトグルタル酸からグルタミン酸を経由してGABAが合成される経路がある[10]。また、神経終末部では、細胞外からグルタミン酸輸送体により、グルタミン酸が取り込まれてGAD65によりGABAが合成される。GABAの分解過程では、GABAはGABA transaminaseによりコハク酸セミアルデヒドとなり、その後酸化されてコハク酸となりTCAサイクルに入る。
-
図.GABAの合成・代謝経路
機能
神経終末部でGAD65により新たに作られたGABAは、小胞型抑制性アミノ酸運搬体(VIAAT、VGATとも呼ばれる)によりシナプス小胞内へ充填され、神経終末部から放出される[11] [12]。
GABAは、GABAA受容体、GABAB受容体、GABAC受容体の3種の受容体に作用することによってその生理機能を発揮する[13]。GABAAとGABAB受容体は中枢神経系に広く分布し、GABAC受容体は成熟脊椎動物ではほぼ網膜のみに限局して分布する。GABAAとGABAC受容体はイオンチャネル型受容体で、Clイオンを主に透過させる。GABAA受容体はαサブユニット、βサブユニット、γサブユニット、δサブユニット、εサブユニットなどによって構成される五量体であるが、脳部位によってサブユニットの発現が異なっている。また、構成サブユニットの違いにより薬物に対する感受性も異なる。GABAC受容体は ρサブユニットで形成される五量体であり、GABAA受容体を抑制するビククリンに感受性がないなど、GABAA受容体とは薬物感受性がかなり異なっている[13]。GABAA受容体はゲフェリンという足場タンパク質によりシナプス部位に維持される[14]。
GABAAおよびGABAC受容体を介した抑制効果は、神経細胞内のCl濃度により変化する。通常、成熟期の神経細胞内Cl濃度は低く保たれており、Clの平衡電位は静止電位よりも過分極側にあるため、GABAA受容体およびGABAC受容体の応答は過分極性である。しかし、発達期においてGABAは脱分極作用(興奮性作用)を示すことがある。これは、細胞内からClを排出する役割を担うトランスポーターの機能や発現が、成熟期の神経細胞と異なるためである[15] [16]。
GABAB受容体は、GABAB1およびGABAB2サブユニットからなる代謝型受容体で、GABAはGABAB1受容体に結合し、GABAB2受容体はGi/oタンパク質を活性化する。GABAB受容体の生理機能としては、K+チャネルの活性化、Ca2+チャネルの抑制、アデニル酸シクラーゼの抑制などの作用がある[17]。
グリシン
グリシンはタンパク質を構成するアミノ酸の中でも最も単純な構造を持っており、不斉炭素を持たないため、D体や L 体といった立体異性体が存在しない。中枢神経系においては、GABAとともに抑制性シナプス伝達を担う。グリシンは、シナプス外に存在するNMDA型グルタミン酸受容体に結合してその機能を調節し[18]、NMDA型グルタミン酸受容体を介した神経細胞死にも関与する[19]。また、グリシンは髄鞘に存在するGluN1とGluN3から成るNMDA受容体にも結合する[20]。グリシンは、主に脊髄や脳幹においてGABAとともに抑制性神経伝達物質として働くが、大脳皮質などの上位中枢では抑制性シナプス伝達はGABAが担っている。
生合成
グリシンは、食事から摂取する他、生体内でもいくつかの経路で合成される。生体内では、
- グリオキシル酸とグルタミン酸からグリシントランスアミナーゼの作用により合成、
- グルタミン酸デカルボキシラーゼ、セリンヒドロキシメチルトランスフェラーゼによって葉酸依存性にセリンから合成
- スレオニン(threonine)の異化
- コリンの代謝
によってグリシンが生成する。
機能
抑制性伝達物質としてグリシンが機能するためには、シナプス前神経終末部のシナプス小胞にグリシンが取り込まれて、神経終末部から放出される必要がある。グリシンを放出する抑制性シナプス前神経終末部には、グリシントランスポーター2型(GlyT2)が発現しており、これによってグリシンが神経終末部内へ取り込まれることにより、グリシン濃度が高まる[21]。神経終末部に取り込まれたグリシンは、小胞型抑制性アミノ酸運搬体によりシナプス小胞内へ充填され、神経終末部から放出される。小胞型抑制性アミノ酸運搬体はグリシンだけでなくGABAも輸送するので、単一神経終末部から GABAとグリシンが共放出(co-release)されることがある[22]。
グリシンはグリシン受容体に作用することで抑制性作用を示す。この作用はストリキニーネで拮抗される。NMDA型グルタミン酸受容体のグリシン結合部位はストリキニーネ感受性がない。グリシン受容体はGABAA受容体と同様Clイオンを通すイオンチャネル型受容体で、αサブユニットとβサブユニットから成る五量体である。グリシン受容体はGABAA受容体と同様にゲフェリンによりシナプス部位に維持される[14]。
関連項目
参考文献
- ↑ 1.0 1.1 Dawson, R.M.C., et al.
Data for Biochemical Research
Oxford, Clarendon Press, 1959. - ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (11th ed.), Merck, 1989, ISBN 091191028X, 4386.
- ↑ http://prowl.rockefeller.edu/aainfo/solub.htm
- ↑
HAYASHI, T. (1958).
Inhibition and excitation due to gamma-aminobutyric acid in the central nervous system. Nature, 182(4642), 1076-7. [PubMed:13590228] [WorldCat] [DOI] - ↑
Otsuka, M., Iversen, L.L., Hall, Z.W., & Kravitz, E.A. (1966).
Release of gamma-aminobutyric acid from inhibitory nerves of lobster. Proceedings of the National Academy of Sciences of the United States of America, 56(4), 1110-5. [PubMed:5230136] [PMC] [WorldCat] [DOI] - ↑
Krnjević, K., & Schwartz, S. (1967).
The action of gamma-aminobutyric acid on cortical neurones. Experimental brain research, 3(4), 320-36. [PubMed:6031164] [WorldCat] [DOI] - ↑
Erlander, M.G., Tillakaratne, N.J., Feldblum, S., Patel, N., & Tobin, A.J. (1991).
Two genes encode distinct glutamate decarboxylases. Neuron, 7(1), 91-100. [PubMed:2069816] [WorldCat] [DOI] - ↑
Esclapez, M., Tillakaratne, N.J., Kaufman, D.L., Tobin, A.J., & Houser, C.R. (1994).
Comparative localization of two forms of glutamic acid decarboxylase and their mRNAs in rat brain supports the concept of functional differences between the forms. The Journal of neuroscience : the official journal of the Society for Neuroscience, 14(3 Pt 2), 1834-55. [PubMed:8126575] [WorldCat] - ↑
Soghomonian, J.J., & Martin, D.L. (1998).
Two isoforms of glutamate decarboxylase: why? Trends in pharmacological sciences, 19(12), 500-5. [PubMed:9871412] [WorldCat] [DOI] - ↑
Waagepetersen, H.S., Sonnewald, U., Larsson, O.M., & Schousboe, A. (1999).
Synthesis of vesicular GABA from glutamine involves TCA cycle metabolism in neocortical neurons. Journal of neuroscience research, 57(3), 342-9. [PubMed:10412025] [WorldCat] - ↑
McIntire, S.L., Reimer, R.J., Schuske, K., Edwards, R.H., & Jorgensen, E.M. (1997).
Identification and characterization of the vesicular GABA transporter. Nature, 389(6653), 870-6. [PubMed:9349821] [WorldCat] [DOI] - ↑
Sagné, C., El Mestikawy, S., Isambert, M.F., Hamon, M., Henry, J.P., Giros, B., & Gasnier, B. (1997).
Cloning of a functional vesicular GABA and glycine transporter by screening of genome databases. FEBS letters, 417(2), 177-83. [PubMed:9395291] [WorldCat] [DOI] - ↑ 13.0 13.1
Bormann, J. (2000).
The 'ABC' of GABA receptors. Trends in pharmacological sciences, 21(1), 16-9. [PubMed:10637650] [WorldCat] [DOI] - ↑ 14.0 14.1
Tyagarajan, S.K., & Fritschy, J.M. (2014).
Gephyrin: a master regulator of neuronal function? Nature reviews. Neuroscience, 15(3), 141-56. [PubMed:24552784] [WorldCat] [DOI] - ↑
Ganguly, K., Schinder, A.F., Wong, S.T., & Poo, M. (2001).
GABA itself promotes the developmental switch of neuronal GABAergic responses from excitation to inhibition. Cell, 105(4), 521-32. [PubMed:11371348] [WorldCat] [DOI] - ↑
Shibata, S., Kakazu, Y., Okabe, A., Fukuda, A., & Nabekura, J. (2004).
Experience-dependent changes in intracellular Cl- regulation in developing auditory neurons. Neuroscience research, 48(2), 211-20. [PubMed:14741396] [WorldCat] [DOI] - ↑
Xu, C., Zhang, W., Rondard, P., Pin, J.P., & Liu, J. (2014).
Complex GABAB receptor complexes: how to generate multiple functionally distinct units from a single receptor. Frontiers in pharmacology, 5, 12. [PubMed:24575041] [PMC] [WorldCat] [DOI] - ↑
Dingledine, R., Borges, K., Bowie, D., & Traynelis, S.F. (1999).
The glutamate receptor ion channels. Pharmacological reviews, 51(1), 7-61. [PubMed:10049997] [WorldCat] - ↑
Katsuki, H., Watanabe, Y., Fujimoto, S., Kume, T., & Akaike, A. (2007).
Contribution of endogenous glycine and d-serine to excitotoxic and ischemic cell death in rat cerebrocortical slice cultures. Life sciences, 81(9), 740-9. [PubMed:17698151] [WorldCat] [DOI] - ↑
Piña-Crespo, J.C., Talantova, M., Micu, I., States, B., Chen, H.S., Tu, S., ..., & Lipton, S.A. (2010).
Excitatory glycine responses of CNS myelin mediated by NR1/NR3 "NMDA" receptor subunits. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(34), 11501-5. [PubMed:20739572] [PMC] [WorldCat] [DOI] - ↑
Gomeza, J., Hülsmann, S., Ohno, K., Eulenburg, V., Szöke, K., Richter, D., & Betz, H. (2003).
Inactivation of the glycine transporter 1 gene discloses vital role of glial glycine uptake in glycinergic inhibition. Neuron, 40(4), 785-96. [PubMed:14622582] [WorldCat] [DOI] - ↑
Wojcik, S.M., Katsurabayashi, S., Guillemin, I., Friauf, E., Rosenmund, C., Brose, N., & Rhee, J.S. (2006).
A shared vesicular carrier allows synaptic corelease of GABA and glycine. Neuron, 50(4), 575-87. [PubMed:16701208] [WorldCat] [DOI]