概要
摂食行動は視床下部を中心として、大脳皮質から脊髄までの神経ネットワークによって制御されている。神経ネットワークの中核にはニューロペプチドY(NPY)産生細胞に代表される摂食行動を促進する神経細胞と、POMC産生細胞に代表される摂食行動を抑制する神経細胞が存在している。グルコースの他、グレリン、コレシストキニン、レプチンなど個体の栄養状態を反映するホルモンは、この神経ネットワークを介して、摂食行動の開始と終止、1日の摂食量、短期的または長期的な体重変動を制御している。
歴史
ネコを用いた破壊実験から、腹内側核に満腹中枢があり、外側野に空腹中枢があると考えられてきた。しかし、過去の破壊実験の多くは近傍の神経線維の破壊を伴うため、単純には解釈できない。例えば、外側野の破壊時には内側前脳束も損傷するが、内側前脳束には摂食行動や報酬行動に重要なドパミン神経線維が豊富に存在する。腹内側核を破壊すると、弓状核からの腹内側核や室傍核への投射線維も破壊されるため、観察される摂食行動変化の原因が腹内側核と弓状核のどちらにあるかを決めることができない。しかし、Cre-loxPシステムを利用した遺伝子改変マウスの開発により、特定の神経細胞集団での遺伝子発現変化が摂食行動や体重制御に与える影響を検討することが可能となり、この10年で摂食制御の神経ネットワークについての理解が大きく進展した。
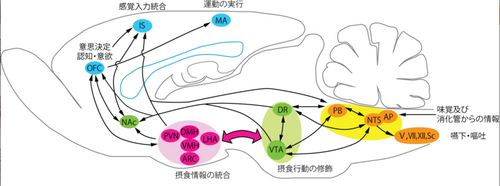
摂食制御に関わる神経核
大脳
- 島皮質
島皮質には味覚、嗅覚を含めたすべての特殊感覚情報が集まるほか、消化管を含めた内臓感覚情報も入力があり、意識、情動、疼痛、恐怖に深く関与している。眼窩前頭皮質を含めた前頭前皮質、側坐核、視床下部、結合腕傍核、孤束核などとの線維連絡がある。空腹時に島皮質の活動が高まることから、摂食行動促進に関与していると考えられている。
- 眼窩前頭皮質
眼窩前頭皮質は、味覚情報が島皮質周辺を経て集まる他、嗅覚や口腔感覚情報が集まり、摂食時の感覚が統合される。さらに、眼窩前頭皮質は側坐核や扁桃体と密な線維連絡を持ち、報酬行動、意思決定に重要な役割を果たすことが知られている。眼窩前頭皮質は空腹時に活性化し、前頭前皮質の運動の実行開始を制御する部位と密な線維連絡を持つことから、摂食に向かう行動開始の決定と実行に重要であると考えられている[1]。
- 側坐核
側坐核は腹側被蓋野からドパミン神経の投射を受け、眼窩前頭皮質や島皮質とも線維連絡があり、摂食の快さ、報酬的側面に基づいた摂食行動の促進に関与していると考えられている[2]。側坐核にGABA受容体作動薬やグルタミン酸受容体拮抗薬を投与すると摂食行動が促進するが、とくに甘みや脂質に富んだ餌の摂取量が増加する。側坐核はメラニン凝集ホルモン(melanin-concentrating hormone: MCH)受容体を豊富に発現し、MCH神経の密な投射がある。
視床下部
- 弓状核
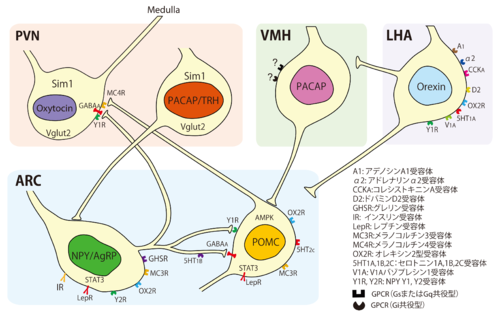
- NPY/AgRP神経
弓状核のNPY/AgRP神経は摂食行動を促進する。ジフテリア毒素受容体をNPY/AgRP神経細胞のみに発現させたマウスにジフテリアトキシンを投与すると、NPY/AgRP神経が数日で脱落する。この脱落に伴って、マウスの摂食量や体重が低下する[3]。NPY/AgRP神経細胞はGABA作動性であり、POMC神経細胞に投射してPOMC神経細胞を抑制するほか、室傍核、孤束核、結合腕傍核へ抑制性の投射をしている。NPY/AgRP神経から室傍核への投射はAgRPによるメラノコルチン4型受容体への逆作動薬としての活性が重要でありNPY・AgRP神経から孤束核、結合腕傍核へのGABA作動性投射により嘔気、嘔吐を抑制し、摂食行動を促進する。NPY/AgRP神経細胞はレプチン、グレリン、オレキシン、インスリン、セロトニンなどの受容体を発現しており、レプチンにより抑制性に、グレリンにより興奮性に制御される。
- POMC神経
弓状核のPOMC神経はα-MSHを介して摂食行動を抑制する。αMSHによる摂食行動抑制の主な標的は室傍核のメラノコルチン4型受容体陽性神経細胞と考えられている[4]。POMC神経細胞の大部分は、NPY/AgRP神経細胞と異なりGABA作動性ではない。POMC神経細胞にはオレキシンの摂食、体重制御に重要なオレキシン2型受容体やレプチン、セロトニン、NPYの受容体も豊富に発現している[5]。また、ATP感受性Kチャネルの変異型サブユニットをPOMC神経細胞に発現させ、POMC神経細胞のグルコースの感知が正常に機能しないマウスは、全身的に耐糖能が低下することから、POMC神経細胞が摂食行動だけでなく糖代謝制御にも重要な役割を果たしている[6]。NPY/AgRP, POMC神経共に、細胞内エネルギーが負の状態で活性化するAMPKを発現しており、これらの細胞のAMPKはレプチンやインスリン、グルコースによって活性が落ちる[7]。POMC神経細胞のAMPK機能を低下させたマウスは軽度の肥満を示すが、AgRP神経細胞のAMPK機能を低下させたマウスの体重や摂食量はほぼ正常である[8]。エストロゲンは摂食行動を抑制するが、エストロゲン受容体は弓状核に豊富に発現しており、エストロゲンによってPOMCの発現が増加する[9]。
- 腹内側核
現在では、腹内側核を満腹中枢とする考えは支持されていなものの、腹内側核の内側部はレプチン受容体が豊富に発現しており、摂食行動に重要な働きをしている。腹内側核は視交叉上核、弓状核、室傍核、背内側核、外側野などと視床下部内に密な線維連絡を持ち、扁桃体、結合腕傍核からの投射を受ける。腹内側核から視床下部外への主な投射は、扁桃体、中隔核、分界条床核、中心灰白質に認められる。腹内側核内の一部の神経細胞に限局して発現するステロイド産生因子1(steroidogenic factor-1: SF-1)遺伝子を利用した遺伝子改変マウスの研究から、腹内側核のSF1神経特異的にレプチン受容体を欠失させると摂食量の増大や肥満を生じることが報告されている[10]。内在性カンナビノイド系を活性化すると摂食行動促進、体重増加を引き起こすが、カンナビノイド受容体CB1は腹内側核に豊富に存在している。
- 背内側核
背内側核は視床下部の全ての神経核群と密な線維連絡がある。視床下部外への主な投射先は、中心灰白質、結合腕傍核、孤束核である。ラット、マウスは夜行性であるが、明期の一定時間に給餌するとその時間に覚醒するようになる。このような摂食行動に関連する概日リズムの調節時に視交叉上核の時計遺伝子の発現は変化しないことから、視交叉上核からの出力が途中で修飾を受けて特定の時間の覚醒行動を引き起こす。この修飾には背内側核が重要であると報告されている[11]。
- 室傍核
室傍核の大細胞領域にはオキシトシン、バゾプレシンを産生し下垂体後葉へ投射する神経が存在し、小細胞性領域にはCRHなどの下垂体前葉に作用するホルモンを産生する神経が存在する。摂食制御に重要なのはこれら以外の神経であり、室傍核から視床下部、脳幹部や脊髄へ投射する。視床下部外の主な投射先は、背側縫線核、中心灰白質、迷走神経背側運動核、青斑核、結合腕傍核、孤束核、最後野である。室傍核は、弓状核のNPY/AgRP神経およびPOMC神経の投射先として重要であり、α-MSHの受容体であるメラノコルチン4型受容体が豊富に発現している。弓状核のPOMC神経は室傍核に投射してα-MSH を分泌し、室傍核のメラノコルチン4型受容体に作用して摂食行動を抑制する。AgRPはメラノコルチン4型受容体の逆作動薬として作用し、摂食行動を促進する。室傍核でのメラノコルチン4型受容体発現を低下させると肥満する[4]。NPYによる摂食行動促進には、Y1受容体とY5受容体が重要であり、どちらも室傍核に発現している。また、室傍核には細胞内エネルギー状態のセンサーとしての役割を持つAMPKが存在し、メラノコルチン4型受容体シグナルによってAMPK活性が低下する[7]。摂食抑制物質として報告されたネスファチン1も室傍核に発現している[12]。
- 外側野
解剖学的境界が不明瞭であることから、外側核ではなく外側野と呼ばれる。外側野は空腹中枢であるという単純な考え方は否定されているものの、外側野は摂食行動を促進するオレキシン、メラニン凝集ホルモン(melanin-concentrating hormone: MCH)およびQRFP (Polyglutamylated arginine-phenylalanineamide peptide)を産生する。オレキシン、MCH、QRFPはそれぞれ外側野の異なる細胞によって産生される。オレキシンは摂食行動を促進する物質として報告されたが、その後の研究から覚醒を促進し睡眠覚醒制御に重要であることが明らかとなった。オレキシンによるラット、マウスの摂食行動促進が明期に限局することから、オレキシンによる摂食量増加は、覚醒行動促進に伴う効果としても説明ができる。MCHもオレキシンと同様に摂食行動を促進するが、オレキシン欠損マウスが肥満傾向を示すのに対してMCH欠損マウスは痩せ型であることから、体重調節の点でオレキシンとMCHの作用は逆である。QRFPは急性投与で摂食行動を促進する。オレキシン神経は弓状核、腹内側核、室傍核などの視床下部内への投射のほか、腹側被蓋野や縫線核などのモノアミン神経、交感神経系へ投射する[13]。
中脳
- 腹側被蓋野
腹側被蓋野は眼窩前頭皮質を含めた皮質、側坐核、線条体、外側野、背側縫線核、青斑核、上丘、中心灰白質などと双方向性の線維連絡がある。ドパミンを産生しないマウスは摂食量が少なく生後数週で死亡する[14]。腹側被蓋野は摂食のヘドニックな価値を制御しており、ドパミン神経を活性化すると摂取するものへの嗜好性が高まる。ドパミン神経はレプチン受容体を発現しており、レプチンは摂取するものへの嗜好性を低下させる[15]。
橋
- 背側縫線核
背側縫線核は、摂食行動に関連する部位では眼窩前頭皮質、弓状核、腹内側核、外側野、腹側被蓋野に投射している。背側縫線核に代表されるセロトニン神経も摂食や体重制御に関与しており、その主な作用は弓状核のセロトニン2B, 2C受容体を介した摂食行動の抑制である。非定形抗精神病薬であるオランザピンやクエチアピンはセロトニン2B, 2C受容体阻害作用があるため、副作用として摂食量増加、肥満を生じる。背側縫線核にはレプチン受容体も豊富に発現しており、セロトニン神経のみでレプチン受容体の発現を無くすと、レプチン受容体欠損マウスと同様の著しい肥満を呈することから、レプチンによる摂食・体重制御の主な標的がセロトニン神経であるという報告もある。この場合、セロトニン神経は弓状核のセロトニン1A, 2B受容体を介して摂食行動を抑制するという[16]。
- 結合腕傍核
結合腕傍核が活性化すると悪心、嘔気、食思不振を引き起こし、摂食行動が抑制される。結合腕傍核と孤束核は互いに密な線維連絡があり、結合腕傍核は孤束核から味覚情報を受ける。結合腕傍核は弓状核のNPY/AgRP神経の投射により抑制性の制御を受けており、この抑制性投射によって結合腕傍核の摂食行動抑制作用が抑えられている[17]。結合腕傍核への興奮性の入力として、孤束核からグルタミン酸作動性投射を、縫線核からセロトニン作動性投射を受ける[18]。結合腕傍核から視床下部弓状核、腹内側核、室傍核へ上行性投射がある。
延髄
- 孤束核
味覚は摂食行動に影響を与える。味覚の1次感覚ニューロンは顔面神経、舌咽神経および迷走神経を経て孤束核に終止する。孤束核の2次ニューロンは結合腕傍核で線維を変え内側毛帯を上行して視床後内側腹側核小細胞部を経て、大脳皮質(43野、前頭弁蓋部島皮質移行部など)へ投射する。ほかに前頭葉や扁桃体中心核へも投射がある。孤束核にはNPY/AgRP神経の抑制性投射があり、大縫線核や不確縫線核からのセロトニン作動性興奮性入力がある。セロトニン神経はセロトニン2C受容体を介して孤束核神経を興奮させ、次いで孤束核から結合腕傍核へのグルタミン酸作動性入力により摂食行動を抑制する。
- 最後野
第四脳室壁に接する最後野は、脳室周囲器官の1つであり、脳血管関門を欠いているため血液中の物質、コレシストキニンやグルカゴン様ペプチド1(glucagon-like peptide 1gon-like peptide: GLP-1)などを感知し摂食行動抑制、つまり一回の摂食行動の終止を促す。最後野への神経線維投射は室傍核と背内側核であり、投射線維の大部分は孤束核とその周囲に終止する。
末梢からの摂食神経回路制御
脂肪組織から分泌されるアディポサイトカインは摂食行動に影響をあたえる。特にレプチンは摂食行動抑制、体重減少を引き起こすことが知られており、レプチン機能低下により著しい肥満を生じる。摂食行動に関するレプチンの作用部位は弓状核、腹内側核、外側野、腹側被蓋野、背側縫線核などである[19]。グルコースやインスリンも摂食神経回路に直接作用しての摂食行動を抑制する。脳全体や視床下部のインスリン発現を低下させると、摂食量が増加する[20]。
コレシストキニン、ペプチドYY(PYY)、グルカゴン様ペプチド1glucagon-like peptide 1(GLP1)などの消化管ホルモンはいずれも迷走神経を介して摂食行動を抑制する。コレシストキニンは十二指腸、空腸に脂肪に富んだ食物が移行すると、小腸のI細胞から分泌される。PYYおよびGLP-1は十二指腸、空腸、結腸のL細胞から分泌される。これらの消化管ホルモンは食事開始後に濃度が上昇し、食後数時間で低下することから、一回の食事の終止に関わると考えられている。また、迷走神経は摂食による腸管の拡張を直接感知して摂食行動を抑制する。主に胃から分泌されるグレリンは、摂食前に血中濃度が上昇し、直接または迷走神経を介して視床下部に作用し摂食行動の開始を促す。末梢からの摂食制御のほとんどは抑制性であるが、グレリンは摂食行動を促進する点で特徴的である[21]。
摂食行動制御の時間的多階層性
摂食行動は複数のフィードバックループによって制御されていると考えられ、急性の効果はすぐに抑制される。例えば、グレリンは急性投与で非常に強い摂食行動促進効果を示すが、グレリンを持続的に投与した場合に摂食量増加が見られるのは投与開始当初の数日だけである。逆に、レプチンは急性投与で強い摂食行動抑制効果を示すが、レプチンを持続的に投与した場合に摂食行動が低下し体重減少が続くのは最初の数日であり、その後は投与前よりは低い体重で安定する。これは、摂食行動を促進または抑制しようとする神経回路が一旦活発になるものの、続いて体重を安定的に保とうとする制御機構が優位になり摂食行動に負の制御をもたらすためである。このため、グレリン欠損マウスのように、急性投与で摂食行動に変化をもたらす分子の発現をなくしても、摂食行動や体重に異常を認めない場合が多い。
摂食行動制御神経回路の種差
神経回路の研究は遺伝子改変マウスなどの齧歯類での研究が大部分であるが、摂食という動物の生存に不可欠な行動を制御する回路は、進化上脳の形成とともに古く、NPY, AgRP, POMC, MCH、オレキシンなどの神経ペプチドはゼブラフィッシュの視床下部にも存在している。鳥類の視床下部には漏斗核(哺乳類の弓状核に相当)、腹内側核、背内側核、外側野が区別され、漏斗核にはNPY, AgRP, POMCを産生する神経細胞が存在する。NPYやAgRPによる摂食行動促進やレプチン、インスリン、コレシストキニンによる摂食行動抑制はニワトリやゼブラフィッシュでも認められている。しかし、種による違いもあり、グレリンはニワトリの摂食行動を抑制する[22][23]。
ヒトの摂食行動制御も脳幹部から視床下部までの基本的な神経回路はマウスと同様であると考えられているが、大脳皮質からの制御の強さと質には違いがあると考えられる。摂食障害の病態にはこの大脳皮質での摂食行動の価値付けや意思決定が重要である[24]。
摂食行動研究の方法論的課題
摂食行動は実験施設でのマウス、ラットで定量的持続的に測定しやすいが、二次的な変化を見ていることを否定することは難しい。例えば、覚醒時間を増やす物質は二次的に摂食量増加をもたらす。より評価が難しいのは摂食量の低下であり、動物が不健康な状態になれば摂食量は低下するので、物質の投与による摂食量の低下が、生理的な意義を持つかどうかは、発現部位や関連する行動変化、絶食での発現変化などの検討が必要になる。
参考文献
- ↑
Rolls, E.T. (2005).
Taste, olfactory, and food texture processing in the brain, and the control of food intake. Physiology & behavior, 85(1), 45-56. [PubMed:15924905] [WorldCat] [DOI] - ↑
Saper, C.B., Chou, T.C., & Elmquist, J.K. (2002).
The need to feed: homeostatic and hedonic control of eating. Neuron, 36(2), 199-211. [PubMed:12383777] [WorldCat] [DOI] - ↑
Gropp, E., Shanabrough, M., Borok, E., Xu, A.W., Janoschek, R., Buch, T., ..., & Brüning, J.C. (2005).
Agouti-related peptide-expressing neurons are mandatory for feeding. Nature neuroscience, 8(10), 1289-91. [PubMed:16158063] [WorldCat] [DOI] - ↑ 4.0 4.1
Balthasar, N., Dalgaard, L.T., Lee, C.E., Yu, J., Funahashi, H., Williams, T., ..., & Lowell, B.B. (2005).
Divergence of melanocortin pathways in the control of food intake and energy expenditure. Cell, 123(3), 493-505. [PubMed:16269339] [WorldCat] [DOI] - ↑
Funato, H., Tsai, A.L., Willie, J.T., Kisanuki, Y., Williams, S.C., Sakurai, T., & Yanagisawa, M. (2009).
Enhanced orexin receptor-2 signaling prevents diet-induced obesity and improves leptin sensitivity. Cell metabolism, 9(1), 64-76. [PubMed:19117547] [PMC] [WorldCat] [DOI] - ↑
Parton, L.E., Ye, C.P., Coppari, R., Enriori, P.J., Choi, B., Zhang, C.Y., ..., & Lowell, B.B. (2007).
Glucose sensing by POMC neurons regulates glucose homeostasis and is impaired in obesity. Nature, 449(7159), 228-32. [PubMed:17728716] [WorldCat] [DOI] - ↑ 7.0 7.1
Minokoshi, Y., Alquier, T., Furukawa, N., Kim, Y.B., Lee, A., Xue, B., ..., & Kahn, B.B. (2004).
AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus. Nature, 428(6982), 569-74. [PubMed:15058305] [WorldCat] [DOI] - ↑
Claret, M., Smith, M.A., Batterham, R.L., Selman, C., Choudhury, A.I., Fryer, L.G., ..., & Withers, D.J. (2007).
AMPK is essential for energy homeostasis regulation and glucose sensing by POMC and AgRP neurons. The Journal of clinical investigation, 117(8), 2325-36. [PubMed:17671657] [PMC] [WorldCat] [DOI] - ↑
Gao, Q., Mezei, G., Nie, Y., Rao, Y., Choi, C.S., Bechmann, I., ..., & Horvath, T.L. (2007).
Anorectic estrogen mimics leptin's effect on the rewiring of melanocortin cells and Stat3 signaling in obese animals. Nature medicine, 13(1), 89-94. [PubMed:17195839] [WorldCat] [DOI] - ↑
Dhillon, H., Zigman, J.M., Ye, C., Lee, C.E., McGovern, R.A., Tang, V., ..., & Lowell, B.B. (2006).
Leptin directly activates SF1 neurons in the VMH, and this action by leptin is required for normal body-weight homeostasis. Neuron, 49(2), 191-203. [PubMed:16423694] [WorldCat] [DOI] - ↑
Mieda, M., Williams, S.C., Richardson, J.A., Tanaka, K., & Yanagisawa, M. (2006).
The dorsomedial hypothalamic nucleus as a putative food-entrainable circadian pacemaker. Proceedings of the National Academy of Sciences of the United States of America, 103(32), 12150-5. [PubMed:16880388] [PMC] [WorldCat] [DOI] - ↑
Maejima, Y., Sedbazar, U., Suyama, S., Kohno, D., Onaka, T., Takano, E., ..., & Yada, T. (2009).
Nesfatin-1-regulated oxytocinergic signaling in the paraventricular nucleus causes anorexia through a leptin-independent melanocortin pathway. Cell metabolism, 10(5), 355-65. [PubMed:19883614] [WorldCat] [DOI] - ↑
Sakurai, T. (2007).
The neural circuit of orexin (hypocretin): maintaining sleep and wakefulness. Nature reviews. Neuroscience, 8(3), 171-81. [PubMed:17299454] [WorldCat] [DOI] - ↑
Szczypka, M.S., Rainey, M.A., Kim, D.S., Alaynick, W.A., Marck, B.T., Matsumoto, A.M., & Palmiter, R.D. (1999).
Feeding behavior in dopamine-deficient mice. Proceedings of the National Academy of Sciences of the United States of America, 96(21), 12138-43. [PubMed:10518589] [PMC] [WorldCat] [DOI] - ↑
Domingos, A.I., Vaynshteyn, J., Voss, H.U., Ren, X., Gradinaru, V., Zang, F., ..., & Friedman, J. (2011).
Leptin regulates the reward value of nutrient. Nature neuroscience, 14(12), 1562-8. [PubMed:22081158] [PMC] [WorldCat] [DOI] - ↑
Yadav, V.K., Oury, F., Suda, N., Liu, Z.W., Gao, X.B., Confavreux, C., ..., & Karsenty, G. (2009).
A serotonin-dependent mechanism explains the leptin regulation of bone mass, appetite, and energy expenditure. Cell, 138(5), 976-89. [PubMed:19737523] [PMC] [WorldCat] [DOI] - ↑
Wu, Q., Boyle, M.P., & Palmiter, R.D. (2009).
Loss of GABAergic signaling by AgRP neurons to the parabrachial nucleus leads to starvation. Cell, 137(7), 1225-34. [PubMed:19563755] [PMC] [WorldCat] [DOI] - ↑
Wu, Q., Clark, M.S., & Palmiter, R.D. (2012).
Deciphering a neuronal circuit that mediates appetite. Nature, 483(7391), 594-7. [PubMed:22419158] [PMC] [WorldCat] [DOI] - ↑
Myers, M.G., Cowley, M.A., & Münzberg, H. (2008).
Mechanisms of leptin action and leptin resistance. Annual review of physiology, 70, 537-56. [PubMed:17937601] [WorldCat] [DOI] - ↑
Biddinger, S.B., & Kahn, C.R. (2006).
From mice to men: insights into the insulin resistance syndromes. Annual review of physiology, 68, 123-58. [PubMed:16460269] [WorldCat] [DOI] - ↑
Neary, M.T., & Batterham, R.L. (2009).
Gut hormones: implications for the treatment of obesity. Pharmacology & therapeutics, 124(1), 44-56. [PubMed:19560488] [WorldCat] [DOI] - ↑
Volkoff, H., & Peter, R.E. (2006).
Feeding behavior of fish and its control. Zebrafish, 3(2), 131-40. [PubMed:18248256] [WorldCat] [DOI] - ↑
Richards, M.P., & Proszkowiec-Weglarz, M. (2007).
Mechanisms regulating feed intake, energy expenditure, and body weight in poultry. Poultry science, 86(7), 1478-90. [PubMed:17575199] [WorldCat] [DOI] - ↑
Kaye, W.H., Fudge, J.L., & Paulus, M. (2009).
New insights into symptoms and neurocircuit function of anorexia nervosa. Nature reviews. Neuroscience, 10(8), 573-84. [PubMed:19603056] [WorldCat] [DOI]
(執筆者:船戸弘正、イラスト作成:柿崎美代)