In situハイブリダイゼーション法
大内 淑代<br>
岡山大学 大学院医歯薬学総合研究科細胞組織学分野
DOI:10.14931/bsd.2163 原稿受付日:2012年7月12日 原稿完成日:2013年3月25日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英:in situ hybridization 独:In situ-Hybridisierung 仏:hybridation in situ
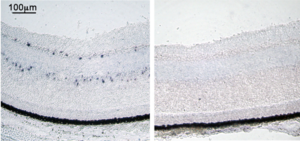
組織切片ISH(トリ胚網膜、opsin 5、青い点状のシグナルがmRNA発現細胞、右はセンスプローブによる陰性コントロール)
発色基質:NBT, BCIP
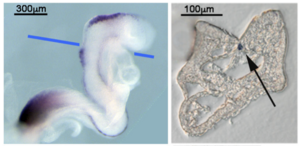
ホールマウントISH (WISH)
マウス胚WISHとWISH後の切片化(Wnt1、青線で切片化、シグナルは矢印[脊索]、凍結切片、未封入)

組織切片蛍光ISH+抗体染色
トリ胚網膜、opsin 5 mRNA (緑)、Islet1タンパク質(マゼンダCy3、上)・GAD65/67タンパク質(マゼンタCy3、下)、核(DAPI)[青])
ISHはFluorescein-tyramide法
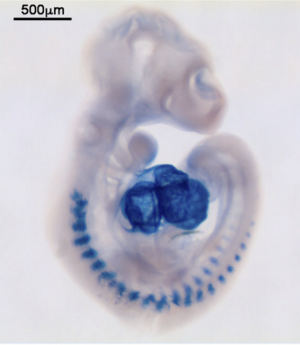
マイクロRNAのWISH(マウス胚、miR-1)
発色基質: NBT, BCIP
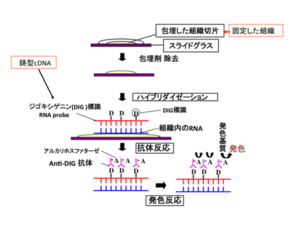
In situとは”原位置で”という意味で、in situハイブリダイゼーション(in situ hybridization: ISH)とは原位置でのハイブリダイゼーション(後述)ということである。ISH法には、染色体ISHと組織切片ISH、ホールマウントISH (whole-mount ISH: WISH) がある[1][2]。染色体ISH法は、染色体における目的遺伝子の遺伝子座を明らかにし、染色体異常を検出することができる。組織ISH法は、組織切片を用いて遺伝子発現の第一段階であるmRNAの局在を細胞レベルで明らかにする。病理組織からウイルスゲノムを検出し、ウイルス感染の診断に用いられることもある。また、胚や器官の一部などを丸ごと用いるISH法を、ホールマウントISH(WISH)という。実験例を図1に示す。遺伝子発現部位の三次元的な情報を得た後で、細胞レベルで遺伝子発現部位を同定しなければならない場合は、WISH後の胚などの組織切片を作製する。図2に、組織切片を用いたin situハイブリダイゼーション法の工程を模式的に示す。ISHは、細胞内mRNAの局在を明らかにする実験であるので、分解されやすいRNAをいかに分解させずに実験を行うかが重要である。
In situハイブリダイゼーション法の各工程
組織の固定
ISH法では細胞が死んだ状態でmRNAを検出する。細胞が死んでしまうと、mRNAは急速に分解され消滅してしまう。そのため、in situハイブリダイゼーション法を用いる場合は、細胞内のmRNAの分解を防ぎ、できるだけ生きていた状態を維持しておく必要がある。細胞や組織などをなるべく自然の状態に保存することを固定とよんでいるが、in situハイブリダイゼーション法の場合はmRNAの固定が非常に重要である。In situハイブリダイゼーション法では、用時調製した4%パラホルムアルデヒド液を用いて還流固定し、臓器等を取り出して短時間、低温でさらに浸漬固定することが多い。新鮮迅速凍結切片を用いてISHを行うこともある。組織切片はスライドガラスに貼付けたもの、あるいは浮遊切片[3]を用いる。
前処理
組織ISH法、WISH法のいずれにおいても、ハイブリダイゼーションを行う前に固定した組織の前処理を行う。主な目的は、界面活性剤で細胞膜の透過性を上げ、タンパク質分解酵素proteinase Kなどを用いて結合組織等を分解しプローブの浸透性をよくすることと、プローブの非特異的な吸着を防ぐことである。特に、タンパク質分解酵素の濃度と処理時間は、組織の種類、固定法とも関連し、in situハイブリダイゼーション法の結果を左右する重要な因子である。
プローブの調製
目的のmRNAを検出するために、そのmRNAと特異的にハイブリダイズする、つまり、目的のmRNAと相補的な配列をもったRNAまたはDNAプローブが必要である。プローブとして、
- 化学合成したDNAを用いるオリゴヌクレオチドプローブ
- DNA合成酵素によりin vitroで合成したDNAプローブ
- RNA合成酵素によりin vitroで合成したRNAプローブ
の3種類がよく用いられている。DNAオリゴプローブは、DNA合成装置で合成する。B, Cにおいては、プローブ合成のための鋳型DNAが必要である。RNA-RNAハイブリッドが3者の中で最も安定であり、現在RNAプローブを用いる方法が一般的である。合成したRNAが分解されないように細心の注意を払う。他にlocked nucleic acid (LNA)(後述)やペプチド核酸をプローブとして用いる方法がある。プローブを可視化のために標識する方法には主に次の2つの方法がある。
- 酵素抗体法または蛍光抗体法:適当な抗原(ジゴキシゲニン (digoxigenin, DIG), フルオレセイン (fluorescein), ビオチン (biotin)など)の結合したヌクレオチドを用いてプローブを標識し、その抗原に対する抗体を用いて発色または蛍光により可視化する。
- 放射性同位元素(radioisotope)を用いて、オートラジオグラフィー法により可視化する。
ハイブリダイゼーション
DNAの二重らせん構造は、塩基対A:Tに形成される2つの水素結合と塩基対G:Cに形成される3つの水素結合により安定に保たれている。この二本鎖を一本鎖にする方法の1つとして、熱変性がある。二重らせんDNA溶液の温度を高くしながら、DNA溶液の260 nmの吸光度A260を測定すると、しだいにA260は高くなる。これはDNAの二重らせんが壊れ、一本鎖になるためで、この温度による吸光度の変化を表す曲線をDNAの融解曲線とよんでいる。この現象は、らせんが消失して塩基間の相互作用が少なくなるため、塩基の光吸収の効率が変化し(深色効果)、各塩基の分子吸光係数が高くなるために生じる。温度の低い時のDNAをヘリックス100%とし、高温での吸光度が一定になる状態でヘリックス0%と仮定すると、ヘリックス50%になる温度(融解温度 (melting temperature: Tm))を決定することができる。
Tmは二重らせんの安定度の目安になる。非常に安定ならせんであれば、Tmは80〜90℃になる。逆に不安定であれば、30〜40℃になる。TmはGC塩基対の含量、核酸の長さ、核酸の塩基対のミスマッチなどに依存し、DNA溶液のイオン強度(塩濃度)や組成により変化する。Tmに関する経験的な式は、例えば、RNA-RNAハイブリッドの場合、
Tm=79.8+18.5(logM)+0.584(%G+C)+0.118 × 10-2(%G+C)2−0.35(%formamide)− 820/l
ここで、Mは1価の正イオンのモル濃度、%G+CはGC含量、%formamideはホルムアミド濃度、lはプローブの長さ(bp)である。
Tmの温度では、全体の50%ほど二重らせんが形成されていることになる。ハイブリダイゼーションの温度Thは、Tmより5〜20℃低い温度で行う。どの程度まで塩基対のマッチを許容するかをstringencyとよぶ。例えば、(Tm−5)℃でハイブリダイズさせると、stringencyが非常に高くなり、完全マッチした安定なDNA-DNAしかハイブリッドを形成しない。しかし、ハイブリダイズする温度を(Tm−20)℃と低下させ、stringencyを低くすると、ミスマッチをもったハイブリッドが形成される可能性が高くなる。
DIGを用いた組織in situハイブリダイゼーション法では、1kb程度のRNAプローブ(GC含量約50%)を使用する場合、50%ホルムアミド中65℃、12〜14時間で、ほぼよい結果が得られる。もし、短いRNAやGC含量の低いRNAをプローブとする場合は、低stringencyの条件でハイブリダイゼーションを行う。プローブの濃度も重要であり、濃度の高いほうが再会合率が高くなる。プローブの長さが大きいほどシグナルが強くなるが、プローブの配列によってはハイブリダイゼーションに交差性を認める結果となる場合もある。2kbをこえるとアルカリ加水分解によってRNAの長さを小さくし、組織への浸透を高めるようにする。
洗浄
非特異的に結合したプローブを除去するために、組織を洗浄する.洗浄の条件を厳しくするとバックグラウンドが低下するが、同時にシグナルも弱くなる。RNA-RNAハイブリットは通常のRNA分解酵素 (RNAse)では分解されないので、これ以降の実験工程はRNAseフリーでなくてよい。
シグナルの検出
酵素抗体法と蛍光抗体法
BCIPがAPにより加水分解されてまず中間産物となり、さらに2量体になって青色色素を産生する。2量体化するときに、2個の水素イオンによりNBTは還元されて不溶性のNBTホルマザンを形成する。(tautomerism:ケト・エノール互変異性)
一方、Fast Red TRは、ナフトールAS-MXリン酸の存在下でAPにより赤色の沈殿物を生じる。Fast Red TRを蛍光性のAP基質であるHNPP (2-hydroxy-3-naphtoic acid-2’-phenylanilide phosphate)と共に用いると、還元されてできるHNPの組織への沈着が増し、HNPの蛍光がさらに長波長側シフトして (565~620nm) 強い橙蛍光を発する。発色反応、発色基質全般についての説明。
標識プローブのみでは発色することができないので、プローブの中に取り込まれている抗原に対する抗体を用いプローブの検出を行う.プローブをDIGで標識した場合、DIGに特異的に結合する一次抗体を用いて検出する。検出に用いる一次抗体には通常の抗体とは異なり、アルカリホスファターゼ(alkaline phosphatase: AP)または西洋ワサビペルオキシダーゼ(horseradish peroxidase: HRP)などの酵素が結合(conjugate)している.例えば、抗体に結合されたAPの基質として、5-Bromo-4-Chloro-3'-Indolylphosphate p-Toluidine salt (BCIP)およびnitro-blue tetrazolium chloride (NBT)を用いた場合は、APがBCIPを脱リン酸化し、中間産物が遊離すると発色する(図3)。一方、抗体に蛍光色素が結合している場合には、蛍光顕微鏡や共焦点レーザー走査顕微鏡で検出する。
放射性同位元素を用いる方法
放射性同位元素(RI)として35S標識された核酸を用いてプローブを合成する。写真用フイルムまたはオートラジオグラフィー用の乳剤を用いてRIの放出するβ線を検出する。
観察と記録
組織切片の場合、色素で対比染色し形態学的な観察を容易にする。結果を顕微鏡で観察し、さらに写真や画像として記録する。
2色ISH法、蛍光ISH法、抗体染色との2重染色
発色法では、アルカリフォスファターゼ (AP) の基質を変えることにより、2つの遺伝子の発現を同時に検出できる。すなわち、調べたい2つの遺伝子のRNAプローブをDIGまたはフルオレセインで標識し、混合プローブでハイブリダイゼーションさせる。まずAP標識抗フルオレセイン抗体で反応させ、洗浄、発色まで行う(基質はFast Red)。その後、酸処理(0.1Mグリシン-HCl、pH2.2)および後固定を行って1色めのアルカリフォスファターゼを失活させる。その後、AP標識抗DIG抗体で反応させ、洗浄、発色を行う(基質NBT/BCIP)。または、DIGまたはフルオレセインで標識した2つのRNAプローブでハイブリダイゼーションさせて洗浄、HRP標識抗DIG抗体で反応させ、HRPの基質ジアミノベンジジン(Diaminobenzidine: DAB)を用いてまず発色させる。次に、AP標識抗フルオレセイン抗体で反応させ、その後APの基質(NBT, BCIP)を用いて発色させる。
蛍光ISH法では、HRP標識の抗体に対して、tyramideを結合させた低分子(ビオチンやフルオレセインなど)を反応させシグナルを増強させる方法 (tyramide signal amplification: TSA) を用いる。すなわちtyramideは、ペルオキシダーゼ活性によってラジカル化し組織(タンパク質のTyr, Trp残基など)に低分子ごと集積する。集積した低分子を、蛍光物質の場合はそのまま蛍光顕微鏡等で検出でき、そうでなければその低分子に対する蛍光標識抗体またはストレプトアビジンを反応させて間接的に検出することもできる。細胞レベルでmRNAの共在性を証明するためには蛍光ISH法は必須であり、AP反応系Fast Red/HNPPと組み合わせることで2重蛍光ISH法を行うことができる。抗体染色との2重染色では、以上のISH工程をタンパク質分解酵素なしで行ってそのあと通常の間接蛍光抗体染色を行う、あるいは先にビオチン化抗体と蛍光標識アビジンを用いてRNAseフリーで抗体染色を行い、その後AP反応系Fast Red/HNPPによるISH法を行うなどの方法がある。さらなる多重蛍光ISH法については、hybridization chain reaction法がある。
マイクロRNAを検出するISH法
Locked nucleic acid (LNA)プローブを用いる。LNAは、リボ核酸の2’位の酸素原子と4’位の炭素原子とが架橋しており、相補的な核酸に対合したときの熱安定性が非常に高く、短いRNAに対して高いTm値でハイブリダイゼーションできる。この性質を利用してLNAプローブによりマイクロRNAのISHが可能になった。
ISHデータベース
Allen Brain Atlasは、マイクロソフト社創設者の一人であるPaul G. Allenの出資によって2003年に設立されたAllen Institute for Brain ScienceのISHデータベースである。2006年12月発表のNature の記事によると、まず約2万の遺伝子のマウス成体脳における組織切片ISHのデータが公開された[4]。現在、マウス脳に加えて、ヒト脳、発生期マウス脳、発生期ヒト脳、マウス脳神経回路、ヒト以外の霊長類脳、マウス脊髄、ヒト神経膠芽腫に関するISHデータベースが公開されている。
関連項目
外部リンク
参考文献
- ↑ 野地澄晴編
免疫染色&in situハイブリダイゼーション
羊土社、東京、2006 - ↑ D.G. Wilkinson
In Situ Hybridization, A Practical Approach, 2nd Edition
Oxford University Press, Oxford, 1999 - ↑ <pubmed> 21037591</pubmed>
- ↑
Lein, E.S., Hawrylycz, M.J., Ao, N., Ayres, M., Bensinger, A., Bernard, A., ..., & Jones, A.R. (2007).
Genome-wide atlas of gene expression in the adult mouse brain. Nature, 445(7124), 168-76. [PubMed:17151600] [WorldCat] [DOI]